ՀՏԴ
Ատոմա-մոլեկուլային ուսմունք: Ատոմի կառուցվածքը: Ուսումնական ձեռնարկ Ֆ.Գրիգորյան, Ա.Գրիգորյան: Հայաստանի պետական ճարտարագիտական համալսարան: Երևան, 2005 թ., 48 էջ:
Նախատեսված է Քիմիա-տեխնոլոգիական և բնապահպանական ճարտարագիտություն մասնագիտության ուսանողների, մագիստրանտների և ասպիրանտների համար:
Գրախոսներ` Հ Մխիթարյան
Ռ.Միրզախանյան
Խմբագիր` Ն. Խաչատրյան
1.2. Քիմիան ճշգրիտ գիտություն է
1.3. Քիմիան և ժամանակակից հասարակության խնդիրները
2.2. Պարզ և բարդ նյութեր: Ալոտրոպիա:
2.3. Քիմիական տարրերի նշանները: Քիմիական բանաձևերը
2.4. Ատոմի զանգված: Հարաբերական ատոմային և մոլեկուլային զանգվածներ
2.6. Գազային նյութերի մոլեկուլային զանգվածի որոշումը
3.4. Կարգահամարի ֆիզիկական իմաստը: Իզոտոպներ
3.5. Սպեկտրոգրաֆի աշխատանքի սկզբունքը
3.7. Գաղափար լուսային քվանտների մասին
3.8. Բորի տեսությունը ջրածնի ատոմի համար
3.9. Բորի տեսության մաթեմատիկական հետևությունները
3.10. Ջրածնի ատոմի սպեկտրի բացատրությունն ըստ Բորի
3.11. Բորի - Զոմերֆելդի տեսության հակասությունները
4. Քվանտային մեխանիկայի տարրերը
4.2. Լույսի ալիքամասնիկային երկվությունը
4.4. Հայզենբերգի անորոշության սկզբունքը
4.6. Ալիքային ֆունկցիան, դրա ֆիզիկական իմաստը և նկարագրման եղանակները
4.7. Շրյոդինգերի հավասարման լուծումը: Միաչափ պոտենցիալ տուփ
4.8. Ջրածնի ատոմի կառուցվածքը ըստ քվանտային մեխանիկայի
4.10. Էլեկտրոնների լրացման հաջորդականությունը բազմաէլեկտրոն ատոմներում
4.11. Էլեկտրոնային բանաձևեր, էլեկտրոնային դիագրամներ
1.1. Քիմիան և բնագիտությունը
Քայլե՞լ եք դուք աշնանային անտառով, զարմացե՞լ եք տերևների գույների փոփոխությունից, նստե՞լ եք իրիկնային խարույկի շուրջն ու զմայլվել բոցի գույներով: Այդ երևույթները քիմիական փոփոխությունների արդյունք են: Քիմիան գործ ունի բոլոր նյութերի հետ, և դրանց հետ կատարվող փոփոխությունները, որ տեսնում ենք մեր շրջապատում, դարձնում են աշխարհը բազմազան ու գեղեցիկ, երբեմն էլ խորհրդավոր: Դրանով է բացատրվում է մետաղի ժանգոտումը, քաղցրավենիքի մարսումը, հ ացի թխումը, մարդու ծերացումը և այլն:
Ձեզանից շատերը ուսումնասիրում են քիմիան, քանի որ այն ընդգրկված է ուսումնական ծրագրերում: Ձեր հիմնական մասնագիտությունը կարող է լինել էլեկտրատեխնիկան, երկրաբանությունը, բժշկությունն ու շինարարությունը, սակայն քիմիայի ուսումնասիրությունն անհրաժեշտ է: Պատճառն այն է, որ մարդկային գործունեության ցանկացած բնագավառ, որը կապված է նյութական աշխարհի հետ, կարիք ունի հասկանալու, թե ինչպե՞ս են նյութերը փոխազդում իրար և շրջապատի հետ, ինչպե՞ս են նյութերը փոփոխվում: Այդ պատճառով քիմիան կարևոր դեր ունի Ձեր ապագա մասնագիտության մեջ: Դուք կլինեք ավելի բազմակողմանի և ստեղծագործ անձ, եթե հասկանաք Ձեր աշխատանքին վերաբերող քիմիական հասկացությունները և կարողանաք անհրաժեշտության դեպքում օգտագործել դրանք:
Քիմիական ուսումնասիրությունների արդյունքում ստեղծվել և օգտագործվում են այնպիսի նյութեր, որպիսիք չի ստեղծել բնությունը և առանց որոնց չէին կարող զարգանալ գիտությունը և արդյունաբերության բոլոր բնագավառները: Ժամանակակից մարդ լինելու համար Դուք կարիք կունենաք տեղեկացված լինելու քիմիայի շատ համապարփակ հարցերի, քիմիական նյութերի օգտագործման մասին: Այս գիրքը կծանոթացնի Ձեզ հիմնական քիմիական հասկացություններին, կօգնի հասկանալու շրջապատող աշխարհը` հնարավորությունները և պահանջները:
Այն ամենը, ինչ մենք տեսնում ենք մեզ շրջապատող աշխարհում մեկ ընդհանուր անունով կոչվում է մատերիա: Մատերիան գտնվում է անընդհատ շարժման` փոփոխությունների մեջ: Մատերիայի շարժման պարզագույն տեսակը մեխանիկական շարժումն է` մի մարմնի տեղափոխությունը մյուսի նկատմամբ: Շարժմա ն այս պարզագույն տեսակը մարդը յուրացրել է ամենից վաղ և դրա օրինաչափությունները ուսումնասիրող բնական գիտությունը կոչվում է մեխանիկա: Ավելի ուշ մարդը յուրացրեց մատերիայի շարժման մի նոր ավելի բարդ տեսակ` ֆիզիկական շարժումը, երբ փոխվում է նյութի ձևը, չափը, ագրեգատային վիճակը: Այս շարժման օրինաչափությունը ուսումնասիրում է ֆիզիկա բնական գիտությունը: Զարգացման շատ ավելի բարձր փուլում (մոտ երկու-երեք հարյուրամյակ առաջ) մարդը ճանաչեց մատերիայի շարժման մի նոր, ավելի բարդ տեսակ, երբ նյութը փոխվում է բաղադրությամբ, երբ մեկ կամ մի քանի նյութերից ստացվում են նոր նյութեր: Այդպիսի շարժումը կոչվում է քիմիական շարժում և դրա օրինաչափությունները ուսումնասիրող բնական գիտությունը կոչվում է քիմիա: Եթե ջրի հոսելը մարդը ճանաչել և օգտագործել էր դեռ նախնադարում, ջրի գոլորշիանալը` ավելի ուշ, ապա այն բանը, որ ջուրը կարող է քայքայվել, առաջացնելով նոր նյութեր` ջրածին և թթվածին, մարդը հասկացել է մոտ երկու հարյուր տարի առաջ միայն: Հետևաբար,
![]() Քիմիան բնական գիտություն է, որն ուսումնասիրում է նյութերի փոխարկումները և դրանց օրինաչափությունները:
Քիմիան բնական գիտություն է, որն ուսումնասիրում է նյութերի փոխարկումները և դրանց օրինաչափությունները:
Մատերիայի շարժման հաջորդ տեսակը կենսաբանական շարժումն է, կենդանի օրգանիզմի ծագումը, զարգացումը և մահացումը, որն ուսումնասիրում է կենսաբանություն բնական գիտությունը և հասարակական շարժումը, մատերիայի ամենաբարձր կազմակերպված տեսակի` մարդկային հասարակության շարժումը, որը ուսումնասիրում է հասարակագիտությունը:
Մատերիան գոյություն ունի երկու վիճակներում` նյութի և դաշտի: Նյութի օրինակ են մի կտոր կավիճը, մի բաժակ ջուրը, շրջապատող առարկաները: Դաշտի օրինակ են էլեկտրական, մագնիսական, գրավիտացիոն դաշտերը: Դաշտը և նյութը ունեն մի շարք ինչպես ընդհանուր, այնպես էլ տարբեր հատկանիշներ: Օրինակ` ընդհանուր հատկանիշ է այն, որ և’ դաշտը, և’ նյութը տեղափոխում են էներգիա: Երկար ժամանակ կար կարծիք, որ նյութի և դաշտի միջև տարբերությունն այն է, որ նյութը ունի զանգված, իսկ դաշտը` ոչ: 20-րդ դարի սկզբում Էյնշտեյնը ցույց տվեց, որ էներգիան ևս ունի զանգված, և ձգողական ուժի ազդեցության տակ լույսը ձգվում է նյութի կողմից:
Զանգվածի մեծությունը կապված է էներգիայի հետ Էյնշտեյնի բանաձևով.
E=mc2,
որտեղ E-n` էներգիայի քանակն է (Ջոուլ), m-ը` զանգվածը (կգ),
c-ն` լույսի արագությունը (մ×վրկ-1):
Լույսի արագությունը բնության կարևոր հասկացություններից է և հավասար է c=2.9979×108 մ×վրկ-1:
Դաշտը իրականացնում է նյութի առանձին մասերի կապը և փոխազդեցությունը:
Պայմանականորեն քիմիան բաժանվել է չորս բաղադրիչ մասերի, օրգանական, անօրգանական, ֆիզիկական և անալիտիկ քիմիայի:
Օրգանական քիմիայի ավանդական բնագավառը կապված է ածխածնի ջրածնական միացությունների ուսումնասիրման հետ, իսկ անօրգանական քիմիան գործ ունի մնացած բոլոր տարրերի և ածխածնի մնացած միացությունների հետ:
Ցանկացած քիմիական ռեակցիա ուղեկցվում է նաև բազմաթիվ ֆիզիկական երևույթներով: Փոխվում է նյութի չափը, անջատվում է լույս, ջերմություն, առաջանում է դետոնացիոն ալիք` պայթյուն: Ցանկացած քիմիական երևույթ կոմպլեքսային բնույթ ունի և այդ պատճառով այն պետք է ուսումնասիրել ոչ միայն քիմիայի, այլ նաև մնացած գիտությունների տեսանկյունից:
Կիբեռնետիկայի հայրը` Նորբերտ Վիները նշել է, որ եթե քիմիական հիմնախնդի լուծման դժվարությունը մաթեմատիկայում է, ապա տասը քիմիկոս ավելի քիչ բան կանեն, քան մեկ մաթեմատիկոս: Սա նշանակում է, որ գիտության բաժանումը մեր կողմից ինչ-որ չափով արհեստական է: Այդ պատճառով տարբեր գիտությունների սահմանագծում առաջացել են նոր գիտություններ` ֆիզիկական քիմիա, քիմիական ֆիզիկա, էլեկտրաքիմիա, կենսաքիմիա, տիեզերական քիմիա և այլն:
1.2. Քիմիան ճշգրիտ գիտություն է
Բոլոր ճշգրիտ գիտություններին բնորոշ են հետևյալ երեք տարբերիչ գծերը.
ա) վերացական դատողությունների առկայությունը,
բ) փորձնական փաստերի կրկնությունը,
գ) գործնական կիրառությունը:
Քիմիայում վերացական դատողությունների դերը կատարում են հասկացությունները, հիպոթեզները, օրենքները և տեսությունները, որոնք մշակված են այնպես, որ համապատասխանեն լաբորատոր դիտարկումներով հաստատված փաստերին: Եթե հայտնաբերվում են երևույթներ, որոնք կրկնվում են փորձից փորձ, և այդ դիտարկումը բերում է ընդհանրացման, ապա այս կերպ հայտնաբերվում է օրենքը:
Օրենքը փորձի ընդհանրացումն է տվյալ երևույթի նկատմամբ, որը կրկնվում է անկախ ժամանակից: Տարբեր հասկացությունների և օրենքների համախումբը, որը բացատրում է տվյալ երևույթների շարքը, կոչվում է տեսություն:
Օրենքը սահմանելուց հետո անհրաժեշտ է այն բացատրել: Սա ստեղծագործական առումով գիտության ամենահետաքրքիր մասն է: Օրենքի բացատրությունը սկսվում է վարկածով:
Վարկածը օգտակար է միայն այն դեպքում, եթե նրա հիման վրա կարելի է անել ենթադրություն, որը կարելի է ստուգել և ժխտել կամ հաստատել:
Վարկածը, որը ստուգվել է բազմաթիվ փորձերով և հաստատվել է, կոչվում է տեսություն: Տեսությունը ծառայում է փաստերի ընդհանրացմանը, որոնք տրված են լայն տիրույթում, ինչպես նաև օրենքների բացատրությանը:
Այդպիսի տեսություններ են` ատոմամոլեկուլային ուսմունքը, նյութի ատոմային կառույցը և այլն:
1.3. Քիմիան և ժամանակակից հասարակության խնդիրները
Հաճախ խնդրի հայտնաբերումը խիստ կարևոր է, որովհետև դրա լուծումից հետո կարող է պարզվել, որ այն խիստ մեծ նշանակություն ունի:
Վերջերս մի խումբ խոշոր գիտնականներ ձևակերպել են ամենաարդիական խնդիրները, որոնց հետ շփվում է մարդկությունը: Նրանք առանձնացրել են այդ խնդիրներից այնպիսիք, որոնց լուծման հարցում քիմիկոսները լուրջ ներդրում կարող են ունենալ: Բերենք այդ չլուծված խնդիրների շարքը:
1. Սննդամթերքի խնդիրը: Աշխարհի այն մասերում, որտեղ 25 տարին մեկ կրկնապատկվում է բնակչության թիվը, իսկ սննդամթերքի արտադրությունը համարյա չի փոխվում, առաջանում է սովի հիմնախնդիր: Քիմիկոսների խնդիրն է ստեղծել բույսերի հիվանդությունների դեմ պայքարի նոր միջոցներ, ինչպես նաև մշակել ավելի արդյունավետ պարարտանյութեր: Անհրաժեշտ է ստեղծել նոր գյուղատնտեսական ծագում ունեցող արհեստական սննդի տեխնոլոգիա:
2. Հումքի օվկիանոսային աղբյուր: Մինչև այժմ մարդկությունը օվկիանոսի հսկայական ռեսուրսների չնչին մասն է օգտագործում գործնական նպատակների համար: Իհարկե օվկիանոսից սպացվում է սնունդ և որոշ միներալներ, սակայն դա կազմում է օվկիանոսի ռեսուրսների չնչին մասը: Բացի դրանից, աշխարհի որոշ մասերում զգացվում է ջրի պակաս, որը օվկիանոսից քաղցրահամ ջրի ստացումը դարձնում է արդիական:
3. Շրջապատող միջավայիրի պաշտպանությունը: Բոլորին հայտնի է օդի և ջրի աղտոտման խնդիրը: Մինչդեռ մինչև այժմ էլ այն չի գտել ընդունելի լուծում: Շրջապատող միջավայրի աղտոտումը պայմանավորված է մարդու գործունեության հետ կապված երկու պատճառներով. բնական և արհեստական: Մենք սովորաբար քիչ ուշադրություն ենք դարձնում աղտոտման բնական պրոցեսներին, մասնավորապես այն պատճառով, որ չենք կարող էականորեն ազդել դրանց վրա: Մարդու գործունեությամբ պայմանավորված պրոցեսները կապված են հիմնականում տրանսպորտի և արդյունաբերության հետ: Տրանսպորտի արտանետումները պակասացնելու համար անհրաժեշտ է ստեղծել նոր վառելիքներ, նոր շարժիչներ, նոր կատալիզատորներ: Լուրջ խնդիրներ կան արդյունաբերության, հատկապես քիմիական արդյունաբերության մեջ արտանետումները նվազեցնելու խնդրում:
4. Կենսաքիմիական պրոցեսներ: Հետազոտման քիմիական մեթոդների կիրառումը կենսաքիմիական պրոցեսներում հանգեցրել է զգալի ձեռքբերումների կենդանի օրգանիզմում նյութափոխանակության, ֆոտոսինթեզի և այլ կենսաբանական երևույթների: Գիտության այդ բնագավառում կան մեծ քանակով չլուծված պրոբլեմներ: Դրանց թվին են պատկանում, մտածելու երևույթի քիմիական մեխանիզմը, ժառանգականությունը, դեղանյութերի ազդեցությունը մարդու օրգանիզմի վրա, կյանքի առաջացումը:
5. Էներգիայի նոր աղբյուրներ: Նավթի, գազի և ածխի պաշարների սպառմանը զուգընթաց մարդկությունը ավելի շատ ուշադրություն պետք է դարձնի միջուկային, արևային և քամու էներգիաների օգտագործմանը:
6. Նոր նյութեր: Մարդկության առաջընթացը թելադրում է նոր նյութերի անհրաժեշտությունը: Արդեն ստեղծվում են կիսահաղորդչային և գերհաղորդչային նյութեր, ջերմակայուն պլաստիկներ, նոր կոմպոզիցիոն պոլիմերներ: Նման խնդիրների լուծումը անհնարին է առանց քիմիկոսի միջամտության:
7. Տեսական հետազոտություններ: Ցանկացած գործնական խնդրի լուծումը թելադրում է որոշակի, տվյալ բնագավառին վերաբերվող նոր տեսական խնդիրների առաջացումը և լուծումը:
2. Ատոմամոլեկուլային ուսմունք
2.1 Մոլեկուլ, ատոմ, տարր
Բոլոր նյութերը բաժանվում են երկու մեծ խմբի` մոլեկուլային և ոչ-մոլեկուլային կառուցվածքի նյութեր:
Մոլեկուլային կառուցվածքի նյութեր կոչվում են այն նյութերը, որոնք կազմված մոլեկուլներից: Օրինակ. շաքարը, ջուրը, թթվածինը:
Ոչ-մոլեկուլային կառուցվածքի նյութերը կազմված են ոչ թե մոլեկուլներից, այլ կառուցվածքային այլ միավորներից (ատոմներից, դրական և բացասական լիցքավորված իոններից, դրական իոններից և ընդհանրացված էլեկտրոններից): Օրինակ. ալմաստը կազմված է ածխածնի ատոմներից, սեղանի աղը` նատրիումի դրական և քլորի բացասական իոններից, երկաթը և ընդհանրապես բոլոր մետաղները` դրական լիցքավորված իոններից և բացասական լիցքավորված ընդհանրացված էլեկտրոններից: Նյութի հատկությունները պայմանավորված են այն կառուցվածքային միավորների հատկություններով, որոնցից կազմված է այն:
![]() Մոլեկուլը`
մոլեկուլային
կառուցվածքով
նյութերի
փոքրագույն
մասնիկն է,
որն ունի դրա
բաղադրությունը,
պահպանում է
դրա քիմիական
հատկությունները
և որոշում է
այդ
հատկությունները:
Մոլեկուլը`
մոլեկուլային
կառուցվածքով
նյութերի
փոքրագույն
մասնիկն է,
որն ունի դրա
բաղադրությունը,
պահպանում է
դրա քիմիական
հատկությունները
և որոշում է
այդ
հատկությունները:
Միևնույն նյութի մոլեկուլներն ունեն նույն բաղդրությունն ու հատկությունները, տարբեր նյութերի մոլեկուլները տարբերվում են ինչպես բաղադրությամբ, այնպես էլ կառուցվածքով և հատկություններով:
Քիմիական հատկությունը նյութերի քիմիական ռեակցիայի մեջ մտնելու ունակությունն է:
Մոլեկուլը կազմված է ատոմներից, որոնք միացած են իրար որոշակի հաջորդականությամբ:
![]() Տարրը որոշակի
հատկություններ
ունեցող
ատոմների
տարատեսակն է,
որն ունի
միջուկի
միևնույն լիցքը:
Օրինակ. H, O, Cl:
Տարրը որոշակի
հատկություններ
ունեցող
ատոմների
տարատեսակն է,
որն ունի
միջուկի
միևնույն լիցքը:
Օրինակ. H, O, Cl:
![]() Ատոմը տարրի
փոքրագույն,
քիմիապես
անբաժանելի
մասնիկն է,
որը
պահպանում է
տարրի
քիմիական հատկությունները:
Ատոմը տարրի
փոքրագույն,
քիմիապես
անբաժանելի
մասնիկն է,
որը
պահպանում է
տարրի
քիմիական հատկությունները:
Ատոմը էլեկտրաչեզոք մասնիկ է, որը կազմված է դրական լիցքավորված միջուկից և դրա շուրջը շարժվող բացասական լիցքավորված էլեկտրոններից: Ամբողջությամբ վերցրած` ատոմը էլեկտրաչեզոք մասնիկ է:
2.2. Պարզ և բարդ նյութեր: Ալոտրոպիա:
Տարրերը բնության մեջ հանդես են գալիս պարզ նյութերի ձևով և բարդ նյութերի բաղադրության մեջ:
Պարզ կոչվում են այն նյութերը, որոնք կազմված են միևնույն տարրի ատոմներից:
Օրինակ, H2 մոլեկուլը կազմված է միայն ջրածին տարրի ատոմներից, հետևաբար պարզ նյութ է:
Բարդ կոչվում են այն նյութերը, որոնք կազմված են տարբեր տարրի ատոմներից:
Օրինակ, ջուրը H2Օ կազմված է ջրածին և թթվածին տարրերի ատոմներց, հետևաբար ջուրը բարդ նյութ է:
Յուրաքանչյուր տարր բնության մեջ առաջացնում է առնվազն մեկ պարզ նյութ: Սակայն կան տարրեր, որոնք առաջացնում են մի քանի պարզ նյութեր:
Միևնույն տարրը, օրինակ թթվածինը` O-ն կարող է առաջացնել երկու պարզ նյութ` O2 և O3, որոնք ունեն տարբեր հատկություններ:
Այն երևույթը, երբ միևնույն տարրը առաջացնում է մի քանի պարզ նյութեր, կոչվում է ալոտրոպիա, իսկ առաջացած պարզ նյութերը` ալոտրոպ ձևափոխություններ:
Ալլոտրոպիայի երևույթը պայմանավորված է երկու պատճառով.
1. Մոլեկուլում ատոմների տարբեր թվով (օրինակ, O2, O3),
2. բյուրեղավանդակի տարբեր կառուցվածքներով (օրինակ, ածխածնի տարբեր ալոտրոպ ձևափոխություններն են ալմաստը, գրաֆիտը, ֆուլերոնը, կարբինը, պոլիկումուլենը):
2.3. Քիմիական տարրերի նշանները: Քիմիական բանաձևերը
Քիմիական տարրերը նշանակվում են տվյալ տարրի լատիներեն անվան առաջին տառով կամ նաև հաջորդ տառերից մեկով, եթե առաջին տառը տարբեր տարրերի անվան մեջ համընկնում է:
Օրինակ, թթվածին` oxigenium – Օ, օսմիում` osmium – Os:
Քիմիական տարրերի լատիներեն անվանումների այդ տառերը կոչվում են քիմիական նշաններ:
Քիմիական նշանը ցույց է տալիս.
1. տվյալ քիմիական տարրը, օրինակ, H – ջրածին, C –ածխածին:
2. տվյալ քիմիական տարրի մեկ ատոմը:
3. տվյալ քիմիական տարրի հարաբերական ատոմական զանգվածը: Օրինակ Ar(H) =1, Ar(C) =12:
4.
տվյալ քիմիական տարրի ատոմների մեկ մոլ քանակը: Օրինակ` ![]()
5. տվյալ տարրի մոլային զանգվածը M(H) =1 գ/մոլ, M(C) =12 գ/մոլ:
![]() Քիմիական նշանների և ինդեքսների միջոցով նյութի որակական և քանակական բաղադրության պայմանական գրառումը կոչվում է բանաձև:
Քիմիական նշանների և ինդեքսների միջոցով նյութի որակական և քանակական բաղադրության պայմանական գրառումը կոչվում է բանաձև:
Քիմիական բանաձևի կամ նշանի առջև դրած թվերը կոչվում են գործակիցներ և ցույց են տալիս տվյալ բանաձևին համապատասխանող կառուցվածքային միավորների թիվը: Քիմիական նշանի ներքևի աջ մասում գրված թիվը կոչվում է ինդեքս և ցույց է տալիս ատոմների թիվը մոլեկուլում:
Բանաձևը ցույց է տալիս.
1. նյութը, օրինակ, H2O – ջուր, CaCl2 –կալցիումի քլորիդ:
2. տվյալ նյութի մեկ մոլեկուլուլը կամ կառուցվածքային միավորը:
3. որակական բաղադրությունը, այսինքն ի՞նչ տարրերից է բաղկացած: Օրինակ H2O -ն բաղկացած է H և O տարրերից:
4. քանակական բաղադրությունը: Օրինակ H2O մոլեկուլը բաղկացած է 2 ատոմ ջրածնից և 1 ատոմ թթվածնից:
5. հարաբերական մոլեկուլային զանգվածը. Mr (H2O) =18 մոլ:
6.
կառուցվածքային միավորների մեկ մոլ քանակը. ![]()
7. կառուցվածքային միավորի մեկ մոլ քանակի զանգվածը M(H2O) =18 գ/մոլ:
2.4. Ատոմի զանգված: Հարաբերական ատոմային և մոլեկուլային զանգվածներ
Տարբեր տարրերի ատոմները իրարից տարբերվում են ոչ միայն միջուկի լիցքի մեծությամբ, այլ նաև զանգվածներով: Ատոմների և մոլեկուլների զանգվածները սովորական միավորներով (գ, կգ) չափելը հարմար չէ, որովհետև ստացվում են շատ փոքր թվեր: Օրինակ, ջրածնի ատոմի զանգվածը
![]() Այդ պատճառով ատոմի և մոլեկուլի զանգվածները չափելու համար ստեղծվել է նոր, ավելի փոքր միավոր:
Այդ պատճառով ատոմի և մոլեկուլի զանգվածները չափելու համար ստեղծվել է նոր, ավելի փոքր միավոր:
Ածխածնի 12C
իզոտոպի ատոմի զանգվածի 1/12 մասը կոչվում է զանգվածի ատոմական միավոր:
![]()
Այդ դեպքում ջրածնի ատոմի զանգվածը ստացվում է 1.008 զ.ա.մ.: Գործնականում ատոմի զանգածի փոխարեն կիրառվում է հարաբերական ատոմային զանգվածը:
![]() Քիմիական տարրի (Ar) հարաբերական ատոմային զանգվածը ցույց է տալիս,թե տվյալ քիմիական տարրի ատոմի զանգվածը քանի անգամ է մեծ ածխածնի
Քիմիական տարրի (Ar) հարաբերական ատոմային զանգվածը ցույց է տալիս,թե տվյալ քիմիական տարրի ատոմի զանգվածը քանի անգամ է մեծ ածխածնի
![]() իզոտոպի զանգվածի 1/12 մասից:
իզոտոպի զանգվածի 1/12 մասից:
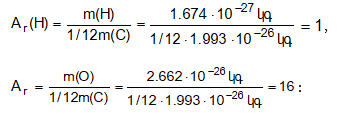
Ինչպես երևում է գրվածից, հարաբերական ատոմային զանգվածը չափողականություն չունեցող մեծություն է: Չպետք է շփոթել հարաբերական ատոմային զանգվածը ատոմի զանգվածի հետ
![]()
Տարրերի հարաբերական ատոմային զանգվածները բերված են պարբերական համակարգում:
Օրինակ.
![]() Նյութի
հարաբերական
մոլեկուլային
զանգվածը` Mr -ը
ցույց է
տալիս, թե
տվյալ նյութի
մոլեկուլի զանգվածը
քանի անգամ է
մեծ ածխածնի
Նյութի
հարաբերական
մոլեկուլային
զանգվածը` Mr -ը
ցույց է
տալիս, թե
տվյալ նյութի
մոլեկուլի զանգվածը
քանի անգամ է
մեծ ածխածնի ![]() իզոտոպի
ատոմի
զանգվածի 1/12
մասից:
իզոտոպի
ատոմի
զանգվածի 1/12
մասից:
Նյութի հարաբերական մոլեկուլային զանգվածը նույնպես չափողականություն չունեցող մեծություն է: Նյութի հարաբերական մոլեկուլային զանգվածը այդ մոլեկուլի կազմի մեջ մտնող բոլոր ատոմների հարաբերական ատոմային զանգվածների գումարն է:
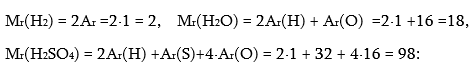
2.5. Նյութի մոլ քանակություն
Միավորների SI համակարգում գոյություն ունի «Նյութի քանակ» հասկացությունը: «Քանակ» նշանակում է կառուցվածքային մասնիկների թիվ:
Քիմիայում որպես նյութի քանակի չափ ընդունված է մոլը:
![]() Մոլը նյութի այն քանակն է, որը պարունակում է այնքան կառուցվածքային միավոր (ատոմ, մոլեկուլ, իոն, ռադիկալ, էլեկտրոն), որքան ատոմ կա 0.012 կգ (12 գ) ածխածնի
Մոլը նյութի այն քանակն է, որը պարունակում է այնքան կառուցվածքային միավոր (ատոմ, մոլեկուլ, իոն, ռադիկալ, էլեկտրոն), որքան ատոմ կա 0.012 կգ (12 գ) ածխածնի ![]() իզոտոպում:
իզոտոպում:
12
գրամ ածխածնի մեջ կա
![]() Այդ թիվը (NA)
կոչվում է Ավոգադրոյի թիվ: Հետևաբար`
Այդ թիվը (NA)
կոչվում է Ավոգադրոյի թիվ: Հետևաբար`
![]() Մոլը նյութի այնպիսի քանակն է, որը պարունակում է
Մոլը նյութի այնպիսի քանակն է, որը պարունակում է ![]() կառուցվածքային մասնիկ:
կառուցվածքային մասնիկ:
Քանի որ մոլեկուլները և ատոմները մենք չենք տեսնում և հաշվել չենք կարող, մոլը օգտագործելու համար անհրաժեշտ է իմանալ մոլի զանգվածը:
Տվյալ նյութի մեկ մոլի զանգվածը կոչվում է մոլային զանգված (M) և չափվում է գ/մոլ միավորներով:
![]() Մոլային զանգվածը նյութի գրամների այն քանակն է, որը թվապես հավասար է հարաբերական ատոմային կամ մոլեկուլային զանգվածին:
Մոլային զանգվածը նյութի գրամների այն քանակն է, որը թվապես հավասար է հարաբերական ատոմային կամ մոլեկուլային զանգվածին:
Ցանկաված նյութի NA հատ մոլեկուլների գումարային զանգվածը այնքան գրամ է, որքան այդ նյութի մոլեկուլային զանգվածն է:
Հետևաբար Ավոգադրոյի թիվը փաստորեն ցույց է տալիս, թե գրամը զանգվածի ատոմական միավորից քանի անգամ է մեծ:
Այսպիսով, նյութի քանակը ելնելով զանգվածից, կարելի է հաշվել հետևյալ բանաձևով.
1811 թ. իտալացի գիտնական Ավոգադրոն մտցրեց մոլեկուլի գաղափարը որպես նյութի փոքրագույն մասնիկի և տվեց մի հիպոթեզ, որը այժմ կոչվում է օրենք:
![]() Տարբեր
գազերի
հավասար
ծավալներում
միևնույն
պայմաններում
պարունակվում
են հավասար
թվով մոլեկուլներ:
Տարբեր
գազերի
հավասար
ծավալներում
միևնույն
պայմաններում
պարունակվում
են հավասար
թվով մոլեկուլներ:
Քանի որ տարբեր գազերի մեկական մոլերը պարունակում են նույն թվով (NA) մոլեկուլներ, ապա ըստ Ավոգադրոյի օրենքի` դրանք պետք է գրավեն նույն ծավալը: Այդ ծավալը կոչվում է մոլային ծավալ (V0) և նորմալ պայմաններում հավասար է 22.4 մոլ/լ-ի:
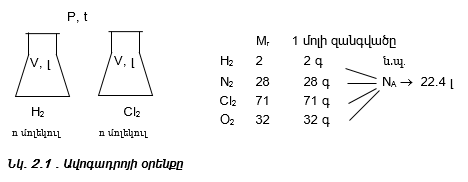
Հետևաբար նյութի քանակը` ելնելով ծավալից կարելի է հաշվել
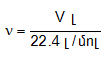
բանաձևով:
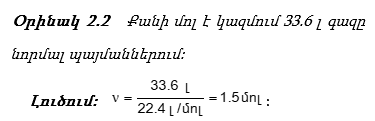
Եթե գազը գտնվում է ոչ նորմալ պայմաններում, ապա մոլային ծավալը կարելի է հաշվել գազային միացյալ հավասարումով`
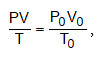
որտեղ զրո ինդեքսով նշված են ճնշումը, ծավալը և ջերմաստիճանը նորմալ պայմաններում (P0 =101.3 կՊա, T0= 273 Կ):
Քանի որ նյութի մեկ մոլում կա NA հատ մասնիկ, ապա նյութի քանակը կարելի է հաշվել` ելնելով մասնիկների թվից
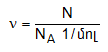
բանաձևով:
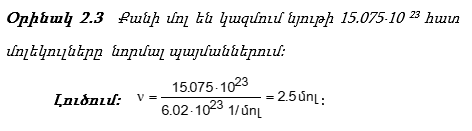
Նկ.2.2-ում
ցույց է
ընդհանրացված
կապը նյութի քանակի
![]() զանգվածի
(m), ծավալի (V) և
մասնիկների
թվի (N) միջև հնարավոր
տասներկու
հաշվարկներով:
զանգվածի
(m), ծավալի (V) և
մասնիկների
թվի (N) միջև հնարավոր
տասներկու
հաշվարկներով:
Այսպիսով նյութի քանակի, ծավալի, զանգվածի և մասնիկների թվի միջև կա հետևյալ կապը`
![]()
Հայտարարում ունենք մեկ մոլին ընկնող մեծություններ` M - 1 մոլի զանգվածը, NA-1 մոլում մասնիկների թիվը, V0-22.4լ/մոլ-1 մոլ գազի ծավալը:
Իմանալով Ավոգադրոյի թվի արժեքը` կարելի է գտնել ցանկացած տարրի մեկ ատոմի զանգվածը գրամներով և գնահատել ատոմի չափերը:

Թեստային ինքնաստուգում
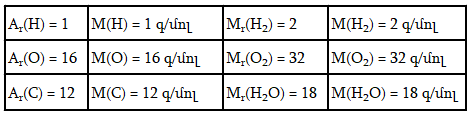
Թեստային հարց Քանի մոլ է կազմում 96գ թթվածինը: Ընտրել ճիշտ պատասխանը
(5 միավոր) 3 մոլ (0 միավոր) 2 մոլ (0 միավոր) 0 մոլ (0 միավոր) -3 մոլ
Թեստային հարց Քանի մոլ է կազմում 33.6լ գազը նորմալ պայմաններում: Ընտրել ճիշտ պատասխանը
(5 միավոր) 1.5 մոլ (0 միավոր) 22.4 մոլ (0 միավոր) 1 մոլ (0 միավոր) 33.6 մոլ
Թեստային հարց Քանի մոլ է կազմում 33.6լ գազը նորմալ պայմաններում: Գրել ճիշտ պատասխանը
(5 միավոր) 1.5
Թեստային
հարց Քանի
մոլ են
կազմում ![]() հատ
մոլեկուլները
նորմալ
պայմաններում:
Ընտրել ճիշտ
պատասխանը
հատ
մոլեկուլները
նորմալ
պայմաններում:
Ընտրել ճիշտ
պատասխանը
(0 միավոր) 5 մոլ (0 միավոր) 1 մոլ (0 միավոր) 33.6 մոլ (5 միավոր) 2.5 մոլ
Թեստային
հարց Քանի
մոլ են
կազմում ![]() հատ
մոլեկուլները
նորմալ
պայմաններում:
Գրել ճիշտ
պատասխանը
հատ
մոլեկուլները
նորմալ
պայմաններում:
Գրել ճիշտ
պատասխանը
(5 միավոր) 2.5
Թեստային ինքնաստուգման վերջ
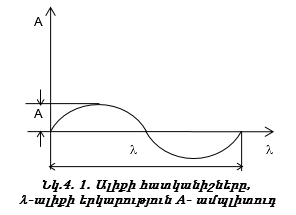
2.6. Գազային նյութերի մոլեկուլային զանգվածի որոշումը
Նյութի հարաբերական մոլեկուլային զանգվածները փորձնականորեն որոշելու համար գտնում են դրանց թվապես հավասար մոլային զանգվածները: Ակնհայտ է, որ գազերի խտությունները, ինչպես նաև որևէ ծավալի զանգվածները, պետք է հարաբերեն իրար այնպես, ինչպես մոլային զանգվածները, քանի որ խտությունները (d) մեկական լիտրերի զանգվածներն են, իսկ մոլային զանգվածները` 22.4-ական լիտրերինը:
Հետևաբար
![]()
![]() հարաբերությունը
կոչվում է
առաջին գազի
հարաբերական
խտությունը
ըստ երկրորդի`
հարաբերությունը
կոչվում է
առաջին գազի
հարաբերական
խտությունը
ըստ երկրորդի`
![]() հետևաբար`
հետևաբար`
![]() որտեղից
որտեղից
![]() այսինքն
գազի մոլային
(մոլեկուլային)
զանգվածը
հավասար է մի
այլ գազի
նկատմամբ դրա
հարաբերական
խտության և
այդ գազի
մոլային
(մոլեկուլային)
զանգվածի
արտադրյալին:
այսինքն
գազի մոլային
(մոլեկուլային)
զանգվածը
հավասար է մի
այլ գազի
նկատմամբ դրա
հարաբերական
խտության և
այդ գազի
մոլային
(մոլեկուլային)
զանգվածի
արտադրյալին:
Եթե
հայտնի գազը
ջրածինն է,
ապա բանձևը
կընդունի
հետևյալ
տեսքը ![]() եթե
թթվածինը` ապա
եթե
թթվածինը` ապա
![]() և
այլն:
և
այլն:
Գազային նյութերի մոլային զանգվածը կարելի է որոշել` օգտվելով նաև մոլային ծավալ հասկացությունից: Եթե հայտնի է գազի որևէ ծավալի զանգվածը նորմալ պայմաններում, ապա հաշվում ենք այդ նյութի 22.4 լ-ի զանգվածը:

Ընդհանրապես
գազերի
ծավալները
չափվում են ոչ-նորմալ
պայմաններում:
Այդ դեպքում,
ինչպես նշվեց
վերը, նման
հաշվարկ կատարելուց
առաջ ծավալը
պետք է բերել
նորմալ պայմանների`
օգտվելով
Բոյլ-Մարիոտտի
և Գեյ-Լյուսակի
միացյալ
հավասարումից` ![]() Մեկ
մոլի համար
Մեկ
մոլի համար ![]() մեծությունը
հաստատուն է և
նշանակվում է
R-ով: Այն
կոչվում է
գազային
ունիվերսալ
հաստատուն և
հավասար է
մեծությունը
հաստատուն է և
նշանակվում է
R-ով: Այն
կոչվում է
գազային
ունիվերսալ
հաստատուն և
հավասար է ![]() Այդ
դեպքում
բանաձևը
կընդունի
հետևյալ տեսքը
PV=RT: Որևէ
Այդ
դեպքում
բանաձևը
կընդունի
հետևյալ տեսքը
PV=RT: Որևէ ![]() մոլի
համար,
ընդունելով,
որ
մոլի
համար,
ընդունելով,
որ ![]() բանաձևը
կընդունի
բանաձևը
կընդունի ![]() տեսքը:
Այդ բանաձևը
կոչվում է
Մենդելեև-Կլայպերոնի
հավասարում,
իմանալով
ցանկացած պայմաններում
գազի որևէ
ծավալի զանգվածը,
այդ բանաձևով
կարելի է
հաշվել դրա մոլի
(մոլեկուլի
զանգվածը):
տեսքը:
Այդ բանաձևը
կոչվում է
Մենդելեև-Կլայպերոնի
հավասարում,
իմանալով
ցանկացած պայմաններում
գազի որևէ
ծավալի զանգվածը,
այդ բանաձևով
կարելի է
հաշվել դրա մոլի
(մոլեկուլի
զանգվածը):
Քիմիական տարրը միջուկի միևնույն լիցք ունեցող ատոմների տեսակ է: Տարրերը բնության մեջ գոյություն ունեն պարզ նյութերի ձևով և բարդ նյութերի բաղադրության մեջ: Ատոմը` տարրի, մոլեկուլը` նյութի փոքրագույն մասնիկներն են, որոնք պահպանում են դրանց հատկությունները: Ատոմների և մոլեկուլների զանգվածները չափվում են զանգվածի ատոմական միավորներով (զ.ա.մ.), որը ածխածնի 12C իզոտոպի ատոմի զանգվածի 1/12 մասն է: Նյութի քանակ նշանակում է կառուցվածքային մասնիկների թիվ, դրա միավորը մոլն է: Նյութի մեկ մոլում պարունակվում է 6.02×1023 հատ կառուցվածքային մասնիկ: Մոլի զանգվածը նյութի գրամների այն քանակն է, որը թվապես հավասար է այդ նյութի հարաբերական մոլեկուլային զանգվածին: Գազային նյութերի մեկ մոլը նորմալ պայմաններում գրավում է 22.1 լ ծավալ:
Սովորելու նպատակը
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1. Ձևակերպել և ճշգրիտ օգտագործել տարր, ատոմ, մոլեկուլ, պարզ և բարդ նյութեր հասկացությունները:
2. Որոշել տարրի կամ նյութի մոլի զանգվածը, կատարել հաշվումներ մոլի զանգվածի, դրանում եղած մասնիկների թվի, գազային նյութերի դեպքում դրանց ծավալի միջև, հաշվել տարրի մեկ ատոմի, նյութի մեկ մոլեկուլի զանգվածը և ծավալը:
Հիմնական հասկացություններ
Քիմիական տարր կոչվում է միջուկի միևնույն լիցք ունեցող ատոմների տեսակը:
Ալոտրոպիան տվյալ տարրի մի քանի պարզ նյութեր առաջացնելու երևույթն է:
Զանգվածի ատոմական միավորը ( Զ.ա.մ.) ածխածնի 12C իզոտոպի ատոմի զանգվածի 1/12 մասն է:
Ատոմի զանգվածը կարող է չափվել գրամներով, կգ-երով և զանգվածի ատոմական միավորներով:
Հարաբերական ատոմական զանգվածը ատոմի զանգվածի հարաբերությունն է զանգվածի ատոմական միավորներին: Այն չունի չափողականություն:
Նյութի քանակ` նշանակում է կառուցվածքային մասնիկների թիվ:
Մոլ կոչվում է նյութի այն քանակը, որը պարունակում է է 6.02.1023 հատ կառուցվածքային մասնիկ:
Մոլի զանգվածը նյութի գրամների այն քանակն է, որը թվապես հավասար է այդ նյութի հարաբերական մոլեկուլային զանգվածին:
3. Ատոմի կառուցվածքը
3.1.Ատոմի միջուկային մոդելը
1911 թ. Ռեզերֆորդն առաջարկեց ատոմի կառույցի փորձով հիմնավորված մոդել: Ըստ նրա ատոմը կազմված է դրական լիցքավորված միջուկից և դրա դաշտում, զգալի հեռավորության վրա, դրա շուրջը պտտվող բացասական լիցքավորված էլեկտրոններից: Միջուկի չափերը (10-13մկմ) շատ փոքր են ատոմի չափերի հետ (10-8մկմ) համեմատած: Միջուկի լիցքը թվապես հավասար է էլեկտրոնների գումարային լիցքին, այսինքն` ատոմը էլեկտրաչեզոք է: Միջուկի զանգվածը շատ մեծ է էլեկտրոնների զանգվածից և միջուկում է կենտրոնացված ատոմի համարյա ամբողջ զանգվածը: Ատոմի կառուցվածքի այս մոդելը նման է արեգակնային համակարգին և հաճախ կոչվում է մոլորակային մոդել:
3.2. Միջուկի բաղադրությունը
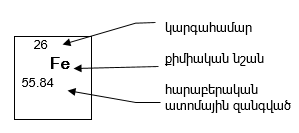
Միջուկը կազմված է դրական լիցքավորված պրոտոններից և էլեկտրաչեզոք նեյտրոններից` բացառությամբ ջրածնի թեթև իզոտոպի ատոմի, որի միջուկը կազմված է մեկ պրոտոնից: Պրոտոնները և նեյտրոնները այլ կերպ կոչվում են նուկլոններ: Աղյուսակ 3.1-ում բերված են նուկլոնների և էլեկտրոնների հիմնական բնութագրերը:
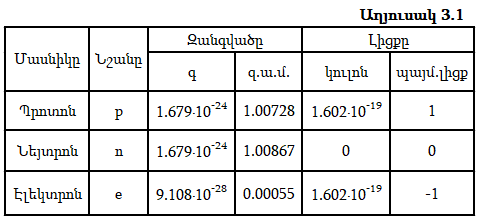
Պրոտոնի և նեյտրոնի զանգվածները համարյա նույնն են և մոտ են մեկ զ.ա.մ.-ին: Դրանք համապատասխանաբար մեծ են էլեկտրոնի զանգվածից 1836.12 և 1838.65 անգամ: Քանի որ էլեկտրոնի զանգվածը շատ փոքր է միջուկի զանգվածից, ապա այն պտտվում է միջուկի շուրջը: Նուկլոնների միջև գործում են հզոր ձգողական ուժեր` միջուկային ուժեր: Այդ ուժերը պայմանավորված չեն լիցքով, հազարավոր անգամ գերազանցում են էլեկտրոստատիկ ձգողության ուժերին և գործում են փոքր (10-15մ) հեռավորության վրա: Դրանց բնույթը հայտնի չէ: Միջուկային ուժերով է պայմանավորված միջուկի հսկայական էներգիան: Այն ռեակցիները, որոնց ընթացքում քայքայվում կամ առաջանում են նոր միջուկներ, կոչվում են միջուկային ռեակցիաներ: Այս ռեակցիաների էներգիան հազարավոր անգամ գերազանցում է քիմիական ռեակցիաների էներգիային:
3.3. Զանգվածային թիվ
Միջուկը բնորոշվում է երկու մեծություններով` կարգահամարով (Z) և զանգվածային թվով (A):
Զանգվածային թիվը որոշվում է միջուկում պարունակվող նուկլոնների (պրոտոնների և նեյտրոնների) թվերի գումարով, իսկ կարգահամարը` միջուկում պրոտոնների թվով:
![]()
որտեղ
N-ը
նեյտրոնների
թիվն է:
Միջուկի բնութագրերը
գրանցվում են
տարրի
քիմիական նշանի
ձախ մասում:
Ներքևում
գրվում է կարգահամարը,
վերևում`
զանգվածային
թիվը: Օրինակ,
ածխածնի
ատոմի
միջուկի
բնութագրերը
նշանակվում են
![]() որը
նշանակում է,
որ միջուկի
լիցքը
(հետևաբար և
պրոտոնների
թիվը) հավասար
է +6-ի, իսկ զանգվածային
թիվը` 12-ի:
Նեյտրոնների
թիվը հավասար է
զանգվածային
թվի և միջուկի
լիցքի
տարբերությանը:
N=A–Z=12-6=6:
որը
նշանակում է,
որ միջուկի
լիցքը
(հետևաբար և
պրոտոնների
թիվը) հավասար
է +6-ի, իսկ զանգվածային
թիվը` 12-ի:
Նեյտրոնների
թիվը հավասար է
զանգվածային
թվի և միջուկի
լիցքի
տարբերությանը:
N=A–Z=12-6=6:
Քանի որ պրոտոնի և նեյտրոնի զանգվածները շատ քիչ են տարբերվում իրարից, ապա զանգվածային թիվը մոտավորապես ցույց է տալիս նաև միջուկի հարաբերական զանգվածը և միշտ ամբողջ թիվ է: Պրոտոնի և նեյտրոնի միջև կա որոշակի փոխադարձ կապ: Որոշակի պայմաններում պրոտոնը կարող է վերածվել նեյտրոնի և հակառակը:
3.4. Կարգահամարի ֆիզիկական իմաստը: Իզոտոպներ
Կարգահամարը ցույց է տալիս.
1. Տարրի հերթական համարը պարբերական համակարգում:
2. Միջուկի դրական լիցքի մոծությունը:
3. Պրոտոնների թիվը մրջուկում:
4. Միջուկի շուրջը պտտվող էլեկտրոնների թիվը:
Ելնելով զանգվածային թվի պատկերացումներից` ստացվում է, որ ատոմային զանգվածները պետք է արտահայտվեն ամբողջ թվերով:
1910թ. Սոդիի կողմից հաստատվել է, թր ռադիոակտիվ քայքայման ժամանակ կարող են առաջանալ միևնույն տարրի ատոմներ, որոնք ունենալով միևնույն միջուկի լիցքը, ունեն տարբեր զանգվածներ, այիսինքն` ունեն նույն կարգահամարը, բայց տարբեր զանգվածային թվեր: Այդպիսի ատոմները կոչվեցին իզոտոպներ:
![]() Ատոմների
տարատեսակները,
որոնք ունեն
միևնույն
թվով
պրոտոններ,
այսինքն
միևնույն միջուկի
լիցքը, բայց
տարբեր թվով
նեյտրոններ,
հետևաբար
տարբեր
զանգվածային
թվեր, կոչվում
են իզոտոպներ:
Ատոմների
տարատեսակները,
որոնք ունեն
միևնույն
թվով
պրոտոններ,
այսինքն
միևնույն միջուկի
լիցքը, բայց
տարբեր թվով
նեյտրոններ,
հետևաբար
տարբեր
զանգվածային
թվեր, կոչվում
են իզոտոպներ:
Օրինակ, ջրածին տարրն ունի երեք իզոտոպ:
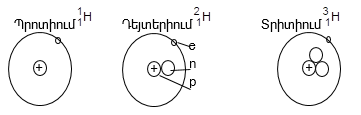
Բնության մեջ բոլոր տարրերը հանդիպում են իզոտոպների խառնուրդի ձևով:
Հարաբերական ատոմային զանգվածը ցույց է տալիս տարրի` բնության մեջ գոյություն ունեցող բոլոր իզոտոպների զանգվածային թվերի միջին մեծությունը, ուստի չի արտահայտվում ամբողջ թվերով:
Տարրի միջին հարաբերական զանգվածը որոշվում է հետևյալ բանաձևով.
![]()
որտեղ ![]() իզոտոպի
զանգվածային
բաժինն է, A -ն
զանգվածային
թիվը:
իզոտոպի
զանգվածային
բաժինն է, A -ն
զանգվածային
թիվը:

Լինում են տարբեր տարրերի ատոմներ, որոնք ունեն միևնույն զանգվածային թիվը: Այդպիսի ատոմները կոչվում են իզոբարներ: Օրինակ.
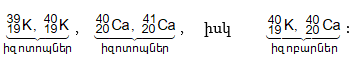
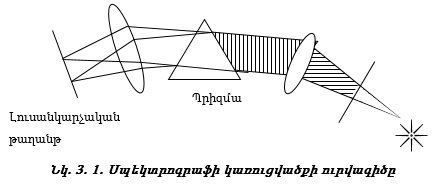
3.5. Սպեկտրոգրաֆի աշխատանքի սկզբունքը
Ատոմների էլեկտրոնային թաղանթների կառուցվածքի պարզաբանման փորձարարական հինքը քիմիական տարրերի սպեկտրների մասին տվյալներն են: Սպեկտրոգրաֆում լույսի փունջը անցնելով իր ալիքի երկարության հետ համաչափելի ճեղքի միջով` ենթարկվում է ցրման (դիֆրակցիայի) և բաղադրիչ ճառագայթները, ընկնելով լուսանկարչային թաղանթի վրա, գրանցվում են ըստ ալիքի երկարության: Տեսանելի և ուլտրամանուշակագույն ճառագայթներն ուսումնասիրելու նպատակով սովորաբար օգտագործում են օպտիկական սպեկտրոգրաֆներ, որոնցում ճառագայթները բաժանում են` անցկացնելով ապակե պրիզմայի միջով` տեսանելի մարզի, կամ կվարցե պրիզմայի միջով` ուլտրամանուշակագույն մարզի համար: Սպեկտրոգրաֆի սկըզբունքային սխեման բերված է նկ. 3.1-ում: Պրիզմայի միջոցով լույսի բաժանումը պայմանավորված է նրանով, որ բեկման ցուցիչը կախված է լույսի ալիքի երկարությունից:
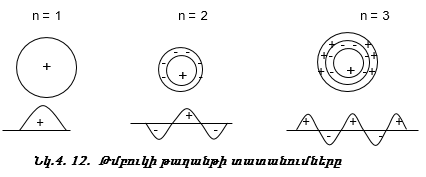
Մարմնի կողմից արձակված լույսի ճառագայթների բաժանման միջոցով ստացված սպեկտրները կոչվում են էմիսիոն սպեկտրներ: Դրանք լինում են անընդհատ, գծային և շերտավոր: Անընդհատ սպեկտրներ առաջացնում են շիկացած պինդ կամ հեղուկ մարմինների արձակած ճառագայթները: Գազերը կարող են ճառագայթել տաքացման կամ էլեկտրական պարպման միջոցով: Դրանց ճառագայթումը տալիս է գծային սպեկտր` կազմված առանձին գծերից, կամ շերտավոր սպեկտր` կազմված շերտերից: Ներկայումս հաստատված է, որ գծային սպեկտրերը ստացվում են ատոմների ճառագայթումից, իսկ շերտավորը` մոլեկուլների: Յուրաքանչյուր տարրի ատոմ և յուրաքանչյուր նյութի մոլեկուլ ունի իր բնորոշ սպեկտրը, որը որոշակի գծերի կամ շերտերի հավաքածու է: Եթե ճառագայթման աղբյուրը տեղադրենք մագնիսական դաշտում, ապա առանձին գիծը վեր է ածվում մի քանի գծի (Զեմանի էֆեկտ): Նման պատկեր է ստացվում, եթե ճառագայթման աղբյուրը տեղավորենք էլեկտրական դաշտում:
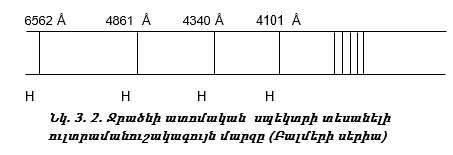
3.6. Ջրածնի ատոմի սպեկտրը
Տեսանելի մարզում ջրածնի սպեկտրն ունի ընդամենը չորս գիծ: Դրան հարող ուլտրամանուշակագույն մարզում կան ևս մի քանի գծեր, որոնք միասին կազմում են Բալմերի սերիան (նկ. 3.2):
Բալմերը
ցույց է տվել,
որ այդ
սերիայի
գծերի ալիքային
թիվը` ![]() կարելի
է հաշվել
հետևյալ
բանաձևով`
կարելի
է հաշվել
հետևյալ
բանաձևով`

որտեղ n=3, 4, 5 …
Ալիքային թիվը ալիքի երկարության հակադարձ մեծությունն է, այսինքն` մեկ սանտիմետրի վրա ալիքների թիվը: Հավասարման մեջ մտնող R հաստատունը կոչվում է Ռիդբերգի հաստատուն:
R=109678 սմ-1:
Ջրածնի ատոմի սպեկտրի ուսումնասիրումը ուլտրամանուշակագույն և ինֆրակարմիր մարզում հայտնաբերել է ևս մի քանի գծերի սերիաներ, որոնք կոչվում են Լայմանի, Պաշենի, Բրեկետի, Պֆունցի սերիաներ (նկ. 3.3):
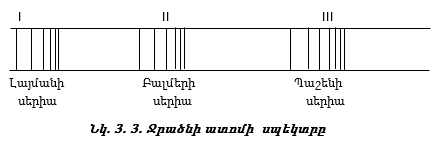
Պարզվել է, որ այդ սերիաների գծերի ալիքային թվերը որոշվում են Բալմերի բանաձևին նման մի ընդհանուր բանաձևով`
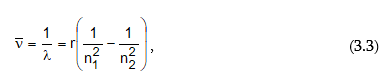
որտեղ n1 և n2–ը ամբողջ թվեր են, ընդ որում` n1 > n2 –ից: n1-ին և n2-ին արժեքներ տալով` կարելի է հաշվել բոլոր սերիաների գծերին համապատասխանող ալիքի երկարությունները: n1=1; n2=2,3,4… - Լայմանի սերիան, n1=2; n2=3,4,5… - Բալմերի սերիան և այլն: Եթե հավասարման երկու մասերը բազմապատկենք c-ով (լույսի արագություն) և h-ով (Պլանկի հաստատուն), ապա կստանանք
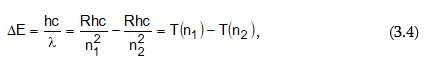
Այսպիսով ստացվեց, որ ճառագայթված էներգիան միշտ կարելի է արտահայտել n1 և n2 ամբողջ թվերից կախված ֆունկցիաների (T) տարբերությամբ: Այդ ֆունկցիաները կոչվում են թերմեր: R-ի և n-ի ֆիզիկական իմաստը պարզվեց միայն Բորի տեսության ստեղծումից հետո:
3.7. Գաղափար լուսային քվանտների մասին
1900 թ. Պլանկը ցույց տվեց, որ տաքացած մարմինների լույս արձակելու հատկությունը կարելի է քանակապես ճիշտ նկարագրել միայն ենթադրելով, որ ատոմների կողմից էներգիան արձակվում կամ կլանվում է ոչ թե անընդհատ, այլ առանձին փոքրագույն բաժիններով` քվանտներով
![]()
որտեղ ![]() արձակված
կամ կլանված
էներգիան է, E-ն
մեկ քվանտի
էներգիան է, n-ը`
ամբողջ թիվ է`
1,2,3,…:
արձակված
կամ կլանված
էներգիան է, E-ն
մեկ քվանտի
էներգիան է, n-ը`
ամբողջ թիվ է`
1,2,3,…:
Քվանտի էներգիան ճառագայթված լույսի հաճախության հետ կապված է
![]()
հավասարումով, որը կոչվում է Պլանկի հավասարում, որտեղ ν-ն լույսի հաճախությունն է, c-ն` լույսի արագությունը, h-ը` Պլանկի հաստատունը. հ=6.625×10-34 Ջ×վրկ:

3.8. Բորի տեսությունը ջրածնի ատոմի համար
Ոեզերֆորդի մոդելը չէր կարող բացատրել ջրածնի ատոմի սպերտրը, որովհետև այդ մոդելն ուներ հակասություններ:
1. Ըստ էլեկտրադինամիկայի օրենքների պտտվող լիցքը, տվյալ դեպքում` էլեկտրոնը, պետք է ճառագայթեր էներգիա: Ճառագայթելով դրա էներգիան պետք է պակասի, աստիճանաբար պտտման շառավիղը պետք է փոքրանա, էլեկտրոնը պետք է ընկնի միջուկի վրա: Սակայն այս պատկերը չի համընկնում փորձի հետ:
2. Քանի որ էլեկտրոնի էներգիան պետք է անընդհատ նվազի, ապա նրա առաջացրած սպեկտրը պետք է լինի անընդհատ: Փորձը ցույց է տալիս, որ ջրածնի սպեկտրը ընդհատ է:
Այս հակասությունները պարզաբանվեցին Բորի կողմից: Նա տվեց նոր տեսություն ջրածնի ատոմի կառուցվածքի վերաբերյալ (1913թ.):
Բորն իր տեսությունը տվել է երեք կանխադրույթների (պոստուլատների) ձևով:
Առաջին կանխադրույթ. Էլեկտրոնը պտտվում է միջուկի շուրջը ոչ թե կամայական ուղեծրերով, այլ քվանտային տեսությանը բավարարող` որոշակի ուղեծրերով: Այդ ուղեծրերը կոչվում են ստացիոնար կամ “թույլատրված”ուղեծրեր:
Երկրորդ կանխադրույթ. Էլեկտրոնը պտտվելով “թույլատրված” ուղեծրերից որևէ մեկով, չի ճառագայթում և չի կլանում էներգիա: Առաջին ուղեծիրը կոչվում է հիմնական ուղեծիր, մնացածները` գրգռված: Գրգռված վիճակում Էլեկտրոնը մնում է ոչ ավելի, քան t=10-8վրկ:
Երրորդ կանխադրույթ. Էլեկտրոնը կարող է մեկ “թույլատրված” ուղեծրից տեղափոխվել մյուսի վրա: Հեռավոր ուղեծրից ավելի մոտ ուղեծիր տեղափոխվելիս ճառագայթում է էներգիա` մեկ քվանտի ձևով:
![]()
Բորի կանխադրույթները խիստ հակասում են դասական էլեկտրադինամիկայի օրենքներին: Ըստ դասական էլեկտրադինամիկայի օրենքների` էլեկտրամագնիսական դաշտում պտտվող լիցքը ճառագայթում է էներգիա: Սակայն այս կանխադրույթներն իրենց արդարացումը ստացան այն արդյունքներում, որոնք Բորը ստացել էր ջրածնի ատոմի սպեկտրը հաշվելիս:
3.9. Բորի տեսության մաթեմատիկական հետևությունները
Ըստ Բորի
Էլեկտրոնը
պտտվում է
ստացիոնար ուղեծրերով,
եթե դրա
շարժման
քանակի
մոմենտը բազմապատիկ
է ![]()
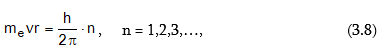
որտեղ me–ն Էլեկտրոնի զանգվածն է, v-ն Էլեկտրոնի արագությունը, r-ը ուղեծրի շառավիղն է:
Շարժման
քանակի
մոմենտը ![]() վեկտորի
և
վեկտորի
և ![]() վեկտորի
վեկտորական
արտադրյալն է`
վեկտորի
վեկտորական
արտադրյալն է`
![]()
![]() մեծությունն
ընդունված է
նշանակել
մեծությունն
ընդունված է
նշանակել ![]() Այսպիսով,
կստանանք
Այսպիսով,
կստանանք
![]()
Էլեկտրոնի արագությունը, ցանկացած պահի համընկնում է շրջանային ուղեծրի շոշափողի հետ (նկ. 3.5) և փոփոխվում է ուղեծրով էլեկտրոնի շարժմանը զուգահեռ:
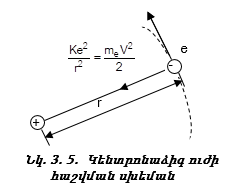
Դրա համար
անհրաժեշտ է
Էլեկտրոնի
վրա, դեպի միջուկն
ուղղված ուժ,
որը
կառաջացնի
դեպի միջուկն
ուղղված արագացում:
Ըստ ուրվագծի
այն հավասար է
![]() Այդ ուժը
կուլոնյան
ձգողական
ուժն է:
Այսպիսով,
կստանանք`
Այդ ուժը
կուլոնյան
ձգողական
ուժն է:
Այսպիսով,
կստանանք`

որտեղ K-ն հաստատուն մեծություն է: Փաստորեն ունենք երկու հավասարում երկու անհայտով (r,V): (3.9) և (3.10) հավասարումների համակարգի լուծումը տալիս է Էլեկտրոնի շարժման արագությունը`

և շառավղի արտահայտություններ`

Տեղադրելով մեծությունների արժեքները` կստանսնք
![]()
և
![]()
Այսպիսով, ջրածնի ատոմում առաջին ուղեծրի շառավիղը a0 = 0.53×10-10 մ է, իսկ արագությունը` v = 2.188×106/ մ/վրկ (նկ. 3.6):
Բորը հաշվել է Էլեկտրոնի էներգիան տարբեր պայմաններում:
Էլեկտրոնի
լրիվ
էներգիան
հավասար է
կինետիկ` ![]() պոտենցիալ
էներգիաների
գումարին`
պոտենցիալ
էներգիաների
գումարին`
![]()
![]() :
(3.15)
:
(3.15)
Տեղադրելով r –ի և V –ի արժեքները` կստանանք
![]()
Քանի որ ջրածնի ատոմում Էլեկտրոնի էներգիան քվանտացվում է, ապա ջրածնի ատոմում կան էներգետիկ մակարդակներ (նկ. 3.7):
3.10. Ջրածնի ատոմի սպեկտրի բացատրությունն
ըստ Բորի
1. Որակական բացատրություն. Առաջին` Լայմանի սերիայի գծերն առաջանում են, երբ Էլեկտրոնը մնացած բոլոր ուղեծրերից անցնում է առաջին ուղեծիր (նկ. 3.7):
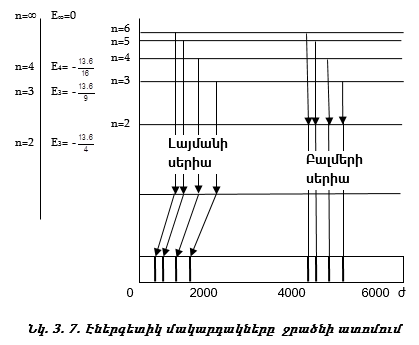
Յուրաքանչյուր թռիչքին համապատասխանում է որոշակի ալիքի երկարությամբ մեկ ֆոտոն: Երկրորդ (Բալմերի) սերիայի գծերն առաջանում են, երբ Էլեկտրոնը մնացած բոլոր ուղեծրերից (3,4,5) թռչում է երկրորդ ուղեծիր:
2.
Քանակական
բացատրություն.
Ըստ երրորդ
պոստուլատի
ունենք ![]()
Տեղադրելով Eհ և Eմ արժեքները (3.4) հավասարման մեջ և տեղափոխելով հավասարումը` կստանանք.
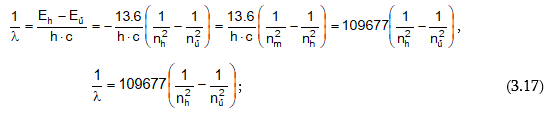
Ստացվեց նույն բանաձևը ինչ-որ Բալմերինը: n1 –ը Բալմերի բանաձևում մոտակա ուղեծրի համարն է, n2 –ը` հեռավոր ուղեծրի համար, λ -ն ճառագայթված ալիքի երկարությունն է:
![]() այն ալիքի
երկարության
հակադարձ
մեծությունն
է, երբ
էլեկտրոնը
անվերջ հեռու
ուղեծրից թռչում
է առաջին
ուղեծիր:
այն ալիքի
երկարության
հակադարձ
մեծությունն
է, երբ
էլեկտրոնը
անվերջ հեռու
ուղեծրից թռչում
է առաջին
ուղեծիր:

Այսպիսով ջրածնի ատոմի սպեկտրալ գծերն առաջանում են հետևյալ կերպ.
nմ =1; nh =2,3,4, … - Լայմանի սերիա,
nմ =2; nh =3,4,5, … - Բալմերի սերիա,
nմ =3; nh =4,5,6, … - Պաշենի սերիա:
3.11. Բորի - Զոմերֆելդի տեսության հակասությունները
Բորը բացատրեց ջրածնի ատոմի կառուցվածքի օրինաչափությունները: Հետագայում Զոմերֆելդը զարգացրեց Բորի տեսությունը և մշակեց բազմաէլեկտրոն ատոմների կառուցվածքի տեսությունը: Ըստ այդ տեսության` ատոմների ստացիոնար ուղեծրերը, ոչ միայն շրջանաձև են, այլ նաև էլիպսաձև և դասավորված են տարածության մեջ տարբեր ձևերով: Սակայն Բորի - Զոմերֆելդի տեսությունը չի բավարարում գիտության ներկայիս պահանջներին:
Չնայած Բորի - Զոմերֆելդի տեսությունը բացատրեց ատոմների սպեկտրների շատ առանձնահատկություններ, սակայն այն ունի մի շարք անհաղթահարելի հակասություններ:
Այս տեսության գիխավոր հակասություններն են.
1. Տեսության հիմքը քվանտացման կանոններն են, որոնք չեն բխում մեխանիկայի և էլեկտրադինամիկայի օրենքներից;
2. Այս տեսությունը չի կարողանում բացատրել սպեկտրալ բնութագրերի որոշ նրբությունները;
3. Բազմաէլեկտրոն ատոմների էներգիան հաշվելիս տալիս է փորձի հետ չհամընկնող տվյալներ (նույնիսկ պարզագույն դեպքի` He – ի ատոմի համար);
4. Տեսությունը չի բացատրում քիմիական կապի առաջացումը:
4. Քվանտային մեխանիկայի տարրերը
4.1. Ալիքներ և մասնիկներ
Ալիքներն ու մասնիկներն ունեն մի շարք ընդհանուր և տարբեր հատկանիշներ, երկուսն էլ տեղափոխում են էներգիա: Մասնիկներն ունեն դադարի զանգված, իմպուլս: Ալիքներն ունեն ալիքի երկարություն (λ), տատանման հաճախականություն (ν) և ամպլիտուդ (A):
Ավելի լավ հասկանալու համար ալիքների և մասնիկների տարբերությունը` կատարենք երկու փորձ.
1. Բաց թողնենք մասնիկների փունջը նեղ ճեղքով: Մասնիկներն անցնելով ճեղքով` կընկնեն էկրանի A կետը (նկ.4.2 ա): A կետի երկու կողմերում ընկնող մասնիկների թիվը կնվազի: Նրբագծված մասը համեմատական է մասնիկների թվին:
2. Կատարենք նույն փորձը ալիքների համար: Բաց թողնենք ալիքների փունջ նեղ ճեղքով,որի լայնությունը համեմատական է ալիքի երկարությանը: Ի տարբերություն մասնիկների` ալիքներն անցնելով ճեղքով, ենթարկվում են դիֆրակցիայի (նկ.4.2 բ): Դիֆրակցիան արգելքի շրջանցումն է ալիքի կողմից:
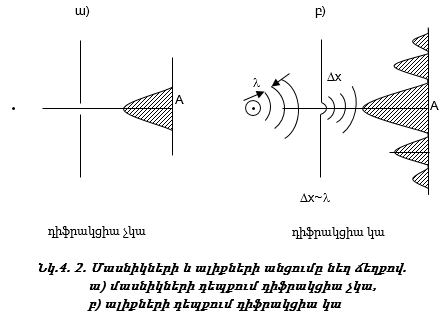
4.2. Լույսի ալիքամասնիկային երկվությունը
Լույսը էլեկտրամագնիսական ալիք է, սակայն տարածվում է առանձին մասնիկիների` ֆոտոնների ձևով: Ըստ Էնշտեյնի հավասարման մեկ ֆոտոնի էներգիան`
E = mc2
որտեղ` m-ը ֆոտոնի զանգվածն է, C –ն` լույսի արագությունը: Մյուս կողմից լույսն ունի ալիքային բնույթ, ենթարկվում է դիֆրակցիայի: Որպես ալիք ֆոտոնի էներգիան որոշվում է Պլանկի բանաձևով.
![]()
Վերջին երկու հավասարումներից հետևում է, որ

Մարմնի զանգվածի և արագության արտադրյալը կոչվում է շարժման քանակ կամ իմպուլս: P = mC, տեղադրելով ( 4.1)-ում` վերջնականորեն կստանանք
![]()
Այս հավասարումն արտահայտում է ֆոտոնի ալիքամասնիկային երկվությունը, որովհետև հավասարման ձախ մասում ունենք ալիոային բնութագիր - λ, աջ մասում մասնիկային` P=mc:
Լույսի մասնիկային բնույթը հաստատվում է ֆոտոէֆեկտի, իսկ ալիքային հատկությունը` դիֆրակցիայի երևույթով:
4.3. Դե-Բրոյլի տեսությունը
1924 թ Լուի Դե-Բրոյլը (Ֆրանսիա) առաջարկեց, որ ալիքամասնիկային երկվությունը բնորոշ է ոչ միայն ֆոտոններին, այլ նաև ցանկացած նյութական մասնիկներին: Ցանկացած նյութական մասնիկի շարժումը կարելի է դիտել որպես ալիքային պրոցես և ալիքի երկարությունը որոշվում է Դե-Բրոյլի բանաձևով`
![]()
որտեղ m–ը նյութի զանգվածն է, v–ն` արագությունը, h–ը` Պլանկի հաստատունը:
Շարժվող մասնիկին համապատասխանող ալիքները ստացել են Դե-Բրոյլի ալիքներ անվանումը:
Հետագայում Դե-Բրոյլի ենթադրությունը հաստատվեց, հայտնաբերվեց էլեկտրոնների դիֆրակցիայի երևույթը, իսկ դիֆրակցիան ալիքային պրոցեսի բնութագիր է: Էլեկտրոնների փունջը դիֆրակցիոն ցանցով անցկացնելիս ֆոտոթաղանթի վրա նկատվում է նույնպիսի դիֆրակցիոն պատկեր, ինչպես ճառագայթների անցման ժամանակ: Որպես դիֆրակցիոն ցանց` օգտագործվել են մետաղների բյուրեղները: Ատոմները բյուրեղում դասավորված են կանոնավոր կարգով` առաջացնելով բնական դիֆրակցիոն ցանց:
1927թ Ջերմերը և Դևիսոնը (ԱՄՆ), Թոմսոնը (Անգլիա) և Տարտակովսկին (ԽՍՀՄ) առաջին անգամ փորձնականորեն հաստատեցին էլեկտրոնների դիֆրակցիան:
Ներկայումս էլեկտրոնների դիֆրակցիան օգտագործում են նյութի կառուցվածքը ուսումնասիրելու նպատակով: Սարքը, որում նկատվում է այդ երևույթը, կոչվում է էլեկտրոնագրաֆ:
Յգտվելով (4.3) հավասարումից օգնությամբ կարող ենք հաշվել λ-ի արժեքը զանազան մարմինների համար (օրինակ 4.1):

Մակրոմարմինների
ալիքային
հատկությունները
ոչնչով չեն
արտահայտվում:
Եթե ալիքի
երկարությունը
զգալիորեն
փոքր է ատոմի
չափերից ![]() ապա
հնարավոր չէ
պատրաստել
այդ չափի
դիֆրակցիոն
ցանց կամ
ճեղք: Այլ է
պատկերը
միկրոմասնիկների
համար: (4.3)
հավասարման
համաձայն
ապա
հնարավոր չէ
պատրաստել
այդ չափի
դիֆրակցիոն
ցանց կամ
ճեղք: Այլ է
պատկերը
միկրոմասնիկների
համար: (4.3)
հավասարման
համաձայն ![]() էլեկտրոնի
ալիքի
երկարությունը
էլեկտրոնի
ալիքի
երկարությունը
![]() այսինքն`
այն ատոմի
չափերի կարգի
մեծություն է:
Այդ չափի
դիֆրակցիոն
ցանց
պատրաստել
անհնարին է:
Բարեբախտաբար
բնության մեջ
կան այդպիսի
ցանցեր: Պինդ
նյութի,
մասնավորապես
մետաղների
բյուրեղային
ցանցում
ատոմների
հեռավորությունը
մի քանի
անգստրեմ է
այսինքն`
այն ատոմի
չափերի կարգի
մեծություն է:
Այդ չափի
դիֆրակցիոն
ցանց
պատրաստել
անհնարին է:
Բարեբախտաբար
բնության մեջ
կան այդպիսի
ցանցեր: Պինդ
նյութի,
մասնավորապես
մետաղների
բյուրեղային
ցանցում
ատոմների
հեռավորությունը
մի քանի
անգստրեմ է ![]() այսինքն`
բավարարում է
դիֆրակցիայի
պայմանին:
այսինքն`
բավարարում է
դիֆրակցիայի
պայմանին:
4.4. Հայզենբերգի անորոշության սկզբունքը
Էլեկտրոնի փունջը նեղ ճեղքով անցկացնելիս էկրանի վրա ստացվում է նույն պատկերը, ինչ որ ալիքների դեպքում:
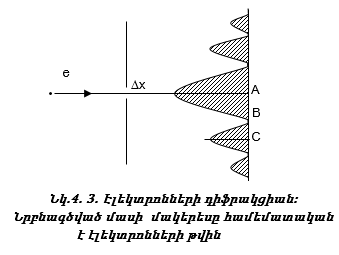
Իսկ ի՞նչ կարելի է ասել էլեկտրոնի մասին, ո՞ր կետը կընկնի: Մեծ հավանականությամբ կարելի է ասել, որ կընկնի A կետը, հնարավոր է նաև C կետը, բայց B կետը չի ընկնի:
Այսպիսով էլեկտրոնների փնջի տեղը ճշգրիտ կարող ենք որոշել, սակայն մեկ էլեկտրոնի տեղը և արագությունը միաժամանկ չենք կարող որոշել: Սա քվանտային մեխանիկայի հիմնական սկզբունքներից մեկն է և կոչվում է Հայզենբերգի անորոշության սկզբունք:
![]() Հնարավոր
չէ
միաժամանակ
ճշգրիտ
որոշել մասնիկի
տեղը և դրա
իմպուլսը (p = mv):
Որքան ճշգրիտ
որոշենք
մասնիկի տեղը,
այնքան
անորոշ է
դառնում դրա
իմպուլսը, և
հակառակը:
Հնարավոր
չէ
միաժամանակ
ճշգրիտ
որոշել մասնիկի
տեղը և դրա
իմպուլսը (p = mv):
Որքան ճշգրիտ
որոշենք
մասնիկի տեղը,
այնքան
անորոշ է
դառնում դրա
իմպուլսը, և
հակառակը:
Անորոշության առնչությունն ունի հետևյալ տեսքը.
![]()
կամ
![]()
որտեղ ![]() մասնիկի
տեղի,
կոորդինատի
անորոշությունն
է,
մասնիկի
տեղի,
կոորդինատի
անորոշությունն
է, ![]() կոորդինատի
ուղղությամբ
իմպուլսի և
արագության
անորոշությունն
է:
կոորդինատի
ուղղությամբ
իմպուլսի և
արագության
անորոշությունն
է:
Քանի որ ![]() մեծությունը,
որը մտնում է
անորոշության
առնչության
մեջ, փոքր
մեծություն է,
ապա մակրոօբյեկտների
համար
մեծությունը,
որը մտնում է
անորոշության
առնչության
մեջ, փոքր
մեծություն է,
ապա մակրոօբյեկտների
համար ![]() էլ
ավելի փոքր
կլինի և
հետևաբար
կոորդինատի և
իմպուլսի
անորոշությունը
չնչին է:
Դրանց տեղը և
արագությունը
միաժամանակ
կարելի է
որոշել մեծ
ճշտությամբ:
Հետևաբար,
դրանց
նկատմաբ
կարելի է
կիրառել
դասական
մեխանիկան:
էլ
ավելի փոքր
կլինի և
հետևաբար
կոորդինատի և
իմպուլսի
անորոշությունը
չնչին է:
Դրանց տեղը և
արագությունը
միաժամանակ
կարելի է
որոշել մեծ
ճշտությամբ:
Հետևաբար,
դրանց
նկատմաբ
կարելի է
կիրառել
դասական
մեխանիկան:
Անորոշությունը հետևանք է տարրական մասնիկների ալիքային հատկության, այլ ոչ թե մեր սարքերի անճշտության:
4.5. Շրյոդինգերի հավասարումը
1925-26 թթ. Շրյոդինգերը (Ավստրիա) և Հայզենբերգը (Գերմանիա) ստեղծեցին միկրոմասնիկների շարժումը նկարագրող նոր մեխանիկա, որը կոչվեց քվանտային մեխանիկա: Նյուտոնի օրենքների հիման վրա ստեղծված մեխանիկան, որը կիրառվում է մակրոմարմինների համար կոչվեց դասական մեխանիկա: Քվանտային մեխանիկայի հիման վրա ստացված արդյունքները լրիվ համապատասխանում են փորձին:
Քվանտային մեխանիկայում մակրոմասնիկների շարժումը նկարագրվում է Շրյոդինգերի հավասարումով: Այն կատարում է նույն դերը քվանտային մեխանիկայում, ինչ որ Նյուտոնի օրենքները դասական մեխանիկայում:
Ինչպես և Նյուտոնի օրենքները, Շրյոդինգերի հավասարումը չի կարելի դուրս բերել ավելի ընդհանուր, հիմնարար դրույթներից:
Շրյոդինգերի հավասարումը մասնակի ածանցյալներով դիֆերենցիալ հավասարում է: Ստացիոնար, այսինքն ժամանակից չկախված վիճակի դեպքում մեկ մասնիկի համար այդ հավասարումը ունի հետևյալ տեսքը.
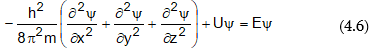
որտեղ m-ը` մասնիկի զանգվածն է, h-ը`Պլանկի հաստատունը, U-ն` պոտենցիլ էներգիան, E-ն` կինետիկ էներգիան, x,y,z-ը` մասնիկի կոորդինատներն են:
![]() փոփոխականը
կոչվում է ալիքային
ֆունկցիա:
Դրա
ֆիզիկական
իմաստը
կբացատրենք
ստորև:
փոփոխականը
կոչվում է ալիքային
ֆունկցիա:
Դրա
ֆիզիկական
իմաստը
կբացատրենք
ստորև:
Լուծել
Շրյոդինգերի
հավասարումը
նշանակում է
գտնել տվյալ
մասնիկին
համապատասխանող
![]() ֆունկցիաները
և դրանց
համապատասխանող
լրիվ
էներգիաները`
E1, E2, E3:
ֆունկցիաները
և դրանց
համապատասխանող
լրիվ
էներգիաները`
E1, E2, E3:
4.6. Ալիքային ֆունկցիան, դրա ֆիզիկական իմաստը և նկարագրման եղանակները
Քանի որ
էլեկտրոնի
շարժումն
ունի
ալիքային բնույթ,
քվանտային
մեխանիկան
այդ շարժումը ատոմում
նկարագրում է ![]() ալիքային
ֆունկցիայի
օգնությամբ:
Ատոմական
տարածության
տարբեր
կետերում այդ
ֆունկցիան
ունի տարբեր արժեքներ:
Մաթեմատիկորեն
այդ
ֆունկցիան
գրվում է
ալիքային
ֆունկցիայի
օգնությամբ:
Ատոմական
տարածության
տարբեր
կետերում այդ
ֆունկցիան
ունի տարբեր արժեքներ:
Մաթեմատիկորեն
այդ
ֆունկցիան
գրվում է ![]() (x,y,z)
արտահայտության
տեսքով, որտեղ
x,y,z-ը` կետի կոորդինատներն
են: Ալիքային
ֆունկցիայի
քառակուսին
ունի որոշակի
ֆիզիկական
իմաստ:
(x,y,z)
արտահայտության
տեսքով, որտեղ
x,y,z-ը` կետի կոորդինատներն
են: Ալիքային
ֆունկցիայի
քառակուսին
ունի որոշակի
ֆիզիկական
իմաստ: ![]() ցույց
է տալիս
դիտարկվող
մասնիկի dV ծավալում
գտնվելու
հավանականությունը:
ցույց
է տալիս
դիտարկվող
մասնիկի dV ծավալում
գտնվելու
հավանականությունը:
![]() մեծությունը
կոչվում է հավանականության
խտություն
կամ էլեկտրոնային
խտություն
(էլեկտրոնի
դեպքում):
մեծությունը
կոչվում է հավանականության
խտություն
կամ էլեկտրոնային
խտություն
(էլեկտրոնի
դեպքում):
Ալիքային ֆունկցիան պետք է բավարարի հետևյալ պայմաններին, այն պետք է լինի.
1. անընդհատ,
2. վերջավոր,
3. միանշանակ,
4. պետք է դառնա 0 այն կետերում, որտեղ մասնիկը չի կարող գտնվել (օրինակ անվերջ հեռու կետում):
Ալիքային
ֆունկցիան,
ավելի ճիշտ
դրա քառակուսին`
(![]() )
կարելի է
ներկայացնել
հետևյալ
եղանակներով.
)
կարելի է
ներկայացնել
հետևյալ
եղանակներով.
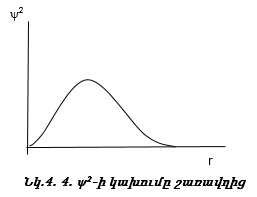
1. անալիտիկ
եղանակով` ![]() =Ae-kr,
=Ae-kr,
2. Գրաֆիկական եղանակով (նկ. 4.4),
3. Աղյուսակի ձևով,
4. Էլեկտրոնային
ամպի
եղանակով:
Տարածության այն
մասերում,
որտեղ
էլեկտրոնի
գտնվելու հավանականությունը,
այսինքն ![]() -ն
մեծ է, դրվում
են խիտ կետեր,
որտեղ փոքր է`
նոսր կետեր:
-ն
մեծ է, դրվում
են խիտ կետեր,
որտեղ փոքր է`
նոսր կետեր:
5. Սահմանային մակերևույթի եղանակ: Այս դեպքում գծվում է ծավալ, որտեղ մասնիկի գտնվելու հավանականությունը մոտ 90 % է:
Միջուկաշուրջ
տարածության
այն մասը,
որտեղ էլեկտրոնի
գտնվելու
հավանականությունը
մեծ է ![]() կոչվում է
օրբիտալ:
կոչվում է
օրբիտալ:
4.7. Շրյոդինգերի հավասարման լուծումը: Միաչափ պոտենցիալ տուփ
Ատոմի և մոլեկուլի համար Շրյոդինգերի հավասարման լուծումը բարդ է, և այստեղ չենք քննարկի, կքննարկվեն միայն պատրաստի լուծումները:
Այդ լուծումներն ստանալու համար քննարկենք Շրյոդինգերի հավասարման լուծումը ավելի պարզ օրինակների դեպքում:
Քննարկենք Շրյոդինգերի հավասարման լուծումը միաչափ պոտենցիալ տուփի համար:
Այս մոդելում մասնիկը (օրինակ էլեկտրոնը) կարող է շարժվել միայն մի ուղղությամբ, օրինակ x առանցքի ուղղությամբ x = 0-ից x = a hատվածում:
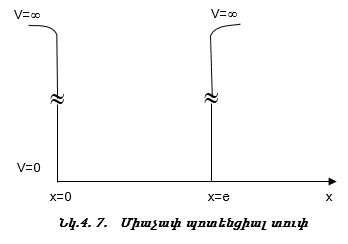
Այդ հատվածի սահմաններում մասնիկի U պոտենցիալ էներգիան հաստատուն է: Հարմար է այն ընդունել հավասար զրոյի:
Տվյալ հատվածի սահմաններից դուրս մասնիկի վրա ազդող v պոտենցիալը անվերջ մեծ Է: Դա նշանակում է, որ մասնիկը 0 < x < a hատվածից դուրս գալ չի կարող, որովհետև կպահանջվի անվերջ մեծ էներգիա` E:
Շրյոդինգերի հավասարումը միաչափ պոտենցիալ տուփի համար կընդունի հետևյալ տեսքը.

Այս
հավասարումը
լուծելու
համար
անհրաժեշտ է
գտնել ![]() ալիքային
ֆունկցիան և E
էներգիայի
արժեքները,
որոնք
բավարարում
են նշված
հավասարմանը:
ալիքային
ֆունկցիան և E
էներգիայի
արժեքները,
որոնք
բավարարում
են նշված
հավասարմանը: ![]() ալիքային
ֆունկցիան
պետք է լինի վերջավոր,
միանշանակ և
անընդհատ: Այն
պետք է դառնա
զրո x = 0 և x=a
դեպքում, քանի
որ այդ
կետերում
մասնիկը չի
կարող գտնվել,
հետևաբար
ալիքային
ֆունկցիան
պետք է լինի վերջավոր,
միանշանակ և
անընդհատ: Այն
պետք է դառնա
զրո x = 0 և x=a
դեպքում, քանի
որ այդ
կետերում
մասնիկը չի
կարող գտնվել,
հետևաբար ![]() -ն
հատվածից
դուրս պետք է
հավասար լինի
զրոյի:
-ն
հատվածից
դուրս պետք է
հավասար լինի
զրոյի:
Նշված պայմաններին բավարարում է

որտեղ n =1,2,3, …,
իսկ А -ն
հաստատուն
մեծություն է:
n = 0 արժեքը
բացառված է,
որովհետև դա
կնշանակի մասնիկի
բացակայությունը
տուփում (![]() = 0):
Տեղադրենք (4.7) -ը
(4.8) հավասարման
մեջ և
դիֆերենցենք
ձախ մասը
= 0):
Տեղադրենք (4.7) -ը
(4.8) հավասարման
մեջ և
դիֆերենցենք
ձախ մասը
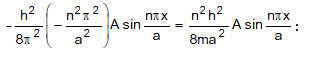
Աջ մասը`
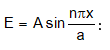
Հավասարեցնելուց և կրճատելուց հետո կստանանք `

որտեղ n = 1, 2, 3:
Այսպիսով,
մենք գտանք (4.7)
հավասարմանը
բավարարող ![]() ֆունկցիան
և էներգիայի
արժեքը,
այսինքն`
լուծեցինք
Շրյոդինգերի
հավասարումը
միաչափ
պոտենցիալ տուփի
համար:
Քննարկենք
ստացված
լուծումը:
ֆունկցիան
և էներգիայի
արժեքը,
այսինքն`
լուծեցինք
Շրյոդինգերի
հավասարումը
միաչափ
պոտենցիալ տուփի
համար:
Քննարկենք
ստացված
լուծումը:
Նախ ընդգծենք, որ ստացված արդյունքը կտրուկ տարբերվում է նման խնդրից, երբ մասնիկը ենթարկվում է դասական մեխանիկայի օրենքներին:
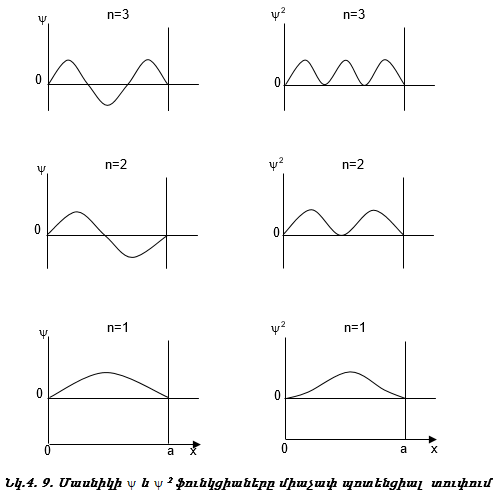
Ակնհայտ է, որ մակրոմասնիկի էներգիան կարող է ընդունել ցանկացած արժեք, և x առանցքի վրա դրա գտնվելու հավանականությունը նույնը կլինի: Ընդհակռակը, մասնիկը, որի համար ճշգրիտ են քվանտային մեխանիկայի օրենքները, ընդունում է խիստ որոշակի արժեքներ, կախված n -ից (նկ. 4.8):

Այսպիսով, մասնիկի էներգիան միաչափ պոտենցիալ տուփում քվանտացված է:
Քանի որ m զանգվածը (4.9) բանաձևում գտնվում է հայտարարում, ապա մեծ զանգված ունեցող մասնիկների համար, այսինքն` մակրոմարմինների համար, էներգիան կստացվի շատ փոքր և քվանտացում չի նկատվի: (4.9) բանաձևից երևում է, որ տուփի չափը նույնպես գտնվում է հայտարարում: Դա նշանակում է, որ մեծ տուփերում քվանտացումը նորից չի նկատվի:
Այսպիսով, քվանտային մեխանիկան բացատրում է ատոմներում և մոլեկուլներում էլեկտրոնի դիսկրետ էներգետիկ մակարդակների առկայությունը:
Քննարկենք մասնիկի գտնվելու հավանականությունը միաչափ տուփում (նկ.4.9).
![]() -ի
կախումը x –ից
համանման է
երկու կողմից
ամրացված
լարի
տատանումներին,
որի դեպքում
լարի
երկարությամբ
տեղավորվում
են ամբողջ
թվով
կիսաալիքներ:
Ինչպես երևում
է նկ.4.9 –ից,
-ի
կախումը x –ից
համանման է
երկու կողմից
ամրացված
լարի
տատանումներին,
որի դեպքում
լարի
երկարությամբ
տեղավորվում
են ամբողջ
թվով
կիսաալիքներ:
Ինչպես երևում
է նկ.4.9 –ից, ![]() -ն,
այսինքն`
մասնիկի
գտնվելու
հավանականությունը
տուփի տարբեր
մասերում
տարբեր է, ի
տարբերություն
դասական
դեպքի: Բացի
դրանից, n>1
արժեքների
դեպքում,
տուփի ներսի որոշ
կետերում
մասնիկի
գտնվելու
հավանականությունը
զրո է,
արդյունք, որը
բոլորովին հնարավոր
չէ դասական
մեխանիկայի
տեսանկյունից:
-ն,
այսինքն`
մասնիկի
գտնվելու
հավանականությունը
տուփի տարբեր
մասերում
տարբեր է, ի
տարբերություն
դասական
դեպքի: Բացի
դրանից, n>1
արժեքների
դեպքում,
տուփի ներսի որոշ
կետերում
մասնիկի
գտնվելու
հավանականությունը
զրո է,
արդյունք, որը
բոլորովին հնարավոր
չէ դասական
մեխանիկայի
տեսանկյունից:
Այն կետերը, որտեղ մասնիկի գտնվելու հավանականությունը զրո է, կոչվում են հանգուցային կետեր, իսկ n-ը` գլխավոր քվանտային թիվ:
Գլխավոր քվանտային թիվը` n-ը, ցույց է տալիս
1. միաչափ տուփ a երկարության մեջ տեղավորված կես ալիքների թիվը,
2. էներգետիկ մակարդակի համարը,
3. դրա յուրաքանչյուր արժեքին համապատասխանում է որոշակի էներգիա, էներգիան կախված է n-ից:
4. հանգուցային կետերի թիվը, այն հավասար է (n+1)-ի:
Մասնիկի էներգիան միաչափ պոտենցիալ տուփում կարելի է հաշվել նաև առանց Շրյոդինգերի հավասարման` օգտագործելով կանգուն ալիքների գաղափարը:
Կանգուն ալիք առաջանում է այն դեպքում, երբ a երկարության մեջ տեղավորվում են ամբողջ թվով կես ալիքներ:
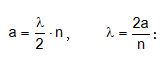
Մյուս կողմից ըստ Դե-Բրոյլի`
![]()
Վերջին երկու հավասարումների աջ մասերը հավասարեցնելով իրար` կստանանք
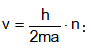
ՈՒնենալով մասնիկի v արագությունը` հաշվենք կինետիկ էներգիան.
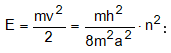
4.8. Ջրածնի ատոմի կառուցվածքը ըստ քվանտային մեխանիկայի
Ջրածնի ատոմն ունի ամենապարզ կառուցվածքը: Այն ունի մեկ էլեկտրոն, որը շարժվում է միջուկի դաշտում: Այդ համակարգի պոտենցիալ էներգիայի ֆունկցիան, որը մտնում է Շրյոդինգերի հավասարման մեջ, ունի հետևյալ տեսքը.

r-ը էլեկտրոնի հեռավորությունն է միջուկից:
Տեղադրենք այս արժեքը Շրյոդինգերի հավասարման մեջ:
Հավասարման լուծումը ջրածնի ատոմի համար ստացվում է շատ բարդ, այդ պատճառով լուծում չենք բերի, կքննարկենք միայն պատրաստի լուծումները: Մասնիկը միաչափ տուփում քննարկելիս տեսանք, որ լուծումը պարունակում է մեկ քվնտային թիվ, որովհետև մասնիկն ունի մեկ ազատության աստիճան: Ատոմում էլեկտրոնն ունի երեք ազատության աստիճան և հետևաբար անհրաժեշտ է երեք քվանտային թիվ: Հետագայում պարզվեց, որ էլեկտրոնը կատարում է ևս մի շարժում, որի շնորհիվ ձեռք է բերում շարժման քանակի սեփական մոմենտ: Այդ շարժումը նկարագրելու համար մտցվեց չորրորդ քվանտային թիվ` սպինային քվանտային թիվը: Այսպիսով, էլեկտրոնի վիճակը ատոմում նկարագրելու համար անհրաժեշտ է 4 քվանտային թիվ:
4.9. Չորս քվանտային թվեր
Էլեկտրոնի վիճակը ատոմում նկարագրվում է 4 քվանտային թվերով: Էլեկտրոնի վիճակ ասելով` հասկանում ենք էլեկտրոնի էներգիան, էլեկտրոնային ամպի ձևը, չափերը, տարածական դասավորությունը, էլեկտրոնի շարժման քանակի մոմենտը միջուկի նկատմամբ, սեփական առանցքի նկատմամբ և այլն: Էլեկտրոնի վիճակը ատոմում լրիվ նկարագրվում է չորս թվերով, որոնք կոչվում են քվանտային թվեր` գլխավոր (n), օրբիտալ (l), մագնիսական (m) և սպինային (s):
1. Գլխավոր քվանտային թիվ - n, ընդունում է ամբողջ արժեքներ, նշանակվում է նաև տառերով.
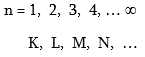
Գլխավոր քվանտային թիվը` n-ը, ցույց է տալիս.
ա) էլեկտրոնի էներգիան: Օրինակ Շրյոդինգերի հավասարման լուծումը ջրածնի ատոմի համար տալիս է.
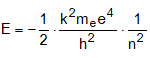
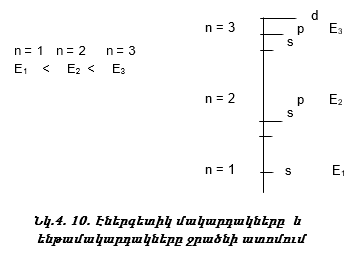
n-ի մեծացման հետ E-ն աճում է (նկ. 4.10):
բ) էլեկտրոնային ամպի կամ օրբիտալի չափը, օրինակ
գ)
հանգուցային
մակերևույթների
թիվը: Հանգուցային
մակերևույթը,
տվյալ դեպում
գունդ, այն
կետերն են,
որտեղ ![]() = 0,
այսինքն` մասնիկը
չի գտնվում:
Հանգուցային
մակերևույթը հասկանալու
համար
քննարկենք
թմբուկի թաղանթի
տատանումները.
= 0,
այսինքն` մասնիկը
չի գտնվում:
Հանգուցային
մակերևույթը հասկանալու
համար
քննարկենք
թմբուկի թաղանթի
տատանումները.
Պլյուս (+) նշանով նշանակվում է թաղանթի ուռչումը, մինուս (-) նշանով` փոս ընկնելը: n=1 դեպքում կա մեկ, n=2 դեպքում` երկու, n=3 դեպքում` երեք հանգուցային գնդաձև մակերևույթ: Այս տատանումները կոչվում են շառավղային տատանումներ: Այժմ քննարկենք նույն ատոմների, մասնավորապես` ջրածնի ատոմի համար:
Ինչպես
արդեն նշել
ենք,
հավանականությունը,
որ էլեկտրոնը
գտնվում է dv
ծավալում,
հավասար ![]() Տվյալ
դեպքում dv ծավալը
dr
հաստությամբ
գնդային
ծավալն է,
այսինքն`
Տվյալ
դեպքում dv ծավալը
dr
հաստությամբ
գնդային
ծավալն է,
այսինքն` ![]() Բազմապատկելով
Բազմապատկելով
![]() կստանանք
էլեկտրոնի
գտնվելու
հավանականություն
r շառավիղ
ունեցող և dr
հաստություն
ունեցող
գնդաձև
շերտում
կստանանք
էլեկտրոնի
գտնվելու
հավանականություն
r շառավիղ
ունեցող և dr
հաստություն
ունեցող
գնդաձև
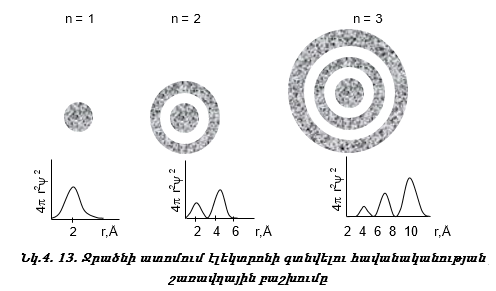
շերտում ![]() Նկ.
4.13-ում բերված է
այդ
հավանականության
կախումը r-ից: n=1
դեպքում
գնդային
շերտի
շառավիղը, որտեղ
էլեկտրոնի
գտնվելու
հավանականությունը
առավելագույնն
է,
Նկ.
4.13-ում բերված է
այդ
հավանականության
կախումը r-ից: n=1
դեպքում
գնդային
շերտի
շառավիղը, որտեղ
էլեկտրոնի
գտնվելու
հավանականությունը
առավելագույնն
է, ![]() Այդ արժեքը
համապատասխանում
է Բորի տեսությամբ
ստացված
ուղեծրի
շառավղին, երբ
n=1: Սակայն
օրբիտալի
տեսքը խիստ
տարբերվում է
Բորի ստացված
արդյունքից:
Ըստ Բորի
էլեկտրոնը
գտնվում է
միայն այդ
հեռավորության
վրա, ըստ
քվանտային
մեխանիկայի`
ցանկացած
կետում, բայց
տարբեր
հավանականությամբ:
Այդ արժեքը
համապատասխանում
է Բորի տեսությամբ
ստացված
ուղեծրի
շառավղին, երբ
n=1: Սակայն
օրբիտալի
տեսքը խիստ
տարբերվում է
Բորի ստացված
արդյունքից:
Ըստ Բորի
էլեկտրոնը
գտնվում է
միայն այդ
հեռավորության
վրա, ըստ
քվանտային
մեխանիկայի`
ցանկացած
կետում, բայց
տարբեր
հավանականությամբ:
դ) ենթամակարդակների թիվը:
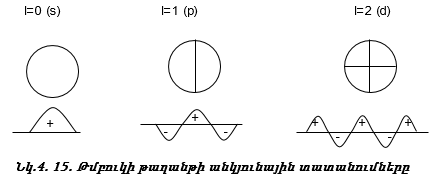
2. Օրբիտալ քվանտային թիվ: Նշանակվում է l տառով:
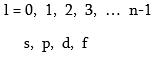
Օրբիտալ քվանտային թվի` l – ի արժեքները կախված են n-ի արժեքներից: Այն ընդունում է 0-ից մինչև n-1 միջակայքի բոլոր ամբողջ թվերի արժեքները:
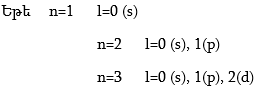
Օրբիտալ քվանտային թիվը ցույց է տալիս
ա) ենթամակարդակի էներգիան (նկ. 4.10);
բ) էլեկտրոնային ամպի ձևը;
գ) կենտրոնով անցնող հանգուցային հարթությունների թիվը: Նորից քննարկենք թմբուկի թաղանթի տատանումները, սակայն այս անգամ` անկյունային տատանումները (նկ. 4.15):
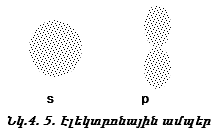
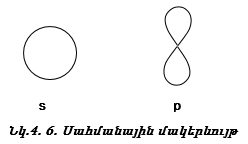
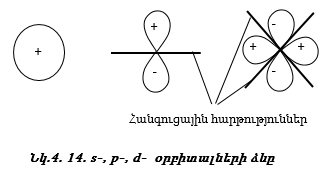
Դրական նշանը ցույց է տալիս ուռուցիկ լինելը, բացասական նշանը` փոս լինելը: Թմբուկի տատանումները նշանակենք l = 0, 1, 2, 3, …: l-ի արժեքները ցույց են տալիս թմբուկի կենտրոնով անցնող հանգուցային հարթությունների քանակը: Հանգուցային հարթության վրա տատանում չկա: l=0 (s) տատանման դեպքում հանգուցային հարթությունների քանակը զրո է, l=1 (p) տատանման դեպքում` մեկ, l=2 (d) տատանման դեպքում` երկու:
Ճիշտ նույն կերպ էլեկտրոնը կատարում է անկյունային տատանողական շարժում (նկ. 4.14): Միջուկով անցնող հանգուցային հարթությունների թիվը s ամպի համար զրո է, p ամպի համար` մեկ, d ամպի համար` երկու:
դ) էլեկտրոնի շարժման քանակի մոմենտը միջուկի նկատմամբ (օրբիտալ մոմենտ).
![]()
3.
Մագնիսական
քվանտային
թիվ:
Նշանակվում է ![]() տառով
և ընդունում է
հետևյալ
միջակայքի
բոլոր ամբողջ
արժեքները,
ներառյալ
զրոն:
տառով
և ընդունում է
հետևյալ
միջակայքի
բոլոր ամբողջ
արժեքները,
ներառյալ
զրոն:

Մագնիսական քվանտային թիվը ցույց է տալիս.
ա) էլեկտրոնային օրբիտալի դիրքը տարածության մեջ: Օրինակ.
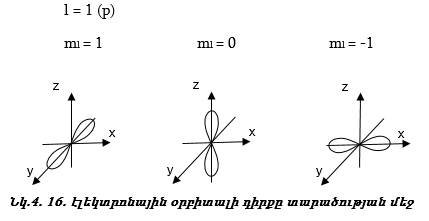
բ) Օրբիտալ շարժման քանակի մոմենտի պրոյեկցիան որևէ առանցքի ուղղությամբ, օրինակ` z առանցքի նկատմամբ ![]()
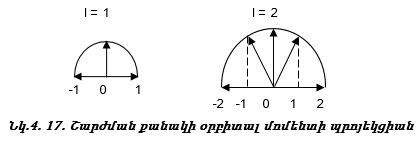
Այսպիսով s վիճակին համապատասխանում է մեկ օրբիտալ,p վիճակին` երեք, d վիճակին` հինգ, f վիճակին` յոթ:
4.
Սպինային քվանտային թիվ: Նշանակվում է S տառով: Ընդունում է երկու արժեք ![]()
Սպինային քվանտային թիվը ցույց է տալիս
ա) էլեկտրոնի շարժման քանակի մոմենտը սեփական առանցքի նկատմամբ
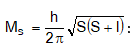
բ) Մագնիսական մոմենտը,
գ) Պարզեցված` էլեկտրոնի պտույտը սեփական առանցքի նկատմամբ:
Քանի որ էլեկտրոնն ունի լիցք, ապա նրա պտույտն առաջացնում է մագնիսական դաշտ` մագնիսական մոմենտ: Էլեկտրոնն ունի երկու մագնիսական մոմենտ, սեփական առանցքի նկատմամբ` սպինային մոմենտ, միջուկի նկատմամբ` օրբիտալ մոմենտ:
Ինչպես և ջրածնի ատոմում, բազմաէլեկտրոն ատոմներում յուրաքանչյուր էլեկտրոնի վիճակը որոշվում է չորս քվանտային թվերի ` n,l,m,s արժեքներով: Այդ թվերը կարող են ընդունել նույն արժեքները, ինչ որ ջրածնի ատոմի համար:
Բազմաէլեկտրոն ատոմներում էլեկտրոնը շարժվում է ոչ միայն միջուկի դաշտում, այլ նաև մնացած էլեկտրոնների դաշտում: Այդ գործոնի ազդեցությունը բերում է նրան, որ միևնույն n, բայց տարբեր l ունեցող էլեկտրոնների էներգիան դառնում է տարբեր: Այսպիսով, բազմաէլեկտրոն ատոմներում էլեկտրոնի էներգիան որոշվում է երկու քվանտային թվերի` n -ի և l -ի արժեքներով: Այսինքն` էներգիան աճում է ինչպես n -ի, այնպես էլ l -ի արժեքների մեծացման հետ:
էլեկտրոնի վիճակը բազմաէլեկտրոն ատոմներում ենթարկվում է Պաուլիի կողմից սահմանված քվանտամեխանիկական սկզբունքին:
![]() Ատոմում
չի կարող
լինել երկու
էլեկտրոն նույն
չորս
քվանտային
թվերով
(Պաուլիի
արգելման
սկզբունքը):
Ատոմում
չի կարող
լինել երկու
էլեկտրոն նույն
չորս
քվանտային
թվերով
(Պաուլիի
արգելման
սկզբունքը):
Այդ սկզբունքի ֆիզիկական իմաստն այն է, որ տարածության միևնույն կետում միաժամանակ չի կարող լինել երկու էլեկտրոն: Քանի որ տվյալ օրբիտալում գտնվող էլեկտրոնների համար n–ի, l–ի և m–ի արժեքները նույնն են, ապա դրանք պետք է տարբերվեն գոնե S–ի արժեքով, իսկ վերջինս ունի երկու արժեք, ուստի յուրաքանչյուր օրբիտալում կարող է լինել երկու էլեկտրոն, որոնք պետք է ունենան հակառակ սպիններ, այսինքն` սպինային քվանտային թվերի արժեքները պետք է լինեն տարբեր:
Էլեկտրոնների առավելագույն թիվը n մակարդակում 2n2 է (Աղյուսակ 1):
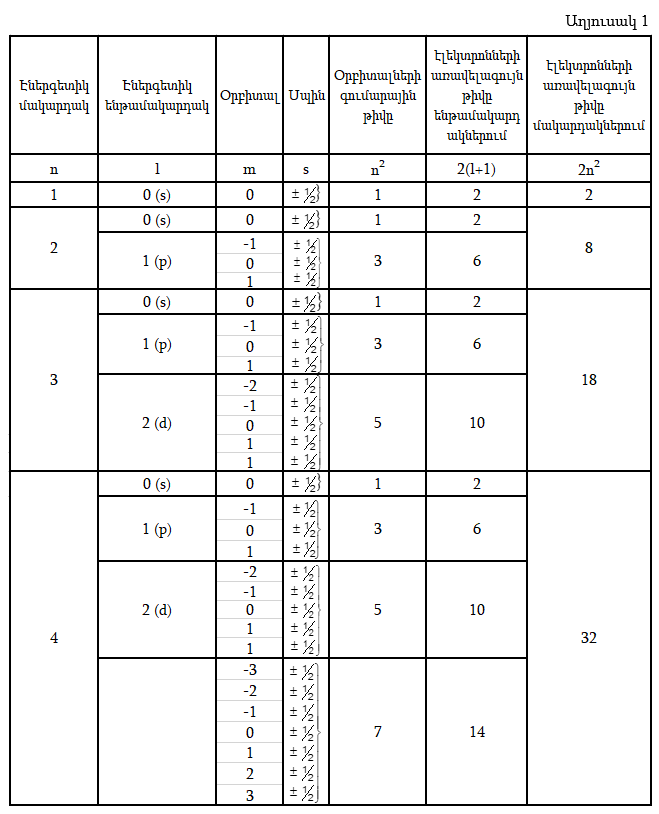
Ատոմում n –ի նույն արժեքները ունեցող էլեկտրոնների համախումբըը կոչվում է էներգետիկ մակարդակ: Էլեկտրոնները, որոնք ունեն նույն n–ի և l–ի արժեքները, կոչվում են էներգետիկ ենթամակարդակ: Էլեկտրոնների առավելագույն թիվը ենթամակարդակում հավասար է l(2l+1):
Այժմ
էներգետիկ
մակարդակներն
ու ենթամակարդակները
նկարագրենք
էներգետիկ
դիագրամների
ձևով:
Ատոմական
օրբիտալը պայմանականորեն
նշանակենք
քառակուսի
վանդակի ձևով,
որի երեք
կողմերում
նշենք երեք
քվանտային
թվերը: ![]()
Մեկ
օրբիտալում
կարող են լինել
կա՛մ մեկ,
կա՛մ երկու
էլեկտրոն,
բայց տարբեր
սպիներով: ![]()
Ելնելով քվանտային թվերի հատկություններից` կառուցենք բազմաէլեկտրոն ատոմի էներգետիկ դիագրամը:
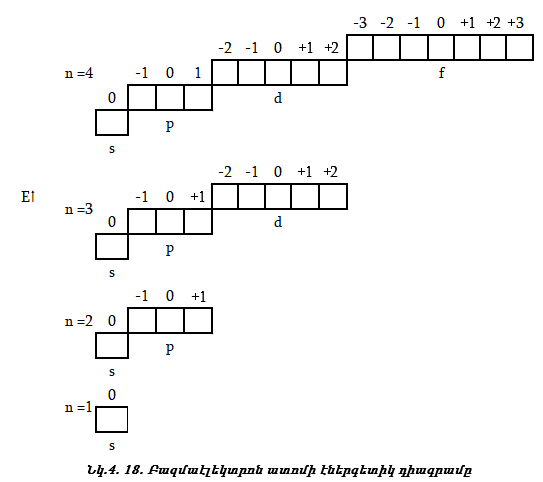
4.10. Էլեկտրոնների լրացման հաջորդականությունը բազմաէլեկտրոն ատոմներում
Էլեկտրոնների լրացումը ատոմների էներգետիկական մակարդակներում և ենթամակարդակներում կատարվում է հետևյալ հաջորդականությամբ (աուֆբատ - սկզբունք):
1. Էլեկտրոնը, առաջին հերթին, լրացնում է այն մակարդակը,իսկ մակարդակում նախ այն ենթամակարդակը, որի էներգիան ամենափոքրն է (նվազագույն էներգիայի սկզբունք):
2. Օրբիտալներում էլեկտրոնները լրանում են ըստ Պաուլիի սկզբունքի: Տվյալ օրբիտալում կարող է լինել մեկ էլեկտրոն, կամ երկու էլեկտրոն հակառակ սպիններով:
![]()
3. Էլեկտրոնների լրացումը տվյալ ենթամակարդակում կատարվում է ըստ Հունդի կանոնի:
![]() Ատոմական
օրբիտալները էլեկտրոններով
լրանում են
այնպես, որ
ատոմը ունենա
սպինային
թվերի
գումարի
առավելագույն
բացարձակ
արժեք:
Ատոմական
օրբիտալները էլեկտրոններով
լրանում են
այնպես, որ
ատոմը ունենա
սպինային
թվերի
գումարի
առավելագույն
բացարձակ
արժեք:
Դա նշանակում է, որ տվյալ ենթամակարդակում սկզբում լրանում է մեկական էլեկտրոն, սպինների նույն ուղղությամբ, հետո նոր զույգավորվում են:
4. Էլեկտրոնների լրացումը կատարվում է ըստ Կլեչկովսկու երկու կանոնների:
![]() I կանոն Էլեկտրոնը
առաջին
հերթին
լրանում է այն
ենթամակարդակում,
որի համար n+l
գումարը
ավելի փոքր է:
I կանոն Էլեկտրոնը
առաջին
հերթին
լրանում է այն
ենթամակարդակում,
որի համար n+l
գումարը
ավելի փոքր է:
![]() II
կանոն եթե
երկու
օրբիտալների
համար n+l
գումարը նույնն
է, ապա
էլեկտրոնը
առաջին
հերթին
լրանում է
այն ենթամակարդակում,
որի n-ը ավելի
փոքր է:
II
կանոն եթե
երկու
օրբիտալների
համար n+l
գումարը նույնն
է, ապա
էլեկտրոնը
առաջին
հերթին
լրանում է
այն ենթամակարդակում,
որի n-ը ավելի
փոքր է:
Ջրածնի ատոմի համար էլեկտրոնի էներգիան կախված է միայն n-ից, մացած ատոմների համար` նաև l-ից, հետևյալ պատճառով: Էլեկտրոնները, որոնք ձգվում են միջուկի կողմից, նաև վանվում են ներքին շերտերի էլեկտրոնների կողմից, այսինքն` տեղի է ունենում արտաքին շերտի էլեկտրոնների էկրանացում ներքին շերտերի էլեկտրոնների կողմից:
4.11. Էլեկտրոնային բանաձևեր, էլեկտրոնային դիագրամներ
Տարրերի ատոմների էլեկտրոնային կոնֆիգուրացիան կարելի է նկարագրել երեք եղանակով`էլեկտրոնային բանաձևերով, էներգետիկ դիագրամներով և էլեկտրոնային ամպերի տեսքով:
Փոքր պարբերության տարրեր: Պարբերական համակարգի առաջին պարբերությունը կազմված է 2 տարրերից: Էլեկտրոնը ջրածնի ատոմում գտնվում է առաջին էներգետիկ մակարդակի s ենթամակարդակում: s -էլեկտրոնային ամպն ունի գնդի ձև:
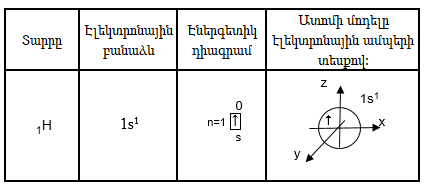
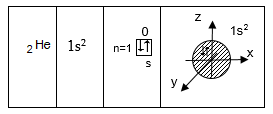
Պաուլիի սկզբունքի համաձայն մեկ օրբիտալում կարող է լինել առավելագույնը երկու էլեկտրոն` հակառակ սպիններով: Երկու էլեկտրոն պարունակող օրբիտալը ներկայացնենք նրբագծված տեսքով:
Երկրորդ և երրորդ պարբերությունները պարունակում են ութական տարր:
Երկրորդ պարբերության տարրերի մոտ լրանում է n=2 շերտը, սկզբում 2s – օրբիտալը, հետո երեք p - օրբիտալները: Ստորև բերված են մի քանի օրինակներ:
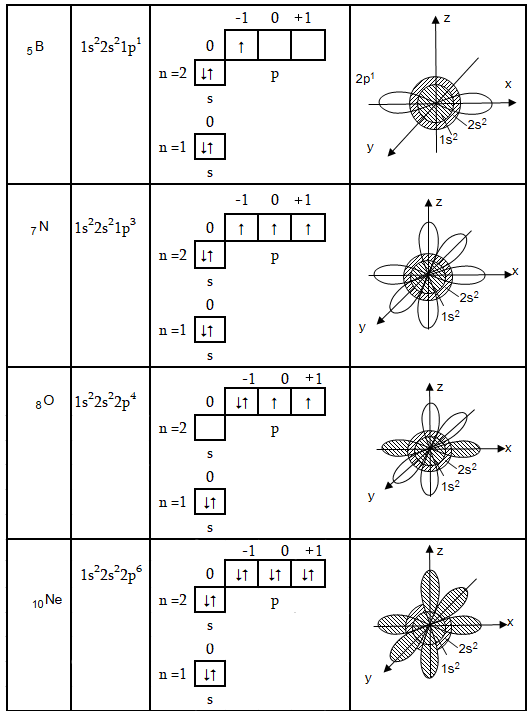
Նեոնի ատոմում երկրորդ էլեկտրոնային շերտում էլեկտրոնների թիվը հասնում է առավելագույնի: Այսպիսով, տարրերի ընդհանուր թիվը երկրորդ պարբերությունում հավասար է երկրորդ էներգետիկ մակարդակի էլեկտրոնների թվին:
Երրորդ պարբերության տարրերի մոտ լրանում է n=3 շերտը, որը կազմված է 3s-, 3p-, 3d-, օրբիտալներից: Ինչպես և երկրորդ պարբերությունում, առաջին երկու տարրերի (Na, Mg) ատոմներում լրանում են s - օրբիտալները, վերջին վեց տարրերի մոտ (Al – Ar) - p - օրբիտալները, օրինակ.
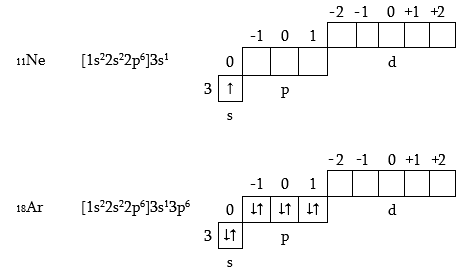
Na և Ar տարրերում մոտ n=1, n=2 շերտերում կրկնվում է նեոնի ատոմի կառուցվածքը, այդ պատճառով պարզության համար բերված ուրվագծերում ցույց է տրված միայն արտաքին շերտի լրացումը: Երրորդ պարբերության վերջին տարրի` արգոնի Ar (ինչպես նաև Ne) մոտ լրանում են s- և p- օրբիտալները, այսինքն` վերջին շերտը չորս երկէլեկտրոնային ամպերն են (մեկ գնդաձև, երեքը` հանտելաձև): Ի տարբերություն երկրորդ պարբերության երրորդ պարբերությունում մնում են դատարկ 3d- օրբիտալները:
Մեծ պարբերության տարրերը: Չորրորդ և հինգերորդ պարբերությունները պարունակում են 18 տարր: Չորրորդ պարբերության ատոմներում էլեկտրոնների լրացումը սկսվում է n=4 շերտի 4s- օրբիտալներից: Ինչպես արդեն նշել ենք, 4s- օրբիտալներլում էլեկտրոնի լրացումը 3d դատարկ օրբիտալի առկայությամբ, պայմանավորված է 3s23p6 շերտի միջոցով միջուկի էկրանացմամբ: Այդ պատճառով կալիումի 19-րդ էլեկտրոնի և կալցիումի 20-րդ էլեկտրոնի համար ավելի ձեռնտու է 4s- վիճակը: Իսկապես, ըստ Կլեչկովսկու առաջին կանոնի, և՛ կալիումի, և՛ կալցիումի համար n+l գումարը 4s- օրբիտալի համար ավելի փոքր է , քան 3d- օրբիտալի համար:

Ըստ Կլեչկովսկու երկրորդ կանոնի, սկզբում լրանում է 3d- օրբիտալը, իսկ հետո` 4p- օրբիտալը:
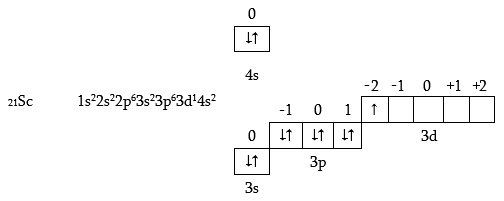
Սկանդիումի ատոմում սկսվում է 3d- օրբիտալի լրացումը.
3d- օրբիտալի լրացումը ավարտվում է Zn-ի ատոմում.
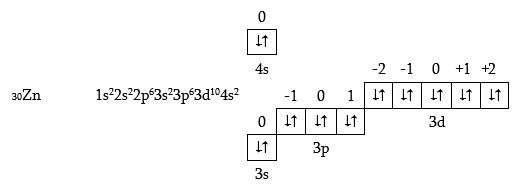
Տասը d-տարրերը, սկսած սկանդիումից և վերջացած ցինկով, կոչվում են անցողիկ տարրեր:
Այս տարրերի էլեկտրոնային թաղանթների կառուցվածքի առանձնահատկությունը նախորդների (s- և p- տարրեր) համեմատությամբ այն է, որ յուրաքանչյուր հաջորդ d- տարրին անցնելիս, նոր էլեկտրոնը լրացնում է ոչ թե արտաքին n = 4, այլ նախավերջին n = 3 էլեկտրոնային շերտը: Կարևոր է նշել, որ տարրերի քիմիական հատկությունները որոշվում են ատոմի արտաքին էլեկտրոնային թաղանթի կառուցվածքով և քիչ են կախված նախավերջին շերտի կառուցվածքից: Բոլոր անցողիկ տարրերի ատոմների արտաքին թաղանթում կա մեկ s– կամ երկու s– էլեկտրոն: Այդ պատճառով բոլոր d- տարրերը մետաղներ են, և դրանց հատկությունները քիչ են փոխվում կարգահամարի մեծացման հետ պարբերություններում, մինչդեռ p- տարրերի հատկությունները փոխվում են տիպիկ մետաղականից տիպիկ ոչ-մետաղականի:
3d- ենթամակարդակի (n=3, l=2) լրացումից հետո էլեկտրոնները Կլեչկովսկու երկրորդ կանոնի համաձայն, զբաղեցնում են 4p- ենթամակարդակը (n=4, l=1): Այդ պրոցեսը սկսվում գալիումի (Z=31) և վերջանում կրիպտոնի ատոմով (Z=36):
![]()
Ինչպես նախորդ ազնիվ գազերի` նեոնի և արգոնի ատոմները, կրիպտոնի ատոմը բնորոշվում է արտաքին էլեկտրոնային շերտի ns2np6 կառուցվածքով, որտեղ n-ը գլխավոր քվանտային թիվն է (նեոն 2s22p6, արգոն 3s23p6, կրիպտոն 4s24p6): Դրանով է մասնավորապես պայմանավորված այդ ատոմների իներտությունը:
Հինգերորդ պարբերությունն սկսվում է Ռուբիդիումով, որի ատոմում լրանում է 5s- ենթամակարդակը: Ստրոնցիումի ատոմի (Z=38) 5s- ենթամակարդակը լրացվում է երկու էլեկտրոնով, որից հետո տեղի է ունենում 4d- ենթամակարդակի լրացում, ընդամենը տասը անցողիկ տարր:
Այնուհետև ինդիումից մինչև քսենոն ազնիվ գազը լրանում է վեց տարրերի P- ենթամակարդակը: Դրանով ավարտվում է հինգերորդ պարբերությունը, որը նման է չորրորդ պարբերությանը:
Վեցերորդ պարբերությունը նախորդների նման սկսվում է երկու S- տարրերով: Այն լրանալուց հետո սկսում է լրանալ 4f- ենթամակարդակը, ըստ Կլեչկովսկու կանոնի:
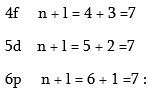
Բոլոր երեք դեպքերում էլ n + l գումարը հավասար է յոթի, սակայն n–ի ամենափոքր արժեքը համապատասխանում է 4f ենթամակարդակին: Իրականում լանթանի (Z = 57) ատոմում լրանում է ոչ թե 4f, այլ 5d ենթամակարդակը
![]()
Սակայն հաջորդ ցերիումի (Z = 58) ատոմում սկսվում է 4f- ենթամակարդակի լրացումը: 5d- էլեկտրոնը, որը կար լանթանի ատոմում, անցնում է 4f-ի վրա: Ցերիումի ատոմի էլեկտրոնային կառուցվածքն է`
![]()
Փաստորեն լանթանի ատոմում Կլեչկովսկու կանոնի խախտումը բացառություն է: Այսպիսով, վեցերորդ պարբերությունում տեղավորված են 14 լանթանոիդներ, որոնց ատոմներում վերջին և նախավերջին էլեկտրոնային թաղանթները նույնն են:
Յուրաքանչյուր հաջորդ տարրի ատոմում էլեկտրոնը լրանում է վերջից հաշված երրորդ էլեկտրոնային թաղանթի f- ենթամակարդակում: Դրա շնորհիվ լանթանոիդների հատկությունները քիչ են տարբերվում:
Յոթերորդ անավարտ պարբերությունը նման է վեցերորդին:
Վերը բերված Կլեչկովսկու կանոնի խախտումը միակը չէ:
Այն դեպքերում, երբ d- ենթամակարդակում պակասում է մեկ էլեկտրոն, կիսով չափ կամ լրիվ լրանալու համար, մեկ էլեկտրոն 4S-ենթամակարդակից անցնում է 3d- ենթամակարդակ:
Այդպիսի վիճակը էներգետիկ տեսակետից ավելի կայուն է: Այդ երևույթը կոչվում է “գլորման’’ երևույթ: Օրինակ, քրոմի և պղնձի ատոմներում 4s- ենթամակարդակում կա ոչ թե երկու, այլ մեկ էլեկտրոն: Արտաքին s-էլեկտրոններից մեկը “գլորվում” է նախավերջին d- ենթամակարդակը: Քրոմի ատոմում էլեկտրոնի գլորումը բերում է d- ենթամակարդակի լրացմանը կիսով չափ (d5), իսկ պղնձի մոտ` լրիվ (d10): Գլորման երևույթը հանդիպում է առաջին խմբում Cr, Mo տարրերի մոտ: Բացի նշված դեպքերից, կան ուրիշ բացառություններ ևս:
Այսպիսով, ատոմների էլեկտրոնային կառուցվածքները որոշում են պարբերական համակարգում տարրերի հատկությունների փոփոխման գլխավոր օրինաչափությունները:
1. Առաջին պարբերության տարրերը, որոնց ատոմներում լրացված է առաջին էլեկտրոնային շերտը, շատ հատկություններով բացառիկ են: Ավելին, դրանց որոշ հատկությունները (H+ իոնի հատկությունները, հեղուկ He) չկան այլ տարրերի մոտ:
2. Երկրորդ պարբերության տարրերը, որոնց ատոմներում լրացվում է երկրորդ էլեկտրոնային շերտը, խիստ տարբերվում են մնացած տարրերից: Դա բացատրվում է նրանով, որ էլեկտրոնների էներգիան երկրորդ շերտում զգալի փոքր է հաջորդ շերտերի էլեկտրոնների էներգիայից և նրանով, որ երկրորդ շերտում չի կարող լինել ութից ավելի էլեկտրոն:
3. d- տարրերը, որոնց ատոմներում էլեկտրոնը լրանում է d- ենթամակարդակում, զգալիորեն քիչ են տարբերվում իրարից, քան գլխավոր ենթախմբի տարրերը:
4. Լանթանոիդների հատկությունների տարբերությունն աննշան է, որովհետև էլեկտրոնները լրանում են վերջից հաշված երրորդ f- ենթամակարդակում:
Ամփոփում
Ատոմը կազմված է դրական միջուկից և դրա շուրջը պտտվող էլեկտրոններից: Միջուկը կազմված է դրական լիցքավորված պրոտոններից և չեզոք նեյտրոններից: Էլեկտրոնը ֆոտոնի նման ունի երկակի` մասնիկային և ալիքային բնույթ: Որպես ալիք էլեկտրոնը միջուկի շուրջն առաջացնում է էլեկտրոնային ամպ:
Էլեկտրոնի վիճակը բնութագրվում է չորս քվանտային թվերով: Գլխավոր քվանտային թիվը ցույց է տալիս էլեկտրոնի էներգիայի մեծությունը: Երկրորդական (ուղեծրային) քվանտային թիվը ցույց է տալիս էլեկտրոնային ամպի ձևը: Մագնիսական քվանտային թիվը ցույց է տալիս էլեկտրոնային ամպի դիրքը տարածության մեջ: Սպինային քվանտային թիվը ցույց է տալիս էլեկտրոնի պտտման ուղղությունը սեփական առանցքի շուրջը: Էլեկտրոնային թաղանթների լրացումը կատարվում է էներգիայի նվազագույն լինելու սկզբունքով այսինքն` լրանում է նախ այն շերտը, իսկ շերտում նախ այն ենթա շերտը, որտեղ էլեկտրոնի էներգիան ավելի փոքր է:
Էլեկտրոնային թաղանթների կառուցվածքի արտահայտությունը քվանտային թվերի օգնությամբ կոչվում են էլեկտրոնային բանաձևեր:
Ատոմական օրբիտալների լրացումը կատարվում է Հունդի կանոնի համաձայն, այսինքն` այնպես, որ ատոմում լինեն առավելագույն թվով կենտ էլեկտրոններ:
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1. Տարբերել տարրական մասնիկները, իմանալ էլեկտրոնի, նեյտրոնի, պրոտոնի զանգվածը, լիցքը:
2. Հասկանալ
էլեկտրոնի
երկակի
բնույթի
իմաստը,
օգտագործել ![]() հարաբերակցությունը:
հարաբերակցությունը:
3. Բացատրել էլեկտրոնային ամպ, ամպի խտություն, էլեկտրոնի տվյալ ծավալում գտնվելու հավանականություն, հավանականության խտություն հասկացությունները:
4. Իմանալ էլեկտրոնի վիճակը բնութագրող չորս քվանտային թվերի իմաստները, արժեքները:
5. Իմանալ էլեկտրոնային թաղանթների լրացման հերթականությունը, կազմել տարրերի էլեկտրոնային բանաձևերը, իմանալ հունդի կանոնը, կազմել ատոմների էլեկտրոնային թաղանթների էներգետիկ դիագրամները:
Հիմնական հասկացություններ
1. Ատոմը կազմված է միջուկից և դրա շուրջը պտտվող էլեկտրոններից:
2. Միջուկը կազմված է պրոտոններից և նեյտրոններից:
3. Էլեկտրոնն ունի երկակի` ինչպես մասնիկի, այնպես էլ ալիքի հատկություններ:
4. Որպես ալիք` էլեկտրոնը միջուկի շուրջը առաջացնում է էլեկտրոնային ամպ:
5. Էլեկտրոնի վիճակը բնութագրվում է չորս քվանտային թվերով.
ա) Գլխավոր քվանտային թիվ (n)` ցույց է տալիս էլեկտրոնի էներգիայի մեծությունը,
բ) Երկրորդական քվանտային թիվ (l)` ցույց է տալիս էլեկտրոնի ամպի ձևը,
գ) Մագնիսական քվանտային թիվ (m)` ցույց է ամպի դիրքը տարածության մեջ,
դ) Սպինային քվանտային թիվ (s)` ցույց է տալիս էլեկտրոնի պտտման ուղղությունը սեփական առանցքի շուրջը:
6. էլեկտրոնային թաղանթների լրացումը էլեկտրոններով կատարվում է էներգիայի նվազագույն լինելու սկզբունքով:
7. Էլեկտրոնային բանաձևերն արտահայտում են էլեկտրոնային թաղանթների կառուցվածքը քվանտային թվերի օգնությամբ:
8. Ատոմական օրբիտալները էլեկտրոններով լրացվում են այնպես, որ ատոմում էլեկտրոնների սպինային թվերի գումարային բացարձակ արժեքը լինի առավելագույնը` այսինքն լինեն առավելագույն թվով կենտ էլեկտրոններ (Հունդի կանոն):