Լ.Ա. ՍԱՀԱԿՅԱՆ, Հ.Գ. ԽԱՉԱՏՐՅԱՆ,
Ք.Հ. ԲԴՈՅԱՆ
ՔԻՄԻԱ
9-րդ դասարան
ՎԵՐԱՀՐԱՏԱՐԱԿՈՒԹՅՈՒՆ
ՄԱՍ 1
ԵՐԱՇԽԱՎՈՐՎԱԾ Է ՀՀ ԿՐԹՈՒԹՅԱՆ, ԳԻՏՈՒԹՅԱՆ,
ՄՇԱԿՈՒՅԹԻ ԵՎ ՍՊՈՐՏԻ ՆԱԽԱՐԱՐՈՒԹՅԱՆ ԿՈՂՄԻՑ
ԵՐԵՎԱՆ
2020
ՀՏԴ
373.167.1:54(075.3)
ԳՄԴ 24.1ց72
Ս 150
Մասնագիտական խմբագիրներ՝
Ժաննա Սարգսյան, ք.գ.թ.
Գյուլնարա Փալիկ ան, ք.գ.թ.
Սահակ ան Լ.
Ս 150
Քիﬕա. 9-րդ դասարանի դասագիրք. մաս 1./ Լ. Սահական,
Հ. Խաչատրյան, Ք. Բդոյան; - Եր.: Տիգրան Մեծ, 2020. - 120 էջ:
ՀՏԴ 373.167.1:54(075.3)
ԳՄԴ 24.1ց72
ISBN 978-99941-0-678-3
© Լ. Սահական, 2020
© Հ. Խաչատրյան, 2020
© Ք. Բդոյան, 2020
© «Տիգրան Մեծ», 2020
© ԴՏՀՏՇՀ, 2020
ԲՈՎԱՆԴԱԿՈՒԹՅՈՒՆ
1.
ՀԱՍԿԱՑՈՒԹՅՈՒՆՆԵՐԻ ԿՐԿՆՈՒԹՅՈՒՆ
3
1.2
10
2.
14
17
22
26
29
32
36
37
42
43
47
3.1
48
54
59
65
68
72
75
79
83
87
88
91
95
101
104
113
ԴԱՍԸՆԹԱՑԻ ԿԱՐԵՎՈՐԱԳՈՒՅՆ
1
ՀԱՍԿԱՑՈՒԹՅՈՒՆՆԵՐԻ
ԿՐԿՆՈՒԹՅՈՒՆ
ՔԻՄԻԱԿԱՆ ԿԱՐԵՎՈՐԱԳՈՒՅՆ
1.1
ՀԱՍԿԱՑՈՒԹՅՈՒՆՆԵՐ. ԱՏՈՄ, ՄՈԼԵԿՈՒԼ,
ՄՈԼ, ՄՈԼԱՅԻՆ ԶԱՆԳՎԱԾ, ՄՈԼԱՅԻՆ ԾԱՎԱԼ
Նյութերն ընդունակ են որոշակի պայմաններում փոխարկվելու այլ
նյութերի։ Այդպիսի փոխարկուﬓերն անվանում են քիﬕական կամ
քիﬕական ռեակցիաներ։
Քիﬕական փոխարկուﬓերի, նրանց ընթանալու պայմանների,
նյութերի բաղադրության և հատկությունների ուսուﬓասիրությունը
քիﬕայի հիﬓական խնդիրն է։
Ներկայումս հայտնի են ավելի քան 60 ﬕլիոն տարբեր նյութեր։
Բոլոր նյութերը կազմված են ատոﬓերից՝ մանրագույն, քիﬕա-
պես անբաժանելի մասնիկներից։
Ատոﬓերի յուրաքանչյուր առանձին տեսակ կոչվում է քիﬕա-
կան տարր։ Ներկայումս հայտնի է 118 քիﬕական տարր։ Ցանկացած
տարր ունի իր անվանումը և պայմանական նշանակումը՝ քիﬕական
նշանը, որոնք ձեզ են ներկայացված քիﬕական տարրերի պարբերա-
կան համակարգում։
Յուրաքանչյուր քիﬕական տարր բնութագրվում է հարաբերական
ատոմային զանգվածով (Ar)։ Այն ֆիզիկական ﬔծություն է, որը ցույց
է տալիս, թե քանի անգամ է տվալ քիﬕական տարրի ատոﬓերի ﬕ-
ջին զանգվածը ﬔծ ածխածնի ատոﬕ զանգվածի 1/12 մասից։ Հարա-
բերական ատոմային զանգվածը չափողականություն չունի։
Բնության ﬔջ քիﬕական տարրերը հանդիպում են ինչպես պարզ
նյութերի (O2, H2, N2 և այլն), այնպես էլ այլ տարրերի հետ կապված
վիճակում՝ բարդ ﬕացությունների ձևով։ Նյութերը, որոնք կազմված
են ﬔկ տարրի ատոﬓերից, անվանում են պարզ նյութեր: Նյութերը,
որոնք կազմված են տարբեր քիﬕական տարրերի ատոﬓերից, կոչ-
վում են բարդ նյութեր կամ քիﬕական ﬕացություններ։
Ինչպես պարզ, այնպես էլ բարդ նյութերն ունեն մոլեկուլային կամ
ոչ մոլեկուլային կառուցվածք։
Մոլեկուլը նյութի աﬔնափոքր չեզոք մասնիկն է, որը կարող
է գոյություն ունենալ ինքնուրույն՝ պահպանելով նրա հիﬓա-
կան քիﬕական հատկությունները։
3
Օրինակ, ջրածին՝ H2, ջուր՝ H2O, ածխածնի(IV) օքսիդ՝ CO2 և այլն:
Սովորական պայմաններում մոլեկուլային կառուցվածք ունեցող նյու-
թերը կարող են լինել գազային, հեղուկ և պինդ (հաﬔմատաբար
ցածր հալման ջերմաստիճանով)։
Ոչ մոլեկուլային կառուցվածքով նյութերը սովորաբար պինդ բյու-
րեղային նյութեր են՝ կառուցված ատոﬓերից կամ իոններից, օրի-
նակ՝ ﬔտաղական երկաթը՝ Fe, ալմաստը՝ C, կալիուﬕ ֆտորիդը՝ KF
և այլն:
Քիﬕայում ցանկացած նյութի քանակական և որակական բաղա-
դրությունն արտահայտվում է քիﬕական բանաձևի օգնությամբ։
Քիﬕական բանաձևը նյութի բաղադրության պայմանական
գրառուﬓ է քիﬕական տարրերի նշանների և ինդեքսների ﬕ-
ջոցով:
Մոլեկուլային կառուցվածքով նյութերը բնութագրվում են հարա-
բերական մոլեկուլային զանգվածի (Mr) ﬔծությամբ, որը հավասար
է այդ մոլեկուլն առաջացնող քիﬕական տարրերի հարաբերական
ատոմային զանգվածների գումարին՝ հաշվի առնելով ինդեքսները։
Օրինակ` Mr(H3PO4) = 3Ar(H) + Ar(P) + 4Ar(O) = 3 · 1 + 31 + 4 · 16 = 98
Ոչ մոլեկուլային կառուցվածքով նյութերի բաղադրությունն ար-
տահայտող բանաձևում ցույց է տրվում ատոﬓերի քանակների պար-
զագույն հարաբերությունը, օրինակ՝ BaSO4, CuCI2: Դրանք կոչվում են
կառուցվածքային (բանաձևային) ﬕավորներ։
Զանգվածից ու ծավալից բացի, որպես նյութի քանակական բնու-
թագիր՝ քիﬕայում թերևս ավելի հաճախ գործածվում է նյութի քա-
նակ ֆիզիկաքիﬕական ﬔծությունը։
Նյութի քանակը տվալ նյութի չափաբաժինն է, որը պարունա-
կում է այդ նյութի որոշակի թվով կառուցվածքային ﬕավորներ:
Նյութի քանակի չափման ﬕավորը մոլն է (առաջացել է լատինե-
րեն moles բառից, որը նշանակում է քանակ):
Մոլը նյութի այն քանակն է, որը պարունակում է այնքան կա-
ռուցվածքային ﬕավոր (ատոմ, մոլեկուլ կամ այլ մասնիկ), որ-
քան ատոմ է պարունակում ածխածնի 12C իզոտոպի 0,012 կգ-ը
(կամ 12 գրամը)։
Հարց է առաջանում. քանի՞ ատոմ է պարունակում 12 գ ածխածին
նյութը։ Գիտնականներին հաջողվել է փորձնական ճանապարհով
գտնել այդ թիվը, որը հավասար է 6,02.1023-ի։ Ի պատիվ իտալացի
4
գիտնական Ավոգադրոյի՝ այդ թիվը կոչվում է Ավոգադրոյի հաստա-
տուն ՝ NA։
NA = 6,02 · 1023 մոլ-1
Այսպիսով, մոլը նյութի այն քանակն է, որը պարունակում է
6,02•1023 մոլեկուլ, ատոմ կամ կառուցվածքային այլ մասնիկ։
Մոլեկուլների թվից կախված՝ նյութաքանակը կարող է լինել ինչ-
պես մոլի բազմապատիկ, դիցուք՝ 2 մոլ (12,04·1023 մոլեկուլ), այնպես
էլ մոլի մաս, օրինակ՝ 0,5 մոլ (3,01·1023 մոլեկուլ)։
Նյութաքանակը՝ n, կապված է մոլեկուլների թվի՝ N–ի հետ հետևյալ
առնչությամբ, որն անﬕջականորեն բխում է մոլի սահմանուﬕց.
N
n =
մոլ (1)
NA
Այս բանաձևը լայնորեն կիրառվում է քիﬕական հաշվարկներում։
Նյութաքանակի ﬕջոցով կարելի է գտնել նյութի տվալ քանակում
պարունակվող մասնիկների թիվը և, հակառակը, մասնիկների թվով
որոշել նյութաքանակը:
Նյութի տվալ քանակում պարունակվող մասնիկների թվի (N) որո-
շումը։
Խնդիր 1: Ի՞նչ թվով մոլեկուլներ է պարունակում 3 մոլ ազոտական թթուն։
Լուծում
Օգտվում ենք (1) հավասարուﬕց.
N = n · NA = 3 · 6,02 · 1023 = 1,806 · 1024 մոլեկուլ
Պատ.՝ N = 1,806 · 1024։
Տրված մասնիկների թվով նյութի քանակի (մոլ) որոշումը։
Խնդիր 2: Որքա՞ն է 9,03 · 1024 թվով ատոﬓերից կազմված երկաթի նյու-
թաքանակը։
Լուծում
Օգտվում ենք (1) հավասարուﬕց.
N
9,03 · 1024
n =
=
= 15 մոլ
NA
6,02 · 1023
Պատ.՝ n = 15:
Ցանկացած քիﬕական ﬕացություն բնութագրվում է ﬔկ մոլի
զանգվածով կամ մոլային զանգվածով։ Քանակապես 1 մոլ նյութի
5
զանգվածը թվապես հավասար է նրա հարաբերական մոլեկուլային
զանգվածին։ Օրինակ` ջրի (H2O) հարաբերական մոլեկուլային զանգ-
վածը 18 է (Mr = 1+1+16=18): Նշանակում է՝ ﬔկ մոլ ջրի զանգվածը 18 գ
է, և այդ զանգվածով ջուրը պարունակում է 6,02 · 1023 մոլեկուլ։
Մոլային զանգվածը նյութի ﬔկ մոլի զանգվածն է։
Մոլային զանգվածը ցույց է տալիս, թե ինչ զանգված ունի 1 մոլ
նյութը, այսինքն՝ 6,02 · 1023 մոլեկուլներից (ատոﬓերից) կազմված
նյութը։
Նյութի մոլային զանգվածը նշանակում են M տառով։ Մոլային
զանգվածի, նյութաքանակի և նյութի զանգվածի կապն արտահայտ-
վում է հետևյալ հավասարումով.
m
M =
(2)
n
Նյութի մոլային զանգվածը նյութի զանգվածի և տվալ զանգ-
վածին համապատասխանող նյութաքանակի հարաբերու-
թյունն է։
Մոլային զանգվածի ﬕավորը գ/մոլն է։
Mr(H2SO4) = 98 M(H2SO4) = 98 գ/մոլ
Իսկ ատոմային կառուցվածք ունեցող պարզ նյութերի համար մո-
լային զանգվածը հավասար է հարաբերական ատոմային զանգվա-
ծին՝ Ar։ Օրինակ՝ երկաթի համար.
Ar(Fe) = 56 M(Fe) = 56 գ/մոլ
1. Նյութի տրված զանգվածում նյութաքանակի որոշում.
m
n =
M
Խնդիր 3: Որքա՞ն է 24,5 գ զանգվածով ֆոսֆորական թթվի նյութաքա-
նակը(n):
m
Լուծում: Անհրաժեշտ է օգտվել
n =
բանաձևից:
M
Հետևաբար՝ պետք է նախ հաշվել ֆոսֆորական թթվի մոլային
զանգվածը.
M(H3PO4) = 3 · 1 + 31 + 4 · 16 = 98 գ/մոլ
Տեղադրելով արժեքները (2) բանաձևի ﬔջ՝ կստանանք.
24,5 գ
n =
=
0,25 մոլ
98 գ/մոլ
Պատ.՝ 0,25։
6
2. Տրված նյութաքանակով նյութի զանգվածի որոշում.
m = n · M
Խնդիր 4: Որքա՞ն է 2 մոլ ծծմբաջրածնի զանգվածը (գ)։
Լուծում։ Հաշվենք ծծմբաջրածնի մոլային զանգվածը.
M(H2S) = 2·1+ 32 = 34 գ/մոլ
Արժեքները տեղադրենք բանաձևի ﬔջ.
m(H2S) = 2 մոլ · 34 գ/մոլ = 68 գ
Պատ.՝ 68։
Խնդիր 5: Քանի՞ մոլ է կազմում և քանի՞ մոլեկուլ է պարունակում 8 գ
թթվածինը՝ O2-ը։
Լուծում
Mr (O2) = 32
M (O2) = 32 գ/մոլ
n (O2) = m(O2)/ M(O2) = 8 գ / 32գ/մոլ = 0,25 մոլ
N (O2) = NA·n (O2) = 6,02·1023 մոլ-1·0,25 մոլ = 1,505·1023 մոլեկուլ
Պատ.՝ 8 գ թթվածինը կազմում է 0,25 մոլ և պարունակում է
1,505·1023 մոլեկուլ։
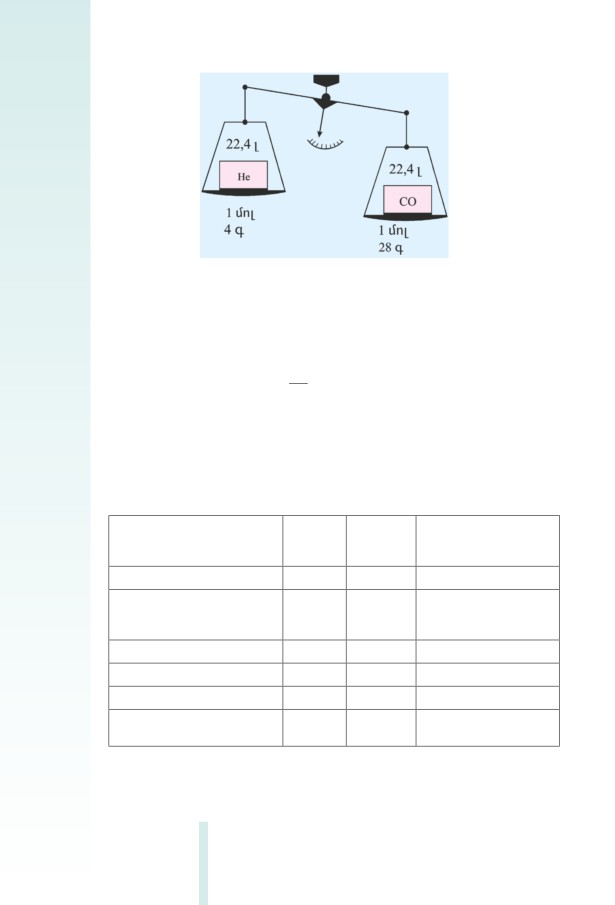
Գազային նյութերի համար օգտագործվում է մոլային ծավալ հաս-
կացությունը։ Ի տարբերություն պինդ և հեղուկ նյութերի՝ ցանկացած
գազի ﬔկ մոլը ﬕատեսակ արտաքին պայմաններում զբաղեցնում է
նույն ծավալը։ Այդ ﬔծությունը կոչվում է մոլային ծավալ՝ Vm:
V
V
n =
Vm =
(3)
Vm
n
Մոլային բանաձևը կարելի է որոշել հետևյալ բանաձևով.
m
=
M
V
Vm Vm =
Նորմալ պայմաններում (0օC և 101,325 կՊ ճնշում) գազի ցան-
կացած ծավալի և նրա քիﬕական քանակի հարաբերությունը
հաստատուն ﬔծություն է և հավասար է 22,4 դմ3/մոլի.
V
Vm =
= 22,4
= 22,4 դմ3/մոլ
n
1
Այս ﬔծությունն էլ գազի մոլային ծավալն է նորմալ պայմաննե-
րում (նկ. 1.1):
Խնդիր 6: Որքա՞ն է ազոտի նյութաքանակը՝ n (մոլ), նրա 56 լ ծավալում
(ն.պ.)։
7
Նկ. 1.1 Գազի մոլային ծավալը
Լուծում
Vm = 22,4 լ/մոլ (ն.պ.)
Տեղադրենք արժեքները (3) հավասարման ﬔջ.
V
n =
= 56
Vm
22,4 = 2,5 մոլ
Պատ.՝ 2,5 ։
Փոխադարձ կապը քիﬕական նյութը բնութագրող հիﬓական ֆի-
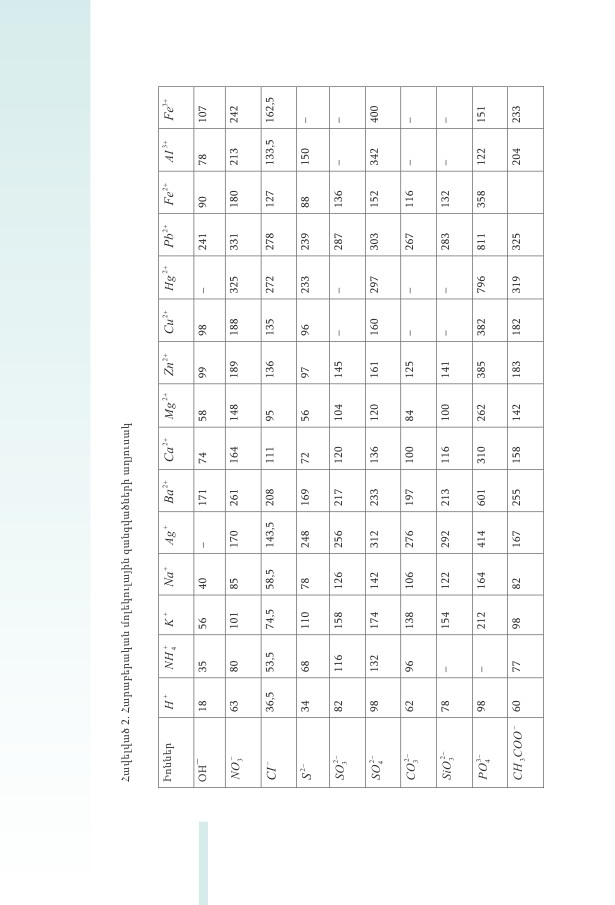
զիկական ﬔծությունների ﬕջև բերված է աղուսակ 1-ում:
Աղուսակ 1: Նյութը բնութագրող հիﬓական ֆիզիկական ﬔծություններ
Ֆիզիկական ﬔծություն
Նշա-
Չափման
Ֆիզիկական
նակումը
ﬕավորը
ﬔծության որոշման
բանաձևը
Նյութի զանգվածը
m(X)
գ
m(X) = M(X) · n(X)
Հարաբերական մոլեկու-
Mr(X)
-
լային (բանաձևային) զանգ-
վածը
Նյութի քանակը
n(X)
մոլ
n(X) = m(X) / M(X)
Մոլային զանգված
M(X)
գ/մոլ
M(X) = m(X) / n(X)
Մոլային ծավալ
Vm(X)
դմ3/մոլ
Vm(X) = V(X) / n(X)
Կառուցվածքային ﬕավոր-
N(X)
-
N(X) = NA· n(X)
ների թիվը
8
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ինչո՞ւ է հայտնի բարդ նյութերի թիվը գերազանցում
պարզ նյութերի թիվը:
2. Բերե՛ք մոլեկուլային և ոչ մոլեկուլային կառուցվածքով
գազային, հեղուկ և պինդ նյութերի օրինակներ:
3. Ի՞նչ են ցույց տալիս մոլեկուլային և ոչ մոլեկուլային կա-
ռուցվածքով նյութերի բանաձևերը։
4. Ո՞րն է նյութի քանակի չափման ﬕավորը, և ի՞նչ է այն արտահայտում։
5. Ածխածնի 3,01 ·1023 թվով ատոﬓերի նյութաքանակը (մոլ) հավասար է.
1. 0,2
2. 0,5
3. 2
4. 5
6. Որոշե՛ք հետևյալ նյութաքանակներով գազային քլորի մոլեկուլների
թիվը՝ ա) 0,1 մոլ, բ) 0,5 մոլ, գ) 1 մոլ, դ) 3 մոլ:
7. Որքա՞ն է լիթիում տարրի զանգվածային բաժինը (%) Li2SO3 բանա-
ձևային ﬕավորով նյութում:
8. Ո՞ր նյութի մոլեկուլում է թթվածնի մոլային բաժինն առավել ﬔծ.
1) CO2
2) SO2
3) SO3
4) SiO2
9. Արդյոք նո՞ւյն, թե՞ տարբեր նյութաքանակներ են հետևյալ զանգվածնե-
րով զույգ նյութերում.
ա) 98 գ H3PO4 և 17 գ NH3, բ) 49 գ H3PO4 և 49 գ H2SO4:
10. Որքա՞ն է 0,2 մոլ կալիուﬕ հիդրօքսիդի զանգվածը (գ):
9
1.2
ՌԵԱԿՑԻԱՆԵՐԻ ՀԱՎԱՍԱՐՈՒՄՆԵՐԻ
Քիﬕական հավասարուﬓերով հաշվարկներ կատարելու համար
անհրաժեշտ է.
հիշել հիﬓական հաշվարկային բանաձևերը.
m
V
N
n =
=
=
M
Vm
NA
ճիշտ կիրառել քանակաչափության օրենքները:
Եթե սկզբնանյութերը քիﬕական փոխազդեցության ﬔջ են
մտնում խիստ որոշակի հարաբերությամբ, իսկ ռեակցիայի հետևան-
քով առաջանում են արգասիքներ, որոնց քանակները ճիշտ են հաշ-
վարկվում, ապա այդպիսի ռեակցիաների հավասարուﬓերն անվա-
նում են քանակաչափական (ստեքիոﬔտրիկ):
Ցանկացած քիﬕական հավասարում գործակիցների օգնու-
թյամբ բացահայտ ցույց է տալիս ռեակցիային մասնակցող նյութերի
(սկզբնանյութերի և վերջանյութերի) մոլային հարաբերությունը։ Բո-
լոր հաշվարկները, ըստ քիﬕական հավասարուﬓերի, հիﬓված են
քանակաչափական հարաբերությունների վրա։
Ռեակցիայի հավասարման ﬔջ նյութի քանակը (մոլերի
թիվը) հավասար է համապատասխան նյութի բանաձևի
առաջ դրված գործակցին։
Օրինակ` H3PO4 + 3KOH = K3PO4 + 3H2O հավասարուﬕց երևում է, որ
ﬔկ մոլ ֆոսֆորական թթվի և 3 մոլ կալիուﬕ հիդրօքսիդի փոխազ-
դեցությունից առաջանում են ﬔկ մոլ կալիուﬕ ֆոսֆատ և 3 մոլ ջուր:
Հաշվարկի քայլաշարը (գործողությունների հաջորդականությու-
նը):
1. Կազﬔլ քիﬕական ռեակցիայի հավասարումը:
2. Միայն մաքուր նյութերի (առանց խառնուրդների) բանաձևերի
վերևում գրառել հայտնի և անհայտ ﬔծությունները՝ համապատաս-
խան չափման ﬕավորներով։ Եթե, ըստ խնդրի պայմանի, ռեակցի-
ային մասնակցում են խառնուրդներ պարունակող նյութեր, ապա
սկզբից պետք է որոշել մաքուր նյութի պարունակությունը։ Անհայտ
քանակով կամ զանգվածով նյութի բանաձևի վերևում դնել X:
10
3. Բանաձևերի տակ գրառել նյութերի քանակներն ըստ ռեակցի-
այի հավասարման գործակիցների։
4. Կազﬔլ հաﬔմատություն և գտնել փնտրվող ﬔծությունը։
5. Գրառել պատասխանը։
Խնդիր 1: Որքա՞ն է 6 մոլ ջրի քայքայուﬕց անջատված թթվածնի քանա-
կը (մոլ):
Գործողությունների հաջորդականությունը
Տրված է n(H2O) = 6 մոլ
Հաշվենք խնդրի ﬔջ արծարծված նյութերի մոլային զանգվածները.
M(H2O) = 18 գ/մոլ, M(O2) = 32 գ/մոլ
Գրենք ռեակցիայի հավասարումը և ընտրենք գործակիցները.
2H2O = 2H2 + O2
Բանաձևերի վրա գրենք նյութերի քանակներն ըստ խնդրի տվալ-
ների, իսկ բանաձևերի տակ գրենք քանակաչափական գործակիցնե-
րը՝ ռեակցիայի հավասարմանը համապատասխան.
6 մոլ
n մոլ
2H2O
=
2H2 + O2
2 մոլ
1 մոլ
Փնտրվող ﬔծությունը գտնելու համար կազﬔնք հաﬔմատու-
թյուն.
6
= n
n = 6/2 = 3 մոլ (O2)
2
1
Պատ.՝ n (O2) = 3։
Խնդիր 2։ Որքա՞ն են 72 գ մագնեզիուﬕ լրիվ այրուﬕց ստացված օքսի-
դի քանակը (մոլ) և զանգվածը (գ):
Տրված է m(Mg) = 72 գ
1. Որոշենք 72 գ մագնեզիուﬕ նյութաքանակը (մոլ).
n(Mg) = m(Mg) / M(Mg) = 72 գ / 24 գ/մոլ = 3 մոլ
2. Կազﬔնք ռեակցիայի հավասարումը.
3 մոլ
X մոլ
3 մոլ · 2 մոլ
= 3 մոլ
2Mg+O2
=
2MgO X =
2 մոլ
2 մոլ
2 մոլ
3. Հաշվենք մագնեզիուﬕ օքսիդի զանգվածը.
m(MgO) = n(MgO) · M(MgO) = 3 · 40 = 120 գ
Պատ.՝ n(MgO) = 3 մոլ, m(MgO) = 120 գ:
Խնդիր 3: Ծծմբի (VI) օքսիդի ի՞նչ թվով մոլեկուլներ կառաջանան 112 լ
(ն.պ.) ծծմբի (IV) օքսիդի և թթվածնի փոխազդեցությունից։
11
Լուծում
1) Հաշվենք ծծմբի (IV) օքսիդի քանակը. n = 112 լ / 22,4 լ/մոլ = 5 մոլ:
2) Կազﬔնք ռեակցիայի հավասարումը։ Հավասարման ﬔջ տե-
ղադրենք նյութաքանակները բանաձևերի ներքևում և վերևում.
5 մոլ
X մոլ
2SO2 + O2
= 2SO3
2 մոլ
2 մոլ
X = 5 մոլ
3. Օգտվելով N = n · NA բանաձևից՝ որոշենք մոլեկուլների թիվը.
N = 5 · 6,02 · 1023 = 30,1 · 1023 = 3,01 · 1024
Պատ.՝ N =3,01 · 1024 մոլեկուլ:
Խնդիրների լուծում, երբ սկզբնանյութերից ﬔկը տրված է ավել-
ցուկով:
Խնդիր 4։ Հաշվել 10 գ ջրածնի և 96 գ թթվածնի փոխազդեցությունից
առաջացած ջրի զանգվածը(գ):
Լուծում
Գրենք ռեակցիայի հավասարումը.
2H2 + O2 = 2H2O
Որոշենք յուրաքանչյուր նյութի սկզբնական քանակը (մոլ).
n(H2) = 10 գ/2 գ/մոլ = 5 մոլ
n(O2) = 96 գ/32 գ/մոլ = 3 մոլ
Ըստ ռեակցիայի հավասարման՝ 5 մոլ ջրածնի այրման համար ան-
հրաժեշտ է 2,5 մոլ թթվածին, բայց խառնուրդում այն 3 մոլ է, նշա-
նակում է՝ այն վերցրած է ավելցուկով, իսկ ջրածինը լրիվ է այրվում։
Հաշվարկը կատարում ենք ըստ ջրածնի.
n(H2O) = n(H2) = 5 մոլ
m(H2O) = 5 մոլ·18 գ/մոլ = 90 գ
Պատ.՝ m(H2O) = 90 գ։
12
ԽՆԴԻՐՆԵՐ ԻՆՔՆՈՒՐՈՒՅՆ ԼՈՒԾՄԱՆ ՀԱՄԱՐ
1. Ի՞նչ զանգվածով (գ) ջուր կառաջանա 67,2 լ (ն.պ.) ﬔ-
թանի (CH4) այրուﬕց։
2. Ի՞նչ ծավալով (լ,ն.պ.) թթվածին կստացվի 20 % խառ-
նուկներ պարունակող 98,75 գ զանգվածով կալիուﬕ
պերմանգանատի ջերմային քայքայուﬕց՝ ըստ հե-
տևյալ հավասարման.
2KMnO4 = K2MnO4 +MnO2 +O2
3.
13 գ ﬔտաղական ցինկի և աղաթթվի փոխազդեցությունից անջատ-
վել է 3,36 լ գազ: Որքա՞ն է ռեակցիայի արգասիքի գործնական ելքը
(%):
4. Որոշե՛ք աղի զանգվածը, որն առաջացել է 20 գ կալցիուﬕ և քլորա-
ջրածնի 5 % զանգվածային բաժնով 635 մլ լուծույթի ( =1,17 գ/մլ) փո-
խազդեցությունից:
5. Հաշվե՛ք ալ ուﬕնի օքսիդ նյութի քանակը (մոլ), որն առաջանում է
0,27 մոլ ալուﬕնն անհրաժեշտ քանակով թթվածնում այրելիս։
6. Հաշվե՛ք ծծմբի զանգվածը (գ), որն անհրաժեշտ է 4 մոլ ծծմբի (IV) օք-
սիդ ստանալու համար։
7. Հաշվե՛ք լիթիուﬕ զանգվածը (գ), որն անհրաժեշտ է 0,6 մոլ լիթիուﬕ
քլորիդ ստանալու համար։
8. Հաշվե՛ք նատրիուﬕ սուլֆիդի նյութաքանակը (մոլ), եթե այն առաջա-
ցել է 20,8 գ ծծմբի և անհրաժեշտ քանակով ﬔտաղական նատրիուﬕ
փոխազդեցությունից։
9. Հաշվե՛ք ﬔտաղական պղնձի քանակը (մոլ), որն առաջացել է 64 գ
պղնձի (II) օքսիդի և անհրաժեշտ քանակով ջրածնի փոխազդեցու-
թյունից:
13
ԴԻՍՈՑՈՒՄ
2
ԷԼԵԿՏՐՈԼԻՏՆԵՐ ԵՎ ՈՉ ԷԼԵԿՏՐՈԼԻՏՆԵՐ
2.1
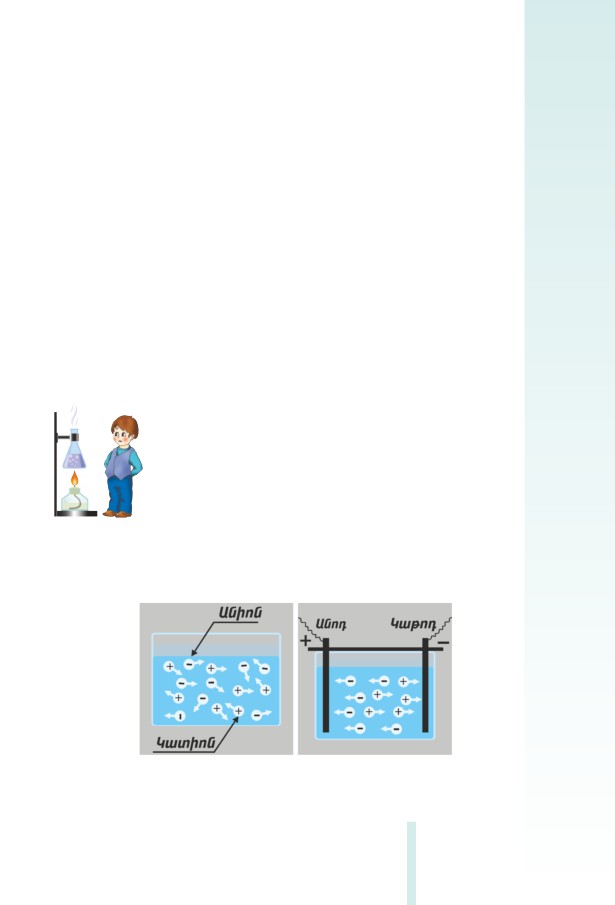
Ջրում լուծվելիս նյութերը կարող են ձեռք բերել հատկանիշներ,
որոնք բնորոշ չեն անհատական մաքուր նյութերին: Նյութերի ջրային
լուծույթների առանձնահատկությունները պարզաբանելու համար ու-
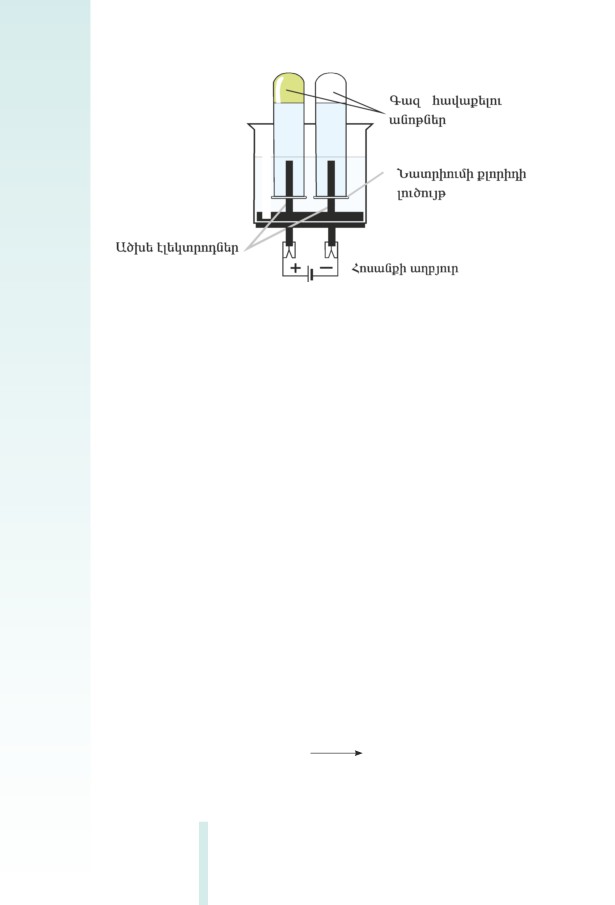
սուﬓասիրենք այդ լուծույթների՝ էլեկտրական հոսանք հաղորդելու
ունակությունը՝ կատարելով հետևյալ փորձերը (նկ. 2.1).
Հոսանքի աղբյուր
Բաժակ
Լամպ
Էլեկտրոլիտներ
Նկ. 2.1 Էլեկտրական հոսանքի հաղորդականության ուսուﬓասիրության
սարք
Փորձ 1. Բաժակում լցրած չոր աղի
(NaCI) ﬔջ էլեկտրոդներ
ընկղﬔնք և սարքը ﬕացնենք հոսանքի աղբյուրին: Շղթա ներառ-
ված լամպը չի վառվում: Նշանակում է՝ չոր աղն էլեկտրական հոսան-
քի հաղորդիչ չէ:
Փորձ 2. Բաժակում լցրած թորած ջրի ﬔջ էլեկտրոդներ ընկղﬔնք
և սարքը ﬕացնենք հոսանքի աղբյուրին: Շղթա ներառված լամպը չի
վառվում: Թորած ջուրը նույնպես էլեկտրական հոսանք չի հաղորդում:
Փորձ 3. Բաժակում լցրած թորած ջրում կերակրի աղ լուծենք և
սարքը ﬕացնենք հոսանքի աղբյուրին: Լամպը վառվում է:
Փորձե՛ք բացատրել նկատված երևույթները:
14
Հարց է առաջանում, թե որն է այդ երևույթի պատճառը: Ինչո՞ւ է կե-
րակրի աղի ջրային լուծույթը հոսանք հաղորդում: Ինչո՞ւ ջուրը և չոր
աղը հոսանք չեն հաղորդում, այն դեպքում, երբ դրանց խառնուրդը,
ինչպես նաև ջրում լուծված ﬕ շարք նյութեր՝ աղեր, թթուներ ու հիմ-
քեր, դառնում են էլեկտրահաղորդիչներ:
Փորձ 4. Բաժակում լցրած բյուրեղային շաքարավազի ﬔջ էլեկ-
տրոդներ ընկղﬔնք և սարքը ﬕացնենք հոսանքի աղբյուրին: Շղթա
ներառված լամպը չի վառվում: Չոր շաքարը էլեկտրական հոսանքի
հաղորդիչ չէ:
Փորձ 5. Բաժակում լցրած թորած ջրում լուծենք շաքարը և սարքը
ﬕացնենք հոսանքի աղբյուրին: Լամպը չի վառվում: Լամպը չի վառ-
վում նաև սպիրտը, խաղողաշաքարը (գլ ուկոզ), թթվածինը և այլն
ջրում լուծելիս:
Վերջին երկու փորձերն ապացուցում են, որ կան նյութեր, որոնք
ջրում լուծելի են, բայց դրանց լուծույթներն էլեկտրական հոսանք չեն
հաղորդում:
Կատարված փորձերի արդյունքներն առավել ընկալելի կդառնան,
եթե դրանք ամփոփենք հետևյալ աղուսակի տեսքով (աղուսակ 2.1):
Աղուսակ 2.1 Նյութերի էլեկտրահաղորդականության վերաբերյալ
փորձերի արդյունքները
Նյութը
Լամպի վառվելը
Եզրակացությունը
Չոր աղ (NaCI)
-
Հաղորդիչ չէ
Թորած ջուր
-
Հաղորդիչ չէ
NaCI ջրային լուծույթ
+
Հաղորդիչ է
Շաքարավազ
-
Հաղորդիչ չէ
Շաքարի լուծույթ
-
Հաղորդիչ չէ
Հաստատվել է նաև, որ ալկալիները և նույնիսկ ջրում անլուծելի
աղերը հալված վիճակում հոսանք են հաղորդում, օրինակ՝ բարիուﬕ
սուլֆատը՝ BaSO4, կամ բարիուﬕ հիդրօքսիդը՝ Ba(OH)2:
Թթուների, ալկալիների և աղերի ջրային լուծույթների՝ էլեկտրա-
կան հոսանք հաղորդելու հատկությունը նկարագրել է անգլիացի ֆի-
զիկոս և քիﬕկոս Մ. Ֆարադեյը 1830–ական թվականներին: Նա նյու-
թերը բաժանել է երկու խմբի՝ էլեկտրոլիտների և ոչ էլեկտրոլիտների
(աղուսակ 2.2):
15
Էլեկտրոլիտներն այն նյութերն են, որոնց ջրային լուծույթները
էլեկտրական հոսանք են հաղորդում (II կարգի հաղորդիչներ),
օրինակ՝ թթուները, հիմքերը և աղերը:
Ոչ էլեկտրոլիտներն այն նյութերն են, որոնց ջրային լուծույթ-
ներն էլեկտրական հոսանք չեն հաղորդում, օրինակ՝ օրգանական
ﬕացությունների ﬔծ մասը, ինչպես նաև ﬕ շարք անօրգանական
նյութեր՝ թթվածինը (O2), ազոտը (N2), ազոտի (I) օքսիդը (N2O) և այլն,
որոնց ﬔծ մասը մոլեկուլային կառուցվածք ունի։
Աղուսակ 2.2 Էլեկտրոլիտների և ոչ էլեկտրոլիտների օրինակներ
Էլեկտրոլիտներ
աղեր
NaCl, KNO3, CuSO4, BaCl2, FeCl3
թթուներ
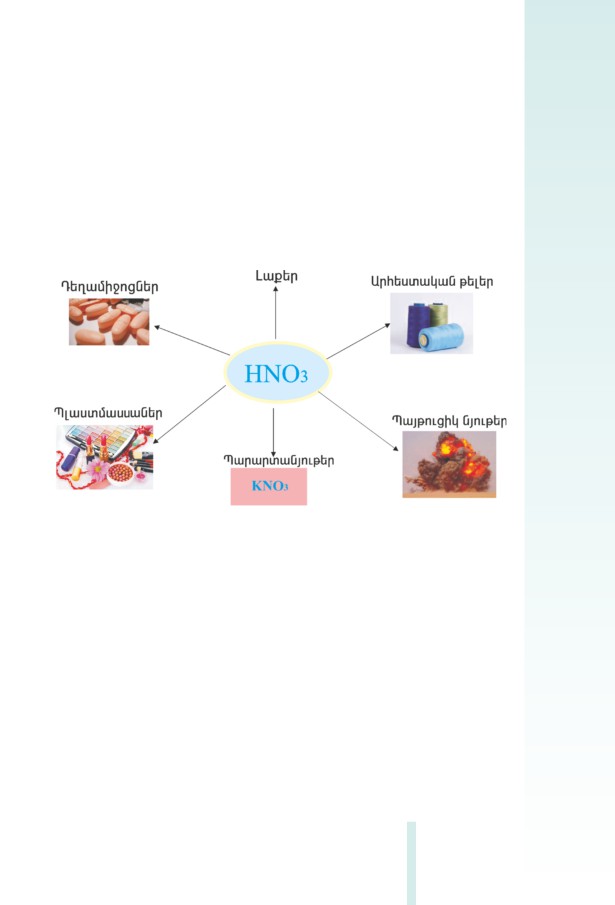
HCl, H2SO4, HNO3, CH3COOH
հիմքեր
NaOH, KOH, Ca(OH)2, NH4OH
Ոչ էլեկտրոլիտներ
H2O, I2, C2H5OH (սպիրտ), C12H22O11 (շաքար), ացետոն
ՀԱՐՑԵՐ ԵՎ ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ
1. Ի՞նչ փորձերի հիման վրա կարելի է եզրակացնել, որ
նատրիուﬕ նիտրատի (NaNO3) և կալիուﬕ ֆտորիդի
(KF) ջրային լուծույթներն էլեկտրական հոսանք են հա-
ղորդում:
2. Ըստ հաղորդականության՝ ինչպե՞ս են դասակարգվում
ջրում լուծելի նյութերը:
3.
Ո՞ր նյութերն են համարվում էլեկտրոլիտներ: Առաջարկե՛ք էլեկտրո-
լիտների նվազագույնը երեք օրինակ:
4.
Ո՞ր նյութերն են համարվում ոչ էլեկտրոլիտներ: Առաջարկե՛ք ոչ
էլեկտրոլիտների նվազագույնը երեք օրինակ:
5.
Ջրում լուծել են հետևյալ գազերը՝ ֆտորաջրածին (HF), թթվածին (O2),
ազոտ (N2), ծծմբի (IV) օքսիդ (SO2): Ստացված լուծույթներից որո՞նք
էլեկտրական հոսանք չեն հաղորդում:
6.
Պինդ վիճակում գտնվող հետևյալ նյութերից երկու սյունակով դո՛ւրս
գրեք համապատասխանաբար էլեկտրական հոսանքի հաղորդիչ-
ներն ու ոչ հաղորդիչները՝ պղինձ, փայտ, ալ ուﬕն, կալցիուﬕ ֆտո-
րիդ, բամբակ, երկաթ, մարմար, արծաթ, կալիուﬕ բրոﬕդ, նատրիու-
ﬕ հիդրօքսիդ:
16
2.2
էԼԵԿՏՐՈԼԻՏԱՅԻՆ ԴԻՍՈՑՄԱՆ ՄԵԽԱՆԻԶՄԸ
Այժմ պարզենք, թե ջրում լուծվելիս ինչ է կատարվում նյութի հետ,
և ինչո՞ւ են հատկապես թթուների, հիմքերի և աղերի լուծույթներն ու
հալույթներն էլեկտրական հոսանք հաղորդում:
Այս հարցին պատասխանելու համար հիշենք, որ էլեկտրական հո-
սանքը լիցքակիր մասնիկների ուղղորդված հոսք է:
Մետաղներում
(I կարգի հաղորդիչներ)
այդ լիցքակիր մասնիկներն էլեկտրոններն
են, և այդ պատճառով էլեկտրական հոսան-
քի հաղորդումը պայմանավորված է ﬔտաղի
բյուրեղավանդակում առկա ազատ էլեկտրոն-
ների («էլեկտրոնային գազի») ուղղորդված
հոսքով:
Իսկ ինչպիսի՞ լիցքավորված մասնիկներ
կան էլեկտրոլիտի ջրային լուծույթում: Օրի-
նակ՝ ի՞նչ է կատարվում աղը ջրում լուծելիս:
Այս հարցն ուսուﬓասիրել է շվեդ գիտնական
ՍՎԱՆՏԵ ԱՎԳՈՒՍՏ
Սվանտե Արենիուսը և 1887թ. առաջ է քաշել
ԱՐԵՆԻՈՒՍ
համարձակ ﬕ վարկած, ըստ որի՝ ջրում լու-
(1859-1927)
ծելիս էլեկտրոլիտը տրոհվում է լիցքավոր-
ված մասնիկների: Քանի որ լուծույթն էլեկ-
Շվեդ ֆիզիկոս և քիﬕ-
կոս: Էլեկտրոլիտների
տրաչեզոք է ﬓում, ուստի այդ մասնիկների
բնագավառում կատա-
ﬕ մասը դրական լիցք է կրում, մյուս մասը՝
րած աշխատանքների
բացասական:
համար 1903 թ. նրան
Նոբել ան մրցանակ է
Ջրում լուծելիս կամ հալելիս էլեկտրոլիտի
շնորհվել:
տրոհուﬓ իոնների անվանում են էլեկտրոլի-
տային դիսոցում:
Նյութի պատկանելությունն էլեկտրոլիտներին կամ ոչ էլեկտրոլիտ-
ներին որոշվում է քիﬕական կապի տեսակով: Էլեկտրոլիտներ են իո-
նային կամ ուժեղ բևեռային կապով ﬕացությունները: Չոր նատրիու-
ﬕ հիդրօքսիդը (NaOH) էլեկտրական հոսանքի հաղորդիչ չէ, ﬕնչդեռ
հալված վիճակում էլեկտրական հոսանք է հաղորդում: Դրանում հա-
մոզվելու համար կատարվել է հետևյալ փորձը:
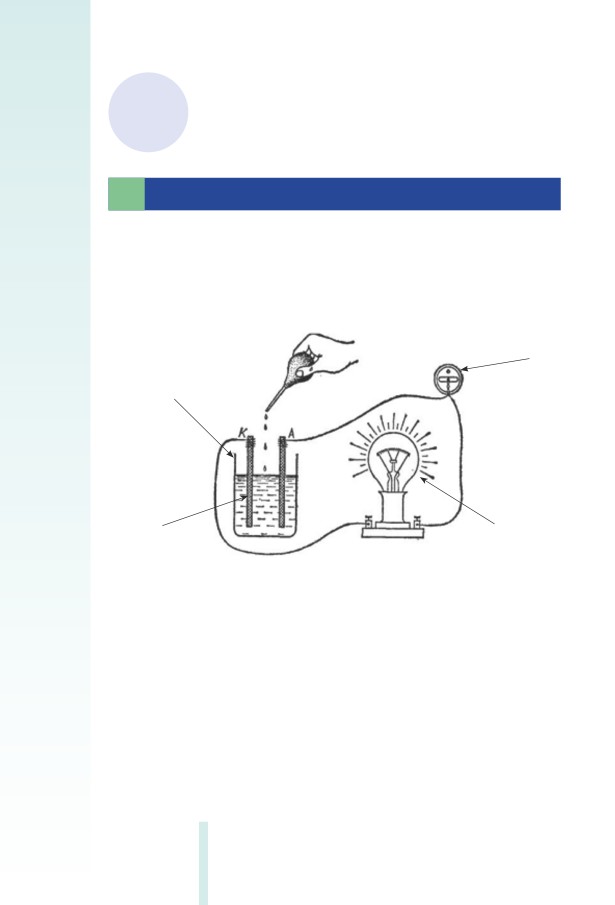
Փորձ 1. Բյուրեղային նատրիուﬕ հիդրօքսիդը (NaOH) հախճապա-
կե թասում տաքացրել են ﬕնչև հալվելը, հալույթի ﬔջ ընկղﬔլ են
էլեկտրոդներ և ﬕացրել էլեկտրական հոսանքի աղբյուրին: Շղթա
ներառված լամպը վառվել է: Նշանակում է՝ նատրիուﬕ հիդրօքսիդի
17
հալույթում ի հայտ են եկել ազատ շարժվող լիցքավորված մասնիկ-
ներ՝ Na+ և (OH)- իոններ: Այլ կերպ ասած՝ նատրիուﬕ հիդրօքսիդը դի-
սոցվում է նատրիուﬕ՝ Na+ և հիդրօքսիդի (OH)- իոններ առաջացնե-
լով: Այդ գործընթացը պարզեցված կարելի է ներկայացնել այսպես.
NaOH Na+ + (OH)-
Այս հավասարուﬓ անվանում են էլեկտրոլիտային դիսոցման հա-
վասարում:
Էլեկտրոլիտային դիսոցումը հնարավոր է դարձել, քանի որ պինդ
վիճակում նատրիուﬕ հիդրօքսիդը իոնային ﬕացություն է. բյուրե-
ղավանդակի հանգույցներում ի սկզբանե Na+ և (OH)¯ իոններն են:
Կալիուﬕ քլորիդը (KCI) հալվում է բարձր ջերմաստիճանում (768°C),
և այդ նյութի հալույթը էլեկտրական հոսանք է հաղորդում: Պատճառը
նույնն է. կալիուﬕ քլորիդի բյուրեղները կազմված են կալիուﬕ K+ և
քլորի Cl¯ իոններից: Հալույթում այդ իոններն սկսում են ազատ շարժ-
վել, այսինքն՝ կրկին տեղի է ունենում դիսոցում, որի պարզեցված
հավասարուﬓ է.
KCl
K+ + Cl-
Թորած ջուրը, ինչպես գիտեք, էլեկտրական հոսանք չի հաղոր-
դում, իսկ կալիուﬕ քլորիդի (KCI), նատրիուﬕ հիդրօքսիդի (NaOH),
քլորաջրածնի (HCI) ջրային լուծույթները հաղորդիչներ են: Նշանա-
կում է՝ աղերի, հիմքերի ու թթուների ջրային լուծույթներում նույնպես
շարժուն իոններ են ի հայտ գալիս:
Իսկ ի՞նչ դեր ունի լուծիչը: Դիսոցման գործընթացն արդյոք կախ-
վա՞ծ է լուծիչի բնույթից: Արդյոք տարբերվո՞ւմ է այս կամ այն նյութի ոչ
ջրային լուծույթն այդ նյութի ջրային լուծույթից: Այս հարցերին պա-
տասխանելու նպատակով կատարենք հետևյալ փորձերը:
Փորձ 2. Փորձանոթներից ﬔկում լցնենք կրաջուր՝ կալցիուﬕ
հիդրօքսիդի՝ Ca(OH)2, ջրային լուծույթ, իսկ մյուսի ﬔջ՝ լուծույթ, որն
ստացվել է կերոսինի ու բենզինի խառնուրդում կալցիուﬕ հիդրօք-
սիդ լուծելով: Երկու փորձանոթի լուծույթներին էլ ֆենոլֆտալեին
ավելացնենք: Առաջին փորձանոթի լուծույթը մորեգույն կդառնա, իսկ
երկրորդ փորձանոթում գույնի փոփոխություն չի նկատվի: Եթե երկ-
րորդ փորձանոթի լուծույթին ﬕ քանի կաթիլ ջուր ավելացնենք, ապա
այդ լուծույթը ևս մորեգույն կդառնա:
Փորձ 3. Բաժակի ﬔջ լցնենք լուծույթ, որն ստացվել է կալիուﬕ
քլորիդն ացետոնում լուծելով, էլեկտրոդներ ընկղﬔնք ու ﬕացնենք
էլեկտրական հոսանքի աղբյուրին: Շղթա ներառված լամպը չի վառվի:
Կատարված փորձերը ﬕանշանակ վկայում են, որ ոչ բևեռային լու-
18
ծիչներում (բենզին, բենզոլ, ացետոն և այլն) էլեկտրոլիտներն իոննե-
րի չեն տրոհվում, իսկ բևեռային լուծիչներում, օրինակ՝ ջրում, դիսոց-
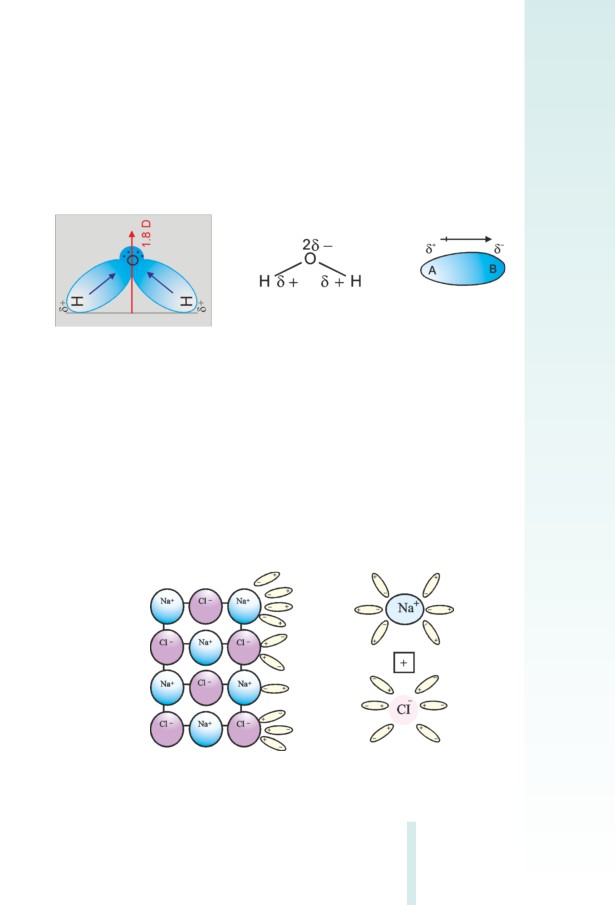
վում են՝ իոններ առաջացնելով: Ջրի մոլեկուլում ջրածնի ու թթվածնի
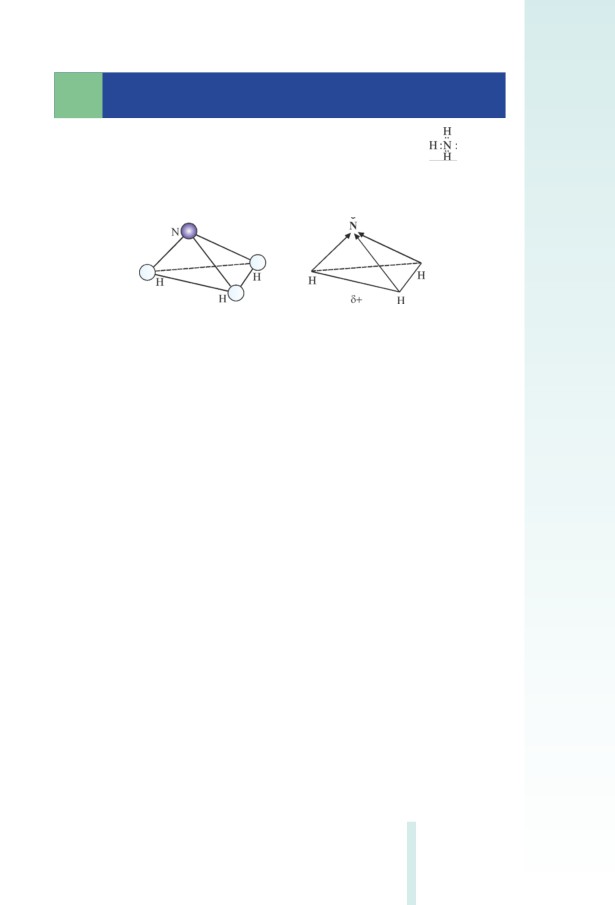
ատոﬓերի ﬕջև քիﬕական կապերը բևեռացված են (ընդ որում, ինչ-
պես գիտեք, այդ կապերի ﬕջև անկունը 104,5° է), ուստիև այդպիսի
մոլեկուլները կարելի է դիտել որպես երկբևեռ (դիպոլ) մասնիկներ
(նկ. 2.2):
Նկ. 2.2 Ջրի երկբևեռ մոլեկուլը
Իոնային կապով ﬕացություններում (օրինակ՝աղերում) իոններն ի
սկզբանե առկա են չլուծված պինդ նյութում: Այսպես՝ կերակրի աղի
(NaCI) բյուրեղավանդակի հանգույցներում Na+ և Cl¯ իոններն են:
Բյուրեղավանդակը քանդվում է բյուրեղավանդակի հանգույցնե-
րում գտնվող իոնների և ջրի երկբևեռ մոլեկուլների էլեկտրաստա-
տիկական (իոն-դիպոլային) փոխազդեցության հետևանքով: Այդ
փոխազդեցությունը՝ հիդրատացումը, ուղեկցվում է ջերմության ան-
ջատումով, ինչն էլ պայմանավորում է բյուրեղավանդակից իոնների
պոկուﬓ ու հիդրատացված իոնների հավասարաչափ բաշխումը լու-
ծույթի ողջ ծավալում (նկ. 2.3):
Նկ. 2.3 Նատրիուﬕ քլորիդի բյուրեղի տրոհումը
19
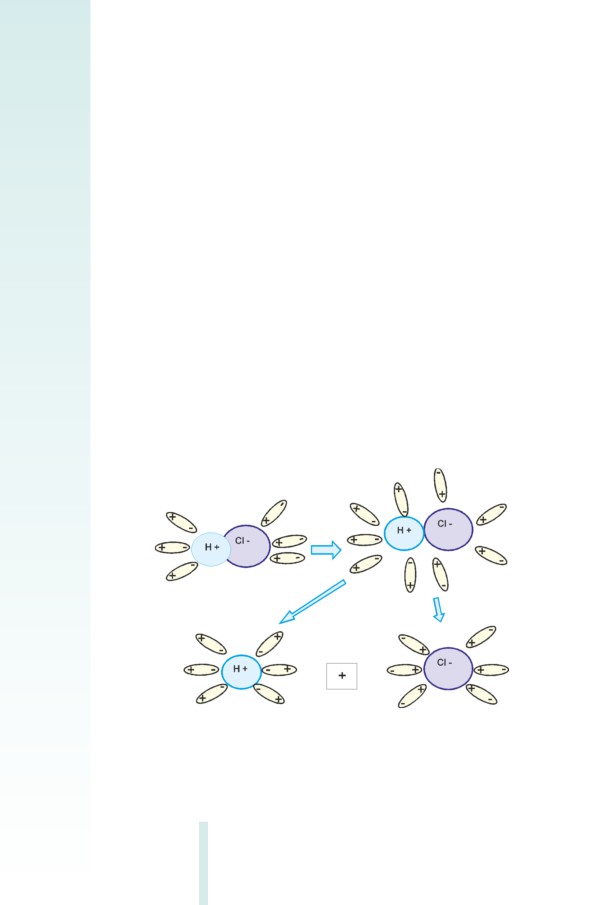
Ջրում, իոնային ﬕացություններից բացի, դիսոցվում են նաև կո-
վալենտային բևեռային ﬕացությունները, օրինակ՝ քլորաջրածինը
(HCI): Սովորական պայմաններում դա գազ է, որի մոլեկուլները կազմ-
ված են կովալենտային բևեռային կապով ﬕացած ջրածնի ու քլորի
ատոﬓերից:
Ջրում լուծելիս դիպոլ-դիպոլային փոխազդեցության հետևանքով
H-Cl կապը խզվում է. H+ իոնը քլորաջրածնի մոլեկուլից ջրի մոլեկուլին
է անցնում՝ (H3O)+ հիդրօքսոնիում իոններ առաջացնելով, այսինքն՝
քլորաջրածնի ջրային լուծույթում առկա են (H3O)+ և հիդրատացված
Cl¯ իոններ (նկ. 2.4):
Այսպիսով, իոնների հիդրատացումը ջրային լուծույթներում
դիսոցման հիﬓական պատճառն է:
Լուծիչի դերը ոչ ﬕայն բևեռացման ու հակառակ լիցքավորված
իոնների առաջացման համար պայման ստեղծելն է, այլև դրանց ﬕ-
ացումը կանխելը: Ջրային լուծույթում իոնները պատված են հիդրատ
թաղանթով՝ ջրային «մուշտակով», որը դիմադրում է իոնների ﬕաց-
մանը: Սակայն դիսոցման գործընթացը պատկերող քիﬕական հա-
վասարուﬓերում հիդրատ թաղանթները չեն գրառվում, քանի որ ջրի
մոլեկուլների թիվը ճշգրիտ որոշելն անհնար է, և, բացի այդ, յուրա-
քանչյուր իոնի շուրջը ջրի մոլեկուլներ նկարելն այնքան էլ հարմար չէ:
Նկ. 2.4 HCI-ի դիսոցման ﬔխանիզմը
20
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Կալիուﬕ քլորիդի (KCl) ջրային լուծույթն էլեկտրական
հոսանքի հաղորդիչ է: Նշանակում է՝ այդ լուծույթում
լիցքավորված մասնիկներ են առկա: Ո՞րն է դրա պատ-
ճառը (ընտրությունը հիﬓավորե՛ք).
ա) էլեկտրական հոսանքը
բ) ջրի մոլեկուլների բևեռային լինելը
գ) կալիում և քլոր տարրերի ատոﬓերի ﬕջև թույլ կա-
պի առկայությունը:
2. Ստորև ներկայացվածներից ընտրե՛ք այն ﬕացությունները, որոնք
ջրային լուծույթում դիսոցվում են դիպոլ-դիպոլային փոխազդեցու-
թյան հետևանքով.
ա) NaCl
բ) KNO3
գ) HF
դ) KF
3. Ո՞րն է լուծիչի դերը դիսոցման գործընթացում:
4. Ինչո՞ւ դիսոցման գործընթացը պատկերելիս հիդրատ թաղանթը չի
գրառվում:
5. Հիﬓականում ի՞նչ ձևով են առկա H+ իոնները լուծույթում:
6. Լրացրե՛ք հետևյալ նախադասության բաց թողած բառերը.
Ջրում լուծելիս կամ ... էլեկտրոլիտի տրոհուﬓ
անվանում են
էլեկտրոլիտային դիսոցում:
7. Քանի՞ մասնիկ է առաջանում ﬔկ մոլեկուլ կալցիուﬕ քլորիդը (CaCl2)
ջրում լուծելիս:
8. Արյանը փոխարինող լուծույթ (Պետրովի լուծույթ) պատրաստելիս 100
գ ջրում լուծում են այսպես կոչված Պետրովի հաբը, որը պարունա-
կում է 1,5 գ նատրիուﬕ քլորիդ (NaCl), 0,02 գ կալիուﬕ քլորիդ (KCl)
և 0,01 գ կալցիուﬕ քլորիդ (CaCl2): Հաշվե՛ք քլորիդ իոնների զանգվա-
ծային բաժինը (%) ստացված լուծույթում:
Առաջադրանք
Փորձե՛ք ինքնուրույն հավաքել էլեկտրական հոսանքի հաղորդա-
կանության ուսուﬓասիրության սարք: Որպես էլեկտրոդներ կարող
եք վերցնել մատիտի ﬕջուկը (գրաֆիտե ձող):
Եկե՛ք խաղանք
Դասարանը բաժանենք 4 խմբի։ Յուրաքանչյուր խումբ պետք է
գրի էլեկտրոլիտների և ոչ էլեկտրոլիտների անուններ և նրանց բա-
նաձևերը։ Հաղթում է այն խումբը, որի առաջարկած նյութերն առավել
շատ են։
21
2.3
Դուք արդեն տեղակ եք, որ էլեկտրոլիտների ջրային լուծույթնե-
րում առկա են իոններ, որոնք պատված են հիդրատ թաղանթով: Ուս-
տի հարցեր են ծագում.
արդյոք տարբերվո՞ւմ են իոնները համապատասխան չեզոք մաս-
նիկներից (ատոմ, մոլեկուլ),
ինչո՞վ են պայմանավորված էլեկտրոլիտների ջրային լուծույթների
հատկությունները:
Այս հարցերին պատասխանելու նպատակով դիտարկենք նատրի-
ուﬕ և քլորի ատոﬓերի ու իոնների կառուցվածքներն ու հատկու-
թյունները:
Նատրիում ու քլոր տարրերի ատոﬓերի (Na0 և Cl0) արտաքին էլեկ-
տրոնային շերտերը ﬕնչև օկտետ (ութնյակ) ավարտված չեն, այնինչ
այդ տարրերի իոններինը (Na+ և Cl-) ավարտված են: Այլ կերպ ասած՝
իոններն ատոﬓերից տարբերվում են իրենց էլեկտրոնային կառուց-
վածքով, ուստիև տարբեր հատկություններ ունեն: Ձեզ արդեն հայտնի
է, որ նատրիումը բուռն փոխազդում է ջրի հետ՝ ջրածին անջատելով:
Հայտնի է նաև, որ կերակրի աղը (NaCI) ջրում լուծելիս ջրի հետ փո-
խազդեցությունը չի ուղեկցվում ջրածնի ու քլորի անջատմամբ:
Ազատ նատրիուﬕ քիﬕական ակտիվությունը պայմանավորված է
այն հանգամանքով, որ այդ տարրի ատոմը հեշտությամբ կորցնում է
իր արտաքին էլեկտրոնային շերտի վալենտային էլեկտրոնն ու ձեռք
բերում իրեն նախորդող իներտ գազին (նեոնին՝ Ne) հատուկ արտա-
քին էլեկտրոնային շերտի դասավորություն:
Նատրիուﬕ քլորիդի (NaCI) բյուրեղներում արդեն իսկ առկա են
նատրիուﬕ իոններ: Հենց դա է պատճառը, որ այդ նյութը ջրում լու-
ծելիս ջրածին չի անջատվում:
Քլորը (CI2) քիﬕապես ակտիվ, դեղնականաչավուն, թունավոր,
հեղձուցիչ հոտով գազ է: Այնինչ քլորիդ իոնները (Cl-) անգույն են,
անհոտ ու թունավոր չեն: Բնականաբար, նատրիուﬕ ու քլորի իոններ
պարունակող կերակրի աղի ջրային լուծույթն անգույն է, անհոտ և
թունավոր չէ, այլ, ընդհակառակը, կենդանի օրգանիզﬓերին օգտա-
կար է ու անհրաժեշտ:
Այսպիսով, էլեկտրոլիտների ջրային լուծույթների հատկություննե-
րը պայմանավորված են հիդրատացված իոնների հատկություննե-
րով:
Իոնների կարևոր հատկություններից է գույնը: Դրանով էլ պայ-
մանավորված է էլեկտրոլիտների ջրային լուծույթների գույնը: Օրի-
22
նակ՝ Na+, K+, Cl-, (NO3)-, (SO4)2-, (PO4)3-, (CO3)2- հիդրատացված իոններն
անգույն են: Այդ իսկ պատճառով NaCI, KNO3, Na2SO4, Na3PO4, K2CO3
աղերի ջրային լուծույթները նույնպես անգույն են: Իոնները լինում են
նաև գունավոր: Այսպես, պղնձի Cu2+ իոններն անգույն են, ընդ որում
պղնձի սուլֆատը՝ CuSO4, սպիտակ բյուրեղային նյութ է: Սակայն
Cu2+ հիդրատացված իոնները երկնագույն են, ուստի այդ և թթվային
ﬓացորդի անգույն իոններ պարունակող աղի ջրային լուծույթները
նույնպես երկնագույն են: Հայտնի են նաև իոններ, որոնք և՛ ազատ,
և՛ հիդրատացված վիճակներում գույն ունեն: Օրինակ՝ քրոմատները
(H2CrO4 քրոմական թթվի աղերը) և՛ բյուրեղային, և՛ լուծված վիճակում
դեղին են, քանի որ դեղին են քրոմատ (CrO4)2- իոնները թե՛ ազատ,
թե՛ հիդրատացված վիճակում: Դեղին է կալիուﬕ քրոմատի՝ K2CrO4
աղի ջրային լուծույթը, ﬕնչդեռ համապատասխան ﬔտաղի իոնը՝ K+,
անգույն է: Գունավոր իոններ պարունակող աղերի օգնությամբ հնա-
րավոր է բացահայտել որոշ իոնների առկայությունը լուծույթում ու
ճանաչել նյութը:
Լաբորատոր փորձ
Եթե աղի, օրինակ՝ պղնձի քլորիդի (CuCI2) կամ կա-
լիուﬕ քրոմատի (K2CrO4) բյուրեղները դնենք որևէ ան-
գույն էլեկտրոլիտի (օրինակ՝ NaCI) լուծույթով թրջած
ֆիլտրի թղթի վրա, ապա բյուրեղահատիկները կլուծ-
վեն, և այդ հատիկներից յուրաքանչյուրի շուրջը՝ թղթի
վրա, գունավոր կլոր բծեր կառաջանան: Թղթի վրա
ծռված ﬔտաղալարի ձևով տեղադրենք երկու էլեկ-
տրոդ, որոնցից ﬔկը ﬕացնենք կուտակիչի դրական, իսկ մյուսը՝ բա-
ցասական բևեռին: Պատկերն արդեն այլ կլինի (նկ. 2.5): Կլոր բծի փո-
խարեն յուրաքանչյուր բյուրեղահատիկից գունավոր լեզվակ կձգվի
Նկ. 2.5 Իոնների շարժուﬓ էլեկտրոլիտի լուծույթի ﬕջով
հաստատուն էլեկտրական հոսանք անցկացնելիս
23
դեպի բացասական լիցքավորված էլեկտրոդը, եթե գունավոր են աղի
դրական լիցքավորված իոնները, տվալ դեպքում՝ Cu2+: Ընդհակառա-
կը, նման լեզվակ դեպի դրական լիցքավորված էլեկտրոդը կձգվի,
եթե գունավոր են աղի բացասական լիցքավորված իոնները, տվալ
դեպքում՝ CrO2-
4 :
Աղուսակ 2.2 ԼԱՅՆՈՐԵՆ ՏԱՐԱԾՎԱԾ ԻՈՆՆԵՐԻ
ՈՐԱԿԱԿԱՆ ՌԵԱԿՑԻԱՆԵՐԸ
Իոն
Ազդանյութ
Ռեակցիայի արդյունք
H+
Հայտանյութ
Լակմուս՝ կարﬕր, ֆենոլֆտալեին՝ անգույն, ﬔթիլ
նարնջագույն՝ կարﬕր
Ag+
Cl-
AgCI՝ ջրում ու թթուներում չլուծվող, լոռանման
սպիտակ նստվածք
Al3+
(OH)-
AI(OH)3՝ (OH)- իոնների ավելցուկում լուծվող, սպի-
տակ նստվածք
(NH4)+
(OH)-
NH3՝ ամոնիակի սուր հոտ
Ba2+
(SO4)2-
BaSO4՝ ջրում ու թթուներում չլուծվող, սպիտակ
նստվածք, բոցը գունավորում է դեղնականաչավուն
Ca2+
CaCO3՝ սպիտակ նստվածք,
CO2-
3
բոցը գունավորում է աղուսակարﬕր
Na+
—
բոցը գունավորում է դեղին
K+
—
բոցը գունավորում է մանուշակագույն
CI-
Ag+
AgCI՝ սպիտակ, լոռանման նստվածք
(PO4)3-
Ag+
Ag3PO4՝ դեղին նստվածք
(NO3)-
H2SO4, Cu
NO2՝ գորշ գազ (դարչնագույն)
(OH)-
հայտանյութ
Լակմուս՝ կապույտ, ֆենոլֆտալեին՝ մորեգույն,
ﬔթիլ՝ նարնջագույն, դեղին
24
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. KCI–ի լուծույթն անգույն է, իսկ KMnO4–ի և CuCI2–ի լու-
ծույթները համապատասխանաբար՝ մորեգույն և կա-
պույտ։ Ո՞ր իոններով են պայմանավորված այդ գույ-
ները։
2. Կալիուﬕ ﬕացությունները բոցին տալիս են հետևյալ
գույնը.
ա) կարﬕր բ) կապույտ գ) դեղին դ) մանուշակագույն:
3. Ի՞նչ աղ պետք է ավելացնել կալիուﬕ քլորիդի լուծույթին, որպեսզի
լուծույթում գոյանա կալիուﬕ նիտրատ։
4. Ո՞ր ազդանյութի օգնությամբ կարելի է հայտաբերել Ag+ իոնը:
5. Ո՞ր նյութի ջրային լուծույթով կարելի է հայտաբերել Cu2+ իոնը:
6. Ո՞ր ազդանյութի օգնությամբ կարելի է հայտաբերել Ba2+ իոնը.
ա) ազոտական թթու,
բ) ազոտային թթու,
գ) աղաթթու,
դ) ծծմբական թթու:
7. Ո՞ր ազդանյութի օգնությամբ կարելի է հայտաբերել S2- իոնը.
ա) կապարի նիտրատ,
բ) կալիուﬕ հիդրօքսիդ,
գ) նատրիուﬕ հիդրօքսիդ,
դ) բարիուﬕ քլորիդ:
8. 78,3 գ բարիուﬕ նիտրատը՝ Ba(NO3)2, լրիվ լուծել են ջրում: Հաշվե՛ք
Ba2+ և (NO3)- իոնների քանակները (մոլ) ստացված լուծույթում:
9-10. Կալցիուﬕ հալոգենիդի լուծույթի և ավելցուկով արծաթի նիտրա-
տի փոխազդեցությունից անջատվել է 18,8 գ նստվածք: Նույն քա-
նակությամբ կալցիուﬕ հալոգենիդի և ավելցուկով կալիուﬕ կար-
բոնատի լուծույթի փոխազդեցությունից անջատվել է 5 գ նստվածք:
Կալցիուﬕ ո՞ր հալոգենիդն է:
9. Որոշե՛ք կալցիուﬕ հալոգենիդի մոլային զանգվածը (գ/մոլ):
10. Հաշվե՛ք 13,8 % զանգվածային բաժնով կալիուﬕ կարբոնատի լուծույ-
թի զանգվածը (գ), որն անհրաժեշտ է 5 գ նստվածք ստանալու հա-
մար:
25
2.4
ԹՈՒՅԼ ԵՎ ՈՒԺԵՂ ԷԼԵԿՏՐՈԼԻՏՆԵՐ
Տարբեր էլեկտրոլիտներ դիսոցվում են տարբեր չափով: Կան
էլեկտրոլիտներ, որոնք դիսոցվում են ամբողջությամբ: Քիչ չեն նաև
այն էլեկտրոլիտները, որոնք դիսոցվում են մասամբ:
Դիսոցման երևույթը բացատրելիս ծագում են հետևյալ հարցերը.
արդյոք բոլոր նյութերի մոլեկուլները նույն քանակո՞վ են տրոհվում
իոնների,
ինչպիսի՞ն է դիսոցված ու չդիսոցված մոլեկուլների թվերի հարա-
բերությունը տարբեր էլեկտրոլիտների լուծույթներում,
ի՞նչ պայմաններում կարելի է դիսոցման հավասարակշռությունը
տեղաշարժել դեպի աջ կամ ձախ:
Այս հարցերի պատասխաններն ստանալու նպատակով կատա-
րենք հետևյալ փորձերը (նկ.1.1)՝ հաﬔմատելով վառվող լամպի պայ-
ծառությունը նույն կոնցենտրացիայով տարբեր էլեկտրոլիտների լու-
ծույթների դեպքում:
Փորձ 1. Էլեկտրոդներն ընկղﬔնք բաժակում լցված կալիուﬕ նիտ-
րատի (KNO3) 80 % զանգվածային բաժնով լուծույթի ﬔջ: Կնկատենք,
որ շղթային ﬕացված լամպի լույսը պայծառանում է:
Փորձ 2. Էլեկտրոդներն ընկղﬔնք քացախաթթվի (CH3COOH) 80 %
զանգվածային բաժնով լուծույթի ﬔջ: Կնկատենք, որ էլեկտրական
լամպը թույլ է վառվում:
Փորձ 3. Նոսրացնենք (ավելացնենք թորած ջուր) կալիուﬕ նիտ-
րատի լուծույթը, լամպի պայծառության փոփոխություն գրեթե չի
նկատվի:
Փորձ 4. Նոսրացնենք քացախաթթվի լուծույթը. այս դեպքում ար-
դեն լամպի պայծառությունն զգալի կﬔծանա:
Քանի որ էլեկտրոլիտների հաղորդականությունը կախված է լու-
ծույթում առկա իոնների թվից, ուստի կատարված փորձերից հան-
գում ենք այն եզրակացության, որ կալիուﬕ նիտրատը լրիվ է դիսոց-
վում, ընդ որում նույնիսկ խիտ լուծույթում, և նոսրացումը դիսոցման
վրա գրեթե չի ազդում: Այնինչ քացախաթթվի լուծույթում դիսոցված
մոլեկուլները փոքրաթիվ են, բայց նոսրացնելիս դրանց թիﬖ ավելա-
նում է: Այսպիսով, էլեկտրոլիտներ կան, որոնք ջրում լուծելիս գործ-
նականում լրիվ են դիսոցվում, և էլեկտրոլիտներ, որոնք մասամբ են
դիսոցվում:
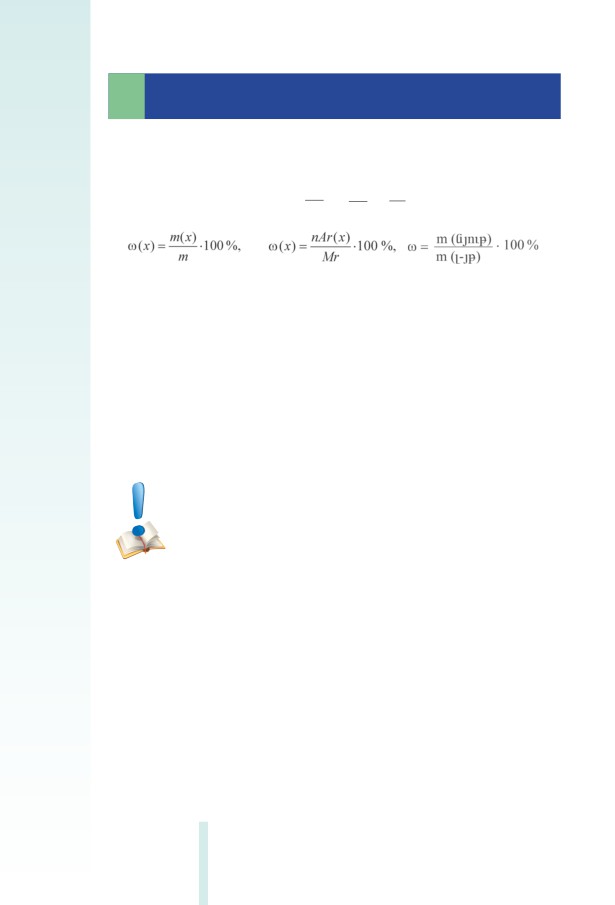
Քանակապես դիսոցումը բնութագրվում է դիսոցման աստիճա-
նով, որը նշանակվում է հունական այբուբենի (ալֆա) տառով:
26
Էլեկտրոլիտի դիսոցման աստիճանը () էլեկտրոլիտի տրոհ-
ված մոլեկուլների թվի և լուծված էլեկտրոլիտի մոլեկուլների
թվի հարաբերությունն է.
n
=
,
N
որտեղ n–ը էլեկտրոլիտի դիսոցված մոլեկուլների թիﬖ է կամ նյու-
թաքանակը, իսկ N–ը՝ լուծված էլեկտրոլիտի մոլեկուլների ընդհանուր
թիվը (կամ նյութաքանակը): Դիսոցման աստիճանը որոշվում է փոր-
ձով ու արտահայտվում ﬕավորի մասերով կամ տոկոսներով, ընդ
որում սովորաբար հարմար է մոլեկուլների թվերի փոխարեն հաշվար-
կը կատարել նյութաքանակներով.
n
=
• 100% ,
N
որտեղ n-ը դիսոցված էլեկտրոլիտի քանակն է (մոլ), իսկ N-ը՝ լուծված
էլեկտրոլիտինը. ո-ը կարող է ընդունել զրոյից ﬕնչև N արժեքներ,
հետևաբար՝ դիսոցման աստիճանն ընդունում է զրոյից (դիսոցում
չկա) ﬕնչև ﬔկ (լրիվ դիսոցում) արժեքները (կամ 0 - 100 %):
Օրինակ, եթե յոդաջրածնի լուծույթում HI-ի 3 մոլից դիսոցվում է
2,7-ը, ապա.
2,7
=
= 0,9 կամ 0,9 • 100% = 90 %
3
90 %–ը ցույց է տալիս, որ լուծույթում յոդաջրածնի յուրաքանչյուր
100 մոլեկուլից 90–ը դիսոցված է:
Դիսոցման աստիճանը կախված է էլեկտրոլիտի բնույթից, հետևա-
բար՝ տարբեր էլեկտրոլիտների դիսոցման աստիճանի արժեքները
տարբեր են: Տարբեր են նաև ﬕևնույն էլեկտրոլիտի դիսոցման աս-
տիճանի արժեքները տարբեր կոնցենտրացիաներով լուծույթներում.
լուծույթը նոսրացնելիս դիսոցման աստիճանն աճում է:
Ըստ դիսոցման աստիճանի ﬔծության՝ էլեկտրոլիտները պայմա-
նականորեն բաժանվում են երկու խմբի՝ ուժեղ և թույլ:
Ուժեղ են այն էլեկտրոլիտները, որոնք ջրում լուծելիս գրեթե
լրիվ դիսոցվում են իոնների:
Այս էլեկտրոլիտների դիսոցման աստիճանը մոտ է ﬔկին, սակայն
խիտ լուծույթներում կարող է 1-ից փոքր լինել: Ուժեղ էլեկտրոլիտնե-
րը նոսրացնելիս էլեկտրահաղորդականությունը քիչ է ﬔծանում, այդ
աճն էլ պայմանավորված է ոչ թե իոնների թվի անﬕջական փոփո-
խությամբ, այլ իոնների շարժման արագության ﬔծացմամբ: Ուժեղ
էլեկտրոլիտների շարքում են դասվում.
27
բոլոր լուծելի աղերը,
ուժեղ թթուները՝ H2SO4, HCI, HNO3, HCIO4, HJ և այլն,
ալկալիները՝ NaOH, KOH, Ba(OH)2, RbOH և այլն:
Թույլ են այն էլեկտրոլիտները, որոնք ջրում լուծվելիս քիչ են տրոհ-
վում իոնների:
Նման էլեկտրոլիտների դիսոցման աստիճանը փոքր է: Թույլ
էլեկտրոլիտների շարքում են դասվում.
թույլ թթուները՝ H2S, H2CO3, H2SiO3, H2SO3, HF և այլն,
չլուծվող հիմքերն ու ամոնիակը,
ջուրը՝ H2O:
Զգայուն սարքերի օգնությամբ հաստատվել է, որ մաքուր ջուրը,
այնուաﬔնայնիվ, էլեկտրական հոսանք է հաղորդում, թեև չափա-
զանց թույլ: Նշանակում է՝ անգամ թորած ջուրն իոններ է պարու-
նակում: Ջուրն աննշան չափով դիսոցվում է ջրածնի H+ և հիդրօքսիդ
(OH)- իոնների.
H2O H+ + (OH)-
կամ
HOH + HOH (H3O)+ + (OH)-
Հիշեցնենք, որ (H3O)+ իոններն անվանում են հիդրօքսոնիում իոն-
ներ:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ի՞նչ գործոններից է կախված էլեկտրոլիտի դիսոցման
աստիճանը:
2. Չափավոր նոսրացնելիս ինչո՞ւ է թույլ էլեկտրոլիտի լու-
ծույթի էլեկտրահաղորդականությունը ﬔծանում:
3. Փորձով ստուգե՛ք էթիլ սպիրտի դիսոցման աստիճանը:
Ինչի՞ է հավասար այն:
4. Մեկ լիտր լուծույթը պարունակում է 0,2 մոլ ֆտորաջրածին (HF): Քանի՞
մոլ ֆտորաջրածին է դիսոցվել, եթե նրա դիսոցման աստիճանը 0,4 է:
5. Հաշվե՛ք ցիանաջրածնական թթվի (HCN) դիսոցման աստիճանը (%),
եթե այդ թթվի 0,1 մոլ/լ կոնցենտրացիայով լուծույթում 0,005 մոլ
ջրածնի իոն (H+) է առկա:
6. Խառնել են մրջնաթթվի (HCOOH) 300 մլ 0,1մոլ/լ և 200 մլ 2մոլ/լ կոն-
ցենտրացիայով լուծույթներ: Գտե՛ք H+ իոնների կոնցենտրացիան
(մոլ/լ) ստացված լուծույթում, եթե այդ լուծույթում մրջնաթթվի դի-
սոցման աստիճանը 2 % է:
28
2.5
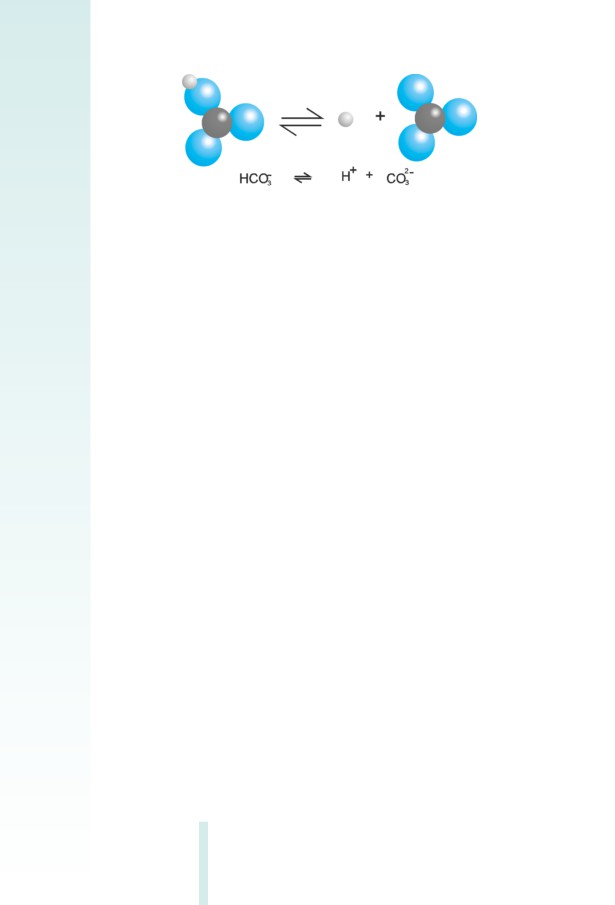
Ջրում լուծելիս թթուները, հիմքերն ու աղերը դիսոցվում են դրա-
կան և բացասական իոնների: Փորձենք գտնել, թե ինչն է ընդհանուրը
ﬕացությունների նույն դասին պատկանող էլեկտրոլիտների դիսոց-
ման գործընթացում:
Նախորդ ենթաբաժնում աղաթթվի օրինակով ցույց տրվեց, որ
ջրի բևեռային մոլեկուլների ազդեցությամբ քլորաջրածինը դիսոց-
վում է՝ առաջացնելով ջրածնի H+ կատիոններ և քլորիդ Cl- անիոններ:
Դիտարկենք ﬔկ այլ թթու, օրինակ՝ պերքլորական թթուն (HCIO4).
HClO4 H+ + ClO -
4
Թթուներն այն էլեկտրոլիտներն են, որոնց դիսոցուﬕց ստաց-
վում են ջրածնի կատիոններ ու թթվային ﬓացորդի անիոններ.
HNO3 H+ + (NO3)¯
HBr H+ + Br¯
H2SO4 2H+ + (SO4)2-
Կախված այն հանգամանքից, թե թթուն դիսոցվելիս ջրածնի քանի
H+ կատիոն է առաջանում, տարբերակում են ﬕահիﬓ և բազմահիﬓ
(երկհիﬓ, եռահիﬓ, քառահիﬓ) թթուներ: Բազմահիﬓ թթուները դի-
սոցվում են աստիճանաբար (դրանով է պայմանավորված այսպես
կոչված թթու աղերի առաջացման փաստը), օրինակ՝ դիտարկենք
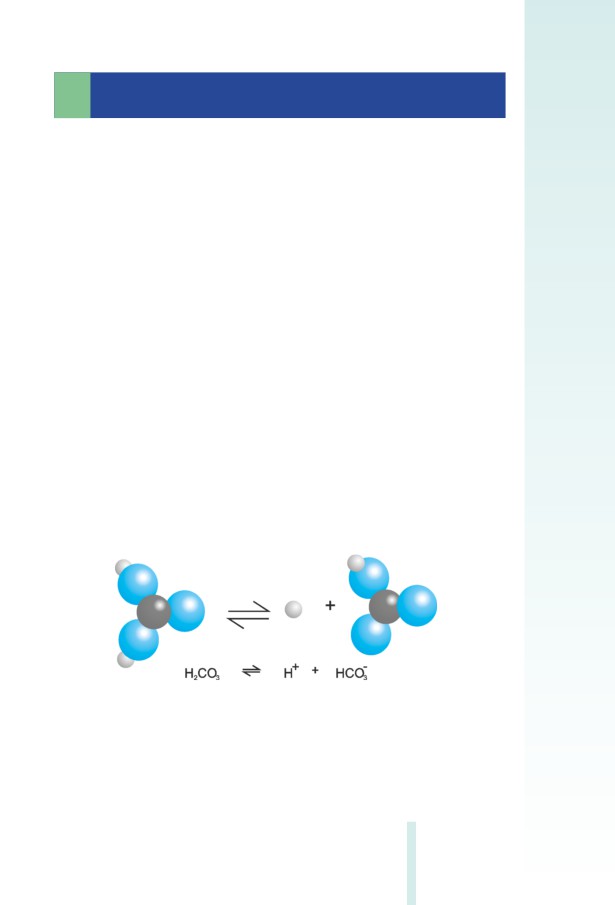
ածխաթթվի դիսոցումը:
Առաջին փուլ՝ H2CO3-ի դիսոցուﬕց առաջանում է հիդրոկարբո-
նատ իոն՝ (HCO3)¯ (նկ. 2.6).
Նկ. 2.6 Ածխաթթվի դիսոցման առաջին փուլի ուրվագիրը
Երկրորդ փուլում հիդրոկարբոնատ իոնը դիսոցվում է՝ առաջացնե-
լով կարբոնատ իոն՝ (CO3)2- (նկ. 2.7).
29
Նկ. 2.7. Ածխաթթվի դիսոցման երկրորդ փուլի ուրվագիրը
Այս բոլոր հավասարուﬓերը հաﬔմատելիս ակնհայտ է դառնում,
որ բոլոր թթուների դիսոցման գործընթացում ընդհանուրը ջրածնի H+
կատիոնների առաջացուﬓ է: Ուստի տրամաբանական է ենթադրել,
թե թթուները բնորոշող ընդհանուր հատկությունները (թթու համ,
հայտանյութի գույնի ﬕատեսակ փոփոխություն, որոշակի բնույթի
քիﬕական ռեակցիաներ և այլն) պայմանավորված են հատկապես
ջրածնի կատիոնների առկայությամբ:
Տարբեր հիմքերի դիսոցման հավասարուﬓերը հաﬔմատելով՝
կարելի է սահմանել.
Հիմքերն այն էլեկտրոլիտներն են, որոնց դիսոցուﬕց առաջա-
նում են ﬔտաղի կատիոններ ու հիդրօքսիդ (OH)¯, անիոններ.
NaOH Na+ + (OH)¯ KOH K+ + (OH)¯
Օքսիդացման +2 (և ավելի) աստիճան դրսևորող ﬔտաղների հիդ-
րօքսիդները դիսոցվում են աստիճանաբար (դրանով է բացատրվում
այսպես կոչված հիﬓային աղերի առաջացման փաստը), օրինակ.
I փուլ
Ca(OH)2 (CaOH)+ + (OH)¯
Il փուլ
(CaOH)+ Ca2+ + (OH)¯
Ջրային լուծույթներում հիմքերի բոլոր ընդհանուր հատկություննե-
րը պայմանավորված են (OH)¯ անիոնների առկայությամբ:
Պետք է նկատի ունենալ, որ թե՛ թթուների, թե՛ հիմքերի դիսոցու-
մը երկրորդ փուլում ավելի դժվար է ընթանում, և հավասարակշռու-
թյունը տեղաշարժվում է դեպի ձախ: Ահա թե ինչու երրորդ փուլում
(օրինակ՝ H3PO4 ֆոսֆորական թթվի դեպքում) սովորական պայման-
ներում դիսոցում գրեթե տեղի չի ունենում:
Վերջապես, տարբեր աղերի դիսոցման հավասարուﬓերը հաﬔ-
մատելով՝ կարելի է սահմանել.
Աղերն էլեկտրոլիտներ են, որոնք դիսոցվելիս առաջացնում են
ﬔտաղի կամ (NH4)+ կատիոններ ու թթվային ﬓացորդի անի-
ոններ:
30
Na2SO4 2Na+ + (SO4)2¯
Հասկանալի է, որ աղերն ընդհանուր հատկություններ չունեն, և
յուրաքանչյուր աղի հատկությունները պայմանավորված են այդ աղի
բաղադրության ﬔջ առկա ինչպես կատիոններով, այնպես էլ անիոն-
ներով: Օրինակ՝ ամոնիուﬕ քլորիդի (NH4CI) հատկությունները պայ-
մանավորված են ինչպես ամոնիում (NH4)+, այնպես էլ քլորիդ՝ Cl- իոն-
ներով:
Աղերը դիսոցվում են անﬕջապես ու լրիվ, այդ էլեկ-
տրոլիտներն աստիճանաբար չեն դիսոցվում:
Հիշեցնենք, որ սովորաբար օգտագործվում են դիսոցման պար-
զեցված ուրվագրեր: Թթու և հիﬓային աղերի հատկություններին
ավելի հանգամանորեն կծանոթանաք հետագայում:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ծծմբական թթվի աստիճանական դիսոցման հավասա-
րումը գրելիս առաջին փուլում դրվում է հավասարման,
իսկ երկրորդ փուլում՝ դարձելիության նշան: Ինչո՞ւ:
2. Միացությունների ո՞ր դասին է պատկանում նյութը,
եթե այդ նյութի լուծույթն էլեկտրականության լավ հա-
ղորդիչ է, բայց որևէ հայտանյութ իր գույնն այդ լուծույ-
թում չի փոխում:
3.
0,05 մոլ քացախաթթուն լուծել են ջրում ու ﬔկ լիտր լուծույթ ստացել:
Պարզվել է, որ թթվի 3 %-ը դիսոցվել է: Ի՞նչ մասնիկներ կլինեն լու-
ծույթում (ջրի մոլեկուլները չհաշված): Որոշե՛ք յուրաքանչյուր տեսակի
մասնիկների քանակը (մոլ):
4. Ջրածնի քանի՞ իոն կա ﬔկ լիտր լուծույթում, որը ﬔկ մոլ HNO2 է պա-
րունակում: Թթվի դիսոցման աստիճանը 20 % է:
5. Վերլուծությամբ պարզվել է, որ նատրիուﬕ սուլֆատի (Na2SO4) 1 լ լու-
ծույթը 1 մոլ (SO4)2- իոններ է պարունակում: Քանի՞ գրամ Na+ իոններ է
պարունակում այդ լուծույթի ﬔկ լիտրը:
31
2.6
ԻՈՆԱՓՈԽԱՆԱԿԱՅԻՆ ՌԵԱԿՑԻԱՆԵՐ
Ծանոթանալով ջրային լուծույթում թթուների, հիմքերի և աղե-
րի դիսոցմանը՝ ﬔնք իմացանք, որ ուժեղ էլեկտրոլիտները ջրային
լուծույթում գոյություն ունեն ﬕայն իոնների ձևով: Հետևաբար՝ բո-
լոր ռեակցիաները, որոնք տեղի են ունենում էլեկտրոլիտների ﬕջև
ջրային լուծույթում, իոնների ﬕջև ընթացող ռեակցիաներ են կամ իո-
նական ռեակցիաներ:
Ջրային լուծույթներում էլեկտրոլիտների իոնների մասնակ-
ցությամբ ընթացող ռեակցիաներն անվանում են իոնափոխա-
նակային:
Հիշենք, որ լուծույթներում բարդ նյութերի ﬕջև ընթացող ռեակ-
ցիաները հիﬓականում փոխանակման են, որոնց ժամանակ բարդ
նյութերը փոխանակվում են իրենց բաղադրիչ մասերով: Էլեկտրո-
լիտներում այդպիսի բաղադրիչ մասերն իոններն են:
Իոնափոխանակային ռեակցիաներն էլեկտրոլիտների լուծույթնե-
րում ընթանում են ﬕայն այն դեպքում, երբ իոնները կապվում են ﬕ-
մյանց, հեռանում են ﬕջավայրից՝ առաջացնելով չլուծվող, գազային
կամ քիչ դիսոցվող նյութեր (ջուր կամ այլ թույլ էլեկտրոլիտներ):
Դիտարկենք ﬕ շարք օրինակներ.
1. Իոնափոխանակային ռեակցիաներ, որոնք ընթանում են քիչ
դիսոցվող նյութի առաջացմամբ.
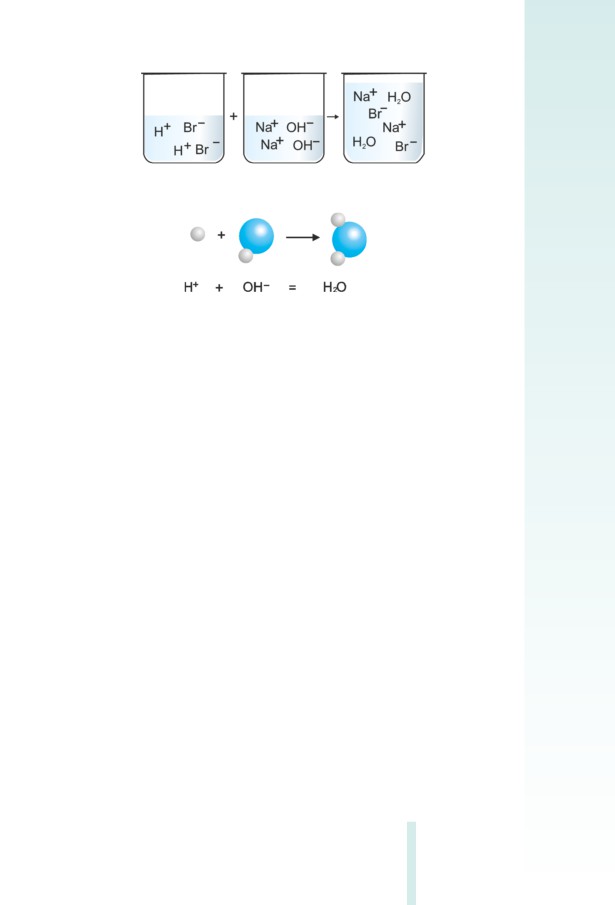
ա) ալկալու և թթվի փոխազդեցության ռեակցիա (չեզոքացման ռե-
ակցիա).
NaOH (լ-թ) + HBr (լ-թ)
= NaBr (լ-թ)
+ H2O (քիչ դիսոցվող)
Ռեակցիայի հավասարման նման գրառումը սովորաբար անվա-
նում են մոլեկուլային հավասարում:
Ներկայացվող ռեակցիային մասնակցող չորս նյութերից երեքը
ուժեղ էլեկտրոլիտներ են և լուծույթում գտնվում են իոնների ձևով
(նկ. 2.8): Ջուրը գործնականում չդիսոցվող թույլ էլեկտրոլիտ է,
գրվում է մոլեկուլային տեսքով, իսկ հավասարումը՝ հետևյալ ձևով.
Na+ + OH¯ + H+ + Br¯ = Na+ + Br¯ + H2O
Ռեակցիայի հավասարման նման գրառումը սովորաբար անվա-
նում են լրիվ իոնական հավասարում:
Եթե լրիվ իոնական հավասարման աջ և ձախ մասերից բացառենք
հավասար թվով նույն իոնները, ապա կստացվի ռեակցիայի կրճատ
իոնական հավասարումը (նկ. 2.9) (սովորաբար սկզբից գրվում է կա-
տիոնը, հետո՝ անիոնը).
32
Նկ. 2.8 Չեզոքացման ռեակցիայի ուրվագիրը
Նկ. 2.9 Չեզոքացման ռեակցիայի կրճատ իոնական
հավասարման ուրվագիրը
բ) Հիﬓային օքսիդի և թթվի փոխազդեցության ռեակցիա.
Մոլեկուլային հավասարումը.
BaO (օքսիդ) + 2HNO3 (լ-թ) = Ba(NO3)2 (լ-թ)
+ H2O (քիչ դիսոցվող)
Ռեակցիայի լրիվ իոնական հավասարումը.
BaO + 2H+ + 2NO3¯ = Ba2+ + 2NO3¯ + H2O
Ռեակցիայի կրճատ իոնական հավասարումը.
BaO + 2H+ = Ba2+ + H2O
գ) Ջրում չլուծվող հիմքի և թթվի փոխազդեցության ռեակցիա.
Մոլեկուլային հավասարումը.
Mg(OH)2 (չլուծվ.) + H2SO4 (լ-թ)
= MgSO4 + 2H2O (քիչ դիսոցվող)
Ռեակցիայի լրիվ իոնական հավասարումը.
Mg(OH)2 + 2H+ + SO42¯ = Mg2+ +SO42¯ + 2H2O
Ռեակցիայի կրճատ իոնական հավասարումը.
Mg(OH)2 + 2H+ = Mg2+ + 2H2O
2. Իոնափոխանակային ռեակցիաներ, որոնք ընթանում են ջրում
քիչ լուծվող նյութի առաջացմամբ.
ա) լուծելի աղի և ալկալու փոխազդեցությունը.
Մոլեկուլային հավասարումը.
CuCl2 (լ-թ) + 2KOH (լ-թ) = 2KCl (լ-թ)
+ Cu(OH)2
Ռեակցիայի լրիվ իոնական հավասարումը.
Cu2+ + 2Cl- + 2K+ + 2OH- = 2K+ + 2Cl- + Cu(OH)2
Ռեակցիայի կրճատ իոնական հավասարումը.
Cu2+ + 2OH- = Cu(OH)2
33
բ) Երկու լուծելի աղերի փոխազդեցությունը.
Մոլեկուլային հավասարումը.
Na2SO4 (լ-թ) + BaCl2 (լ-թ) = BaSO4 + 2NaCI (լ-թ)
Լրիվ իոնական հավասարումը.
2Na+ + SO42¯ + Ba2+ + 2Cl¯ = BaSO4 + 2Na+ + 2Cl¯
Կրճատ իոնական հավասարումը.
SO42¯ + Ba2+
= BaSO4
3. Իոնափոխանակային ռեակցիաներ, որոնք ընթանում են գա-
զային նյութի առաջացմամբ.
ա) լուծելի աղի (սուլֆիդի) և թթվի փոխազդեցությունը.
Մոլեկուլային հավասարումը.
K2S + 2HCl = 2KCl + H2S
Ռեակցիայի լրիվ իոնական հավասարումը.
2K+ + S2- + 2H+ + 2Cl- = 2K+ + 2Cl- + H2S
Կրճատ իոնական հավասարումը.
S2- + 2H+ = H2S
բ) Ջրում չլուծվող աղի (կարբոնատի) և թթվի փոխազդեցությունը.
Մոլեկուլային հավասարումը.
BaCO3 + 2HCI = BaCI2 + H2O + CO2
Ռեակցիայի լրիվ իոնական հավասարումը.
BaCO3 + 2H+
= Ba2+ + H2O + CO2
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ի՞նչ հատկանիշներով կարելի է որոշել, որ իոնափո-
խանակային ռեակցիան ընթացել է ﬕնչև վերջ։
2. Ի՞նչ հաջորդականությամբ պետք է գրել իոնափոխա-
նակային ռեակցիաները։
3. Ո՞րն է լրիվ և կրճատ իոնական հավասարուﬓերի
տարբերությունը։
4. Կազﬔ՛ք մոլեկուլային և իոնական ռեակցիաների հավասարուﬓերը
հետևյալ նյութերի լուծույթների ﬕջև.
ա) կալցիուﬕ քլորիդի և արծաթի նիտրատի,
բ) բարիուﬕ նիտրատի և նատրիուﬕ սուլֆատի,
գ) երկաթի (II) սուլֆատի և կալիուﬕ հիդրօքսիդի:
34
5. Կազﬔ՛ք հետևյալ կրճատ իոնական հավասարուﬓերին համապա-
տասխան ﬔկական մոլեկուլային հավասարում.
ա) Mg2+ + 2OH¯ = Mg(OH)2
բ) Fe(OH)2 + 2H+ = Fe2+ + H2O
գ) SO32¯ + 2H+ = SO2 + H2O
6. Բերե՛ք կարբոնատ՝ CO 2-
3
, իոններ պարունակող երեք նյութի օրինակ։
7. Ո՞ր ռեակցիան է կոչվում չեզոքացման, և ո՞րն է նրա էությունը։
8. Կալիուﬕ քլորիդի և նոսր ծծմբական թթվի լուծույթները ﬕմյանց
խառնելիս փոխազդեցություն տեղի չի ունենում։ Ցո՛ւյց տվեք այդ՝
գրառելով ենթադրյալ ռեակցիայի կրճատ իոնական հավասարումը։
9. Ո՞ր դեպքում իոնափոխանակային ռեակցիան կընթանա ﬕնչև վերջ
գազային նյութի անջատման հետևանքով.
ա) կալցիուﬕ քլորիդ և նատրիուﬕ կարբոնատ,
բ) լիթիուﬕ հիդրօքսիդ և բրոմաջրածնային թթու,
գ) կալիուﬕ կարբոնատ և աղաթթու,
դ) պղնձի սուլֆատ և նատրիուﬕ հիդրօքսիդ:
10. Բերե՛ք ռեակցիայի հավասարման երկու օրինակ, որոնց կրճատ իո-
նական հավասարուﬓ ունենա հետևյալ տեսքը.
H+ + OH¯ = H2O
11. Ո՞ր նյութերի ﬕջև ջրային լուծույթում ընթացող ռեակցիայի հավա-
սարման կրճատ իոնական հավասարուﬓ է.
Ag+ + Br¯= AgBr
ա) արծաթի և բրոմաջրածնի,
բ) արծաթի և բրոﬕ,
գ) արծաթի նիտրատի և նատրիուﬕ բրոﬕդի,
դ) արծաթի քլորիդի և նատրիուﬕ ֆտորիդի:
12. Նատրիուﬕ սուլֆատի 0,4 լ ջրային լուծույթը պարունակում է 28,4 գ
իոն (անիոն և կատիոն): Որքա՞ն է նատրիում իոնների մոլային կոն-
ցենտրացիան (մոլ/լ) այդ լուծույթում:
13. Որքա՞ն է KH2PO4 + 2KOH = K3PO4 + 2H2O ռեակցիայի կրճատ իոնական
հավասարման քանակաչափական գործակիցների գումարը:
14. Որքա՞ն է տաքացման պայմաններում 2,5-ական մոլ ամոնիուﬕ կար-
բոնատի և բարիուﬕ հիդրօքսիդի ﬕջև ընթացող իոնափոխանա-
կային ռեակցիայի հետևանքով անջատված գազի ծավալը (լ,ն.պ.):
35
ԷԼԵԿՏՐՈԼԻՏԱՅԻՆ ԴԻՍՈՑՄԱՆ ՏԵՍՈՒԹՅԱՆ
2.7
ՀԻՄՆԱԴՐՈՒՅԹՆԵՐԸ
Ինչպես արդեն գիտեք, շվեդ գիտնական Սվանտե Արենիուսն
առաջինը 1887 թվականին բացահայտեց հալված և լուծված թթունե-
րի, հիմքերի ու աղերի առանձնահատուկ վարքի՝ իոնների տրոհվելու
ընդունակությունն ու ձևակերպեց էլեկտրոլիտային դիսոցման հիմ-
նական տեսական դրույթները:
Էլեկտրոլիտային դիսոցման ներկայիս տեսությունը կարելի է ամ-
փոփել հետևյալ չորս հիﬓադրույթով.
1. էլեկտրոլիտները հալվելիս կամ ջրում լուծվելիս տրոհվում են
իոնների: Այդ գործընթացն անվանում են էլեկտրոլիտային դի-
սոցում:
2. Ջրային լուծույթներում իոնները քիﬕապես կապված են ջրի
մոլեկուլների հետ. հիդրատացված են: Իոններն ատոﬓերից
տարբերվում են ինչպես էլեկտրոնային կառուցվածքով, այնպես
էլ հատկություններով:
3. Էլեկտրոլիտի ջրային լուծույթում և հալույթում իոնները շարժ-
վում են անկանոն: Այդ ընթացքում իոնները բախվում են ﬕմ-
յանց՝ կրկին մոլեկուլներ առաջացնելով, ուստի էլեկտրոլի-
տային դիսոցման գործընթացը դարձելի է:
4. Էլեկտրոլիտի լուծույթի կամ հալույթի ﬕջով հաստատուն էլեկ-
տրական հոսանք անցկացնելիս իոնների շարժումը կարգա-
վորվում է. դրական լիցքավորված իոնները, որոնց անվանում
են կատիոններ, շարժվում են դեպի կաթոդ, իսկ բացասական
լիցքավորված իոնները՝ անիոնները, շարժվում են դեպի անոդ:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Թվարկե՛ք ու պարզաբանե՛ք էլեկտրոլիտային դիսոց-
ման ժամանակակից տեսության չորս հիﬓադրույթնե-
րը:
2. Ինչո՞վ են տարբերվում իոններն ատոﬓերից:
3. Ինչո՞ւ է էլեկտրոլիտային դիսոցման գործընթացը դար-
ձելի:
4.
Մեկական մոլ քլորաջրածնական և ֆտորաջրածնական թթուներ
պարունակող 471,5 գ լուծույթին ավելացրել են 30 գ ﬔտաղական
կալցիում: Որքա՞ն է թթվի զանգվածային բաժինը (%) ռեակցիաներն
ավարտելուց հետո ﬓացած լուծույթում:
36
2.8
ՀԻԴՐՈԼԻԶ : ԱՂԵՐԻ ՀԻԴՐՈԼԻԶԸ
Ձեզ արդեն հայտնի է, որ գոյություն ունեն նյութեր (հայտանյու-
թեր), որոնք, լուծույթի բնույթից կախված, փոխում են իրենց գույնը:
Օրինակ՝ լակմուս հայտանյութը թթվի լուծույթում կարմրում է, հիմքի
լուծույթում՝ կապտում, ﬕնչդեռ չեզոք ﬕջավայրում մանուշակագույն
է ( նկ. 2.10):
Նկ. 2.10 Լակմուս հայտանյութի գույնը տարբեր ﬕջավայրերում
Փորձերն ապացուցում են, որ թթվային ﬕջավայր կարող է ունե-
նալ ոչ ﬕայն թթվի լուծույթը, իսկ հիﬓային ﬕջավայր՝ ոչ ﬕայն հիմ-
քի լուծույթը: Համոզվելու համար կատարե՛ք ﬕ քանի պարզ փորձ
(նկ. 2.11):
Փորձ 1. Նատրիուﬕ կարբոնատի՝ Na2CO3, ջրային լուծույթին ավե-
լացրե՛ք 2-3 կաթիլ ֆենոլֆտալեին: Լուծույթը կգունավորվի մորու գե-
ղեցիկ գույնով՝ հաստատելով (OH)- իոնների առկայությունն այդ լու-
ծույթում: Որտեղի՞ց հայտնվեցին (OH)- իոնները. չէ՞ որ Na2CO3 նյութն
այդպիսի իոններ չի պարունակում:
Նկ. 2.11 Հայտանյութերի գույնը աղերի լուծույթներում
Փորձ 2. Ալուﬕնի քլորիդի՝ AICI3, ջրային լուծույթին ավելացրե՛ք 2-3
կաթիլ լակմուսի լուծույթ: Լուծույթը կկարմրի, ինչը համոզիչ վկայու-
թյուն է, որ այնտեղ H+ իոններ կան: Կրկին հարց է ծագում. որտեղի՞ց
հայտնվեցին H+ իոնները. չէ՞ որ AICI3 նյութն իր բաղադրության ﬔջ
նույնիսկ ջրածին (H) տարր չի պարունակում: Պատասխանը ﬔկն է.
երկու դեպքում էլ համապատասխանաբար (OH)- և H+ իոններն առա-
ջացել են ջրից (H2O):
37
Փորձենք բացատրել հակասությունը կալիուﬕ ֆտորիդ (KF) աղի
օրինակով: Այդ աղը ջրում լուծելիս իոնների է տրոհվում.
KF K+ + F-
Ինչպես արդեն գիտեք, դիսոցումը տեղի է ունենում հիդրատաց-
ման, այսինքն՝ իոնների ու ջրի բևեռացված մոլեկուլների փոխազ-
դեցության հետևանքով: Այդ փոխազդեցությունը հանգեցնում է ջրի
մոլեկուլների լրացուցիչ բևեռացման, ուստի հնարավոր են դառնում
H-OH կապի ճեղքումը ջրի մոլեկուլում ու նոր H-F կապի առաջացումը.
F- + HOH HF + (OH)-
Նկարագրված գործընթացն անվանում են հիդրոլիզ (ջրատարրա-
լուծում):
Աղի հիդրոլիզն աղի ու ջրի մոլեկուլների ﬕջև ընթացող իո-
նափոխանակային ռեակցիա է, որի հետևանքով թույլ էլեկտ-
րոլիտի առաջացման պատճառով ﬕջավայրում փոխվում են
H+ կամ OH- իոնների քանակները:
Աղի հիդրոլիզի հետևանքով ﬕջավայրում առաջանում է քիչ դի-
սոցվող նյութ, ինչի պատճառով էլ փոխվում են H+ կամ OH- իոնների
հավասարակշիռ քանակները (այդ իոններից որևէ ﬔկի ավելցուկ է ի
հայտ գալիս):
Ցանկացած աղ կարելի է դիտել որպես հիմքի ու թթվի ﬕջև ըն-
թացող ռեակցիայի արգասիք: Այդ առումով աղերը կարելի է ստորա-
բաժանել 4 խմբի:
Ուժեղ թթվից և ուժեղ հիմքից առաջացած աղեր՝ KNO3, NaCI,
Na2SO4, Ba(NO3)2, KCIO4 և այլն:
Այդպիսի աղերը հիդրոլիզի չեն ենթարկվում: Համոզվենք փորձով:
Փորձ 3. Երեք փորձանոթում նատրիուﬕ քլորիդի (NaCI) լուծո՛ւյթ
լցրեք ու փորձանոթներից յուրաքանչյուրում ձեզ հայտնի հայտանյու-
թերից (ﬔթիլօրանժ, ֆենոլֆտալեին, լակմուս) 2-ական կաթի՛լ ավե-
լացրեք: Երեք հայտանյութի գույներն էլ կվկայեն, որ լուծույթում ﬕ-
ջավայրը չեզոք է:
Լուծելի աղերը, որոնք ուժեղ թթվից և ուժեղ հիմքից են առա-
ջացել, ջրում չեն հիդրոլիզվում: Այդ աղերի ջրային լուծույթ-
ները չեզոք են:
Ուժեղ թթվից և թույլ հիմքից առաջացած աղեր՝ AI2(SO4)3,
NH4CI, Pb(NO3)2, Fe(NO3)2 և այլն:
Որպես օրինակ դիտարկենք ամոնիուﬕ քլորիդի (NH4CI) հիդրոլի-
զը: Այդ աղը ջրում լուծելիս դիսոցվում է.
38
NH4CI NH4+ + Cl-
Ամոնիում իոնը և ջուրը փոխազդում են, քանի որ առաջանում է
NH4OH մոլեկուլը, որը քիչ է ենթարկվում դիսոցման: Այդ փոխազդե-
ցությունը կարտահայտվի հետևյալ ռեակցիաների հավասարուﬓե-
րով.
NH4+ + HOH NH4OH + H+
NH4CI + H2O NH4OH + H+ + Cl-
Հավասարուﬕց երևում է, որ առաջացած H+ և OH- իոնները չեն
հավասարակշռվում, և ﬕջավայրը դառնում է թթվային:
Ուժեղ թթվից և թույլ հիմքից առաջացած աղերը ջրային լու-
ծույթում հիդրոլիզվում են: Այդ աղերի ջրային լուծույթներում
ﬕջավայրը թթվային է:
Թույլ թթվից և ուժեղ հիմքից առաջացած աղեր՝ Na2S, KNO2,
K2SO3, NaF, NaCN և այլն:
Որպես օրինակ դիտարկենք նատրիուﬕ ցիանիդը (NaCN): Թույլ
ցիանաջրածնական թթվի (կապտաթթվի)՝ HCN, աղի դիսոցուﬕց
առաջացած (CN)- իոնները փոխազդում են ջրի հետ.
NaCN Na+ + (CN)-
(CN)-+ HOH HCN + (OH)-
(CN)- և ջրի փոխազդեցությունից լուծույթում (OH)- իոններ են կու-
տակվում, որոնք էլ պայմանավորում են ﬕջավայրի հիﬓային ռեակ-
ցիան: Քննարկվող ռեակցիայի գումարային հավասարուﬓ է.
NaCN + HOH NaOH + HCN
Թույլ թթվից և ուժեղ հիմքից առաջացած աղերը ջրային լու-
ծույթում հիդրոլիզվում են: Այդ աղերի ջրային լուծույթներում
ﬕջավայրը հիﬓային է:
Բազմահիﬓ թույլ թթվից առաջացած աղերը հիդրոլիզի են են-
թարկվում աստիճանաբար: Սենյակային ջերմաստիճանում, որպես
կանոն, հիդրոլիզն ընթանում է առաջին փուլով, օրինակ.
K2CO3 2K+ + (CO3)2-
(CO3)2- + HOH
(HCO3)- + (OH)-
2K+ + (CO3)2- + HOH K+ + (HCO3)- + K+ + (OH)-
K2CO3 + HOH KHCO3 + KOH
39
Թույլ թթվից և թույլ հիմքից առաջացած աղեր՝ NiF2, (NH4)2CO3,
(CH3COO)2Cu, CH3COONH4 և այլն:
Այս աղերը նույնպես հիդրոլիզի են ենթարկվում, սակայն ﬕջա-
վայրի ռեակցիան տվալ դեպքում որոշվում է հիդրոլիզից առաջա-
ցած թույլ թթվի ու թույլ հիմքի հաﬔմատական ուժով, օրինակ.
CH3COONH4 + HOH CH3COOH + NH4OH
Տվալ աղի ջրային լուծույթում լակմուսը մանուշակագույն է ներկ-
վում, այսինքն՝ ﬕջավայրի ռեակցիան չեզոք է, քանի որ քացախա-
թթուն (CH3COOH) և ամոնիուﬕ հիդրօքսիդը (NH4OH) ջրային լուծույ-
թում գրեթե նույն չափով են դիսոցվում:
Հիդրոլիզի խորությունը կախված է տարբեր գործոններից, մաս-
նավորապես լուծույթի ջերմաստիճանից ու կոնցենտրացիայից: Այս-
պես, աղերի ﬔծ մասը սենյակային ջերմաստիճանում քիչ է հիդրո-
լիզվում: Բայց լուծույթը տաքացնելիս հիդրոլիզը խորանում է, քանի
որ հիդրոլիզը ջերմակլանիչ գործընթաց է:
Հիդրոլիզը խորանում է լուծույթը նոսրացնելիս: Ավելորդ չէ վեր-
ջում նշել, որ ջրում չլուծվող աղերի հիդրոլիզի մասին խոսելն անի-
մաստ է:
Հայտնի են ﬕացություններ, որոնք ջրային լուծույթում գոյություն
չունեն, քանի որ լրիվ հիդրոլիզվում են, ինչպես, օրինակ՝ ալուﬕնի
սուլֆիդը (AI2S3).
Al2S3 + 6HOH 2Al(OH)3 + 3H2S
Նյութերի լուծելիության աղուսակում (տե՛ս գրքի գունավոր ներ-
դիրը) նման աղերին համապատասխանող վանդակներն առանձնաց-
ված են գույնով: Այդպիսի աղերից են, օրինակ՝ սնդիկի ֆտորիդը՝
HgF2, բարիուﬕ սուլֆիդը՝ BaS, քրոﬕ(III) սուլֆիտը՝ Cr2(SO3)3 և այլն:
Ջրի ﬕլիարդ մոլեկուլից ﬕայն ﬔկն է իոնների դի-
սոցվում: Ջուրն այնքան թույլ էլեկտրոլիտ է, որ սովո-
րաբար այդ դիսոցուﬓ անտեսում են ու ﬕայն հատուկ
դեպքերում են հաշվի առնում:
40
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Արդյոք կարո՞ղ է աղի ջրային լուծույթում լակմուսի
թուղթը կարմրել, իսկ կապտե՞լ: Պատասխանը հիﬓա-
վորե՛ք օրինակներով:
2. Ստորև թվարկվածներից երեք սյունակով առանձնաց-
րե՛ք համապատասխանաբար այն նյութերը, որոնք.
ա) հիդրոլիզի չեն ենթարկվում,
բ) ջրային լուծույթում լակմուսը կապույտ են գունավորում,
գ) ջրային լուծույթում լակմուսը կարﬕր են գունավորում:
Բոլոր դեպքերում պատասխանը հիﬓավորե՛ք.
NaCl, AgCl, CuSO4, AlCl3, CaCl2, FeCO3, Na2SO4, CuO, Na2CO3
3. Առաջարկե՛ք այնպիսի աղի օրինակ, որը հիդրոլիզի է ենթարկվում,
բայց ﬕջավայրի ռեակցիան չեզոք է ﬓում:
4. Գրե՛ք հետևյալ աղերի հիդրոլիզը պատկերող ռեակցիաների հավա-
սարուﬓերն ու նշե՛ք ﬕջավայրի բնույթը (թթվային, հիﬓային կամ չե-
զոք).
Ca(NO2)2, ZnCl2, Na2S, Cr(NO3)2
5. I սյունակում ներկայացված ազդակներին համապատասխան՝ II սյու-
նակից ընտրե՛ք նատրիուﬕ կարբոնատի (Na2CO3) հիդրոլիզի գոր-
ծընթացի փոփոխության տարբերակը.
I
II
1) լուծույթի տաքացում
ա) ﬔծանում է
2) լուծույթի սառեցում
բ) փոքրանում է
3) լուծույթի նոսրացում
գ) չի ազդում
4) ալկալու լուծույթի ավելացում
41
«էԼԵԿՏՐՈԼԻՏԱՅԻՆ ԴԻՍՈՑՈԻՄ»
ԹԵՄԱՅԻ ՎԵՐԱԲԵՐՅԱԼ ՓՈՐՁԱՐԱՐԱԿԱՆ ԽՆԴԻՐՆԵՐԻ ԼՈԻԾՈԻՄ
Խնդիր 1. Իրականացրե՛ք ռեակցիաներ նյութերի հետևյալ զույգերի
ﬕջև.
ա) Zn և HCI, NaOH և H2SO4, MgO և H2SO4, CaCO3 և HCI
բ) CuO և H2SO4, Ca(OH)2 և HNO3, Fe և H2SO4, Na2SiO3 և H2SO4
Խնդիր 2. Իրականացրե՛ք ռեակցիաներ հետևյալ նյութերի զույգերի
լուծույթների ﬕջև.
ա) KOH և HCI, CuSO4 և NaOH, Na2CO3 և HNO3
բ) CaCI2 և AgNO3, Na2SO3 և HCI, Ca(OH)2 և HNO3
գ) AI2(SO4)3 և NaOH, K2CO3 և HNO3, NaOH և H2SO4
Խնդիր 3. Ձեզ տրամադրված անհրաժեշտ նյութերից օգտվելով՝
ստացե՛ք ա) BaSO4 բ) Fe(OH)3 գ) AgCI դ) CO2:
Խնդիր 4. Համարակալված, բայց չպիտակավորված չորս փորձա-
նոթում լցված են հետևյալ նյութերի լուծույթները.
HCI, NaOH, CuSO4, Ba(NO3)2
Ձեզ տրամադրված ազդանյութերից օգտվելով՝ որոշե՛ք, թե որ
փորձանոթում որ նյութն է:
Խնդիր 5. NaOH, H2SO4, CuCI2, NaCI, AgNO3, Na2CO3, BaCI2 նյութերից
որո՞նք զույգ-զույգ կփոխազդեն ջրային լուծույթներում: Իրականաց-
րե՛ք ընթացող ռեակցիաները և գրե՛ք ռեակցիաների հավասարուﬓե-
րը:
Խնդիր 6. Համարակալված, բայց չպիտակավորված չորս փոր-
ձանոթում լցված են հետևյալ նյութերի ջրային լուծույթները՝ քլո-
րաջրածնային թթու
(աղաթթու), արծաթի նիտրատ, նատրիուﬕ
ֆոսֆատ, կալցիուﬕ կարբոնատ: Առանց այլ ազդանյութեր օգտա-
գործելու՝ որոշե՛ք, թե որ փորձանոթում որ նյութն է (խնդիրը լուծելիս
նախ աղ ուսա՛կ կազﬔք, ապա, այդ աղուսակի տվալների համա-
ձայն, փորձե՛ր կատարեք):
Առաջադրանքներ
Աշխատանքային տետրում գրե՛ք ձեր կատարած փորձերի վերա-
բերյալ համառոտ հաշվետվություն:
Գրե՛ք ձեր իրականացրած ռեակցիաների մոլեկուլային, իոնային ու
կրճատ իոնային հավասարուﬓերը:
42
2.9
Օքսիդավերականգնման (ՕՎ) ռեակցիաները քիﬕական երևույթ-
ների հատուկ դաս են: Այդ ռեակցիաների բնորոշ առանձնահատ-
կությունն այն է, որ գործընթացն իրականանում է աﬔնաքիչը երկու
ատոﬓերի օքսիդացման աստիճանների փոփոխությամբ՝ ﬔկի օքսի-
դացմամբ ու մյուսի վերականգնմամբ:
Այն ռեակցիաները, որոնք ընթանում են նյութերի բաղադրու-
թյան ﬔջ առկա տարրերի ատոﬓերի օքսիդացման աստի-
ճանների փոփոխությամբ, անվանում են օքսիդավերականգ-
նման ռեակցիաներ:
Այդ ռեակցիաների ընթացքը պայմանավորված է էլեկտրոնի ան-
ցումով ﬔկ ատոﬕց (իոնից) մյուսին, ինչի հետևանքով էլ օքսիդաց-
ման աստիճանի փոփոխություն է տեղի ունենում:
Էլեկտրոն տրամադրող տարրի ատոմը ﬔծացնում է իր օքսիդաց-
ման աստիճանը. օքսիդանում է:
Էլեկտրոն ընդունող տարրի ատոմը փոքրացնում է իր օքսիդաց-
ման աստիճանը. վերականգնվում է:
Այն նյութերը, որոնց մոլեկուլներն իրենց օքսիդացման աստի-
ճանը փոքրացնող ատոﬓեր են պարունակում, անվանում են
օքսիդացնողներ (օքսիդիչներ), իսկ իրենց օքսիդացման աս-
տիճանը ﬔծացնող ատոﬓեր պարունակող նյութերը՝ վերա-
կանգնողներ (վերականգնիչներ):
Օրինակ՝ հետևյալ ռեակցիայում.
2Al + 6HCl = 2AlCl3 + 3H2
ալուﬕնի ատոﬓ էլեկտրոն է տրամադրում ու ﬔծացնում իր օքսի-
դացման աստիճանը 0-ից +3.
Al0 - 3e = Al3+
Ուրեﬓ՝ այստեղ վերականգնող է ալ ուﬕնը:
Ջրածնի իոնն ընդունում է ալ ուﬕնի ատոﬕ տրամադրած էլեկտ-
րոններն ու փոքրացնում իր օքսիդացման աստիճանը +1-ից 0: Ուրեﬓ՝
քլորաջրածինը (HCI) օքսիդացնող է.
2H+ + 2e = H0
2
Ընդհանուր հավասարուﬓ իոնային տեսքով կարելի է պատկերել
այսպես.
2Al0 + 6H+ = 2Al3++ 3H0
2
Օքսիդացուﬓ ու վերականգնումը նույն ռեակցիայի երկու կող-
43
ﬔրն են: Դրանք երկու այնպիսի կիսառեակցիաներ են, որոնցից յու-
րաքանչյուրի ինքնուրույն գոյությունն անհնար է, իսկ այդ կիսառե-
ակցիաների ﬕաժամանակա ընթացքն ապահովում է ﬕասնական
օքսիդավերականգնման ռեակցիայի կայացումը:
Չնայած ռեակցիայի ընթացքում հիﬓական դերը ստանձնում են
իրենց օքսիդացման աստիճանը փոխող ատոﬓերը, այնուաﬔնայ-
նիվ համապատասխան ռեակցիաները դիտարկելիս ընդունված է օք-
սիդացնող ու վերականգնող անվանել ոչ թե առանձին ատոﬓերը,
այլ այդ ատոﬓերը պարունակող նյութերը:
Այսպես, հետևյալ ռեակցիայում.
Fe + CuCl2 = FeCl2 + Cu
Օքսիդացնող է պղնձի քլորիդը (CuCI2), որի մոլեկուլի բաղադրու-
թյան ﬔջ առկա պղնձի իոնը (Cu2+) էլեկտրոններ է ﬕացնում.
Cu2+ + 2e = Cu0
Հիշենք, որ -1 կամ +1 լիցքի դեպքում դրվում է համապատասխա-
նաբար «-» կամ «+»՝ առանց 1 թվի:
Ընդհանուր առմամբ էլեկտրոնների տեղաշարժը պատկերվում է
երկու կիսառեակցիայի ձևով: Օրինակ՝ մագնեզիուﬕ՝ թթվածնով օք-
սիդացման ռեակցիան կարելի է ներկայացնել այսպես.
2Mg + O2 = 2MgO
ա) օքսիդացման ռեակցիա.
Mg0 - 2e Mg2+
բ) վերականգնման ռեակցիա.
O20+ 4e 2Օ2-
Oքսիդավերականգնման ռեակցիայի հավասարման կազմումը
Օքսիդավերականգնման ռեակցիաների հավասարուﬓերի կազ-
մումը հիﬓված է ռեակցիայի ընթացքում յուրաքանչյուր քիﬕական
տարրի ատոﬓերի թվի ու լիցքի պահպանման սկզբունքների վրա:
Լիցքի պահպանման սկզբունքից հետևում է, որ վերականգնողի
տրամադրած էլեկտրոնների ընդհանուր թիվը պետք է հավասար լի-
նի օքսիդացնողի ստացած էլեկտրոնների թվին: Էլեկտրոնային այս
հաշվեկշռի հիման վրա էլ որոշում ենք ռեակցիաների հավասարում-
ների գործակիցները:
Հավասարումը կազﬔլու համար պետք է իմանալ ռեակցիայի ելա-
նյութերի և վերջանյութերի բանաձևերը նյութերի ու քիﬕական տար-
րերի հայտնի հատկությունների հիման վրա:
էլեկտրոնային հաշվեկշռի եղանակը հիﬓված է ելանյութերի ու
44
վերջանյութերի ատոﬓերի օքսիդացման աստիճանների հաﬔմա-
տության վրա: Դիտարկենք նշված եղանակը ծծմբաջրածնի (H2S)
այրման ռեակցիայի օրինակով:
Նախ՝ գրում ենք ռեակցիայի հավասարման ուրվագիրը.
H2S + O2 H2O + SO2
Ապա՝ որոշում ենք ռեակցիայի ընթացքում իրենց օքսիդացման
աստիճանը փոխող տարրերն ու գրառում այդ տարրերի օքսիդաց-
ման աստիճանները.
H2S-2 + O20 H2O-2 + S+4O-2
2
Տարբերակում ենք օքսիդացնողն ու վերականգնողը:
Ծծմբաջրածինը (H2S) վերականգնող է, քանի որ այդ նյութի մոլե-
կուլի բաղադրության ﬔջ առկա ծծմբի ատոﬕ օքսիդացման աստի-
ճանը ﬔծացել է.
S-2 S+4
Թթվածինը (O2) օքսիդացնող է, քանի որ տեղի է ունեցել այդ ատո-
ﬕ օքսիդացման աստիճանի փոքրացում.
O0 O-2
Այնուհետև կազմում ենք օքսիդացման և վերականգնման կիսա-
ռեակցիաների հավասարուﬓերը.
S-2 - 6e S+4| 2
O0
+ 4e 2O-2|3
2
Հաշվի առնելով, որ էլեկտրոնների փոխանցումը կատարվում
է համարժեքորեն, աﬔնափոքր բազմապատիկը գտնելու կանո-
նով որոշում ենք փոխանցված էլեկտրոնների ընդհանուր թիվը, որը
տվ ալ ռեակցիայում հավասար է 12-ի: Գտնված բազմապատիկնե-
րը (ծծմբաջրածնի համար՝ 2, թթվածնի համար՝ 3) օքսիդացնողի ու
վերականգնողի բանաձևերի գործակիցներն են հավասարման ձախ
մասում և համապատասխան ﬕացությունների բանաձևերի գործա-
կիցները՝ աջ մասում:
Ապա՝ ընտրում ենք ﬓացած գործակիցներն ըստ առանձին ատոմ-
ների ու գրում վերջնական հավասարումը.
2H2S + 3O2 2H2O + 2SO2
45
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Հետևյալ ռեակցիաների ուրվագրերում քիﬕական
նշանների վրա գրե՛ք օքսիդացման աստիճաններն ու
ցո՛ւյց տվեք էլեկտրոնների անցումը.
Mg + Cl2 MgCl2
Mg + HCl MgCl2 + H2
2. Տրված են քիﬕական ռեակցիաների ուրվագրեր: Այդ
ռեակցիաներից առանձնացրե՛ք օքսիդավերականգ-
նման ռեակցիաները և հավասարեցրե՛ք էլեկտրոնային
հաշվեկշռի եղանակով.
NH3 + O2 NO + H2O
Cu + HNO3 Cu(NO3)2 + NO2 + H2O
FeCl3 + KOH Fe(OH)3 + KCl
MgCO3 + HCl MgCl2 + H2O + CO2
3.
Ո՞րն է «հինգերորդ ավելորդ» պարզ նյութը կամ ﬕացությունը (ընտ-
րությունը հիﬓավորե՛ք).
ա) նատրիում, ծծմբաջրածին, կալիուﬕ պերմանգանատ, բարիում,
ջրածին. բ) ծծմբի (VI) օքսիդ, ամոնիակ, ազոտական թթու, ֆտոր,
ֆոսֆորի (V) օքսիդ:
4.
Քանի՞ գրամ թթվածին կանջատվի 49 գ Բերթոլեի աղի (KClO3) ջեր-
մային քայքայուﬕց MnO2 կատալիզատորի ներկայությամբ:
5.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O քիﬕական ռեակցիան իրականաց-
նելիս 2 մոլ քլոր (Cl2) է անջատվել: Որքա՞ն է օքսիդացնողի զանգվա-
ծը (գ):
6.
4FeS + 7O2 = 2Fe2O3 + 4SO2 ռեակցիան իրականացնելիս 0,6 մոլ ծծմբի
(IV) օքսիդ (SO2) է անջատվել: Որքա՞ն է վերականգնողի զանգվածը
(գ):
7. Էլեկտրոնային հաշվեկշռի եղանակով ընտրե՛ք տրված ուրվագրով
քիﬕական ռեակցիայի հավասարման գործակիցներն ու հաշվե՛ք
ելանյութերի անհրաժեշտ զանգվածները, եթե այդ ռեակցիան իրա-
կանացնելիս 0,3 մոլ ածխածնի (IV) օքսիդ (CO2) է անջատվել.
Fe2O3 + CO Fe + CO2
46
3
Մենք անցնում ենք տարբեր քիﬕական
տարրերի առաջացրած պարզ և բարդ
նյութերի քիﬕայի՝ անօրգանական քիﬕ-
այի հիմունքների ուսուﬓասիրությանը:
Բոլոր քիﬕական տարրերը՝ կախված
ատոﬓերի կառուցվածքից և հատկու-
թյուններից, բաժանվում են ﬔտաղների
և ոչ ﬔտաղների: Մետաղների և ոչ ﬔ-
տաղների են բաժանվում նաև քիﬕական
տարրերի առաջացրած պարզ նյութերը՝
կախված նրանց ֆիզիկական և քիﬕական հատկություններից:
Պարբերական աղուսակի 22 քիﬕական տարր ոչ ﬔտաղներ են:
Այդ 22 տարրերից երկուսը՝ ջրածինը և թթվածինը, համառոտ դի-
տարկվել են 8-րդ դասարանում: VIIIA խմբի վեց ոչ ﬔտաղներ՝ հելի-
ում, նեոն, արգոն, կրիպտոն, քսենոն, ռադոն, քիﬕապես ոչ ակտիվ
ﬕատոմ գազեր են: Շատ ցածր քիﬕական ակտիվության պատճա-
ռով այդ գազերը հաճախ անվանում են իներտ կամ ազնիվ գազեր:
Սովորաբար քիﬕայի սկզբնական դասընթացում բավարարվում ենք
ﬕայն դրանց հիշատակությամբ:
Բոր, արսեն, սելեն, տելուր և աստատ ոչ ﬔտաղներին առօրյայում
հազվադեպ ենք առնչվում և այդ պատճառով նույնպես չենք ուսում-
նասիրում:
Այսպիսով, ﬔր ուշադրության կենտրոնում են ինը ոչ ﬔտաղա-
կան քիﬕական տարր՝ ֆտոր՝ F, քլոր՝ CI, բրոմ՝ Br, յոդ՝ I, ծծումբ՝ S,
ազոտ՝ N, ֆոսֆոր՝ P, ածխածին՝ C, սիլիցիում՝ Si:
Ոչ ﬔտաղների ատոﬓերում արտաքին էլեկտրոնային շեր-
տը պարունակում է 4-ից ﬕնչև 8 էլեկտրոն: Բացառություն են
ջրածնի՝ H, հելիուﬕ՝ He, բորի՝ B ատոﬓերը:
47
3.1
ՀԱԼՈԳԵՆՆԵՐԻ ԸՆԴՀԱՆՈՒՐ ԲՆՈՒԹԱԳԻՐԸ
Հալոգեններ ընդհանուր անվանումով ﬕավորված են քիﬕական
տարրերի պարբերական համակարգի VIIA խմբի ֆտոր՝ F, քլոր՝ CI,
բրոմ՝ Br, յոդ՝ I տարրերը: Հալոգենների խմբին է պատկանում նաև
ռադիոակտիվ աստատ՝ At տարրը, որի քանակը երկրակեղևում ան-
չափ փոքր է: Նրա հատկությունների վերաբերյալ ﬔզ շատ քիչ բան է
հայտնի, և այն չենք դիտարկելու:
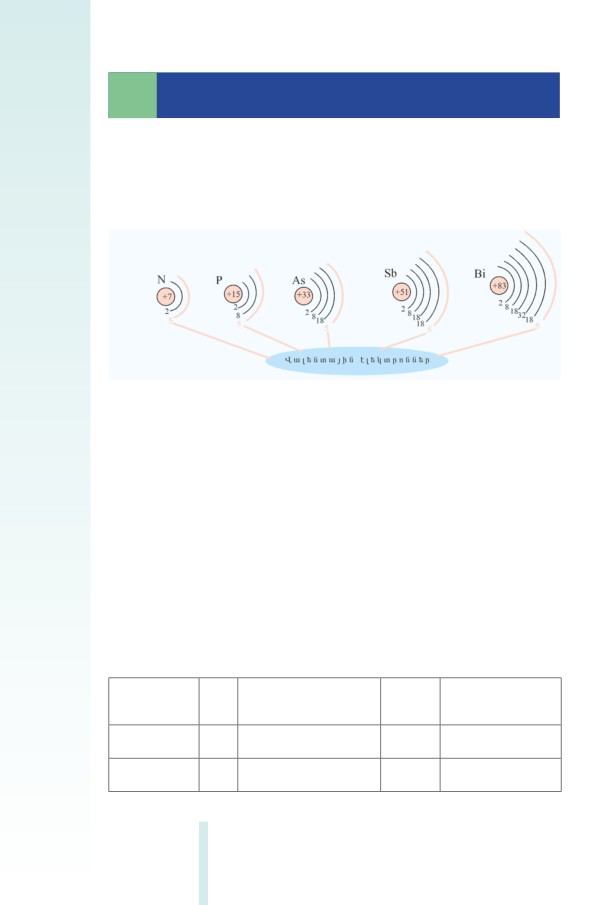
Հալոգենների ատոﬓերն արտաքին էլեկտրոնային շերտում պա-
րունակում են 7-ական էլեկտրոն (նկ. 3.1), արտաքին շերտի էլեկտրո-
նային բանաձևն է՝ ns2np5:
Նկ. 3.1 Էլեկտրոնների բաշխումը VII A խմբի տարրերի ատոﬓերում
Հալոգենների ատոﬓերին ﬕայն ﬔկ էլեկտրոն է պակասում՝ հա-
մապատասխան պարբերությունը եզրափակող իներտ գազի ատոﬕ
ns2np6 էլեկտրոնային կառուցվածքը ստանալու համար: Քիﬕական
ﬕացություն առաջացնելիս հալոգենների ատոﬓերն ընդունակ են
հեշտությամբ ﬕացնելու ﬔկ էլեկտրոն, և այդ պատճառով հալոգեն-
ների ատոﬓերի առավել բնութագրական օքսիդացման աստիճանը
-1 է: Մասնավորապես ﬔտաղի հետ փոխազդելիս հալոգենի ատոմը
նրանից ﬔկ էլեկտրոն է վերցնում և փոխարկվում -1 լիցքով իոնի: Հա-
լոգենի և ﬔտաղի ատոﬓերի ﬕջև ծագում է իոնային կապ, և առա-
ջանում է աղ: Այստեղից էլ ծագել է ենթախմբի «հալոգեններ» ընդ-
հանուր անվանումը՝ «աղածիններ» (hունարենից թարգմանաբար՝
halos՝ աղ, genos՝ ծնող):
Հալոգենների քիﬕական ակտիվությունը բավականին ﬔծ է, որի
պատճառով բնության ﬔջ ազատ վիճակում չեն հանդիպում:
Ֆտորի բնական հիﬓական հանքանյութերն են ֆտորապատիտ-
ները՝ 3Ca3(PO4)2 .CaF2 և պլավիկան սպաթը՝ CaF2 (նկ. 3.2): Քլոր պա-
րունակող հանքանյութերն են հալիտը (քարաղ)՝ NaCI (նկ. 3.3), սիլ-
վինը՝ KCI (նկ. 3.4), սիլվինիտը (NaCI և KCI մանրագույն բյուրեղների
խառնուրդ):
Ծովի ջուրը պարունակում է ﬔծ քանակներով քլոր (քլորիդ իոն-
ների՝ CI¯, ձևով): Բրոմը և յոդը սեփական հանքանյութեր չեն առա-
48
Նկ. 3.2 Պլավիկ ան սպաթ
Նկ. 3.3 Քարաղ
Նկ. 3.4 Սիլվին
ջացնում: Քլորի հանքանյութերը պա-
րունակում են քիչ քանակներով բրոմ
և յոդ: Այդ տարրերի աղբյուրներ են
որոշ «դառը» լճեր, օրինակ՝ Ղրիﬕ
աղային լիճը և Կասպից ծովի Կարա-
բողազգյոլ ծոցը: Յոդի ﬕացություն-
ներ առկա են նաև նավթահորային
ջրերում և ծովային ջրիմուռներում
(նկ. 3.5):
Նկ. 3.5 Ծովային ջրիմուռ լաﬕ-
նարիա
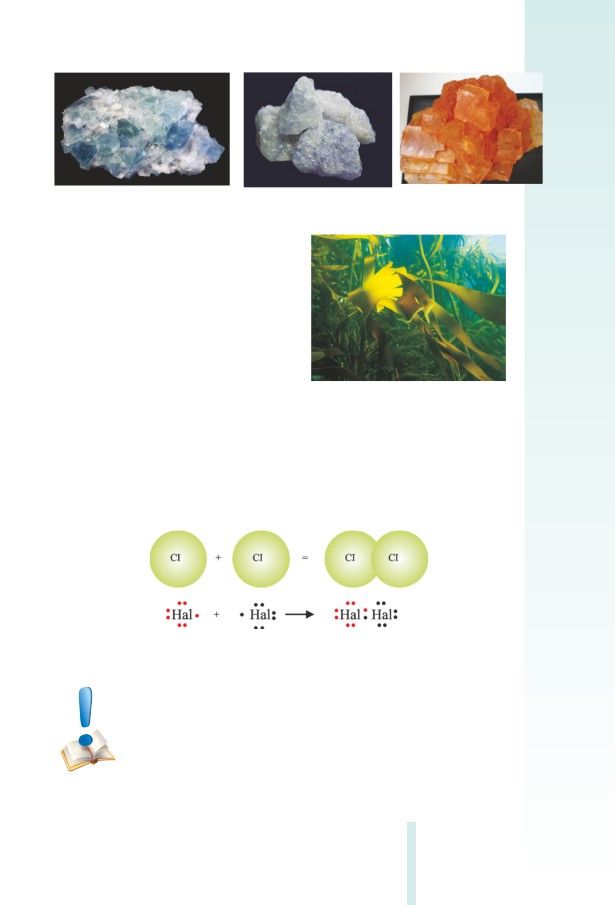
Հալոգեններ՝ պարզ նյութեր
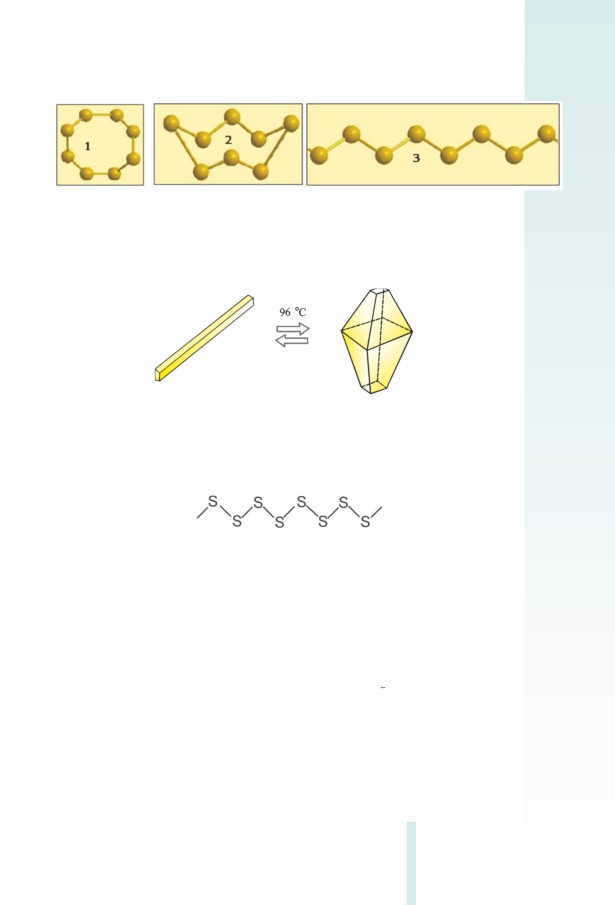
Հալոգենները գոյություն ունեն երկատոմ մոլեկուլների ձևով,
որոնք առաջանում են հալոգենների ատոﬓերի արտաքին էներգի-
ական մակարդակի կենտ էլեկտրոնների զույգվելու հաշվին: Կապը
երկու ատոﬕ ﬕջև կովալենտային ոչ բևեռային է (նկ. 3.6):
Նկ. 3.6 Հալոգենների մոլեկուլի առաջացումը
Բոլոր ագրեգատային վիճակներում (գազային, գո-
լորշի, հեղուկ կամ պինդ) հալոգեն պարզ նյութերը
կազմված են երկատոմ մոլեկուլներից (F2, CI2, Br2, I2):
49
Աղուսակ 3.1 Հալոգեններ պարզ նյութերի ֆիզիկական հատկությունները
Պարզ
Ագրեգա-
Գույնը
Հոտը
Հալման
Եռման
նյութ
տային
ջերմաս-
ջերմաս-
վիճակը,
տիճանը,
տիճանը,
20 °C
°C
°C
Ֆտոր՝
գազ, չի հե-
բաց դեղին
սուր,
-220
-183
F2
ղուկանում
գրգռող
Քլոր՝
գազ, հեղու-
դեղնակա-
սուր,
-101
-34
CI2
կանում է
նաչ
խեղդող
ճնշման
տակ
Բրոմ՝
հեշտ ցնդող
կարմրա-
տհաճ
-7
-7
Br2
հեղուկ
գորշ
Յոդ՝ I2
պինդ, են-
մուգ մանու-
սուր
+114
+186
թարկվում է
շակագույն`
սուբլիմաց-
ﬔտաղա-
ման
կան փայլով
Պինդ վիճակում F2, CI2, Br2, I2 պարզ նյութերն ունեն մոլեկուլային
բյուրեղավանդակ, ինչն էլ հաստատվում է դրանց ֆիզիկական հատ-
կություններով (աղուսակ 3.1): Բոլոր հալոգենները հոտ և գույն ու-
նեն: Գույնը բաց դեղինից փոխվում է կարմրագորշ բրոﬕ, ապա յոդի
մանուշակագույն գոլորշիների (յոդը պինդ վիճակում գրեթե սև, ﬔ-
տաղական փայլով նյութ է):
Մոլային զանգվածի ﬔծացման հետ հալոգենների հալման և եռ-
ման ջերմաստիճանները բարձրանում են, ﬔծանում է խտությունը.
ֆտորը և քլորը գազեր են, բրոմը՝ հեղուկ, յոդը՝ պինդ նյութ: Դա կապ-
ված է հալոգենների ատոﬓերի և մոլեկուլների չափերի ﬔծացման
հետ (նկ. 3.7), ինչով էլ պայմանավորված է ﬕջմոլեկուլային փոխազ-
դեցության ուժերի ﬔծացումը:
Քլորը, բրոմը և յոդը ջրում վատ են լուծվում, ֆտորը փոխազդում
է ջրի հետ:
Նկ. 3.7 Կապի երկարությունը հալոգենների մոլեկուլներում
Հալոգեններն ազատ վիճակում շատ թունավոր են,
նույնիսկ յոդը, եթե նրա կոնցենտրացիան օդում ﬔծ է:
50
Հալոգենների քիﬕական ակտիվությունը
Բոլոր հալոգեններն ուժեղ օքսիդիչներ են: Առավել վառ արտա-
հայտված օքսիդացնող հատկությամբ օժտված է ֆտորը:
Ատոմային համարի և ատոﬕ շառավղի ﬔծացման հետ հալո-
գենների օքսիդացնող հատկությունը փոքրանում է:
Յուրաքանչյուր հալոգեն իր պարբերությունում աﬔնաուժեղ օք-
սիդացնողն է, որը հստակ դրսևորվում է ﬔտաղների և հալոգենների
փոխազդեցության ժամանակ: Այսպես, ֆտորը սովորական պայման-
ներում փոխազդում է ﬔտաղների ﬔծ մասի, իսկ տաքացման պայ-
մաններում՝ նույնիսկ ազնիվ ﬔտաղների՝ արծաթի, ոսկու, պլատինի
հետ: Ալ ուﬕնը և ցինկը ֆտորի մթնոլորտում բոցավառվում են.
2AI + 3F2 = 2AIF3,
Zn + F2 = ZnF2
Մյուս հալոգենների և ﬔտաղների փոխազդեցությունն ընթանում է
տաքացման պայմաններում.
0
0
0
0
0
0
+3 -1
0
օ
+3
-1
Cu + Br2 =0 CuBr2,t
2Fe + 3Cl2 t
2FeCl3,
2Al + 3I2 t
=
2AlI3
2e
6e
6e
Պղինձը քլորի և բրոﬕ հետ փոխազդելիս առաջանում է պղնձի (II)
հալոգենիդ, իսկ յոդի հետ առաջանում է ﬕայն պղնձի (I) յոդիդ՝ CuI:
Քլոր պարունակող անոթի ﬔջ մանրացված ﬔտաղական անտի-
մոնի բյուրեղիկներ մտցնելիս այն այրվում է բռնկուﬓերով՝ փոքր ու
գեղեցիկ հրավառության նման (դա աﬔնագեղեցիկ քիﬕական ռե-
ակցիան է).
2Sb + 3CI2 = 2SbCI3,
2Sb + 5CI2 = 2SbCI5
Քանի որ կարգաթվի ﬔծացման հետ հալոգենների օքսիդացնող
ուժը թուլանում է, ուստի յուրաքանչյուր հալոգեն իր հաջորդներին
դուրս է մղում ﬔտաղի կամ ջրածնի հետ առաջացրած ﬕացություն-
ների ջրային լուծույթներից (այս ռեակցիաներից էլ օգտվելով՝ ստա-
նում են բրոմ և յոդ տարրերը).
0
+1
-1
+1
-1
0
0
+1 -1
+1 -1
0
Cl2 +
2NaBr(լ-թ) =
2NaCl(լ-թ) + Br2,
Br2 +
2KI(լ-թ) =
2KBr(լ-թ) + I2
2e
2e
Ֆտորի համար այս ռեակցիան բնութագրական չէ, քանի որ այն
ընթանում է լուծույթում, իսկ ֆտորի ﬕջավայրում ջուրն այրվում է.
0
-2
-1
0
2F2 +
2H2O = 4HF + O2
4e
51
Այս ռեակցիայում թթվածինը կատարում է իր համար ան-
սովոր վերականգնիչի դեր: Սա ﬕակ դեպքն է, երբ թթվա-
ծինն այրման ռեակցիայի արգասիք է և ոչ թե ելանյութ:
Այսպիսով, ֆտորը ﬕայն օքսիդացնող է՝ բոլոր տարրերից առա-
վել ուժեղը: Մյուս հալոգենները, իրենց ﬕացող տարրի էլեկտրա-
բացասականությունից կախված, դրսևորում են նաև վերականգնող
հատկություններ՝ ﬕացություններում ցուցաբերելով դրական օք-
սիդացման աստիճան: Դրա ցայտուն օրինակներն են հալոգենների
թթվածնային ﬕացությունները: Ինչպես արդեն նշվել է, հալոգեննե-
րը թթվածնի հետ անﬕջականորեն չեն փոխազդում, և հալոգենների
ու թթվածնի ﬕացությունները ստացվում են անուղղակի ճանապար-
հով: Ֆտորից բացի բոլոր հալոգեններն առաջացնում են օքսիդներ,
որոնցում հալոգենները դրսևորում են +1-ից +7 օքսիդացման աստի-
ճաններ: Այդ օքսիդներին համապատասխանում են թթուներ՝ HHalOn
ընդհանուր բանաձևով:
Հալոգենների ջրածնային ﬕացությունները
Հալոգենների և ջրածնի փոխազդեցության ռեակցիայի ընդհանուր
հավասարուﬓ է.
H2 + Hal2 = 2HHaI
Ստացվում են հալոգենաջրածիններ՝ ֆտորաջրածին, քլորաջրա-
ծին, բրոմաջրածին և յոդաջրածին:
Հալոգենների հայտաբերումը
Ֆտորն ազատ վիճակում առաջին անգամ հայտնաբերել է ֆրանսիացի
քիﬕկոս Ա.Մուասանը, որի համար արժանացել է Նոբել ան մրցանակի: Այդ
տարրն իր անունն ստացել է հունարեն «ֆտորոս» (քայքայող) բառից:
Քլորն առաջին անգամ հայտնաբերվել է շվեդ քիﬕկոս Կ.Շեելեի կող-
ﬕց 1774 թ.: Տարրն իր անունն ստացել է պարզ նյութի գույնից (հունարեն՝
քլորոս - դեղնականաչ):
Բրոմը հայտնաբերվել է 1826 թ. ֆրանսիացի քիﬕկոս Ա.Բալարի կողﬕց:
Տարրն անվանվել է պարզ նյութի հոտից (հունարեն բրոմոս՝ գարշահոտ):
Յոդը ստացվել է 1811 թ. ֆրանսիացի գիտնական Բ.Կուրտուայի կողﬕց,
իսկ անվանուﬓ ստացել է պարզ նյութի գոլորշիների գույնից՝ մանուշակա-
գույն (հունարեն՝ իոդես՝ մանուշակագույն):
Հալոգեն, ֆտոր, քլոր, բրոմ, յոդ, հալոգենների ատոմ-
ների կառուցվածք, ատոﬓերի օքսիդացման աստիճան,
հալոգեն պարզ նյութեր, ֆիզիկական և քիﬕական
հատկություններ, օքսիդացնող և վերականգնող հատկություննե-
րի փոփոխություն:
52
Խմբային առաջադրանք
Համացանցից գտե՛ք էլեկտրոնային հասցեներ, որոնք
կարող են լինել լրացուցիչ աղբյուրներ բանալի բառերի
և բառակապակցությունների բովանդակության լրիվ բա-
ցահայտման համար: Առաջարկե՛ք ուսուցչին ձեր օգնու-
թյունը նոր դասը պատրաստելու համար, կատարե՛ք հա-
ղորդում հաջորդ դասի վերաբերյալ:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Թվարկե՛ք հալոգեններ քիﬕական տարրերը և տվե՛ք
դրանց կարճ բնութագրերը:
2. Ո՞ր հալոգենն է օժտված առավել ուժեղ ա) ոչ ﬔտա-
ղական հատկություններով բ) էլեկտրաբացասակա-
նությամբ, գ) օքսիդացնող ուժով: Փորձե՛ք հիﬓավորել:
3. Ինչպե՞ս են փոխվում հալոգենների առաջացրած պարզ նյութերի
հալման և եռման ջերմաստիճանները, խտությունը կարգաթվի ﬔ-
ծացման հետ:
4. Քիﬕական կապի երկարություն է համարվում հեռավորությունը.
ա) ատոﬓերի ﬕջև մոլեկուլում,
բ) ատոﬓերի էլեկտրոնային շերտերի ﬕջև,
գ ) մոլեկուլում երկու ատոﬓերի ﬕջուկների ﬕջև,
դ ) մոլեկուլում երկու ատոﬓերի արտաքին էլեկտրոնների ﬕջև:
5. Նշե՛ք պրոտոնների, նեյտրոնների և էլեկտրոնների թիվը 19F իզոտո-
պում:
6. Քանի՞ անգամ է քլորի խտությունը ﬔծ օդի խտությունից (ն.պ.):
7. Քանի՞ էլեկտրոն է պարունակում քլորի ﬔկ մոլեկուլը:
8. Հաշվե՛ք բրոﬕ ﬔկ մոլեկուլի զանգվածը (գ):
9. Մեկ ճաշի գդալ կերակրի աղը կշռում է մոտ 10 գ: Որքա՞ն է աղի զանգ-
վածային բաժինը (%) լուծույթում, որն ստացվել է նշված զանգվածով
աղը 1 լ ջրում լուծելիս:
10. Բնական հալիտ (NaCI) հանքանյութի նմուշը վերլուծության ենթար-
կելիս հայտնաբերվել է 60 % քլոր՝ ըստ զանգվածի: Որքա՞ն է մաքուր
նատրիուﬕ քլորիդի զանգվածային բաժինը (%) հանքանյութի այդ
նմուշում:
53
ՀԱԼՈԳԵՆԱՋՐԱԾԻՆՆԵՐ, ՀԱԼՈԳԵՆԱՋՐԱԾ-
3.2
ՆԱՅԻՆ ԹԹՈՒՆԵՐ ԵՎ ՆՐԱՆՑ ԱՂԵՐԸ
Հալոգենաջրածիններ ստացվում են ջրածնի և հալոգենների ան-
ﬕջական փոխազդեցությունից:
Ֆտորը և ջրածինը ցանկացած պայմանում փոխազդում են պայ-
թյունով: Քլորի և ջրածնի փոխազդեցությունը պայթյունով է ընթա-
նում արեգակնային լույսի ուղղակի ազդեցությամբ կամ տաքացնելիս,
բրոմը և ջրածինը տաքացնելիս փոխազդում են առանց պայթյունի:
Նշված ռեակցիաները ջերմանջատիչ են: Բյուրեղային յոդի և ջրածնի
փոխազդեցությունը թույլ ջերմակլանիչ է, այն դանդաղ է ընթանում
նույնիսկ տաքացնելիս:
Ֆտորաջրածին ստանում են խիտ ծծմբական թթվի և պլավիկան
սպաթի փոխազդեցությունից.
CaF2+H2SO4 = CaSO4+2HF
Բարձր էլեկտրաբացասականության հետևանքով կապող էլեկ-
տրոնային զույգը հալոգենաջրածինների մոլեկուլներում շեղված է
դեպի հալոգենի ատոմը. հալոգենաջրածինների մոլեկուլներում քի-
ﬕական կապը կովալենտային բևեռային է:
Ֆտորաջրածնից բացի (19°C-ում ցնդող հեղուկ է), հալոգենաջրա-
ծինները սուր հոտով անգույն գազեր են, ջրում լավ են լուծվում՝ հա-
մապատասխան թթուներ առաջացնելով: Ֆտորաջրածինը խառնվում
է ջրի հետ ցանկացած հարաբերությամբ: Մեկ ծավալ ջրում 0°C-ում
լուծվում է 500 ծավալ HCl, 600 ծավալ HBr և 450 ծավալ HI: Բարձր
լուծելիությունը ջրում թույլ է տալիս ստանալ թթուների խիտ լուծույթ-
ներ:
Խնդիր 1
Հաշվե՛ք բրոմաջրածնի զանգվածային բաժինը (%) լուծույթում, որն
ստացվել է ﬔկ լիտր ջրում 600 լ (ն.պ.) բրոմաջրածին լուծելիս:
Լուծում
Ինչպես արդեն գիտենք, լուծված նյութի զանգվածային բաժինը լուծույ-
թում որոշվում է հետևյալ բանաձևով.
m (նյութ)
=
100
m (լ-թ)
600
Լուծված նյութի զանգվածը՝
m (նյութ) =
81 = 2169,64
գ
22,4
Լուծույթի զանգվածը՝ m (լ-թ) = 1000 + 2169,64 = 3169,64
54
2169,64
=
100% = 68,46 %
3169,64
Հալոգենաջրածինները ջրային լուծույթում դիսոցվում են՝ առաջացնե-
լով համապատասխան թթուներ.
HHal H+ + Hal-
HF - ֆտորաջրածնային թթու (պլավիկ ան)
HCI - քլորաջրածնային թթու (աղաթթու)
HBr - բրոմաջրածնային թթու
HI - յոդաջրածնային թթու
Թթվի ուժը HF — HCl — HBr — HI շարքում ﬔծանում է։
Խնդիր 2
Որքա՞ն է ֆտորիդ իոնների քանակը (մոլ/լ) և զանգվածը (գ) ֆտորա-
ջրածնի 0,1 մոլ/լ կոնցենտրացիայով 1 լ լուծույթում, եթե = 9 %:
Լուծում
Մեզ հայտնի է, որ դիսոցման աստիճանը որոշվում է հետևյալ բանա-
ձևով.
n
=
• 100% , որտեղ.
N
n-ը դիսոցված էլեկտրոլիտի քանակն է (մոլ)
N-ը՝ լուծված էլեկտրոլիտի քանակը (մոլ)
Խնդրի պահանջն է գտնել n-ը.
N
n =
= 0,09 . 0,1 = 0,009
մոլ ֆտորաջրածին դիսոցվել է.
100
HF H+ + F-
Ըստ դիսոցման հավասարման՝ n(F-) = n(HF) = 0,009 մոլ
m(F-) = 0,009 . 19 = 0,171 գ
Պատ.՝ 0,009 մոլ, 0,171 գ:
Պլավիկ ան թթուն օժտված է ﬕ շարք առանձնահատկություննե-
րով.
1. հալոգենաջրածնային թթուների ﬔջ առավել թույլ թթուն է,
2. պլավիկան թթուն ջրային լուծույթում գոյություն ունի առավելա-
պես H2F2 մոլեկուլների ձևով, որի պատճառով հայտնի են նրա ինչպես
չեզոք աղերը՝ ֆտորիդները (NaF, KF), այնպես էլ թթու աղերը (NaHF2,
KHF2): Ֆտորիդներից անլուծելի է կալցիուﬕ ֆտորիդը՝ CaF2,
3. պլավիկան թթվի և ֆտորաջրածնի երրորդ առանձնահատկու-
թյունը SiO2-ի հետ փոխազդեցությունն է.
SiO2 + 4HF = SiF4 + 2H2O
Ջրային լուծույթում ռեակցիան ընթանում է ջրում լուծելի H2SiF6
բարդ ﬕացության առաջացումով.
SiO2 + 6HF = H2SiF6 + 2H2O
55
Ջրում լուծելի ֆտորիդները (NaF, KF և այլն) թունավոր
են: Մարդու և շրջակա ﬕջավայրի համար վտանգավոր
է նաև ֆտորաջրածինը, որը թթվային անձրևների բա-
ղադրիչներից ﬔկն է:
Քլորաջրածին և աղաթթու
Քլորաջրածնի ստացումը
Արդյունաբերության ﬔջ քլորաջրածին
ստանում են սինթեզով՝ քլորի և ջրածնի ﬕացման ռեակցիայով.
H2 + CI2 = 2HCI
Լաբորատորիայում քլորաջրածին ստանում են խիտ ծծմբական
թթվի (70 %) և բյուրեղական նատրիուﬕ քլորիդի փոխազդեցությու-
նից (նկ. 3.8): Թույլ տաքացման պայմաններում ռեակցիան կանգնում
է թթու աղի առաջացման փուլի վրա.
NaCIբյուրեղ + H2SO4խիտ = NaHSO4 + HCI
Ուժեղ տաքացնելիս ստացվում է նատրիուﬕ սուլֆատ՝ Na2SO4.
2NaCI + H2SO4 = Na2SO4 + 2HCI
Սուլֆատային եղանակով հնարավոր չէ ստանալ HBr և HI, քանի որ
բրոմաջրածինը և յոդաջրածինն ուժեղ վերականգնիչներ են և խիտ
ծծմբական թթվից օքսիդանում են, օրինակ.
2NaBr +2H2SO4(խիտ) = Br2 + SO2 + Na2SO4 + 2H2O
Սովորաբար օգտագործում են խիտ աղաթթու, որում քլորաջրած-
նի զանգվածային բաժինը 37 % է: Խիտ թթուն խոնավ օդում ծխում է
(նկ. 3.9):
Գազային, չոր վիճակում գտնվող հալոգենաջրածինները չեն փո-
Նկ. 3.8 Քլորաջրածնի ստացումը
Նկ. 3.9 Ծխացող աղաթթու
56
խազդում ﬔտաղների ﬔծ մասի հետ: Ջրային լուծույթներն օժտված
են թթուների ընդհանուր հատկություններով. փոխազդում են ﬔծ
թվով ﬔտաղների, նրանց օքսիդների և հիդրօքսիդների հետ՝ առա-
ջացնելով աղեր՝ հալոգենիդներ (ֆտորիդներ, քլորիդներ, բրոﬕդ-
ներ, յոդիդներ).
Zn + 2HCI = ZnCI2 + H2
CuO + 2HCI = CuCI2 + H2O
AI(OH)3 + 3HCI =AICI3 + 3H2O
AgNO3 + HCI = AgCI + HNO3
NH3 + HCI = NH4CI
Ակտիվության շարքում ջրածնից հետո գտնվող ﬔ-
տաղները և հալոգենաջրածնային թթուները չեն փոխազ-
դում:
Օքսիդավերականգնման ռեակցիաներում հալոգենաջրածնային
թթուները վերականգնիչներ են, ընդ որում վերականգնիչ ընդունա-
կությունը Cl¯, Br¯, I¯ շարքում իոնի շառավղի ﬔծացման հետ ﬔծա-
նում է.
MnO2 + 4HCI = MnCI2 +CI2+ 2H2O
1
2CI¯ - 2e CI0
2
Mn4+ +2e Mn2+
1
2KMnO4 + 10HCI + 3H2SO4 = 2MnSO4 + 5CI2 + K2SO4 + 8H2O
2CI¯ - 2e CI0
5
2
Mn7+ +5e Mn2+
2
Հայտնի է, որ արծաթի ֆտորիդը լուծելի է, իսկ AgCI, AgBr, AgI աղե-
րը գործնականում անլուծելի են: Հալոգենիդ իոնի շառավղի ﬔծաց-
ման հետ արծաթի հալոգենիդի լուծելիությունը փոքրանում է: Առա-
վել քիչ լուծելի է արծաթի յոդիդը՝ AgI:
Լաբորատոր փորձ
Քլորիդների, բրոﬕդների և յոդիդների հայտաբե-
րումը
Երեք փորձանոթներում 2-ական մլ նատրիուﬕ քլո-
րիդի, նատրիուﬕ բրոﬕդի և նատրիուﬕ յոդիդի լու-
ծույթներ լցրե՛ք և յուրաքանչյուրին կաթիլներով ավե-
լացրե՛ք արծաթի նիտրատի լուծույթ: Ի՞նչ եք նկատում:
Լաբորատոր տետրում գրառե՛ք ձեր դիտարկուﬓերը: Գրե՛ք ռեակ-
ցիաների հավասարուﬓերը:
57
Հալոգենաջրածին, ֆտորաջրածին, պլավիկան
թթու, քլորաջրածին, աղաթթու, դիսոցման աստիճան,
բրոմաջրածին, յոդաջրածին, արծաթի քլորիդ, արծաթի
բրոﬕդ, արծաթի յոդիդ, հայտաբերման ռեակցիա:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ո՞ր նյութերն են օգտագործվում որպես հայտանյութեր:
Անվանե՛ք դրանցից ձեզ արդեն հայտնիները: Ինչպե՞ս
են դրանք գունափոխվում հալոգենաջրածնային թթու-
ների ջրային լուծույթներում:
2. Ի՞նչ ենք հասկանում ուժեղ և թույլ թթու ասելով: Ինչ-
պե՞ս է բացատրվում HF - HCI - HBr - HI շարքում թթվի
ուժի ﬔծացումը:
3. Ինչո՞ւ հնարավոր չէ բրոմաջրածնի և յոդաջրածնի ստացումը համա-
պատասխան հալոգենիդի և խիտ ծծմբական թթվի փոխազդեցու-
թյունից:
4. NaF, NaCI, NaBr, NaI աղերի խառնուրդին արծաթի նիտրատի լուծույթ
ավելացնելիս առաջին հերթին ո՞ր աղը կնստի:
5. Ինչո՞ւ քլորաջրածին, բրոմաջրածին և յոդաջրածին գազերը չի կարե-
լի հավաքել ջրի տակ ջրի դուրսմղման եղանակով:
6. Ի՞նչ ռեակցիա է իրականացվել, եթե նրա կրճատ իոնային հավասա-
րուﬓ է FeO + 2H+ = Fe2+ + H2O:
7. Ի՞նչ քանակով (մոլ) ցինկ պետք է լուծել աղաթթվում` 340 գ ցինկի քլո-
րիդ ստանալու համար:
8. Ի՞նչ ծավալով (լ, ն.պ.) ջրածին կանջատվի 96 գ մագնեզիուﬕ և ավել-
ցուկով վերցրած բրոմաջրածնային թթվի փոխազդեցությունից:
9. Որքա՞ն է բրոﬕդ իոնների քանակը (մոլ) և զանգվածը (գ) բրոմա-
ջրածնի 0,1 մոլ/լ կոնցենտրացիայով 1 լ լուծույթում, եթե = 93,5 %:
10. Ի՞նչ զանգվածով (գ) աղ կառաջանա, եթե երկաթի (II) օքսիդի հետ
փոխազդի յոդաջրածնի 25,6 % զանգվածային բաժնով 500 գ լու-
ծույթ:
58
3.3
ԴՐԱՆՑ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ
ԿԻՐԱՌՈՒԹՅՈՒՆՆ ՈՒ ԿԵՆՍԱԲԱՆԱԿԱՆ ԴԵՐԸ
Բոլոր հալոգեններից իր կիրառությամբ առավել ﬔծ նշանակու-
թյուն ունի քլորը: Բնական քլորը երկու իզոտոպի խառնուրդ է՝ 35CI
(75,5 %) և 37CI (24,5 %): Քլոր տարրի հարաբերական ատոմային զանգ-
վածը որոշվում է հետևյալ ձևով.
75,5 . 35 + 24,5 . 37
Ar(CI) =
=35,49
Ar(CI) 35,5
100
Ե՛վ արդյունաբերության ﬔջ, և՛ լաբորա-
տորիայում քլոր ստանում են քլորիդ (CI¯)
իոնների օքսիդացուﬕց. 2CI¯ - 2e = CI0
2
Լաբորատորիայում քլոր ստանում են
քլորաջրածնի օքսիդացուﬕց (նկ. 3.10 ).
4HCI + MnO2 = CI2+ MnCI2 + 2H2O
Որպես օքսիդացնող կարելի է վերցնել
նաև KCIO3, KMnO4, K2Cr2O7 և այլն:
Նկ.3.10 Քլորի ստացումը
լաբորատորիայում
Լաբորատոր փորձ
Քլորի ստացումը և հատկությունների ուսուﬓասի-
րությունը
Չոր փորձանոթում վերցրե՛ք կալիուﬕ պերմանգանատի ﬔկ-եր-
կու բյուրեղ և ավելացրե՛ք 20 %-անոց աղաթթվի ﬕ քանի կաթիլ: Ի՞նչ
է նկատվում:
Որոշե՛ք անջատվող գազի գույնը սպիտակ թղթի ֆոնի վրա: Ձեր
դիտարկուﬓերը գրանցե՛ք: Գրե՛ք ռեակցիայի հավասարումը: Գոր-
ծակիցներն ընտրե՛ք էլեկտրոնային հաշվեկշռի եղանակով:
Արդյունաբերության ﬔջ քլոր ստանում են նատրիուﬕ քլորիդի
հալույթի կամ խիտ ջրային լուծույթի էլեկտրոլիզից (նկ. 3.11).
2NaCl + 2H2O Էլեկտրոլիզ H2 + Cl2 + 2NaOH
59
Նկ. 3.11 Էլեկտրոլիզի սարք
Քլորը օդից մոտ 2,5 անգամ ծանր գազ է: 20oC-ում 1 լ ջրում լուծ-
վում է 2,5 լ քլոր: Ստացված դեղին լուծույթն անվանում են քլորաջուր:
Քլոր գազը մոտ 0,6 ՄՊա ճնշման տակ սենյակային ջերմաստիճա-
նում վերածվում է հեղուկի: Հեղուկ քլորը պահում են պողպատյա բա-
լոններում կամ գլանատակառներում (ցիստեռն):
Քլորը պնդանում է -101oC-ում՝ առաջացնելով կանաչավուն բյու-
րեղներ: Սառցաջրի ﬔջ քլոր անցկացնելիս առաջանում են քլորի
հիդրատի՝ CI2 . 8H2O, դեղնականաչավուն բյուրեղներ:
Յուրաքանչյուր տարի աշխարհում արտադրվում է մոտ 30 մլն
տոննա քլոր: Նրա ﬔծ մասը ծախսվում է քլորաջրածնի ստացման
համար: Մեծ քանակով քլոր է ծախսվում օրգանական նյութերի քլո-
րացման վրա: Այդպես ստացվում են տարբեր պլաստմասսաներ,
կաուչուկ, բույսերի պաշտպանության ﬕջոցներ, սինթետիկ մանրա-
թելեր, ներկեր, դեղաﬕջոցներ, լուծիչներ: Քլորը կիրառում են բամ-
բակ ա գործվածքների և թղթի սպիտակեցման համար օգտագործ-
վող քլորակրի և քլորաﬕնի արտադրությունում: Քլորը կիրառելի չէ
բրդյա գործվածքների և ﬔտաքսի գունաթափման համար, քանի որ
այդ թելերը սպիտակուցային են և փոխազդում են քլորի հետ: Քլորը
ոչնչացնում է հիվանդածին ﬕկրոօրգանիզﬓերը, և այդ պատճառով
այն օգտագործում են խﬔլու ջրի վարակազերծման համար (նկ. 3.12):
Լույսի ազդեցությամբ ջրի հետ փոխազդելիս քլորն առաջացնում է
ատոմական թթվածին (Օ), որն էլ վարակազերծում է ջուրը.
hv
CI2
2CI·
2CI· + H2O = 2HCI + O
60
Քլորի և ալկալիների (KOH, NaOH) փոխազդեցությունից ստացվում
է սպիտակեցնող հեղուկ (ժավելաջուր).
CI2 + 2NaOH = NaOCI +NaCI +H2O
Որպես ախտահանող և սպիտակեցնող նյութ օգտագործվում է
նաև քլորակիրը՝ Ca(CI)OCI:
Առաջադրանք
Ծանոթացում քլոր պարունակող սպիտակեցնող նյութերի հատ-
կություններին
Դիտարկե՛ք ձեզ տրված սպիտակեցնող նյութի նմուշը: Նկարա-
գրե՛ք նրա արտաքին տեսքը, զգույշ որոշե՛ք հոտը:
Եթե սպիտակեցնող նյութը պինդ ագրեգատային վիճակում է,
ապա պատրաստե՛ք նրա ջրային լուծույթը: Ստացված լուծույթը բա-
ժանե՛ք երկու մասի: Մի մասին ավելացրե՛ք լակմուս, մյուսի ﬔջ ընկղ-
ﬔ՛ք ներկած բամբակ ա գործվածք: Ի՞նչ եք նկատում:
Քլոր պարունակող սպիտակեցնող նյութերն արդյու-
նավետ են ﬕայն սառը ջրում, քանի որ տաքացնելիս
նրանք քայքայվում են: Օրինակ, նատրիուﬕ հիպոքլո-
րիտը քայքայվում է և կորցնում իր սպիտակեցնող ուժը.
tօ
3NaCIO
NaCIO3 + 2NaCI
Նկ. 3.12 Քլորի կիրառությունը
61
Քլորը պատկանում է այն տարրերի թվին, առանց որոնց անհնար
է կենդանի օրգանիզﬓերի գոյությունը: Քլորն օրգանիզմ է մտնում
նատրիուﬕ քլորիդի ձևով, որը խթանում է նյութափոխանակությունը,
մազերի աճը, օրգանիզﬕն հաղորդում է ուժ և կորով: Նատրիուﬕ
քլորիդը հիﬓականում գտնվում է արյան պլազմայում: Մարդուն օրա-
կան անհրաժեշտ է 20 գ կերակրի աղ:
Հատուկ դեր ունի աղաթթուն՝ HCI, որը մտնում է ստամոքսահյութի
բաղադրության ﬔջ: Առանց 0,2 %-անոց աղաթթվի գործնականում
դադարում է սննդի յուրացումը:
Գունավոր ﬔտալուրգիայում քլորացման ճանապարհով հանքե-
րից կորզում են տիտան, նիոբիում, տանտալ ﬔտաղները:
Քլորը կիրառություն է գտել նաև ռազմական գործում՝ որպես քի-
ﬕական զենք: Այժմ այն փոխարինվել է առավել արդյունավետ քլոր
պարունակող թունավոր նյութերով, օրինակ՝ ֆոսգենով՝ COCI2:
Յոդ
Մարդու օրգանիզմում յոդն անհրաժեշտ է հատկապես վահանաձև
գեղձի կողﬕց արտադրվող հորմոնի համար:
Վարակազերծող ընդունակություն ունի նաև յոդը, որը սովորա-
բար օգտագործում են սպիրտային թուրﬕ ձևով (յոդի 5 %-անոց
սպիրտային լուծույթ)՝ վերքերն ախտահանելու նպատակով:
Չի կարելի յոդի թուրմով մշակել բաց վերքերը, քանի
որ յոդն ընդունակ է քայքայելու օրգանիզﬕ հյուսվածք-
ները:
Յոդ պարզ նյութն օժտված է օսլայի հետ փոխազդելու բացառիկ
հատկությամբ, որի հետևանքով առաջանում է մուգ կապույտ գունա-
վորում: Այն յոդի հայտաբերման ռեակցիան է, և անվանում են յոդօս-
լայի ռեակցիա, որը համարվում է քիﬕայի առավել զգայուն ռեակ-
ցիաներից ﬔկը:
Յոդի գլխավոր սպառողներն են դեղագործությունը և քիﬕական
արդյունաբերությունը:
Բրոմ
Բրոմը կարևոր նշանակություն ունի լուսանկարչական ժապավեն-
ների արտադրության ﬔջ: Լուսանկարչությունը հիﬓված է լույսի
ազդեցությամբ արծաթի բրոﬕդի քայքայման վրա: Լուսաժապավենի
վրա սև պատկերն առաջանում է անջատված ﬔտաղական արծաթի
մանրագույն մասնիկներից.
62
hv
2AgBr
2Ag + Br2
Նատրիուﬕ բրոﬕդը, որը սովորաբար «բրոմ» են անվանում,
բժշկության ﬔջ օգտագործում են որպես նյարդային համակարգը
հանգստացնող ﬕջոց:
Ֆտոր
Ֆտոր տարրը մտնում է ոսկրային հյուսվածքների և հատկապես
ատաﬕ արծնի (էմալ) բաղադրության ﬔջ, որի ամրությունը և փայլը
պայմանավորված են հենց այդ տարրով: Ֆտորի բացակայությունը
ատաﬕ կարիես հիվանդության առաջացման պատճառ է դառնում:
Դուք երևի նկատել եք ատաﬕ մածուկի տուփերի վրա «ֆտորաց-
ված» բառը: Ֆտորն անհրաժեշտ տարր է գեղձերում, մաններում և
նյարդային բջիջներում ընթացող նյութափոխանակության գործըն-
թացներում: Կարևոր նշանակություն ունեն նաև ֆտորի ﬕացություն-
ները ﬕջուկային արդյունաբերության և էլեկտրատեխնիկայի համար:
Մեծ կիրառություն ունի տեֆլոնը, որը քառաֆտորէթիլենի պոլի-
ﬔրն է: Այս պլաստիկը քիﬕապես շատ իներտ է և բացառիկ կայուն
օրգանական ﬕացություն, որը չի քայքայվում նույնիսկ 400-450oC
ջերմաստիճանում: Ձեզ բոլորիդ ծանոթ է խոհանոցային ամանեղենը,
որոնց վրա գրված է «տեֆլոն»: Տեֆլոնը ﬔծ չափերով օգտագործ-
վում է նաև ﬔքենաշինության ﬔջ:
Ֆտորաջրածինն օգտագործում են չթափանցող, նախշավոր և գե-
ղարվեստական ապակիներ ստանալու համար: Ֆտորաջրածինը փո-
խազդում է ապակու բաղադրության ﬔջ մտնող սիլիցիուﬕ (IV) օքսի-
դի հետ՝ ըստ հետևյալ հավասարման.
SiO2 + 4HF = SiF4 + 2H2O
Ապակու և ֆտորաջրածնի փոխազդեցության ռեակ-
ցիայից օգտվելով՝ լիտվացի գեղանկարիչ Մ.Կ.Չյուրլ ո-
նիսը ստեղծել է գեղարվեստի մոտ 30 գործ.
Մ.Կ.Չյուրլոնիսի նկարներից՝ «Ձﬔռ»
63
Քլոր, քլորիդ իոն, օքսիդացում, ստամոքսահյութ, կա-
րիես, նատրիուﬕ բրոﬕդ, տեֆլոն, արծն, յոդի թուրմ:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Քիﬕական տարրերի ﬔջ աﬔնաուժեղ օքսիդիչը
ֆտորն է: Ինչպե՞ս են օքսիդացնում ֆտորիդ իոնը (F¯) և
ստանում ազատ ֆտոր (F2):
2. Ի՞նչ նյութեր են ստացվում կերակրի աղի խիտ լուծույ-
թի էլեկտրոլիզից:
3. Ո՞ր տարրը չի մտնում ատաﬕ էմալի բաղադրության
ﬔջ.
ա) ֆտոր
բ) կալցիում
գ) ֆոսֆոր դ) քլոր
4. Բժշկության ﬔջ որպես նյարդային համակարգը հանգստացնող ﬕ-
ջոց օգտագործվում է բրոմ: Քիﬕական տեսակետից ի՞նչ սխալ է պա-
րունակում այդ արտահայտությունը:
5. Լաբորատորիայում քլոր ստանալու համար երբեﬓ քլորաջրածինն
օքսիդացնում են կալիուﬕ քլորատով՝ KCIO3 (Բերթոլեի աղ): Գրե՛ք
այդ ռեակցիայի հավասարումը, որոշե՛ք օքսիդացնողն ու վերականգ-
նողը:
6. Որոշե՛ք քլոր տարրի օքսիդացման աստիճանները հետևյալ ﬕացու-
թյուններում.
HCIO, KCIO4, HCIO3, CI2O7, HCIO2
7. Տեֆլոն կայուն պոլիﬔրը քառաֆտորէթենի (C2F4) պոլիﬔրն է: Որքա՞ն
է ֆտոր տարրի զանգվածային բաժինն (%) այդ նյութում:
8. Որքա՞ն կլինի քլորի այն ծավալը (լ, ն.պ.), որն անհրաժեշտ է 300 գ
կալիուﬕ յոդիդի 15 % զանգվածային բաժնով լուծույթից ամբողջ յոդը
դուրս մղելու համար: Ի՞նչ զանգվածով (գ) նոր աղ կստացվի:
9. Ի՞նչ ծավալով (լ) քլորաջրածին կստացվի 150 լ քլորի և 200 լ ջրածնի
փոխազդեցությունից: Ո՞ր գազն է վերցրած ավելցուկով և ի՞նչ ծավա-
լով (լ):
10. Ի՞նչ զանգվածով (գ) յոդ է անհրաժեշտ 1 կգ յոդի թուրմ (յոդի 5 %
զանգվածային բաժնով սպիրտային լուծույթ) պատրաստելու համար:
64
VIA ԽՄԲԻ ՈՉ ՄԵՏԱՂՆԵՐԻ՝ ՔԱԼԿՈԳԵՆՆԵՐԻ
3.4
ԸՆԴՀԱՆՈՒՐ ԲՆՈՒԹԱԳԻՐԸ
Այս գլխում ﬔնք դիտարկում ենք Մենդելեևի պարբերական աղու-
սակի VIA խմբի տարրերը: Այդ խմբի ոչ ﬔտաղների ենթախմբում են
դասվում թթվածինը՝ Օ, ծծումբը՝ S, սելենը՝ Se, տելուրը՝ Te:
VIA խմբի առաջին տարրի՝ թթվածնի հատկություններին դուք ծա-
նոթ եք 8-րդ դասարանից: Այդ խմբի մյուս անդաﬓերը՝ ծծումբը, սե-
լենը և տելուրը, նման են իրենց կառուցվածքով և հատկություններով:
Ինչպես և թթվածինը, նրանք բնության ﬔջ հանդիպում են ﬔտաղնե-
րի հետ առաջացրած ﬕացությունների ձևով: Մի քանի սուլֆիդների
դուք արդեն ծանոթ եք, օրինակ՝ երկաթի (II) սուլֆիդ՝ FeS, կապա-
րի (II) սուլֆիդ՝ PbS: Սելենը և տելուրն առաջացնում են ﬔտաղների
սելենիդներ և տելուրիդներ: Երկրի կեղևում այդ տարրերը գտնվում
են հանքերի ձևով, այդ պատճառով նրանց տրվել է «քալկոգեններ»
անվանումը, որը հունարենից թարգմանաբար նշանակում է «պղինձ
ծնող»:
Չեզոք ատոﬓերի արտաքին էլեկտրոնային շերտում գտնվում
է 6 էլեկտրոն (նկ. 3.13).
Նկ. 3.13 VIA խմբի տարրերի ատոﬓերի կառուցվածքների ուրվագրերը
Քալկոգենների առավելագույն վալենտականությունը համընկնում
է խմբի համարին և հավասար է վեցի, բացառությամբ թթվածնի, որը,
որպես կանոն, երկվալենտ է:
Թթվածին տարրից բացի, VIA խմբի տարրերից մարդու համար ﬔծ
նշանակություն ունի ծծումբը, որի հատկություններն էլ ﬔնք պետք է
մանրամասն ուսուﬓասիրենք: Այդ խմբի երկու ոչ ﬔտաղներ՝ սելենը
և տելուրը, հազվագյուտ տարրեր են:
Պոլոնիումը ռադիոակտիվ է և բնության ﬔջ չի հանդիպում:
65
VIA խմբի տարրերի որոշ բնութագրիչներ ներկայացված են ստորև
(աղուսակ 3.4):
Աղուսակ 3.4 VIA խմբի տարրերի որոշ բնութագրիչներ
Քիﬕա-
Էլեկտրաբացա-
Ատոﬕ
Տարածվածու-
Կարևոր
կան
սականությունն
շառավիղ,
թյունը
օքսիդացման
տարր
ըստ Պոլինգի
նմ
Երկրի կեղևում,
աստիճանները
ցուցնակի
զանգված.
բաժին, %
O (Z = 8)
3,5
0,066
47
-2
S (Z = 16)
2,6
0,104
0,05
-2, +4, +6
Se (Z = 34)
2,5
0,160
5 . 10-6
-2, +4, +6
Te (Z = 52)
2,1
0,17
1 . 10-7
-2, +4, +6
Po (Z=84)
2,0
տվալներ
-
-2, +2, +4, +6
չկան
Պարբերության համարի ﬔծացման հետ ավելանում է VIA խմբի
տարրերի ատոﬓերի էլեկտրոնային շերտերի թիվը, և հետևաբար՝
ﬔծանում են այդ խմբի տարրերի ատոﬓերի շառավիղները, որի հե-
տևանքով ոչ ﬔտաղական հատկությունները թուլանում են, ﬔտա-
ղական հատկությունները՝ ուժեղանում:
Օրինաչափորեն փոխվում են նաև համապատասխան պարզ նյու-
թերի ֆիզիկական հատկությունները (աղուսակ 3.5): VIA խմբում
տարրերի կարգաթվի ﬔծացման հետ օրինաչափորեն ﬔծանում են
այդ տարրերի առաջացրած պարզ նյութերի հալման ու եռման ջեր-
մաստիճանները, փոխվում են ագրեգատային վիճակն ու գույնը:
Աղուսակ 3.5 Քալկոգենների առաջացրած որոշ պարզ նյութերի ﬕ շարք
ֆիզիկական հատկություններ
Նյութի անվանումը
Ագրեգատային
Գույնը
վիճակը, 20oC
Թթվածին՝ Օ2
գազ
անգույն
Ծծումբ՝ S
պինդ
դեղին
Սելեն՝ Se
պինդ
մոխրագույն
Տելուր՝ Te
պինդ
արծաթամոխրագույն
Պոլոնիում՝ Po
պինդ
սպիտակարծաթավուն
VIA խմբի տարրերը ﬔտաղների և ջրածնի հետ առաջացրած ﬕա-
ցություններում ցուցաբերում են նվազագույն օքսիդացման աստի-
ճան՝ -2:
66
VIA խմբի բոլոր տարրերի համար բնութագրական է -2 օքսիդաց-
ման աստիճանը.
O
-2
S + 2e
S
Այդ տարրերն առաջացնում են ջրածնային ցնդող ﬕացություններ՝
H2R ընդհանուր բանաձևով: Դրանցից ﬔկը ձեզ լավ հայտնի ջուրն է,
որն օժտված է թթվահիﬓային երկակիությամբ: Մյուս քալկոգենների
ջրածնային ﬕացությունները ջրային լուծույթում թույլ թթուներ են,
որոնց դիսոցման ընդհանուր հավասարումը գրվում է հետևյալ ձևով.
H2R HR- + H+
H2S, H2Se, H2Te շարքում թթվի դիսոցման աստիճանն աճում է, իսկ
կայունությունը՝ նվազում:
Ոչ ﬔտաղների հետ փոխազդելիս քալկոգեններն առավել հաճախ
տրամադրում են 4 վալենտային էլեկտրոն:
Թթվածնի հետ քալկոգեններն առաջացնում են թթվային օքսիդ-
ների երկու շարք՝ RO2 և RO3, որոնց համապատասխանում են H2RO3 և
H2RO4 թթուները:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Հաﬔմատե՛ք թթվածնի և ծծմբի ատոﬓերի էլեկտրո-
նային կառուցվածքները: Ի՞նչն է նրանց համար ընդ-
հանուր, և ինչո՞վ են նրանք տարբերվում:
2. VIA խմբի տարրերից ո՞րն է աﬔնատարածվածը Երկրի
կեղևում:
3. Որոշե՛ք VIA խմբի տարրերի օքսիդացման աստիճաննե-
րը հետևյալ ﬕացություններում.
ա) AI2S3
բ) Na2SO3
գ) Li2Te
դ) Na2SeO4
ե) SO3
4. Ի՞նչ զանգվածով (գ) SeO3 պետք է լուծել ջրում՝ սելենական թթվի 80 %
զանգվածային բաժնով 725 գ լուծույթ ստանալու համար:
5. Մարդու օրգանիզմում ծծումբը մտնում է ծծումբ պարունակող աﬕ-
նաթթուների բաղադրության ﬔջ: Ծծմբի պարունակությունը մար-
դու օրգանիզմում կազմում է 0,15 % ՝ ըստ զանգվածի: Որքա՞ն է ծծմբի
զանգվածը (գ) 70 կգ զանգվածով մարդու օրգանիզմում:
6. Որքա՞ն է տելուր տարրի զանգվածային բաժինը (%) հանքում, որի ﬔկ
տոննան պարունակում է 17,85 գ նատրիուﬕ տելուրատ՝ Na2TeO4:
Սելենը ﬔծացնում է աչքի ցանցաթաղանթի լուսա-
զգայունությունը:
Տաք սելենական թթվում՝ H2SeO4, լուծվում է նաև ոսկին:
67
ԾԾՈՒՄԲ: ԾԾՄԲԻ ԲՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԸ
3.5
ԵՎ ԱԼՈՏՐՈՊ ՁԵՎԱՓՈԽՈՒԹՅՈՒՆՆԵՐԸ:
ՔԻՄԻԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
ԾԾՈՒՄԲ
Z = 16
S
3s23p6
Ar = 32
Ծծմբի ատոﬓերը, ինչպես և պարբերական համակարգի VIA խմբի
բոլոր տարրերը, արտաքին էներգիական մակարդակում պարու-
նակում են 6 էլեկտրոն, որոնցից երկուսը չզույգված են (կենտ են):
Թթվածնի ատոﬓերի հաﬔմատությամբ ծծմբի ատոﬓերն ունեն ﬔծ
շառավիղ, էլեկտրաբացասականության փոքր արժեք, որի պատճա-
ռով էլ ցուցաբերում են արտահայտված վերականգնիչ հատկություն՝
առաջացնելով ﬕացություններ, որոնցում ծծմբի ատոﬓերը ցուցա-
բերում են +2, +4, +6 օքսիդացման աստիճան: Ավելի փոքր էլեկտրա-
բացասականությամբ օժտված տարրերի հետ (ջրածին, ﬔտաղներ)
փոխազդելիս ծծումբը ցուցաբերում է օքսիդիչ հատկություն՝ ձեռք
բերելով -2-ի հավասար օքսիդացման աստիճան:
Բնական ﬕացությունները
Բնության ﬔջ ծծումբը հանդիպում է երեք ձևով.
1. բնածին կամ ինքնածին ծծումբ, որը ծծմբի շեղանկ ուն տարա-
ձևությունն է (S8),
2. սուլֆիդային ծծումբ՝ ծծմբաջրածինը և նրա աղերը. ցինկի խա-
բուսակ՝ ZnS, կինովար՝ HgS, կապարափայլ՝ PbS, պիրիտ (ծծմբահրա-
քար)՝ FeS2 , երկաթի (II) սուլֆիդ՝ FeS և այլն,
3. սուլֆատային ծծումբ՝ գլաուբերյան աղ՝ Na2SO4 . 10H2O, գիպս՝
CaSO4 . 2H2O, պղնձարջասպ՝ CuSO4 . 5H2O, երկաթարջասպ՝ FeSO4 .
7H2O և այլն:
Ծծումբ պարզ նյութ
Ծծմբին բնորոշ է ալոտրոպիան:
68
1) Շեղանկուն ծծումբ` S8(1): Առավել կայուն ձևափոխությունն է.
2) Ասեղնաձև (մոնոկլին) ծծումբ(2)՝ մուգ դեղին ասեղներ: Կայուն
է 96oC-ից բարձր ջերմաստիճանում, սովորական ջերմաստիճանում
փոխարկվում է շեղանկուն ծծմբի (նկ. 3.14).
Նկ. 3.14 Ծծմբի ալոտրոպ ձևափոխությունների փոխադարձ փոխարկումը
3) Պլաստիկ ծծումբ՝ շագանակագույն ռետինանման ամորֆ զանգ-
ված է, անկայուն է, արագ փոխարկվում է շեղանկ ուն ծծմբի.
Ծծումբ ստանում են.
1. Արդյունաբերության ﬔջ բնածին ծծումբը հալելով ջրային գո-
լորշիներով:
2. Ծծմբաջրածնի ոչ լրիվ օքսիդացուﬕց (թթվածնի անբավարա-
րության պայմաններում).
2H2S + O2 2S + 2H2O
Քիﬕական հատկությունները
Ծծմբի օքսիդացնող հատկությունը
( S0 + 2e
S-2)
1) Ծծմբի և ալկալիական ﬔտաղների փոխազդեցությունն ընթա-
նում է առանց տաքացման. 2Na + S Na2S
Ծծմբի և մյուս ﬔտաղների փոխազդեցությունն ընթանում է տա-
քացման պայմաններում.
2) Որոշ ոչ ﬔտաղների և ծծմբի փոխազդեցությունից տաքացման
69
պայմաններում առաջանում են երկտարր ﬕացություններ: Օրինակ՝
t
2P + 3S
P2S3
Ծծմբի վերականգնող հատկությունը.
(S - 2e
S+2, S - 4e
S+4,
S - 6e
S+6)
1) Թթվածնի հետ.
t
S + O2
SO2
2SO2 + O2 V2O5, t
2SO3
2) Հալոգենների հետ (բացի յոդից).
t
S + Cl2
SCl2
3) Օքսիդիչ թթուների հետ, oրինակ՝
S + 2H2SO4(խիտ)
3SO2 + 2H2O
Լաբորատոր փորձ
Ծծմբի այրուﬓ օդում և թթվածնում
Նյութերի այրման գդալիկի ﬔջ քիչ քանակությամբ
ծծո՛ւմբ վերցրեք և այրե՛ք: Ինչպիսի՞ն է այրվող ծծմբի
բոցի բնույթը: Ինչպե՞ս կփոխվի բոցը, եթե այրվող
ծծմբով գդալիկը մտցնենք թթվածնով փորձանոթի
ﬔջ. այս նպատակի համար անհրաժեշտ է ստանալ թթվածին, օրի-
նակ՝ ջրածնի պերօքսիդի քայքայուﬕց՝ MnO2-ի ներկայությամբ.
2H2O2 MnO2
2H2O +O2
Ի՞նչ հոտ ունի ծծմբի այրման արգասիքը: Ի՞նչ տարբերություն եք
տեսնում օդում և մաքուր թթվածնում ծծմբի այրման ռեակցիաների
ﬕջև: Գրե՛ք ընթացող ռեակցիաների հավասարուﬓերը:
Ծծմբի կիրառությունը
Արդյունահանվող ծծմբի կեսից ավելին ծախսվում է ծծմբական
թթու ստանալու համար: Ծծմբի կիրառման բնագավառներն են՝ կաու-
չուկի վուլկանացում՝ ռետինի ստացում, էբոնիտի ստացում, լուցկու
արտադրություն, սև վառոդի ստացում, գյուղատնտեսության ﬔջ՝
ﬖասատուների դեմ պայքար, բժշկության ﬔջ՝ մաշկային հիվանդու-
թյունների բուժում:
70
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Գրե՛ք ծծմբի առավել տարածված ﬕացությունների
բանաձևերը և անվանե՛ք:
2. Ծծմբի հալման ջերմաստիճանը 113oC է: Առաջարկե՛ք
ծծմբի և ավազի խառնուրդից ծծմբի բաժանման եղա-
նակ:
3. Որոշե՛ք քիﬕական կապի տեսակը ծծմբի առաջացրած հետևյալ ﬕա-
ցություններում՝ ծծմբաջրածին, ծծմբի (IV) օքսիդ, նատրիուﬕ սուլֆիդ:
4. Ելնելով պարբերական համակարգում ունեցած դիրքից և ատոﬕ կա-
ռուցվածքից՝ հաﬔմատե՛ք.
ա) ծծումբը և թթվածինը,
բ) ծծումբը և քլորը:
5. Հաստատե՛ք կամ հերքե՛ք հետևյալ պնդուﬓերի ճշմարտացիությունը
ծծումբ տարրի վերաբերյալ, չգիտեմը նույնպես տարբերակ է.
1) ծծումբը գտնվում է III պարբերությունում, VIA խմբում,
2) ծծմբի ատոմը 32 էլեկտրոն է պարունակում,
3) արտաքին էլեկտրոնային շերտում առկա է 6 էլեկտրոն,
4) ծծմբի ատոﬕ էլեկտրոնային թաղանթը կազմված է երկու էլեկտրո-
նային շերտից,
5) ծծմբի բարձրագույն օքսիդացման աստիճանը +4 է,
6) ծծումբն առաջացնում է թթվային օքսիդներ և թթուներ:
5
1
2
3
4
5
6
Ճիշտ է
Սխալ է
Չգիտեմ
6. Ի՞նչ ծավալով (լ, ն.պ.) ծծմբի (IV) օքսիդ կստացվի 5 % խառնուկ պա-
րունակող 166,4 գ ծծմբի այրուﬕց:
7. Հաշվե՛ք ռեակցիայի արգասիքի զանգվածը (գ). ա) 2,5 մոլ ցինկի և 3
մոլ ծծմբի փոխազդեցությունից, բ) 13 գ ցինկի և 13 գ ծծմբի փոխազ-
դեցությունից:
Ծծումբ տարրը մտնում է բոլոր բույսերի և կենդանի-
ների հյուսվածքների, սպիտակուցների բաղադրության
ﬔջ: Սխտորի, մանանեխի, սոխի ու կաղամբի յուրահա-
տուկ հոտերը պայմանավորված են ծծումբ պարունակող
օրգանական ﬕացություններով:
71
3.6
ԾԾՄԲԱՋՐԱԾԻՆ ԵՎ ՍՈՒԼՖԻԴՆԵՐ
Ֆիզիկական հատկությունները
Սովորական պայմաններում տհաճ հոտով (նեխած ձվի հոտը պայ-
մանավորված է H2S-ով), թունավոր, անգույն գազ է, վատ է լուծվում
ջրում (նորմալ պայմաններում 1 ծավալ ջրում լուծվում է 3 լ H2S)։
Ծծմբաջրածինը խիստ թունավոր է, և նրա հետ կապ-
ված բոլոր փորձերը պետք է կատարել քարշիչ պահա-
րանում:
Ստացումը
1) Ստացվում է հալված ծծմբի ﬕջով ջրածին բացթողնելիս.
t
H2 + S
H2S
2) Սուլֆիդների և ուժեղ թթուների փոխազդեցությունից.
FeS + 2HCl
FeCl2 + H2S
FeS + 2H+ = Fe2+ + H2S
Քիﬕական հատկությունները
1) H2S-ը ջրային լուծույթում թույլ երկհիﬓ թթու է.
H2S H+ + HS-
HS- H+ + S2-
Ծծմբաջրածնի ջրային լուծույթն անվանում են ծծմբաջրածնային
թթու, երբեﬓ՝ ծծմբաջրածնային ջուր: Ծծմբաջրածնային թթուն
փոխազդում է հիմքերի հետ՝ առաջացնելով երկու տեսակի աղ՝
չեզոք՝ սուլֆիդներ և թթու՝ հիդրոսուլֆիդներ.
H2S + 2NaOH
Na2S + 2H2O
Եթե ալկալու ջրային լուծույթի ﬕջով անցկացնենք ծծմբաջրածնի
ավելցուկ, ապա կստացվի թթու աղ՝ հիդրոսուլֆիդ.
H2S + NaOH
NaHS + H2O
2) H2S–ը ցուցաբերում է շատ ուժեղ վերականգնող հատկություն.
H2S + Br2
S + 2HBr
H2S + H2SO4(խիտ)
S + SO2 + 2H2O
3) Ծծմբաջրածնի և թթվածնի փոխազդեցությունը.
72
Թթվածնի պակասի դեպքում տեղի է ունենում ծծմբաջրածնի ոչ
լրիվ այրում, և առաջանում է ազատ ծծումբ (այդպես են արդյունաբե-
րության ﬔջ ﬔծ քանակներով ազատ ծծումբ ստանում).
2H2S + O2
2S + 2H2O
Թթվածնի ավելցուկում ծծմբաջրածինը լրիվ այրվում է, և առաջա-
նում է ծծմբի (IV) օքսիդ.
2H2S + 3O2
2SO2 + 2H2O
4) Լուծելի սուլֆիդների և ծծմբաջրածնի որակական ռեակցիան
ջրում և թթուներում չլուծվող PbS և CuS սև նստվածքի առաջացուﬓ է.
H2S + Pb(NO3)2
PbS + 2HNO3
Na2S + Pb(NO3)2
PbS + 2NaNO3
Pb2+ + S2-
PbS
ՍՈՒԼՖԻԴՆԵՐ
Ստացումը
1) Բազմաթիվ սուլֆիդներ ստացվում են ﬔտաղները ծծմբի հետ
տաքացնելիս: Ծծումբը սնդիկի հետ ﬕանում է սովորական ջերմաս-
տիճանում.
Hg + S
HgS
2) Լուծելի սուլֆիդները ստացվում են ալկալիների և ծծմբաջրած-
նի փոխազդեցությունից (սուլֆիդներից լուծելի են ﬕայն ամոնիուﬕ
սուլֆիդը, ալկալիական և որոշ հողալկալիական ﬔտաղների սուլ-
ֆիդներ).
H2S + 2KOH
K2S + 2H2O
Քիﬕական հատկությունները
Ջրում լուծելի սուլֆիդները ջրային լուծույթներում խիստ հիդրո-
լիզված են, որի հետևանքով նրանց ջրային լուծույթներն ունեն հիմ-
նային ռեակցիա: Առաջին փուլի հիդրոլիզին համապատասխանում է
հետևյալ հավասարումը.
K2S + H2O KHS + KOH
S2- + H2O HS- + OH-
Անցած դարերի գեղանկարիչների կտաﬖերի սևանա-
լու պատճառը PbSO4 սպիտակ ներկի փոխազդեցությունն
է սպիտակուցների փտուﬕց առաջացած ծծմբաջրածնի
հետ, որի հետևանքով առաջանում է սև PbS: Նկարները
վերականգնում են հետևյալ ռեակցիայով.
PbS(սև) + 4H2O2
PbSO4(սպիտակ) + 4H2O
73
Մետաղների ակտիվության շարքում երկաթից ձախ գտնվող ﬔ-
տաղների սուլֆիդները, ներառյալ երկաթի սուլֆիդը, լուծելի են ու-
ժեղ թթուներում.
ZnS + H2SO4
ZnSO4 + H2S
Ջրում չլուծվող սուլֆիդներից շատերն ունեն բնորոշ գույն: Այս-
պես, ցինկի սուլֆիդը (ZnS)՝ սպիտակ, պղնձի սուլֆիդը (CuS)՝ սև,
կադﬕուﬕ սուլֆիդը (CdS)՝ դեղին, սնդիկի սուլֆիդը (կինովար, HgS)՝
կարﬕր, մանգանի սուլֆիդը (MnS)՝ վարդագույն: Դեռ հնուց այդ սուլ-
ֆիդներն օգտագործել են ներկեր ստանալու համար:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Գրե՛ք ծծմբաջրածնի էլեկտրոնային բանաձևը: Նշե՛ք
կովալենտային կապին չմասնակցած վալենտային
էլեկտրոնների թիվը:
2. Որքա՞ն է ծծմբաջրածնի խտությունն ըստ օդի:
3. Հաստատե՛ք կամ հերքե՛ք պնդուﬓերի ճշմարտացիությունը ծծմբա-
ջրածնի վերաբերյալ, չգիտեմը նույնպես տարբերակ է.
1) թունավոր գազ է,
2) շատ լավ է լուծվում ջրում,
3) ջրային լուծույթում ուժեղ թթու է,
4) առաջացնում է երկու տեսակի աղեր՝ հիդրոսուլֆիդներ և սուլֆիդներ,
5) քիﬕական կապը ծծմբաջրածնի մոլեկուլում կովալենտային ոչ
բևեռային է,
6) հայտաբերման ազդանյութը Pb(NO3)2 է:
1
2
3
4
5
6
Ճիշտ է
Սխալ է
Չգիտեմ
4. H2S-ի
20oC հագեցած ջրային լուծույթում ծծմբաջրածնի զանգվա-
ծային բաժինը 0,425 % է: Ընդունելով, որ լուծույթի խտությունը 1 գ/
սմ3 է, հաշվե՛ք 1 լ լուծույթում լուծված H2S-ի ծավալը (ն.պ.):
5.
8,96 լ (ն.պ.) ջրածինը փոխազդել է 8 գ ծծմբի հետ: Ո՞ր նյութն է առա-
ջացել և ի՞նչ ծավալով:
6. Հաշվե՛ք ծծմբաջրածնի ծավալը (ն.պ.), որը կարելի է ստանալ.
ա) 8.8 գ երկաթի (II) սուլֆիդի և աղաթթվի փոխազդեցությունից,
բ) 20 % խառնուկներ պարունակող 22 գ երկաթի (II) սուլֆիդի և աղա-
թթվի փոխազդեցությունից:
74
3.7
ԾԾՄԲԻ
ՕՔՍԻԴՆԵՐ՝ SO2 ԵՎ SO3Ծծմբի (IV) օքսիդ՝ SO2 (ծծմբային անհիդրիդ կամ ծծմբային գազ)
SO2-ի մոլեկուլում քիﬕական կապը կովալենտային բևեռային է,
ծծմբի օքսիդացման աստիճանը՝ +4:
Ֆիզիկական հատկությունները
Սուր հոտով, օդից 2,2 անգամ ծանր անգույն գազ է, լավ լուծվում է
ջրում (1 ծավալ ջրում լուծվում է 40 ծավալ (ն.պ.) SO2)։ Գունազրկում է
ﬔծ թվով ներկեր, սպանում է ﬕկրոօրգանիզﬓերին:
Ստացումը
Արդյունաբերության ﬔջ SO2-ը ստացվում է.
1) Ծծումբը թթվածնում այրելիս.
S + O2
SO2
2) Սուլֆիդների օքսիդացուﬕց.
4FeS2 + 11O2
2Fe2O3 + 8SO2
2ZnS + 3O2
2ZnO + 2SO2
3) Ծծմբաջրածնի լրիվ այրուﬕց.
2H2S + 3O2 = 2SO2 + 2H2O
Լաբորատորիայում ծծմբային գազ ստացվում է.
1) ծծմբային թթվի աղերը հանքային թթուներով մշակելիս.
Na2SO3 + 2HCl
2NaCl + SO2 + H2O
2) ծծմբի և խիտ ծծմբական թթվի փոխազդեցությունից.
S + 2H2SO4(խիտ)
3SO2+ 2H2O
Քիﬕական հատկությունները
1)
SO2-ը թթվային օքսիդ է: Ջրում լուծելիս առաջացնում է ﬕջին
ուժի, երկհիﬓ, անկայուն թթու՝ H2SO3 (գոյություն ունի ﬕայն ջրային
լուծույթում).
SO2 + H2O H2SO3
H2SO3 H+ + HSO3
H+ + SO2-
3
75
Լաբորատոր փորձ
Գլանի ﬔջ ջո՛ւր լցրեք և ﬕ քանի կաթիլ մանու-
շակագույն լակմո՛ւս ավելացրեք: Այրման գդալիկի ﬔջ
ծծումբ այրե՛ք և գդալիկն իջեցրե՛ք ջրով լցված գլանի
ﬔջ՝ պահելով այն ջրի մակարդակից ﬕ փոքր բարձր
(նկ. 3.15): Պահե՛ք գդալիկը ﬕնչև ծծմբի լրիվ այրվելը:
Գլանում ստացված լուծույթը կարﬕր կներկվի:
Նկ. 3.15 Ծծմբային թթվի ստացումը
Գլանի լուծույթից ﬕ փոքր լցրե՛ք փորձանոթի ﬔջ ու թույլ տաքաց-
րե՛ք: Կանջատվեն գազի պղպջակներ, կզգացվի սուր հոտ, և լուծույ-
թի կարﬕր գույնը կփոխվի մանուշակագույնի: Նկատված երևույթնե-
րը բացատրե՛ք: Գրե՛ք ռեակցիաների հավասարուﬓերը:
Հիմքերի և ծծմբային թթվի փոխազդեցությունից առաջանում են
երկու տեսակի աղեր՝
թթու՝ հիդրոսուլֆիտներ և չեզոք՝ սուլֆիտներ.
Ba(OH)2 + SO2
BaSO3 (բարիուﬕ սուլֆիտ) + H2O
Ba(OH)2 + 2SO2
Ba(HSO3)2 (բարիուﬕ հիդրոսուլֆիտ)
Աղեր առաջանում են նաև SO2 թթվային օքսիդի և լուծելի հիﬓային
օքսիդների փոխազդեցությունից.
SO2 + CaO = CaSO3
Ծծմբի (IV) օքսիդում ծծումբ տարրի օքսիդացման աստիճանը +4
է և ռեակցիաներում կարող է ցուցաբերել և՛ օքսիդացնող, և՛ վերա-
կանգնող հատկություններ:
Օքսիդացման ռեակցիաներ
2SO3
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
76
Ալկալիական ﬔտաղների սուլֆիտները ջրային լուծույթում օքսի-
դանում են օդի թթվածնով.
2Na2SO3 + O2
2Na2SO4
Վերականգնման ռեակցիաներ.
SO2 + 2H2S
3S + 2H2O
Լաբորատոր փորձ
Վերցրե՛ք երեք բաժակ և լցրե՛ք ծծմբի (IV) օքսիդով.
Փորձ 1. Առաջին բաժակի ﬔջ իջեցրե՛ք կարﬕր
վարդ: Վարդը կսպիտակի:
Փորձ 2. Երկրորդ բաժակի ﬔջ կարﬕր ֆուքսինով
ներկված թուղթ կամ կտոր իջեցրե՛ք: Կարﬕր գույնը
կանհետանա:
Փորձ 3. Երրորդ բաժակի ﬔջ մանուշակագույն թանաքով թրջած
թուղթ կամ կտոր իջեցրե՛ք: Այս դեպքում էլ թուղթը կամ կտորը գու-
նազրկվում է:
Ծծմբի (VI ) օքսիդ՝ SO3 (ծծմբական անհիդրիդ)
Ֆիզիկական հատկությունները
Օդում «ծխում» է, ուժեղ կլանում է խոնավություն, պահում են զոդ-
ված անոթներում: 17օC-ից բարձր ջերմաստիճանում անգույն ցնդող
հեղուկ է: 17օC-ից ցածր ջերմաստիճանում փոխարկվում է սպիտակ
բյուրեղական նյութի:
Թթվային օքսիդ է, բուռն կլանում է ջուրը՝ անջատելով ﬔծ քանա-
կությամբ ջերմություն, և առաջացնում ծծմբական թթու.
SO3+ H2O = H2SO4 + Q
Ստացումը և հատկությունները.
0, p)
(V2O5, t
2SO2 + O2
2SO3
Ծծմբական անհիդրիդը թթվային օքսիդ է և փոխազդում է հիմքե-
րի, հիﬓային օքսիդների հետ.
2NaOH + SO3
Na2SO4 + H2O
NaOH + SO3
NaHSO4
BaO + SO3
BaSO4
SO3–ը լավ լուծվում է անջուր ծծմբական թթվում: Ստացված լուծույ-
թը կոչվում է օլեում:
SO3-ը ուժեղ օքսիդիչ է, հեշտությամբ քայքայվում է՝ անջատելով
թթվածին, ինչով էլ պայմանավորված է նրա օքսիդացնող հատկու-
թյունը:
77
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Գրե՛ք հետևյալ փոխարկուﬓերին համապատասխան
ռեակցիաների հավասարուﬓերը.
S
SO2
K2SO3
BaSO3
SO2
2. Գրե՛ք ծծմբային թթվի՝ H2SO3, դիսոցման հավասարումը
առաջին և երկրորդ փուլով:
3. Հետևյալ ռեակցիաների հավասարուﬓերի ուրվագրերում տեղադրե՛ք
գործակիցները: Ո՞ր դեպքում է ծծմբային գազն օքսիդիչ.
SO2 + CI2 + H2O = H2SO4 + HCI
SO2 + H2
S + H2O
4. Ընտրե՛ք այն պնդուﬓերը, որոնք վերաբերում են SO3-ին.
ա) անգույն, մածուցիկ հեղուկ է,
բ) թթվային օքսիդ է,
գ) օժտված է սպիտակեցնող և վարակազերծող հատկությամբ,
դ) չի կարելի անﬕջականորեն ստանալ ծծմբից,
ե) ջրում լուծելիս առաջանում է ﬕջին ուժի անկայուն թթու,
զ) ուժեղ օքսիդիչ է:
5. Ընտրե՛ք այն նյութերը, որոնց հետ կարող է փոխազդել SO2-ը, գրե՛ք
ռեակցիաների հավասարուﬓերը.
Ag, Zn, CO2, Li2O, KOH, H2O, Na2CO3
6. Ի՞նչ զանգվածով ծծմբի (VI) օքսիդ պետք է լուծել 1 կգ 95 %-անոց
ծծմբական թթվում, որպեսզի թթվի կոնցենտրացիան հավասարվի
98 %-ի:
7.
15,68 լ (ն.պ.) ծծմբի (IV) օքսիդի օքսիդացուﬕց ստացվել է 53,2 գ
ծծմբի (VI) օքսիդ: Հաշվել ռեակցիայի արգասիքի ելքը (%):
8. Բանջարեղենի պահեստից բորբոսասնկերը վերացնելու համար օգ-
տագործում են ծծմբի (IV) օքսիդ, որն ստացվում է ծծմբի այրուﬕց:
Ի՞նչ զանգվածով ծծումբ կպահանջվի 75 մ3 ծավալով տարածքը ախ-
տահանելու համար, եթե 1 մ3 տարածքի համար պահանջվում է 1,6 գ
ծծմբի (IV) օքսիդ:
78
3.8
ԾԾՄԲԱԿԱՆ ԹԹՎԻ ԱՂԵՐԸ
Քիﬕական բանաձևը՝ H2SO4
Կառուցվածքային բանաձևը.
Ֆիզիկական հատկությունները
Ծանր, չցնդող, յուղանման հեղուկ է (արջասպայուղ), =1,84 գ/սմ3,
լավ լուծվում է ջրում՝ անջատելով ﬔծ քանակությամբ ջերմություն:
tօհալմ. = 10,3օC , tօեռմ. = 296օC, օժտված է ջուր խլելու ընդունակու-
թյամբ (ածխացնում է թուղթը, փայտը, շաքարը):
Ծծմբական թթուն փոքր բաժիններով պետք է լցնել
ջրի ﬔջ և ոչ թե հակառակը (նկ. 3.16):
Նկ. 3.16 Ծծմբական թթվի նոսրացումը
Ծծմբական թթվի արտադրությունը
Առաջին փուլ. SO2-ի ստացումը.
S +O2 = SO2
4FeS2 + 11O2
2Fe2O3 + 8SO2 + Q
Երկրորդ փուլ. SO2-ի օքսիդացումը. մաքրելուց, չորացնելուց և
ջերմափոխանակիչի ﬕջով անցկացնելուց հետո մղում են կոնտակ-
տային ապարատ (450օC - 500օC, կատալիզատոր՝ V2O5), որտեղ
ծծմբային անհիդրիդը փոխարկվում է ծծմբական անհիդրիդի.
2SO2 + O2
2SO3
Երրորդ փուլ. կլանող աշտարակում SO3-ը կլանում են խիտ ծծմբա-
կան թթվով: Կլանման համար չի կարելի ջուր օգտագործել, որովհե-
տև գոյանում է ծծմբական թթվի մանր կաթիլներից կազմված մառա-
խուղ.
79
nSO3 + H2SO4(խիտ)
(H2SO4 • nSO3) (օլեում)
Քիﬕական հատկությունները
Ուժեղ երկհիﬓ թթու է.
H2SO4
H+ + HSO-4
HSO4 H+ + SO2-4
Առաջին փուլում ﬕջին կոնցենտրացիաների դեպքում դիսոցվում
է 100 %-ով, իսկ երկրորդ փուլում 70 %:
Փոխազդեցությունը ﬔտաղների հետ.
ա) նոսր ծծմբական թթուն փոխազդում է ﬕայն ջրածնից ձախ
գտնվող ﬔտաղների հետ.
Zn + H2SO4(նոսր)
ZnSO4 + H2
բ) խիտ H2SO4-ը ուժեղ օքսիդացնող է: Մետաղների հետ փոխազ-
դելիս (բացի Au, Pt-ից) կարող է վերականգնվել ﬕնչև SO2 կամ H2S
(առանց տաքացնելու խիտ ծծմբական թթուն չի փոխազդում Fe, Al,
Cr ﬔտաղների հետ, որոնք պասիվանում են՝ պատվելով օքսիդի շեր-
տով).
2Ag + 2H2SO4
Ag2SO4 + SO2 + 2H2O
8Na + 5H2SO4
4Na2SO4 + H2S + 4H2O
Խիտ H2SO4-ը որպես ուժեղ օքսիդիչ տաքացման պայմաններում
փոխազդում է որոշ ոչ ﬔտաղների հետ.
C + 2H2SO4(խիտ)
+ 2H2O
S + 2H2SO4(խիտ)
3SO2 + 2H2O
Որպես թթու փոխազդում է հիﬓային օքսիդների, հիմքերի, աղե-
րի հետ.
CuO + H2SO4
CuSO4 + H2O
H2SO4 + 2NaOH
Na2SO4 + 2H2O
H2SO4 + Cu(OH)2
CuSO4 + 2H2O
BaCl2 + H2SO4
BaSO4 + 2HCl
Ջրում և թթուներում չլուծվող BaSO4-ի առաջացումը համարվում է
ծծմբական թթվի և լուծելի սուլֆատների հայտաբերման որակական
ռեակցիան:
Ծծմբական թթվի աղերը կոչվում են սուլֆատներ: Սուլֆատներից
ﬔծ նշանակություն ունեն.
պղնձարջասպը՝ CuSO4 . 5H2O, օգտագործվում է գյուղատնտեսու-
թյան ﬔջ որպես բույսերի հիվանդությունների ու ﬖասատուների
դեմ պայքարելու ﬕջոց,
անգլիական կամ դառը աղը՝ MgSO4 . 7H2O, կիրառվում է բժշկու-
թյան ﬔջ որպես լուծողական,
80
գլաուբերյան աղը՝ Na2SO4 . 10H2O, օգտագործվում է բժշկության
ﬔջ,
երկաթարջասպը՝ FeSO4 . 7H2O, օգտագործվում է գյուղատնտեսու-
թյան ﬔջ որպես թունաքիﬕկատ, թանաքի պատրաստման, փայ-
տի մշակման համար,
գիպսը՝ CaSO4 . 2H2O, ﬕնչև 150օC տաքացնելիս փոխարկվում է
կեսջրյա գիպսի՝ CaSO4 . 0,5H2O, որն ալեբաստր անվամբ օգտա-
գործվում է շինարարության, ճարտարապետության, բժշկության,
քանդակագործության ﬔջ,
կալիուﬕ սուլֆատը՝ K2SO4, կալիումական պարարտանյութ,
շիբը՝ KAI(SO4)2 . 12H2O, օգտագործվում է բժշկության ﬔջ, կենցա-
ղում, կաշիների դաբաղման համար և այլն: Ծծմբական թթվի և
նրա աղերի կիրառությունը տրված է ստորև (նկ. 3.17).
Նավթի
Ներկերի
Հանքային
մաքրում
արտադրություն
պարարտանյութերի
արտադրություն
Լվացող
Դեղերի
նյութերի
արտադրություն
արտադրություն
Ծծմբական
Մետաղագոր-
Մանրաթելի
ծություն
արտադրություն
թթու H2SO4
Պլաստմասսանե-
Մարտկոցներ
րի արտադրություն
Նկ. 3.17 Ծծմբական թթվի և նրա աղերի կիրառությունը
Խմբային աշխատանք
Վերցրե՛ք 70 % զանգվածային բաժնով ծծմբական
թթվի լուծույթ, ֆիլտրի թղթի վրա այդ լուծույթով ապա-
կա ձողով գրե՛ք H2SO4 բանաձևը և թուղթը պահե՛ք տաք
էլեկտրական սալիկի վրա: Թղթի վրա երևում է H2SO4
բանաձևի սև հետքը: Այդ նույն գործողությունը կատարե՛ք 98 %-անոց
ծծմբական թթվով: Ի՞նչ է նկատվում: Ձեր դիտարկուﬓերը գրանցե՛ք
լաբորատոր տետրերում: Գրե՛ք ռեակցիաների հավասարուﬓերը և՛
առաջին, և՛ երկրորդ դեպքերում:
81
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Պատկերե՛ք ծծմբական թթվի էլեկտրոնային բանաձևը:
Որքա՞ն է պատկերված էլեկտրոնային զույգերի թիվը:
2. Գրե՛ք ջրային լուծույթում ծծմբական թթվի դիսոցման
հավասարուﬓերը:
3. Հաստատե՛ք կամ հերքե՛ք ճշմարտացիությունը ծծմբական թթվի վե-
րաբերյալ: Չգիտեմը նույնպես տարբերակ է.
1. առանց հոտի, անգույն, մածուցիկ հեղուկ է,
2. երկհիﬓ ուժեղ թթու է, լավ լուծվում է ջրում,
3. սուր հոտով անգույն հեղուկ է,
4. լավ լուծվում է ջրում, ﬕահիﬓ թթու է,
5. երկհիﬓ թթու է, ջրում համարյա չի լուծվում,
6. հայտաբերման ազդանյութը Ba2+ իոնն է:
4. Ծծմբական թթվի և կավճի փոխազդեցությունից առաջանում է չեզոք
աղ, և անջատվում է ածխածնի (IV) օքսիդ: Գրե՛ք նշված ռեակցիայի
լրիվ և կարճ իոնային հավասարուﬓերը:
5. Երեք չպիտակավորված փորձանոթներում գտնվում են նատրիուﬕ
սուլֆատի, նատրիուﬕ սուլֆիտի և նատրիուﬕ սուլֆիդի լուծույթներ:
Ինչպե՞ս կարելի է իմանալ, թե որ փորձանոթում որ նյութն է գտնվում՝
օգտվելով ﬕայն ﬔկ ազդանյութից:
6. Խառնել են 1 մոլ KOH և 1 մոլ H2SO4: Ո՞ր աղն է առաջացել և ի՞նչ քա-
նակով (մոլ):
7. Ի՞նչ նյութեր կառաջանան և ի՞նչ զանգվածներով (գ), եթե 49 գ ծծմբա-
կան թթու պարունակող լուծույթին ավելացնենք 30 գ նատրիուﬕ
հիդրօքսիդ:
8. 2 կգ 14,7 % զանգվածային բաժնով ծծմբական թթվի լուծույթ պատ-
րաստելու համար ի՞նչ զանգվածով (գ) այդ թթվի 98 %-անոց լուծույթ
կպահանջվի:
82
3.9
ՔԻՄԻԱԿԱՆ ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅՈՒՆԸ
Մեր շուրջը մշտապես հազարավոր քիﬕական ռեակցիաներ են
ընթանում: Այրվում են փայտը և բնական գազը, ժանգոտում է երկա-
թը, կաթը փոխարկվում է կաթնաշոռի, ֆոտոժապավենի վրա հայտ-
նվում են պատկերներ և այլն:
Հայտնի է, որ քիﬕական ռեակցիաների ﬕ մասն ընթանում է ակն-
թարթորեն: Այդպիսի արագ ընթացող ռեակցիաներ են պայթյունով
ուղեկցվող ռեակցիաները: Օրինակ՝ ջրածնի և թթվածնի խառնուր-
դում կայծ առաջացնելիս ռեակցիան ավարտվում է ﬔկ ակնթարթում.
2H2 + O2 = 2H2O + Q
Լուծույթներում իոնների ﬕջև ընթացող բազմաթիվ ռեակցիաներ
նույնպես ընթանում են ակնթարթորեն, օրինակ՝ ուժեղ թթվի և ուժեղ
հիմքի ﬕջև ընթացող չեզոքացման ռեակցիան.
HCI + NaOH = NaCI + H2O
Եվ կան բազմաթիվ ռեակցիաներ, որոնք ընթանում են դանդաղ:
Օրինակ՝ փայտի փոխարկումը քարածխի տևել է ﬕլիոնավոր տա-
րիներ, իսկ գլ ուկոզի սպիրտային խմորման գործընթացը տևում է
շաբաթներ և աﬕսներ.
C6H12O6 ֆերﬔնտ
2C2H5OH + 2CO2
Պայմաններից կախված՝ ﬕևնույն ռեակցիան կարող է ընթանալ
տարբեր արագությամբ: Օրինակ՝ նյութերն օդում այրվում են ավելի
դանդաղ, քան մաքուր թթվածնում:
Քիﬕական ռեակցիայի արագության մասին գիտելիքներն ունեն
կարևոր գործնական և գիտական նշանակություն:
Իսկ ի՞նչ է հասկացվում ռեակցիայի արագություն ասելով, և ի՞նչ
գործոններ են ազդում նրա վրա:
Ֆիզիկայում շարժվող մարﬓի արագությունը որոշում են՝ չափե-
լով այն հեռավորությունը, որն անցել է այդ մարﬕնը ﬕավոր ժամա-
նակահատվածում: Քիﬕական ռեակցիայի ընթացքում փոխվում են
փոխազդող նյութերի քանակները՝ որոշակի ժամանակում փոխարկ-
վելով վերջանյութերի:
Համասեռ քիﬕական ռեակցիայի արագությունը (V) ռեակցի-
ային մասնակցող նյութերից որևէ ﬔկի կոնցենտրացիայի փո-
փոխությունն է ﬕավոր ժամանակահատվածում:
Քանի որ ժամանակի ընթացքում կոնցենտրացիան անընդհատ
փոխվում է, անընդհատ փոխվում է նաև արագությունը, հետևաբար՝
ճիշտ է խոսել ռեակցիայի ﬕջին արագության մասին.
83
C
V= C2 - C1
=
,
t
t
որտեղ C1-ը և C2-ը ժամանակի t1 և t2 պահերի կոնցենտրացիաներն
են: Արագության չափման ﬕավորն է մոլ/լ.վրկ:
Եթե արագությունը որոշվում է ըստ ելանյութերի կոնցենտրացիայի
փոփոխության, ապա C2 - C1 տարբերության արժեքը կլինի բացասա-
կան, որի պատճառով արագության որոշման բանաձևի աջ մասում՝
կոտորակի առաջ, դրվում է ﬕնուս (-) նշանը, որպեսզի արագու-
թյունն ունենա դրական արժեք.
C
V= -C2 - C1
= -
t
t
Խնդիր
Ածխածնի (II) օքսիդն օքսիդացնելիս այդ նյութի սկզբնական կոն-
ցենտրացիան եղել է 0,8 մոլ/լ, իսկ 30 վայրկան անց դարձել է 0,2
մոլ/լ: Որքա՞ն է ռեակցիայի ﬕջին արագությունը:
Լուծում
Գրենք ﬕջին արագության որոշման բանաձևը և տեղադրենք ար-
ժեքները.
Հաշվարկի սկիզբը ընդունվում է զրո:
C2 - C1
Vﬕջ.= -
= -
= 0,02 մոլ/լ.վրկ
t2 - t1
Պատ.՝ Vﬕջ. = 0,02 մոլ/լ.վրկ
Ինչի՞ց է կախված ռեակցիայի արագությունը:
1. Փոխազդող նյութերի բնույթից: Ռեակցիայի արագությունն
առաջին հերթին կախված է նյութի բաղադրությունից և քիﬕական
կապի տեսակից:
2. Ազդանյութերի կոնցենտրացիայից: Որպեսզի նյութերը փո-
խազդեն, պետք է նրանց մոլեկուլները բախվեն: Որքան ﬔծ է մո-
լեկուլների թիվը, այնքան ﬔծ է մասնիկների բախման հավանա-
կանությունը և ռեակցիան այդքան արագ կընթանա: Փորձնական
ճանապարհով հաստատվել է կինետիկայի հիﬓական օրենքը հոմո-
գեն ռեակցիայի համար, որն անվանում են նաև զանգվածների ազդ-
ման օրենք:
Քիﬕական ռեակցիայի արագությունն ուղիղ հաﬔմատական
է փոխազդող նյութերի կոնցենտրացիաների արտադրյալին:
A + B = C + D ընդհանուր ռեակցիայի համար արագությունը որոշ-
վում է հետևյալ հավասարումով.
84
V = K . CA . CB,
որտեղ K հաﬔմատականության գործակիցն անվանում են ռեակ-
ցիայի արագության հաստատուն, որի մանրամասն քննարկմանը
կանդրադառնանք բարձր դասարաններում:
3. Ջերմաստիճանից: Ջերմաստիճանը բարձրացնելիս ռեակցիան
արագանում է: Որքան բարձր է ջերմաստիճանը, այնքան հեշտ են
մոլեկուլներն առաջացնում ակտիվ ﬕջանկ ալ մասնիկներ և հաղթա-
հարում էներգիական արգելակը:
Եթե պատրաստենք ջրածնի և թթվածնի խառնուրդ, ապա ռեակ-
ցիան նրանց ﬕջև սենյակային ջերմաստիճանում չի ընթանա: Աս-
տիճանաբար ջերմաստիճանը բարձրացնելիս 400oC-ում դանդաղ
կսկսվի ջրային գոլորշիների առաջացումը: Հետագա տաքացուﬕց
600oC-ում տեղի կունենա պայթյուն: Ռեակցիան կավարտվի ակնթար-
թորեն:
Փորձը ցույց է տվել, որ յուրաքանչյուր 10oC տաքացնելիս ռեակցի-
ան արագանում է 2-4 անգամ: Այս կանոնն (Վանթ Հոֆի կանոն) ունի
հետևյալ մաթեմատիկական արտահայտությունը.
V2
V1 = t210 t1
V2-ը ռեակցիայի արագությունն է t2 ջերմաստիճանում, V1-ը ռեակ-
ցիայի արագությունն է t1 ջերմաստիճանում, -ն կոչվում է ջերմաստի-
ճանային գործակից, որը ցույց է տալիս, թե քանի անգամ է ռեակցիան
արագանում ջերմաստիճանը յուրաքանչյուր 10oC-ով բարձրացնելիս:
Այդ գործակիցը կարող է ընդունել 2-4 արժեքներ՝ կախված ռեակցի-
այի բնույթից:
4.Կատալիզատորների առկայությունից: Ռեակ-
ցիան արագանում է կատալիզատոր կոչվող նյութերի
առկայությամբ:
Լաբորատոր փորձ
Քիﬕական ռեակցիայի արագության վրա ազդող
գործոնները
1. Համարակալե՛ք 4 ﬕանման փորձանոթ:
2.
1-ին փորձանոթում լցրե՛ք 1 մլ 5 %-անոց աղաթթու, իսկ 2-րդ
փորձանոթում՝ 15 %-անոց: Երկու փորձանոթներում էլ գցե՛ք ցինկի ﬔ-
կական հաբ: Ի՞նչ եք նկատում: Ո՞ր փորձանոթում է ռեակցիան ավելի
արագ ընթանում:
3. 3-րդ փորձանոթում լցրե՛ք 1 մլ 5 %-անոց աղաթթու, նրա ﬔջ
գցե՛ք ցինկի ﬔկ հաբ և փորձանոթն իջեցրե՛ք տաք ջրով լի բաժակի
85
ﬔջ: Հաﬔմատե՛ք ջրածնի անջատման ինտենսիվությունն առաջին և
երրորդ փորձանոթներում:
4. 4-րդ փորձանոթում վերցրե՛ք 1 մլ 5 %-անոց աղաթթու և նրա ﬔջ
ավելացրե՛ք ցինկի հաբի զանգվածին հավասար զանգվածով ցինկի
փոշի: Ի՞նչ է նկատվում: Հաﬔմատե՛ք ջրածնի անջատման ինտենսի-
վությունն առաջին և չորրորդ փորձանոթներում:
Ի՞նչ գործոններից է կախված ցինկի և աղաթթվի ﬕջև ընթացող
ռեակցիայի արագությունը: Եզրակացությունները գրե՛ք ձեր տետրե-
րում:
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ինչո՞ւ է ﬕսը սենյակային ջերմաստիճանում ավելի
արագ փչանում, քան սառնարանում:
2. Ինչո՞ւ խոնավ և տաք կլիմա ունեցող երկրներում ﬕրգն
ավելի շուտ է հասունանում, քան հյուսիսային երկրնե-
րում:
3. Ո՞ր նյութերն են անվանում կատալիզատորներ: Բերե՛ք կատալիտիկ
ռեակցիաների օրինակներ:
4. Ջրի մաքրման կայաններից ﬔկում 1 մ3 ջուրը պարունակում է 300 մգ
քլոր, և այն լրիվ անհետանում է 100 ժամում: Երկրորդ ջրամաքրման
կայանում 1 մ3 ջուրը պարունակում է 200 մգ քլոր, և այն լրիվ անհե-
տանում է 200 ժամում: Ո՞ր դեպքում է քլորի փոխազդեցության ռեակ-
ցիան ջրի հետ ավելի արագ ընթանում և քանի՞ անգամ:
5. Կատարվել է կալիուﬕ պերմանգանատի քայքայուﬕց թթվածնի
ստացման երկու փորձ: Առաջին փորձում 75 մլ թթվածին են ստացել
3 րոպեում, իսկ երկրորդ փորձում՝ 100 մլ 5 րոպեում: Ո՞ր դեպքում է
թթվածնի ստացման արագությունն ավելի ﬔծ:
6. Քանի՞ անգամ կﬔծանա ռեակցիայի արագությունը ջերմաստիճանը
40 աստիճանով բարձրացնելիս: Ռեակցիայի արագության ջերմաս-
տիճանային գործակիցը 3 է:
Եթե բույսերը վտիտ են, նվազ հյութեղ, իսկ ծառե-
րի ճյուղերն ու տերևները փայլուն կանաչի փոխարեն՝
աղոտ, պղտոր մուգ գույնի, ապա ենթահողն առատ
է այնպիսի հանքանյութերով, որոնցում գերիշխում է
ծծումբը:
86
ԾԾՄԲԱԿԱՆ ԹԹՎԻ ԵՎ ԴՐԱ ԱՂԵՐԻ ՀԱՅՏԱԲԵՐՈՒՄԸ
Սարքավորուﬓեր և ազդանյութեր
Լաբորատոր կալան, փորձանոթներ, նատրիուﬕ սուլֆատի, քլորի-
դի և նիտրատի 5 % զանգվածային բաժիններով լուծույթներ, ծծմբա-
կան թթվի, աղաթթվի և ազոտական թթվի 10 % զանգվածային բա-
ժիններով լուծույթներ, պղնձարջասպի փոշի:
Աշխատանքի ընթացքը
1. Երեք փորձանոթներում լցրե՛ք 1-ական մլ ազոտական և ծծմբա-
կան թթուների լուծույթներ և աղաթթու: Յուրաքանչյուրին 1-ական մլ
բարիուﬕ քլորիդի լուծո՛ւյթ ավելացրեք: Ի՞նչ եք նկատում: Ո՞ր փորձա-
նոթում է քիﬕական ռեակցիա ընթանում: Գրե՛ք ռեակցիայի մոլեկու-
լային, լրիվ ու կրճատ իոնային հավասարուﬓերը:
2. Ուսուցչից ստացե՛ք պղնձարջասպի երկնագույն փոշի, լուծե՛ք
ջրում և ապացուցե՛ք, որ այն սուլֆատ իոններ է պարունակում:
3. Երեք փորձանոթներում լցրե՛ք 1-ական մլ նատրիուﬕ նիտրա-
տի, քլորիդի և սուլֆատի լուծույթներ: Յուրաքանչյուրին 1-ական մլ
բարիուﬕ քլորիդի լուծույթ ավելացրե՛ք: Ի՞նչ եք նկատում: Ո՞ր փոր-
ձանոթում է քիﬕական ռեակցիա ընթանում: Գրե՛ք ռեակցիայի մոլե-
կուլային, լրիվ ու կրճատ իոնային հավասարուﬓերը:
4. Նախորդ փորձում ստացված նստվածքով փորձանոթի ﬔջ ﬕ
քանի կաթիլ ծծմբական թթվի լուծո՛ւյթ ավելացրեք: Ի՞նչ փոփոխու-
թյուն է նկատվում: Գրանցե՛ք ձեր կարծիքը լաբորատոր տետրում:
Հանգե՛ք ընդհանուր եզրակացության՝ որ ազդանյութի օգնությամբ
կարելի է հայտաբերել սուլֆատ՝ SO2-
4
իոնները:
Մաշկի վրա թափվելիս ծծմբական թթուն առաջաց-
նում է այրվածքներ: Նման դեպքում մարﬓի այդ մա-
սը պետք է լվանալ սոդայի՝ NaHCO3 լուծույթով, ապա՝
առատ ջրով:
87
3.10
ԲՆՈՒԹԱԳԻՐԸ
Մենդելեևի պարբերական համակարգի VA խումբը կոչվում է ազո-
տի ենթախումբ, որի ﬔջ մտնում են ազոտ՝ N, ֆոսֆոր՝ P, արսեն՝ As,
ծարիր՝ Sb, և բիսմութ՝ Bi տարրերը: Դրանք բոլորն էլ p-տարրեր են,
արտաքին էլեկտրոնային թաղանթում ունեն հինգական էլեկտրոն
(նկ. 3.18 և աղուսակ 3.6):
Նկ. 3. 18 VA խմբի տարրերի ատոﬓերի կառուցվածքների ուրվագրերը
VA խմբի տարրերից առավել ﬔծ նշանակություն ունեն ազոտը և
ֆոսֆորը: Քննարկվող ենթախմբի տարրերի ատոﬓերի արտաքին
էներգիական մակարդակներում առկա են հինգական էլեկտրոններ,
որոնցից երեքը զույգված չեն։ Դրանից բխում է, որ այս ենթախմբի
տարրերի ատոﬓերը կարող են այլ տարրերի ատոﬓերից երեք
էլեկտրոն ﬕացնել՝ համապատասխան ﬕացություններում -3 օքսի-
դացման աստիճան դրսևորելով։ Սակայն դա տեղի է ունենում ﬕայն
իրենցից ավելի փոքր էլեկտրաբացասականությամբ տարրերի, օրի-
նակ՝ ջրածնի ու ﬔտաղների ատոﬓերին ﬕանալիս, իսկ ավելի ﬔծ
էլեկտրաբացասականությամբ տարրերի ատոﬓերին ﬕանալիս VA
խմբի տարրերի ատոﬓերն էլեկտրոններ են տրամադրում ու լիցքա-
վորվում դրական (աղուսակ 3.6)։
Աղուսակ 3.6 VA խմբի տարրերի որոշ բնութագրիչներ
Քիﬕական
Ar
Էլեկտրաբացա-
Ատոﬕ
Կարևոր օքսիդաց-
տարր
սականությունն
շառա-
ման աստիճաններ
ըստ Պոլինգի
վիղը
Ազոտ
14
3,0
0,074
-3,-2,-1,
0,+1,+2,+3,+4,+5
Ֆոսֆոր
31
2,1
0,110
-3, 0, +1, +2, +3,
+4, +5
88
Ազոտի ատոﬕ արտաքին էներգիական մակարդակում թափուր
օրբիտալներ չկան, և այդ ատոմը չի կարող գրգռվել։ Ահա՛ թե ինչու
ազոտի բնութագրական վալենտականությունը 3 է։ Սակայն, ինչպես
գիտեք, դոնորակցեպտորային ﬔխանիզմով առաջանում է չորրորդ
կապը, և ազոտի ատոմը դառնում է քառավալենտ։
VA խմբի տարրերի ատոﬓերի շառավիղները կարգաթվի ﬔծաց-
ման հետ ﬔծանում են, էլեկտրաբացասականությունը՝ փոքրանում,
ուստի ﬔտաղական հատկություններն ուժեղանում են. ազոտն ու
ֆոսֆորը տիպական ոչ ﬔտաղներ են, արսենն ու ծարիրը երկդիﬕ
տարրեր են, իսկ բիսմութը ﬔտաղ է։
Ազոտի մոլեկուլը երկատոմ է՝ N2, իսկ ենթախմբի ﬓացած տար-
րերի առաջացրած պարզ նյութերի մոլեկուլները բարձր ջերմաստի-
ճաններում՝ գազային վիճակում, հիﬓականում 4-ական ատոﬓերից
են կազմված (P4, As4)։ Այդ տարրերի առաջացրած պարզ նյութերի ﬕ
շարք ֆիզիկական հատկություններ բերված են ստորև (աղուսակ 3.7):
Աղուսակ 3.7 VA խմբի տարրերի պարզ նյութերի որոշ
ֆիզիկական հատկություններ
Անվանուﬓ ու
Ագրեգատային
Գույնը
մոլեկուլային բանաձևը
վիճակը (20oC)
Ազոտ՝ N2
գազ
անգույն
Սպիտակ ֆոսֆոր՝ P4
մոմանման (պինդ)
դեղնասպիտակավուն
Կարﬕր ֆոսֆոր
պինդ
կարﬕր
Արսեն՝ As
պինդ
մոխրագույն
VA խմբի տարրերի կարևոր օքսիդներն են R2O3 և R2O5, որտեղ R-ն
ազոտի ենթախմբի ցանկացած տարր է։ Այդ օքսիդներին համապա-
տասխանում են HRO2 կամ H3RO3 և HRO3 կամ H3RO4 թթուները, օրինակ.
N2O3
HNO2
P2O3
H3PO3
N2O5
HNO3
P2O5
H3PO4 կամ HPO3
Ազոտի ենթախմբի տարրերն առաջացնում են RH3 բանաձևով
ներկայացվող գազային ջրածնային ﬕացություններ, որոնց կայու-
նությունը NH3 (ամոնիակ) -PH3 (ֆոսֆին) -AsH3 (արսին) - SbH3 (ստի-
բին) շարքում կտրուկ նվազում է, իսկ BiH3 (բիսﬕն) ընդհանրապես չի
առաջանում։ Այդ ﬕացությունները թույլ հիմքեր են, ընդ որում կար-
գաթվի ﬔծացման հետ հիﬓային հատկությունները թուլանում են։
VA խմբի տարրերը բնության ﬔջ
Դիտարկվող խմբի տարրերից բնության ﬔջ աﬔնատարածվածն
ազոտն է, որն ազատ վիճակում, ըստ ծավալային բաժնի, կազմում
89
է երկրագնդի մթնոլորտի մոտավորապես 78 %-ը, սակայն ﬕացու-
թյունների ձևով՝ երկրակեղևում, ըստ զանգվածային բաժնի՝ 0,0017 %։
Այդ ﬕացություններից կարևորագույններն են տարբեր բորակները
(սելիտրաները), որոնց դեռ հանգամանորեն կանդրադառնանք։
Ըստ տարածվածության՝ հաջորդ տարրը ֆոսֆորն է, որի զանգ-
վածային բաժինը երկրակեղևում 0,105 % է, այսինքն՝ ազոտից էապես
ավելի։ Այդ տարրի բնական ﬕացությունները՝ հանքատեսակները,
կդիտարկենք համապատասխան ենթագլխում։
Արսենը, ծարիրն ու բիսմութը դասվում են հազվագյուտ և ցրված
տարրերի շարքում ու առավել հաճախ հանդիպում են կապարի,
պղնձի և արծաթի հանքերում, հազվադեպ՝ նաև բնածին տեսքով։
VA խմբի տարրերի կենսաբանական դերն ու կիրառությունը
Այս խմբից ազոտն ու ֆոսֆորը կարևորագույն կենսածին տարրեր
են։ Ազոտն առկա է սպիտակուցների, նուկլեինաթթուների, հեմոգլո-
բինի և բազմաթիվ այլ կենսաբանորեն ակտիվ նյութերի մոլեկուլների
բաղադրության ﬔջ։ Չափահաս մարդու օրգանիզմը ﬕջին հաշվով
1,8 կգ ազոտ է պարունակում։
Ֆոսֆորը նույնպես առկա է կենդանի օրգանիզﬓերի համար
խիստ կարևոր նյութերի, օրինակ՝ նուկլեինաթթուների և լիպիդների
բաղադրության ﬔջ։
Ազոտի, ֆոսֆորի և այդ տարրերի ﬕ շարք ﬕացությունների կի-
րառություններին կանդրադառնանք համապատասխան ենթագլուխ-
ներում։
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ինչպե՞ս են փոխվում ազոտի ենթախմբի տարրերի
առաջացրած պարզ նյութերի հատկությունները կար-
գաթվի ﬔծացման հետ: Պատասխանը ﬔկնաբանե՛ք
օրինակներով:
2. Որոշե՛ք VA խմբի տարրերի օքսիդացման աստիճաննե-
րը հետևյալ ﬕացությունների բանաձևերում՝ PCI5, AsF5,
POCI3, HNO2:
3. Ի՞նչ զանգվածով (գ) արսեն կարելի է ստանալ 50 մոլ արսենի (III) օք-
սիդից, եթե վերականգնման ռեակցիայի ելքը 90 % է:
4. Չափահաս մարդու օրգանիզմը ﬕջին հաշվով 1,8 կգ ազոտ է
պարունակում: Ի՞նչ զանգվածով (կգ) կալիուﬕ նիտրատի է այն
համապատասխանում:
90
ԱԶՈՏ. ՍՏԱՑՈՒՄԸ, ՖԻԶԻԿԱԿԱՆ ԵՎ
3.11
ՔԻՄԻԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Ազոտը ﬕացություններում կարող է դրսևորել -3-ից ﬕնչև +5 օք-
սիդացման բոլոր աստիճանները.
-3
-2
-1
0
+1
+2
+3
+4
+5
NH3
NH2 - NH2
NH2OH
N2
N2O
NO
HNO2
NO2
N2O5
Բնական իզոտոպները՝ 14
7N և 17N։
Մոլեկուլային բանաձևը՝ N2։
Հարաբերական մոլեկուլային զանգվածը՝ Mr(N2) = 28։
Մոլային զանգվածը՝ M(N2) = 28 գ/մոլ։
Օդից թեթև է մոտավորապես 1,04 անգամ։
Ֆիզիկական հատկությունները
Անհոտ, անհամ, ջրում քիչ լուծվող գազ է. 100 լ ջրում (20°C) 1,54 լ
ազոտ է լուծվում (հիշեցնենք, որ այդ նույն պայմաններում ջրում 3,1 լ
թթվածին է լուծվում)։ Ահա թե ինչու ջրում լուծված օդն ավելի հա-
րուստ է թթվածնով՝ մթնոլորտայինի հաﬔմատ, ինչն էլ նպաստում
է ջրային բույսերի ու կենդանիների շնչառությանը։ -195,8°C անգույն
հեղուկ է, -209,86°C ազոտը պնդանում է ձյան տեսքով:
Ազոտի երկատոմ մոլեկուլը (N2) առաջանում է այդ տարրի երկու
ատոﬕ չզույգված (կենտ) էլեկտրոնների զույգվելու շնորհիվ։ Մոլե-
կուլում ատոﬓերը կապված են կովալենտային ոչ բևեռային եռակի
կապով։ Մեկ մոլ ազոտ առաջանալիս անջատվում է 941,6 կՋ էներ-
գիա:
Ազոտի ատոﬓերի ﬕջև առկա է եռակի կապ, որոնցից ﬔկը -կապ
է, իսկ երկուսը՝ :
կամ N N
Ստացումը
Արդյունաբերության ﬔջ ազոտ ստանում են հեղուկ օդի կոտորա-
կային թորումով (հեղուկ ազոտը եռում է ավելի ցածր ջերմաստիճա-
նում, քան հեղուկ թթվածինը)։
Լաբորատորիայում ազոտ ստանում են ամոնիումային աղերի ու
նիտրիտների խառնուրդի տաքացմամբ, օրինակ.
NH4CI + NaNO2 = N2 + 2H2O + NaCI
Ազոտ կարելի է ստանալ նաև շիկացած պղնձի վրայով օդի
հոսք անցկացնելով։ Պղնձի վրայով օդն անցկացնելիս թթվածինը
91
կապվում է պղնձի հետ, և մնում է ազոտը իներտ գազերի խառ-
նուրդի հետ:
Քիﬕական հատկությունները
Սովորական պայմաններում ազոտը քիﬕապես ակտիվ տարր չէ,
ինչը հիﬓականում պայմանավորված է մոլեկուլում առկա կովալեն-
տային ոչ բևեռային երեք կապով, որոնց ճեղքման համար ﬔծ քանա-
կությամբ էներգիա է պահանջվում.
N2(գ) 2N (գ) - 941,6 կՋ/մոլ
Ահա թե ինչու ազոտը քիﬕական նյութերի ճնշող ﬔծամասնու-
թյան հետ փոխազդում է ﬕայն տաքացման, ճառագայթման, էլեկ-
տրական պարպման պայմաններում կամ կատալիզատորի ներկայու-
թյամբ։
Ազոտի և ջրածնի փոխազդեցությունը
Ազոտը ﬕանում է ջրածնին ու առաջացնում ցնդող ջրածնային
ﬕացություն՝ ամոնիակ (NH3)։ Ազոտը ջրածնի հետ փոխազդում է
բարձր ճնշման տակ (200-1000 մթն), 450-500°C ջերմաստիճանում
երկաթ կատալիզատորի ներկայությամբ.
3H2 + N2
2NH3
Ազոտի և ﬔտաղների փոխազդեցությունը
Տաքացման պայմաններում ալկալիական ու հողալկալիական ﬔ-
տաղները և ազոտը փոխազդում են՝ առաջացնելով իոնային ﬕացու-
թյուններ՝ նիտրիդներ։ Միայն լիթիումը և ազոտն են փոխազդում հա-
ﬔմատաբար ցածր ջերմաստիճաններում (սենյակայինից փոքր-ինչ
բարձր).
6Li + N2 = 2Li3N
Նիտրիդներն աղանման նյութեր են։ Դրանք հեշտությամբ հիդրո-
լիզի են ենթարկվում, օրինակ.
Li3N + 3H2O = 3LiOH + NH3
Մագնեզիուﬕ նիտրիդը՝ Mg3N2, ստացվում է մագնեզիուﬕ ժապա-
վենն օդում այրելիս: Այս դեպքում երկու զուգահեռ ռեակցիա է ընթա-
նում.
2Mg + O2 = 2MgO
3Mg + N2 = Mg3N2
Նշենք, որ իոնային կապով նիտրիդներ են առաջացնում ﬕայն IA
և IIA խմբերի ﬔտաղները։
92
Ազոտի և թթվածնի փոխազդեցությունը
Ազոտն ու թթվածինն օդի բաղադրամասերն են ու շատ դժվար են
փոխազդում։ Նման փոխազդեցություն տեղի է ունենում ամպրոպնե-
րի ընթացքում (նկ. 3.19) կամ շատ բարձր ջերմաստիճաններում (վոլ-
տյան աղեղ): Միակ օքսիդը, որ առաջանում է այդ ժամանակ, NO-ն է.
N2 + O2 = 2NO
Նկ. 3.19 Ամպրոպ
Սովորական պայմաններում հալոգենները և ծծումբը ազոտի հետ
չեն փոխազդում։ Ազոտը չի փոխազդում նաև ալկալիների ու թթունե-
րի հետ։
Կիրառությունը
Ազոտը հիﬓականում կիրառվում է ամոնիակի ու ազոտական
թթվի արտադրության ﬔջ։ Քիﬕական արդյունաբերության ﬔջ ու
գիտական լաբորատորիաներում ազոտն օգտագործվում է որպես
Նկ. 3.20 Ազոտի շրջապտույտը բնության ﬔջ
93
իներտ ﬕջավայր՝ նյութերի օքսիդացումը կանխելու նպատակով։
Բժշկության ﬔջ մաքուր ազոտը կիրառվում է որպես իներտ ﬕջա-
վայր՝ թոքախտը, նաև ողնաշարի ու հոդերի հիվանդությունները բու-
ժելիս։ Ինչպես և մյուս կենսածին տարրերը, ազոտը նույնպես շրջա-
պտույտ է գործում բնության ﬔջ (նկ. 3.20):
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ի՞նչ քիﬕական կապեր են առկա ազոտի մոլեկուլում։
2. Ազոտ հունարենից վերծանվում է ոչ + կանք (a + zoes),
սակայն հայտնի է, որ առանց այդ տարրի ցանկացած
կենդանի օրգանիզﬕ գոյությունն անհնար է։ Փորձե՛ք
բացատրել այդ հակասությունը։
3. Արդյոք հնարավո՞ր է գրել հեղուկ օդից ազոտի ստացման ռեակցիայի
հավասարումը։
4. Հաﬔմատե՛ք ջրում ազոտի, թթվածնի ու ջրածնի լուծելիությունները։
5. Այրվող գազը, որպես խառնուրդ, մոլեկուլային ազոտ է պարունա-
կում։ Արդյոք հնարավո՞ր է ազոտի (II) օքսիդի առաջացումը նշված
գազը սովորական գազայրիչում այրելիս (պատասխանը հիﬓավո-
րե՛ք)։
6. Ի՞նչ ծավալով (լ, ն. պ.) ազոտ կարելի է ստանալ 3 կգ հեղուկ օդից,
որում ազոտի զանգվածային բաժինը 76 % է։
7.
4,2 գ լիթիուﬓ ամբողջությամբ փոխազդել է ազոտի հետ, և ստաց-
ված նյութը հիդրոլիզի է ենթարկվել։ Ո՞ր գազն է անջատվել, ի՞նչ ծա-
վալով (ն.պ.)։
8. Ազոտի և թթվածնի 200 մլ խառնուրդին 100 մլ ջրածին են ավելացրել
ու խառնուրդը պայթեցրել։ Առաջացած ջրի գոլորշիները հեղուկաց-
նելուց և սկզբնական պայմանների վերադարձնելուց հետո ստացված
գազային խառնուրդի ծավալը 174 մլ է կազﬔլ։ Հաշվե՛ք ազոտի ծա-
վալային բաժինը (%) սկզբնական խառնուրդում։
94
ԱՄՈՆԻԱԿ. ՍԻՆԹԵԶԸ, ՀԱՏԿՈՒԹՅՈՒՆՆԵՐՆ ՈՒ
3.12
ԿԻՐԱՌՈՒՄԸ: ԱՄՈՆԻՈՒՄԱՅԻՆ ԱՂԵՐ
Քիﬕական բանաձևը՝ NH3: Էլեկտրոնային բանաձևը՝
Ամոնիակի մոլեկուլում կովալենտային անկ ունը՝
107,5°, իսկ մոլեկուլը բուրգի տեսք ունի (նկ. 3.21).
Նկ. 3.21 Ամոնիակի մոլեկուլի կառուցվածքը
Ամոնիակի ստացումը
Լաբորատորիայում սովորաբար ամոնիակ ստանում են ամոնիու-
ﬕ քլորիդից՝ NH4Cl։
Նշված աղը կալցիուﬕ հիդրօքսիդին (հանգած կրին) խառնե-
լիս արդեն իսկ սովորական պայմաններում ամոնիակ է անջատվում
(տաքացնելիս գազի անջատուﬓ արագանում է).
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
Լաբորատորիայում ամոնիակ ստացվում է նաև ամոնիակաջուրը
(NH4OH) տաքացնելիս.
NH4OH = NH3 + H2O
Արտադրության ﬔջ ամոնիակ ստանում են ազոտից և ջրածնից՝
սինթեզով.
3H2 + N2
2NH3 + 92 կՋ/մոլ
Ամոնիակի առավելագույն ելքն ապահովվում է 450-500°C ջերմաս-
տիճանի ու 200-1000 մթն ճնշման պայմաններում և երկաթ կատա-
լիզատորի ներկայությամբ։ Նշված պայմաններում ամոնիակ ստաց-
վում է ընդաﬔնը 10 % ելքով, որը ﬔծացնելու ձգտմամբ օգտվում են
արտադրության շրջադարձային սկզբունքից. չփոխազդած գազերը
սինթեզի սարք են վերադարձվում:
ԱՄՈՆԻԱԿԻ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐՆ ՈՒ ԿԻՐԱՌՈՒՄԸ
Ֆիզիկական հատկությունները
Ամոնիակն անգույն, բնորոշ սուր հոտով թունավոր գազ է, մոտա-
վորապես 1,7 անգամ օդից թեթև, շատ լավ լուծվում է ջրում։ Սովորա-
95
կան պայմաններում ﬔկ լիտր ջրում մոտ 700 լ
ամոնիակ է լուծվում։ Դրանում կարող եք հա-
մոզվել փորձով:
Ամոնիակով լցված գլանը ֆենոլֆտալեին
պարունակող ջրով թասի ﬔջ շրջելիս ամոնի-
ակի լավ լուծելիության շնորհիվ գլանը կլցվի
գունավոր ջրով (նկ. 3.22)։
101 կՊա ճնշման պայմաններում -33°C ջեր-
մաստիճանում ամոնիակը հեղուկանում է։ Քա-
նի որ հեղուկ ամոնիակի գոլորշիացման ջերմու-
թյունը ﬔծ է, ուստի այդ հեղուկն օգտագործում
Նկ. 3.22
Ամոնիակի լուծումը
են սառնարաններում։ 25 % զանգվածային բաժ-
ջրում
նով ամոնիակի ջրային լուծույթն անվանում են
ջրային ամոնիակ կամ ամոնիակային ջուր, իսկ բժշկության ﬔջ օգ-
տագործվող 10 %-անոց լուծույթն անվանում են անուշադրի սպիրտ:
Քիﬕական հատկությունները
Որպես բարդ նյութ ամոնիակն օժտված է հիﬓային հատկու-
թյուններով՝ ամոնիակի մոլեկուլում ազոտ տարրի չընդհանրացված
էլեկտրոնային զույգի հաշվին։ Քանի որ ամոնիակի մոլեկուլում ազո-
տի ատոﬕ օքսիդացման աստիճանը նվազագույնն է (-3), ուստի այդ
ատոﬓ օժտված է վերականգնող հատկությամբ։
Քննարկենք ամոնիակի քիﬕական հատկությունները և՛ որպես
հիմք, և՛ որպես վերականգնող։
Ամոնիակի ու ջրի փոխազդեցությունը
Լուծվելիս ամոնիակը ﬕանում է ջրի հետ՝ ամոնիուﬕ հիդրօքսիդ
առաջացնելով՝ NH4OH (ամոնիակաջուր), որը թույլ հիմք է։ Այդ ռեակ-
ցիան դարձելի է.
NH3 + H2O NH3 . H2O NH+
4
+ OH-
Ամոնիակի լուծույթում ֆենոլֆտալեինը մորեգույն է ներկվում,
այսինքն՝ լուծույթը թույլ հիﬓային է։ Դա վկայում է, որ ամոնիուﬕ
հիդրօքսիդը դիսոցվում է՝ (ՕH)- իոններ առաջացնելով: Մեկ մոլ ամո-
նիակ պարունակող 1 լ լուծույթում ամոնիակի դիսոցման աստիճանը
0,4 % է։
Ամոնիակի ու թթուների փոխազդեցությունը
Ամոնիակը փոխազդում է թթուների հետ (և՛ անջուր, և՛ ջրային)՝
ամոնիումային աղեր առաջացնելով, օրինակ՝ քլորաջրածնի կամ
աղաթթվի հետ (նկ. 3.23).
96
NH3 + HCl = NH4Cl
Նկ. 3.23 Ամոնիակի ու աղաթթվի փոխազդեցությունը
(ծուխ առանց կրակի)
Նշենք, որ քլորաջրածինն ամոնիակի հայտաբերման ազդանյութն է։
NH+
4
իոնը՝ +1 օքսիդացման աստիճանով, ﬔտաղի կատիոնի դեր է
կատարում։
Այդ կատիոնն առաջանում է ամոնիակի մոլեկուլում ազոտի ատո-
ﬕ ազատ էլեկտրոնային զույգի հաշվին՝ դոնորակցեպտորային ﬔ-
խանիզմով չորրորդ կովալենտային կապի առաջացման հետևանքով.
Ամոնիակում՝ NH3, և ամոնիում իոնում՝ (NH4)+, ազոտի օքսիդաց-
ման աստիճանը -3 է, սակայն ազոտի վալենտականությունն ամոնի-
ակի մոլեկուլում 3 է, իսկ ամոնիում իոնում՝ 4։
Բազմահիﬓ թթուների ու ամոնիակի փոխազդեցությունն ընթա-
նում է փուլերով, օրինակ.
H2SO4 + NH3 = NH4HSO4
NH4HSO4 + NH3 = (NH4)2SO4
Ամոնիակի ու թթվածնի փոխազդեցությունը
Ամոնիակն օդում չի այրվում, բայց կարող է այրվել մաքուր թթված-
նում։ Այրումը դիտելու նպատակով կատարենք հետևյալ փորձը:
Ամոնիակատար նեղ խողովակը տեղադրենք ավելի լայն խողովա-
կի ﬔջ, վերջինիս ﬕջով թթվածին անցկացնենք և ամոնիակը վա-
ռենք։ Այդ գազը կայրվի բաց կանաչավուն բոցով, ընդ որում ազոտ և
ջուր կառաջանան.
4NH3 + 3O2 = 2N2 + 6H2O + Q
97
Ռեակցիան ջերմանջատիչ է ու ոչ դարձելի։
Բարձր ջերմաստիճանում ամոնիակի ու թթվածնի
կամ օդի խառնուրդը պայթյունավտանգ է։
Թթվածնի ու ամոնիակի խառնուրդի ﬔջ պլատինե տաք
պարույր տեղադրելիս վերջինիս մակերեսին ամոնիակը փոխազդում
է թթվածնի հետ՝ ազոտի (II) օքսիդ և ջուր առաջացնելով.
4NH3 + 5O2 = 4NO + 6H2O + Q
Ռեակցիայի հետևանքով անջատված ջերմության հաշվին պա-
րույրը շիկանում է ու պայծառ լույս արձակում։
Ամոնիակի օքսիդացման օրինակով առաջին անգամ հան-
դիպում ենք այնպիսի փաստի, որ կարելի է ռեակցիայի ուղ-
ղությունը փոխել, այդ ռեակցիայի պայմանները փոփոխելով՝
նույն ելանյութերից տարբեր արգասիքներ ստանալ։
Ամոնիակը որոշ ﬔտաղների օքսիդների հետ տաքացնելիս վերա-
կանգնում է ﬔտաղները, օրինակ.
tօ
3FeO + 2NH3
3Fe + N2 + 3H2O
tօ
3CuO + 2NH3
3Cu + N2 + 3H2O
Կիրառությունը
Ամոնիակը կիրառվում է ազոտական թթվի ու ազոտային պարար-
տանյութերի արտադրության ﬔջ։
ԱՄՈՆԻՈՒՄԻ ԱՂԵՐԸ
Ամոնիուﬕ աղեր ստացվում են ամոնիակի և թթուների փոխազդե-
ցությունից, օրինակ.
NH3 + HNO3 = NH4NO3
Ամոնիուﬕ աղերը բյուրեղային ﬕացություններ են՝ իոնային բյու-
րեղավանդակով, որի հանգույցներում են (NH4)+ կատիոնն ու թթվային
ﬓացորդ անիոնը։
Ամոնիուﬕ աղերը ջրում լուծելի են, ուժեղ էլեկտրոլիտներ են ու
լրիվ դիսոցվում են, օրինակ.
NH4NO3 (NH4)+ + (NO3)-
Ամոնիուﬕ աղերն օժտված են աղերի ընդհանուր հատկություննե-
րով և մասնավորապես փոխանակման ռեակցիաների են մասնակցում.
98
1. աղերի հետ.
NH4Cl + AgNO3 = AgCl + NH4NO3
Cl- + Ag+ = AgCl
2. թթուների հետ.
(NH4)2CO3 + 2HCI = 2NH4CI + CO2 + H2O
3. ալկալիների հետ.
NH4Cl + NaOH = NH4OH = NaCl
Ամոնիուﬕ հիդրօքսիդն անկայուն նյութ է, ուստի քայքայվում է.
NH4OH = NH3 + H2O
Հետևաբար՝ ալկալիների ու ամոնիուﬕ աղերի փոխազդեցությու-
նից ամոնիակ է անջատվում.
NH4Cl + NaOH = NH3 + NaCl + H2O
(NH4)+ + (OH)- = NH3 + H2O
Այս ռեակցիան ընդհանուր է ամոնիուﬕ բոլոր աղերի համար:
Ամոնիուﬕ աղերի հայտաբերման ռեակցիան նրանց փոխազ-
դեցությունն է ալկալիների հետ, որի հետևանքով ամոնիակ է
անջատվում:
Ամոնիուﬕ աղերը ենթարկվում են ջերմային քայքայման։ Օրինակ՝
ամոնիուﬕ քլորիդը տաքացնելիս քայքայվում է՝ առաջացնելով ամո-
նիակ ու քլորաջրածին.
tօ
NH4Cl
= NH3 + HCl
Ռեակցիայի արգասիքները փորձանոթի սառը պատերին նորից
ﬕանում են՝ կրկին ամոնիուﬕ քլորիդ առաջացնելով։ Նույն կերպ են
քայքայվում ամոնիուﬕ կարբոնատը՝ (NH4)2CO3, և ամոնիուﬕ հիդրո-
կարբոնատը՝ NH4HCO3.
tօ
(NH4)2CO3
2NH3+ CO2+H2O
օ
t
NH4HCO3
= H2O + NH3 + CO2
Սակայն ամոնիուﬕ նիտրատի քայքայուﬕց ազոտի (I) օքսիդ է
առաջանում, իսկ ամոնիուﬕ նիտրիտի քայքայուﬕց՝ ազոտ.
օ
t
NH4NO3
=
2H2O + N2O
օ
t
NH4NO2
=
2H2O + N2
99
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Հաﬔմատե՛ք ամոնիակի և ազոտի ֆիզիկական հատ-
կությունները:
2. Որքա՞ն են ազոտի օքսիդացման աստիճանն ու վալեն-
տականությունն ամոնիուﬕ իոնում:
3. Կարելի՞ է չորացնել գազային ամոնիակը՝ այն բաց թողնելով խիտ
ծծմբական թթվի լուծույթի ﬔջ: Ի՞նչ ռեակցիաներ կարող են ընթա-
նալ:
4. Ավարտե՛ք հետևյալ ուրվագրերին համապատասխան ռեակցիաների
հավասարուﬓերը.
ա) 2NH3 + H3PO4
բ) NH3 + Br2 NH4Br + N2
5. Ի՞նչ ծավալով (լ) ազոտի (II) օքսիդ կարելի է ստանալ 100 լ ամոնիակի
կատալիտիկ օքսիդացուﬕց:
6. Ամոնիակի 25 % զանգվածային բաժնով 50 գ լուծույթ պատրաստելու
համար ի՞նչ ծավալով (լ, ն.պ.) ամոնիակ է անհրաժեշտ:
7. Ամոնիակի 10 % զանգվածային բաժնով լուծույթն անուշադրի սպիրտ
անվամբ օգտագործվում է բժշկության ﬔջ: Ի՞նչ ծավալով (լ, ն.պ.)
ամոնիակ պետք է լուծել ﬔկ լիտր ջրում՝ անուշադրի սպիրտ ստա-
նալու համար:
100
3.13
ՔԻՄԻԱԿԱՆ ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅՈՒՆ
Ամոնիակի սինթեզի ռեակցիան դարձելի է։ Դա նշանակում է, որ
ջրածինն ու ազոտը լրիվ չեն փոխարկվում ամոնիակի։ Պատճառն
այն է, որ ամոնիակի որոշակի քանակություն առաջանալուց հետո
ռեակցիայի պայմաններում այդ նյութն սկսում է քայքայվել։
Դարձելի են այն ռեակցիաները, որոնք ﬕևնույն պայմաննե-
րում ընթանում են երկու փոխհակադարձ ուղղություններով։
Հիշե՛ք, որ ձախից աջ ընթացողն ուղիղ ռեակցիան է, օրինակ.
N2 + 3H2 = 2NH3
իսկ աջից ձախ ընթացողը՝ հակադարձ ռեակցիան.
2NH3 = N2 + 3H2
Դարձելի ռեակցիաների հավասարուﬓերը գրելիս հավասարման
նշանի (=) փոխարեն դարձելիության նշան ( ) է դրվում, օրինակ.
3H2 + N2
2NH3 + 92 կՋ/մոլ
Դարձելի ռեակցիաներում ուղիղ ռեակցիայի արագության ար-
ժեքն սկզբում առավելագույնն է, ապա նվազում է ելանյութերի քա-
նակների փոքրացման հետ։ Ընդհակառակը, ռեակցիայի արգասիք-
ների կոնցենտրացիաների ﬔծացման հետ հակադարձ ռեակցիայի
արագությունն աճում է։ Քանի որ ուղիղ ռեակցիայի արագությունն
անընդհատ նվազում է, իսկ հակադարձ ռեակցիայինը՝ աճում, նշա-
նակում է, ի վերջո, ինչ-որ պահից սկսած՝ ուղիղ և հակադարձ ռե-
ակցիաների արագությունները հավասարվում են, և հաստատվում է
շարժուն հավասարակշռային վիճակ։
Քիﬕական հավասարակշռությունը փոխազդող համակարգի
այն վիճակն է, երբ հակադարձ ռեակցիայի արագությունը հա-
վասարվում է ուղիղ ռեակցիայի արագությանը։
Ռեակցիային մասնակցող նյութերի կոնցենտրացիաները քիﬕա-
կան հավասարակշռություն հաստատվելու պահին անվանում են հա-
վասարակշռային կոնցենտրացիաներ։
Արտաքին անփոփոխ պայմաններում քիﬕական հավասարա-
կշռության վիճակը կարող է պահպանվել երկար ժամանակ։
Արտաքին գործոնների (ջերմաստիճանի, ճնշման, կոնցենտրա-
ցիայի փոփոխության) ազդեցությամբ այդ համակարգերը հավասա-
րակշիռ վիճակից հանվում են։ Խախտվում է հավասարակշռությունը.
ուղիղ և հակադարձ ռեակցիաների արագություններն սկսում են ﬕ-
101
մյանցից տարբերվել, համակարգում առավելապես ընթանում է գե-
րակշռող արագությամբ ռեակցիան ﬕնչև նոր հավասարակշռության
հաստատումը՝ արդեն նոր հավասարակշռային կոնցենտրացիայով։
Արտաքին գործոնների ազդեցությամբ ընթացող փոփոխություն-
ները որոշվում են շարժուն հավասարակշռության տեղաշարժի
սկզբունքով, որն անվանում են նաև Լը Շատելիեի սկզբունք (այդ
սկզբունքը հայտնաբերել է XIX-XX դարերի ֆրանսիացի նշանավոր
ֆիզիկոս և քիﬕկոս Հանրի լը Շատելիեն):
Եթե հավասարակշիռ վիճակում գտնվող համակարգն արտա-
քին գործոնների ազդեցությանն է ենթարկվում, ապա հավա-
սարակշռությունը տեղաշարժվում է այն ուղղությամբ, որը թու-
լացնում է այդ ազդեցությունը։
Այս սկզբունքի համաձայն՝ ջերմաստիճանը բարձրացնելիս քիﬕ-
ական հավասարակշռությունը տեղաշարժվում է ջերմակլանիչ ռեակ-
ցիայի կողմը։ Քանի որ ամոնիակի սինթեզի ռեակցիան ջերմանջա-
տիչ է, նշանակում է՝ ջերմաստիճանը բարձրացնելիս այդ ռեակցիայի
հավասարակշռությունը տեղաշարժվում է դեպի ձախ՝ դեպի ամոնի-
ակի քայքայում։ 500°C-ից բարձր ջերմաստիճաններում ամոնիակը
համարյա լրիվ քայքայվում է (400°C-ից ցածր ջերմաստիճաններում
ջրածինն ու ազոտը չեն փոխազդում, քանի որ ամոնիակի ռեակցիայի
առաջացման համար անհրաժեշտ էներգիան շատ ﬔծ է), իսկ օպտի-
մալը 450°C է։
Օպտիմալ է կոչվում այն ջերմաստիճանը, որն ապահովում է
ռեակցիայի առավելագույն ելք:
Ճնշման բարձրացումը տեղաշարժում է քիﬕական հավասա-
րակշռությունը դեպի ծավալի փոքրացում։ Վերը նշված ամոնիակի
սինթեզի ռեակցիայում չորս ծավալից երկու ծավալ է ստացվում,
հետևաբար՝ ճնշումը բարձրացնելիս հավասարակշռությունն ամո-
նիակի առաջացման կողﬓ է տեղաշարժվում։ Հիշե՛ք, որ ամոնիակի
սինթեզն իրականացվում է 200-1000 մթն ճնշման տակ։
Կատալիզատորը հավասարակշռության տեղաշարժ
չի առաջացնում, քանի որ նույն չափով արագացնում է և՛
ուղիղ, և՛ հակադարձ ռեակցիաները։
102
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ո՞ր ռեակցիաներն են կոչվում դարձելի: Բերե՛ք օրինակ-
ներ:
2. Ածուխն ածխածնի (IV) օքսիդի հետ փոխազդելիս ըն-
թանում է դարձելի ռեակցիա՝ ըստ հետևյալ հավասար-
ման. C(պ) + CO2(գ)
2CO(գ) - Q:
Ի՞նչ պայմաններում CO գազի առաջացումը կլինի նվա-
զագույնը:
3. Արդյունաբերության ﬔջ ամոնիակ ստանում են դարձելի ռեակցի-
այով, որի հավասարուﬓ է.
3H2 + N2
2NH3 + 92 կՋ/մոլ
Ի՞նչ պայմաններում ամոնիակի առաջացումը կլինի առավելագույնը:
4. Ո՞ր կողմը կտեղաշարժվի հավասարակշռությունը.
C2H6(գ)
C2H4(գ) + H2(գ) -Q
ա) ճնշումը փոքրացնելիս, բ) ջերմաստիճանը բարձրացնելիս,
գ) ջերմաստիճանն իջեցնելիս: Պատասխանը հիﬓավորե՛ք:
5. Ինչպե՞ս կտեղաշարժվի հետևյալ ռեակցիայի հավասարակշռությունը.
3Fe(պ) + 4H2O(գ)
Fe3O4(պ) + 4H2(գ)
ա) ջրածին ավելացնելիս, բ) ճնշումը բարձրացնելիս: Պատասխանը
հիﬓավորե՛ք:
6. Փակ համակարգում ստեղծվել է A2(գազ) + 2B(գազ)
2AB(գազ) հավասա-
րակշռությունը:
Որքա՞ն է եղել A2 նյութի կոնցենտրացիան սկզբնական խառնուրդում,
եթե նյութերի հավասարակշռային կոնցենտրացիաներն են [AB] = 1
մոլ/լ, [B] = 1 մոլ/լ, [A2] = 0,5 մոլ/լ:
7-8. Երկու համարակալված (1 և 2) փակ անոթներում տեղավորել են 1-ա-
կան մոլ I2-ի գոլորշի և տաքացրել տարբեր ջերմաստիճաններում:
Երկու անոթներում էլ ստեղծվել է I2(գազ)
2I(գազ) հավասարակշռու-
թյուն: Առաջին անոթում խառնուրդի ﬕջին մոլային զանգվածը եղել
է 203,2 գ/մոլ, իսկ երկրորդում՝ 158,75 գ/մոլ:
7. Որքա՞ն է չտրոհված յոդի մոլեկուլների նյութաքանակը (մոլ) առաջին
անոթում:
8. Որքա՞ն է գոյացած յոդի ատոﬓերի նյութաքանակը (մոլ) երկրորդ
անոթում:
103
3.14
ԱԶՈՏԱԿԱՆ ԹԹՈՒՆ ԵՎ ՆՐԱ ԱՂԵՐԸ
Ազոտն առաջացնում է օքսիդներ, որոնցում դրսևորում է +1-ից
ﬕնչև +5 օքսիդացման աստիճաններ (աղուսակ 3.8)։
Աղուսակ 3.8 Ազոտի օքսիդների և դրանց համապատասխան թթուների
բանաձևերը
Օքսիդացման
+1
+2
+3
+4
+5
աստիճանները
Oքսիդները
N2O
NO
N2O3
NO2(N2O4)
N2O5
Թթուները
-
-
HNO2
HNO2 և
HNO3
HNO3
Ազոտի (I) օքսիդ՝ N2O
Ազոտի (I) օքսիդը՝ N2O (այլ կերպ անվանում են ծիծաղաբեր գազ),
հաճելի հոտով, անզգայացնող հատկությամբ անգույն գազ է, ջրում
չի լուծվում ու անտարբեր օքսիդների շարքում է դասվում։ Լաբորա-
տորիայում ազոտի (I) օքսիդ են ստանում ամոնիուﬕ նիտրատի ջեր-
մային քայքայուﬕց.
NH4NO3 N2O + 2H2O
Ազոտի (II) օքսիդ՝ NO
Անգույն, անհոտ, ջրում չլուծվող գազ է: NO-ն անտարբեր օքսիդ
է և օդում արագ օքսիդանում է՝ առաջացնելով ազոտի (IV) օքսիդ։
Առաջանում է օդում ամպրոպի ընթացքում.
tօ
N2 + O2
2NO
Արդյունաբերության ﬔջ ստացվում է ամոնիակի կատալիտիկ օք-
սիդացուﬕց.
4NH3 + 5O2 Kt
4NO + 6H2O
Լաբորատորիայում ստանում են պղնձի ու նոսր ազոտական թթվի
փոխազդեցությունից.
3Cu + 8HNO3 = 3Cu(NO3)2 + 4H2O + 2NO
Ազոտի (III) օքսիդ՝ N2O3
Անկայուն ﬕացություն է։ Գոյություն ունի -5°C-ից ցածր ջերմաս-
տիճանում, կապույտ հեղուկ է: Այս օքսիդն ազոտային թթվի (HNO2)
անհիդրիդն է:
Ազոտի (IV) օքսիդ՝ NO2
Հեղձուցիչ հոտով, գորշ-դարչնագույն գազ է (ահա թե ինչու այդ
գազը հաճախ անվանում են «աղվեսի պոչ»)։ Սառեցնելիս վերածվում
104
է գրեթե անգույն (բաց դեղին) հեղուկի, որի մոլեկուլի բաղադրությու-
նը N2O4 է (NO2-ի դիﬔրն է):
Պարզ նյութերի՝ ազոտի ու թթվածնի անﬕջական
փոխազդեցությունից ﬕայն ազոտի (II) օքսիդ է ստաց-
վում, իսկ ազոտի մյուս օքսիդներն ստացվում են անուղ-
ղակի ճանապարհով։
Օրինակ՝ սովորական պայմաններում ազոտի (IV) օքսիդն առաջա-
նում է հետևյալ փոխազդեցությունից.
2NO + O2 = 2NO2
Ազոտի (IV) օքսիդն ազոտային թթվի և ազոտական թթվի խառն
անհիդրիդն է։ Սառը ջրում այդ նյութը լուծելիս նշված երկու թթվի
խառնուրդն է ստացվում.
2NO2 + H2O = HNO2 + NHO3
Ալկալու լուծույթում ազոտի (IV) օքսիդը լուծելիս երկու աղի խառ-
նուրդ է ստացվում, իսկ թթվածնի ներկայությամբ ﬕայն նիտրատ է
առաջանում.
2NO2 + 2NaOH = NaNO3 + NaNO2+H2O
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Ազոտի(IV) օքսիդը տաքացնելիս քայքայվում է: Դա է պատճառը,
որ այրվող մագնեզիումը շարունակում է այրվել ազոտի (IV) օքսի-
դում.
tօ
2NO2
=
2NO + O2
Ազոտի (V) օքսիդ՝ N2O5
Ազոտական թթվի անհիդրիդն է, պինդ, անգույն նյութ է։ Այս օքսի-
դը կարելի է ստանալ հետևյալ կերպ.
P2O5 + 2HNO3 = N2O5 + 2HPO3
ԱԶՈՏԱԿԱՆ ԹԹՈՒ
Քիﬕական բանաձևը՝ HNO3։
Ստացումը
Բնության ﬔջ քիչ քանակությամբ ազոտական թթու առաջանում
է ամպրոպների ընթացքում։ Էլեկտրական պարպուﬓերի ազդեցու-
թյամբ օդի հիﬓական բաղադրամասերը՝ ազոտը և թթվածինը, փո-
խազդում են՝ առաջացնելով ազոտի (II) օքսիդ.
N2 + O2 = 2NO
Ստացված ազոտի (II) օքսիդը սովորական պայմաններում օքսի-
դանում է օդի թթվածնով՝ ﬕնչև ազոտի (IV) օքսիդ, որը թթվածնի
105
մասնակցությամբ լուծվում է անձրևաջրում՝ ազոտական թթու առա-
ջացնելով.
2NO + O2 = 2NO2
4NO2 + O2 + 2H2O = 4HNO3
Արդյունաբերական եղանակով ազոտական թթու ստացվում է ﬕ-
մյանց հաջորդող չորս փուլերով:
Առաջին փուլ՝ ամոնիակի սինթեզ.
N2 +3H2 2NH3 (450-500°C, 200-1000 մթն, երկաթ կատալիզատոր)
Երկրորդ փուլ՝ ամոնիակի կատալիտիկ օքսիդացում.
4NH3 + 5O2 = 4NO + 6H2O
Օքսիդացուﬓ ընթանում է հպումային սյունակաթսայում՝ 550-
600°C ջերմաստիճանում, պլատին-ռոդիում համաձուլվածք (Pt-Rh)
կատալիզատորի ներկայությամբ։
Երրորդ փուլ՝ ազոտի (II) օքսիդի օքսիդացումը հաﬔմատաբար
ցածր ջերմաստիճանում.
2NO + O2 = 2NO2
Չորրորդ փուլ՝ ջրում ազոտի (IV) օքսիդի լուծում թթվածնի մաս-
նակցությամբ.
4NO2 + O2 + 2H2O = 4HNO3
Ստացված լուծույթում ազոտական թթվի զանգվածային բաժինը
60 %-ից բարձր է։
Օգտագործվող «խիտ ազոտական թթուն» 68 % զանգվածային
բաժնով HNO3–ի լուծույթն է։ Անջուր ազոտական թթու կարելի է ստա-
նալ՝ ֆոսֆորի (V) օքսիդի վրայից խիտ ազոտական թթուն թորելով։
Ֆիզիկական հատկությունները
Մաքուր ազոտական թթուն սուր, հեղձուցիչ հոտով, անգույն հե-
ղուկ է, խտությունը՝ 1,52 գ/սմ3, հալման ջերմաստիճանը՝ -41°C, քայ-
քայվելով եռում է 86°C ջերմաստիճանում, ցանկացած հարաբերու-
թյամբ խառնվում է ջրին։
Ազոտական թթուն օդում ուժեղ «ծխում» է, քանի որ խոնավ օդում
ջրային գոլորշիների հետ մասամբ հեղուկ թթվի մանր կաթիլներից
բաղկացած քուլաներ են առաջանում։
Քիﬕական հատկությունները
Ազոտական թթուն շատ ուժեղ ﬕահիﬓ թթու է և ջրում գրեթե լրիվ
դիսոցվում է.
HNO3 H+ + NO3
Ազոտական թթուն, ինչպես և մյուս թթուները, փոխազդում է.
106
հիմքերի հետ.
KOH + HNO3 = KNO3 + H2O
Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
հիﬓային օքսիդների հետ.
CuO + 2HNO3 = Cu(NO3)2 + H2O
աղերի (կարբոնատների, սուլֆիտների ու սիլիկատների) հետ,
օրինակ.
MgCO3 + 2HNO3 = Mg(NO3)2 + H2O + CO2
Ազոտական թթվի մոլեկուլի անկայունությունը կարևոր առանձնա-
հատկություն է։ Ջրային լուծույթում այդ թթուն հաﬔմատաբար ավելի
կայուն է։ Մինչդեռ 98 % զանգվածային բաժնով ազոտական թթուն
անկայուն ﬕացություն է, լույսի ազդեցությամբ քայքայվում է.
4HNO3 = 2H2O + 4NO2 + O2
Ազոտական թթուն ﬔտաղների հետ յուրահատուկ է փոխազդում,
մյուս թթուների նման ջրածին չի անջատում, այլ անջատում է ազո-
տի օքսիդներ, ամոնիակ (ամոնիուﬕ նիտրատ) կամ ազատ ազոտ։
Նշանակում է՝ այս դեպքում վերականգնվում է ոչ թե ջրածինը, այլ
ազոտը, որի օքսիդացման աստիճանը +5-ից կարող է նվազել ﬕնչև
-3։ Ակնհայտ է, որ այս դեպքում նիտրատ (NO3)- իոնը, որում ազոտի
օքսիդացման աստիճանը +5 է, ուժեղ օքսիդացնող հատկությամբ է
օժտված։
Մետաղների հետ ազոտական թթվի փոխազդեցության այս կամ
այն ձևը կախված է թթվի կոնցենտրացիայից ու փոխազդող ﬔտաղի
ակտիվությունից։ Որպես օրինակ դիտարկենք պղնձի և ազոտական
թթվի խիտ ու նոսր լուծույթների փոխազդեցությունը։
Լաբորատոր փորձեր
Փորձ 1. Փորձանոթի ﬔջ գտնվող պղնձալարի մանր
կտորների վրա խիտ ազոտական թթու ավելացրե՛ք։
Առաջանում է յուրահատուկ հոտով, կարմրագորշ
գազ՝ ազոտի (IV) օքսիդ, որի քուլաները դուրս են
ժայթքում փորձանոթից։ Փոխազդեցությունն ավարտ-
վելուց հետո փորձանոթում ﬓում է երկնագույն լուծույթ՝ պղնձի (II)
նիտրատ։
Ռեակցիայի գումարային հավասարուﬓ է.
Cu + 4HNO3(խիտ) = Cu(NO3)2 + 2NO2 + 2H2O
Փորձ 2. Փորձանոթի ﬔջ գտնվող պղնձալարի մանր կտորների
վրա նոսր ազոտական թթու լցրե՛ք։ Առաջանում է անգույն գազ, որը
107
փորձանոթից դուրս գալու պահին դեղնում է ու ապա անհետանում։
Հավանաբար կռահեցիք, որ այդ գազը ազոտի (II) օքսիդն է։
Այս դեպքում ևս փորձանոթում առաջանում է պղնձի (II) նիտրատի
երկնագույն լուծույթ։ Ռեակցիան ընթանում է ըստ հետևյալ հավա-
սարման.
3Cu + 8HNO3(նոսր) = 3Cu(NO3)2 + 2NO + 4H2O
Ակտիվ ﬔտաղների հետ փոխազդելիս խիտ ազոտական թթուն
հիﬓականում վերականգնվում է ﬕնչև ազոտի (IV) օքսիդ, իսկ նոսր
ազոտական թթուն՝ ﬕնչև ազոտի (I) օքսիդ, ազատ ազոտ կամ ամո-
նիակ, որն ազոտական թթվի ավելցուկի հետ փոխազդելիս ամոնիու-
ﬕ նիտրատ է առաջացնում, օրինակ.
4Mg + 10HNO3(նոսր) = 4Mg(NO3)2 + N2O + 5H2O
4Mg + 10HNՕ3(շատ նոսր) = 4Mg(NO3)2 + NH4NO3 + 3H2O
Որքան նոսր է ազոտական թթուն, և որքան ակտիվ է այդ թթվի հետ
փոխազդող ﬔտաղը, այնքան ավելի խորն է ազոտը վերականգնվում։
Հարկ է նշել, որ ﬔտաղների ու ազոտական թթվի փոխազդե-
ցության ընթացքում ազոտի վերականգնման արգասիքների
խառնուրդ է ստացվում։ Որպես ռեակցիայի հիﬓական ար-
դյունք է ընդունվում այն ﬕացությունը, որի քանակությունն
այդ խառնուրդում գերակշռում է։
Սովորական պայմաններում խիտ ազոտական թթուն չի փոխազ-
դում երկաթի, կոբալտի, նիկելի, քրոﬕ, ալուﬕնի հետ, քանի որ այդ
ﬔտաղների մակերեսը օքսիդների պաշտպանիչ թաղանթով է պատ-
վում։ Սակայն տաքացնելիս խիտ ազոտական թթուն հեշտությամբ
լուծում է նաև այդ ﬔտաղները, օրինակ.
օ
t
Fe + 6HNO3(խիտ)
= Fe(NO3)3 + 3NOշ + 3HշO
Ոսկու (Au), պլատինի (Pt), վոլֆրաﬕ (W), տանտալի (Ta) և էլի ﬔկ-
երկու ﬔտաղի հետ ազոտական թթուն ընդհանրապես չի փոխազ-
դում։ Սակայն ոսկին ու պլատինը լուծվում են այսպես կոչված ար-
քայաջրում՝ ազոտական թթվի և քլորաջրածնական թթվի 1։3 մոլային
հարաբերությամբ խառնուրդում։
Ազոտական թթուն փոխազդում է նաև ոչ ﬔտաղներից շատերի
հետ։ Եթե, օրինակ՝ թասի ﬔջ ածխի կտորներ գցենք, թասը տաքաց-
նենք ու կաթոցիկից խիտ ազոտական թթու կաթեցնենք, ապա ածու-
խը կբռնկվի.
C + 4HNO3(խիտ) = CO2+ 4NO2 + 2HշO
Փորձ 1. Ազոտական թթուն տաքացրե՛ք, ու թթվի ﬔջ առկայծող
մարխ իջեցրե՛ք։ Մարխն անﬕջապես բռնկվում է (նկ. 3.25).
108
Նկ. 3.25 Առկայծող մարխն ազոտական թթվում բռնկվում է
Ազոտական թթվի աղերը՝ նիտրատներ
Ազոտական թթվի բոլոր աղերն առանց բացառության ջրում լու-
ծելի, բյուրեղային նյութեր են, ենթարկվում են ջերմային քայքայման՝
ﬔծ մասամբ թթվածին անջատելով։
Նատրիուﬕ, կալիուﬕ, կալցիուﬕ, ստրոնցիուﬕ՝ Sr(NO3)2, բա-
րիուﬕ՝ Ba(NO3)2, և ամոնիուﬕ՝ NH4NO3, նիտրատներն անվանում են
նաև սելիտրաներ (բորակներ. ահա՛ թե ինչու ազոտն անվանում են
նաև բորակածին)։ Սելիտրաներից առաջին երեքը հանդիպում են
բնության ﬔջ ու երբեﬓ կոչվում գտնվելու տեղանքի անունով՝ KNO3՝
հնդկական, NaNO3՝ չիլիական, Ca(NO3)2՝ նորվեգական սելիտրաներ։
Ստացումը
Դուք արդեն ծանոթացաք ազոտական թթվի քիﬕական հատ-
կություններին ու տեղեկացաք, որ լաբորատորիայում նիտրատնե-
րը ստացվում են ազոտական թթուն հիմքերի, հիﬓային օքսիդների,
աղերի, ﬔտաղների, ինչպես նաև այլ նյութերի հետ փոխազդելիս:
Արդյունաբերության ﬔջ ﬔտաղների նիտրատներն ստանում են
կարբոնատների ու ազոտական թթվի փոխազդեցությունից, օրինակ.
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
Մետաղների նիտրատներ կարելի է ստանալ նաև ազոտի (IV) օք-
սիդի և ալկալիների փոխազդեցությունից թթվածնի մասնակցու-
թյամբ, օրինակ.
4NaOH + 4NO2 + O2 = 4NaNO3 + 2H2O
Ամոնիուﬕ նիտրատը՝ NH4NO3, ստացվում է ամոնիակի ու ազոտա-
կան թթվի փոխազդեցությունից.
109
NH3 + HNO3 = NH4NO3
Նիտրատները կայուն ﬕացություններ չեն ու տաքացնելիս քայ-
քայվում են: Դրանում համոզվելու համար կատարենք հետևյալ փոր-
ձը:
Լաբորատոր փորձ
Փորձանոթի ﬔջ քիչ քանակությամբ նատրիուﬕ
կամ կալիուﬕ նիտրատ լցնենք ու տաքացնենք: Մոտ
300°C ջերմաստիճանում աղը հալվում է, և տաքաց-
նելը շարունակելիս թթվածին է անջատվում: Հալ-
ված աղի ﬔջ շիկացած ածխի կտոր գցելիս վերջինս
բռնկվում է ու արագ այրվում՝ փորձանոթում «թռվռալով»:
Աղ առաջացնող ﬔտաղի բնույթից կախված՝ նիտրատները տար-
բեր կերպ են ջերմային քայքայման ենթարկվում:
Ալկալիական ու հողալկալիական ﬔտաղների նիտրատների քայ-
քայուﬕց ստացվում են համապատասխան նիտրիտը՝ ազոտային
թթվի (HNO2) աղը, և թթվածին, օրինակ.
օ
t
2NaNO3
=
2NaNO2 + O2
Ոչ ակտիվ ﬔտաղների (Hg, Ag, Au և այլն) նիտրատների ջերմային
քայքայուﬕց ստացվում են համապատասխան ﬔտաղը, ազոտի (IV)
օքսիդ և թթվածին, օրինակ.
օ
t
2AgNO3
=
2Ag + 2NO2 + O2
Մնացած ﬔտաղների նիտրատների ջերմային քայքայուﬕց
ստացվում են համապատասխան ﬔտաղի օքսիդը, ազոտի (IV) օք-
սիդ և թթվածին, օրինակ.
tօ
2Cu(NO3)2
=
2CuO + 4NO2+ O2
Դուք արդեն գիտեք, որ ամոնիուﬕ նիտրատը քայքայվում է՝ առա-
ջացնելով ազոտի (I) օքսիդ.
tօ
NH4NO3
= N2O + 2H2O
Նիտրատներն օժտված են աղերին բնորոշ քիﬕական հատկու-
թյուններով:
Նիտրատները բարձր ջերմաստիճաններում ուժեղ օքսիդացնող-
ներ են՝ անջատվող թթվածնի շնորհիվ: Նիտրատների օքսիդացնող
հատկության վրա է հիﬓված դրանց օգտագործումը պայթուցիկ
նյութերի արտադրության ﬔջ:
Նիտրատները լայնորեն կիրառվում են որպես պարարտանյութեր:
110
(NO3)- իոնի հայտաբերումը
Նիտրատ իոնի առկայությունը հեշտությամբ որոշվում է նիտրա-
տը խիտ ծծմբական թթվի և պղնձի հետ թույլ տաքացնելիս, ինչի
հետևանքով դեղնագորշ (դարչնագույն) գույնով ու բնորոշ հոտով
գազային ազոտի (IV) օքսիդ է անջատվում: Ընթացող ռեակցիաներն
են.
H2SO4 + 2NaNO3 = Na2SO4 + 2HNO3
4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2H2O
Ազոտական թթվի կիրառությունները ներկայացված են ստորև
(նկ. 3.26).
Նկ. 3.26 Ազոտական թթվի կիրառությունները
111
ՀԱՐՑԵՐ, ՎԱՐԺՈՒԹՅՈՒՆՆԵՐ ԵՎ ԽՆԴԻՐՆԵՐ
1. Ազոտի ո՞ր օքսիդներն են փոխազդում ալկալիների
հետ օքսիդացման աստիճանի փոփոխությամբ: Գրե՛ք
այդ ռեակցիաների հավասարուﬓերը:
2. Հաստատե՛ք կամ հերքե՛ք պնդուﬓերի ճշմարտացի-
ությունը ազոտի (IV) օքսիդի վերաբերյալ: Չ գ ի տ ե մ ը
նույնպես տարբերակ է.
1) անգույն գազ է,
2) կարմրագորշ գազ է,
3) 1,6 անգամ ծանր է օդից,
4) խտությունը հավասար է օդի խտությանը:
4
1
2
3
4
ճիշտ է
սխալ է
չգիտեմ
3. Կարտոֆիլի ﬔջ առկա նիտրատի ավելցուկից ազատվելու համար
անհրաժեշտ է այն կեղևահանել, եփել, ջուրը թափել: Ի՞նչ է կատար-
վում կարտոֆիլում պարունակվող նիտրատների հետ:
4. 17 կգ զանգվածով ամոնիակի կատալիտիկ օքսիդացուﬕց ստացվել
է 27 կգ ազոտի (II) օքսիդ: Որքա՞ն է ռեակցիայի ելքը (%) տեսականի
հաﬔմատ:
5. Ի՞նչ ծավալով (լ,ն.պ.) և ազոտի ո՞ր օքսիդն է ստացվում 18,8 գ պղնձի (II)
նիտրատը քայքայելիս:
6. Ազոտի օքսիդների քիﬕական վերլուծությունից պարզվել է, որ.
ա) 45 գ առաջին օքսիդը պարունակում է 21 գ ազոտ,
բ) 23 գ երկրորդ օքսիդը պարունակում է 7 գ ազոտ,
գ) 135 գ երրորդ օքսիդը պարունակում է 35 գ ազոտ:
Որո՞նք են այդ օքսիդների բանաձևերը:
112
ԱՄՈՆԻԱԿԻ ՍՏԱՑՈՒՄՆ ՈՒ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԻ
ՈՒՍՈՒՄՆԱՍԻՐՈՒԹՅՈՒՆԸ
Ամոնիակ ստանալու, հավաքելու և այդ գազի հատկություններն
ուսուﬓասիրելու նպատակով անհրաժեշտ է.
1) ամոնիուﬕ քլորիդի և կալցիուﬕ հիդրօքսիդի խառնուրդը տա-
քացնել և օդի դուրսմղման եղանակով ամոնիակը հավաքել փորձա-
նոթում,
2) ֆենոլֆտալեինի թղթով ստուգել ամոնիակի առկայությունը,
վերջինս ջրում լուծել ու հաստատել ամոնիակաջրի առաջացումը,
3) ամոնիակից ստանալ ամոնիուﬕ քլորիդ և ամոնիուﬕ նիտրատ:
Սարքավորուﬓեր ու ազդանյութեր
Լաբորատոր կալան, սպիրտայրոց, բռնիչ, լուցկի, փորձանոթներ,
ծնկաձև գազատար խողովակով խցան, ջրով լի թաս, սանդ, ժամա-
ցույցի ապակի, բամբակ, ապակե խողովակներ, նյութերի այրման
գդալիկներ, թիակ, ֆենոլֆտալեինի թուղթ, խիտ աղաթթու և խիտ
ազոտական թթու, ամոնիուﬕ քլորիդ, կալցիուﬕ հիդրօքսիդ, ֆե-
նոլֆտալեինի լուծույթ, ծծմբական թթվի լուծույթ, արծաթի նիտրատի
լուծույթ, ամոնիուﬕ քլորիդի լուծույթ:
Աշխատանքի ընթացքը
Փորձ 1.
Հավաքե՛ք ամոնիակի ստացման սարքը: Սանդի կամ հախճապա-
կե թասի ﬔջ գդալիկով ամոնիուﬕ քլորիդ և կալցիուﬕ հիդրօքսիդ
լցրե՛ք ու ձողով կամ սանդի կոթով խառնե՛ք: Երբ ամոնիակի սուր հոտ
զգաք, թիակով կամ գդալիկով խառնուրդը զգույշ լցրե՛ք կալանի թա-
թին ամրացրած չոր փորձանոթի ﬔջ՝ վերջինս թաթից հանելով: Փոր-
ձանոթը ծնկաձև գազատար խողովակ ունեցող խցանով փակե՛ք ու
կրկին կալանի թաթին ամրացրե՛ք այնպես, որ փորձանոթը քիչ թեք-
ված լինի բերանի կողմը, իսկ գազատար խողովակը՝ վերև: Վերջինիս
վրա չոր փորձանոթ հագցրե՛ք՝ ամոնիակը հավաքելու նպատակով:
Վառե՛ք սպիրտայրոցը: Սկզբում տաքացրե՛ք ամոնիուﬕ քլորիդի
ու կալցիուﬕ հիդրօքսիդի խառնուրդով լցված ամբողջ փորձանո-
թը (բոցի 2-3 շարժմամբ), ապա տաքացրե՛ք այն տեղը, որտեղ խառ-
նուրդն է:
Երբ կզգաք ամոնիակի սուր հոտն ու փորձանոթի բերանի մոտ
մառախուղ կնկատեք, ջրով թրջված ֆենոլֆտալեինի թուղթը մոտեց-
րե՛ք բերանքսիվայր շրջած փորձանոթի բերանին: Թուղթը մորեգույն
113
կներկվի, դա հաստատում է, որ, իրոք, փորձանոթը լի է ամոնիակ
գազով: Այդ պահին խառնուրդի տաքացուﬓ ընդհատե՛ք:
Ամոնիակով լի փորձանոթն զգուշությամբ հանե՛ք գազատար խո-
ղովակի վրայից ու բութ մատով իսկույն փակե՛ք: Միաժամանակ գա-
զատար խողովակի անցքը փակե՛ք թրջված բամբակի գնդիկով: Բութ
մատով փակած փորձանոթը ջրով լի թասի ﬔջ իջեցրե՛ք ու ջրի տակ
մատը հեռացրե՛ք:
Ի՞նչ եք նկատում: Ինչո՞ւ ջուրը փորձանոթի ﬔջ բարձրացավ:
Ջրի տակ փորձանոթի բերանը դարձյալ մատով փակե՛ք ու փոր-
ձանոթը ջրից հանե՛ք: Համոզվելու նպատակով, որ ամոնիակը, ջրում
լուծվելով, ﬕաժամանակ փոխազդում է վերջինիս հետ, ստացված
լուծույթից ﬕ քիչ լցրե՛ք փորձանոթի ﬔջ ու վրան 2-3 կաթիլ ֆենոլ-
ֆտալեինի լուծույթ ավելացրե՛ք: Լուծույթը մորեգույն կներկվի:
Ինչո՞ւ: Գրե՛ք ամոնիակի և ջրի փոխազդեցության ռեակցիայի մոլե-
կուլային ու իոնային հավասարուﬓերը:
Այժմ կատարե՛ք ամոնիակի մյուս քիﬕական հատկություններին
վերաբերող փորձեր:
Գազատար խողովակի անցքից բամբակը հեռացրե՛ք, սպիրտայ-
րոցը վառե՛ք ու խառնուրդը նորից տաքացրե՛ք: Ապակե ձողը խիտ
աղաթթվով թրջե՛ք ու գազատար խողովակի ծայրին մոտեցրե՛ք: Նույ-
նը կատարե՛ք խիտ ազոտական թթվի հետ: Ի՞նչ եք նկատում: Գրե՛ք
համապատասխան ռեակցիաների հավասարուﬓերը:
Իսկ այժմ ուսուﬓասիրե՛ք ձեր ստացած ամոնիակաջրի հատկու-
թյունները:
Փորձ 2.
Ձեր ստացած ամոնիակի ջրային լուծույթից 4-5 մլ լցրե՛ք չոր փոր-
ձանոթի ﬔջ և 2-3 կաթիլ ֆենոլֆտալեինի լուծույթ ավելացրե՛ք: Լու-
ծույթը մորեգույն կներկվի: Այդ լուծույթին կաթիլ-կաթիլ ծծմբական
թթվի լուծույթ ավելացրե՛ք, ﬕնչև գունավորուﬓ անհետանա:
Ինչո՞ւ անհետացավ գունավորումը: Գրե՛ք համապատասխան ռե-
ակցիայի մոլեկուլային, լրիվ և կրճատ իոնային հավասարուﬓերը:
Առաջադրանք
Աշխատանքային տետրում գրի՛ առեք ձեր կատարած փորձերի
նկարագրություններն ու պատասխանե՛ք հետևյալ հարցերին.
ա) ինչո՞ւ ամոնիակը հավաքեցիք բերանքսիվայր շրջած փորձանո-
թում: Ուրիշ էլ ի՞նչ գազեր կարելի է հավաքել այդ եղանակով,
բ) ինչպե՞ս կարելի է ապացուցել, որ ամոնիակի ջրային լուծույթն
ամոնիուﬕ իոններ՝ (NH4)+ է պարունակում:
114
əɊɧɎɕɧɊɗ 3
ɡɩɡɠ ɟɞɡɫɒɎɩɔ ɯɔɏɔɘɊɘɊɟ əɊɨɘɡɫɒɞɡɫɟɟɎɩɑ
ɟʌʏʙʀ
Ɋɺʗɼɺɸʖɸʌʂʍ
Ɍʏʙʌʍɿ
ɖʖʏʙʀʌʏʙʍɿ*
tʇɸʃʋ.
tɼʓʋ.
ʕʂʊɸʆɿ 20ʜC
(ʜC-ʏʕ)
(ʜC-ʏʕ)
Ɋɽʏʖ
ɺɸɽ
ɸʍɺʏʙʌʍ
1,25
-210
-196
ɤʗɸʅʂʍ
ɺɸɽ
ɸʍɺʏʙʌʍ
0,0899
-259
-253
əɼʃʂʏʙʋ
ɺɸɽ
ɸʍɺʏʙʌʍ
0,138
-
-238,9
ɒʀʕɸʅʂʍ
ɺɸɽ
ɸʍɺʏʙʌʍ
1,43
-219,4
-183
Ɋʅʄɸʅʍʂ(IV)
ɺɸɽ
ɸʍɺʏʙʌʍ
1,977
-56,6
-78,5
ʜʛʔʂɻ
ɤʏʙʗ
ʇɼʉʏʙʆ
ɸʍɺʏʙʌʍ
1( 4϶C)
0
100
ɦʍɻʂʆ
ʇɼʉʏʙʆ
ɸʗʅɸʀɸ-
13,55
-38,84
356,7
ʔʑʂʖɸʆ
ɭɸʘɸʄɸʀʀʏʙ
ʇɼʉʏʙʆ
ɸʍɺʏʙʌʍ
1,05
17
118
ɐʀʂʃ ʔʑʂʗʖ
ʇɼʉʏʙʆ
ɸʍɺʏʙʌʍ
0,79
-114,2
78,4
Ɏʗʆɸʀ
ʑʂʍɻ ʍʌʏʙʀ
ɸʗʅɸʀɸ-
7,86
1539
3200
ʋʏʄʗɸɺʏʙʌʍ
ɡʔʆʂ
ʑʂʍɻ ʍʌʏʙʀ
ɻɼʉʂʍ
19,3
1063
2947
ɝɸɺʍɼɽʂʏʙʋ
ʑʂʍɻ ʍʌʏʙʀ
ɸʗʅɸʀɸ-
1,74
648
1095
ʋʏʄʗɸɺʏʙʌʍ
ɣʉʂʍʈ
ʑʂʍɻ ʍʌʏʙʀ
ʆɸʗʋʂʗ
8,92
1084,5
2540
Ɋʗʅɸʀ
ʑʂʍɻ ʍʌʏʙʀ
ɸʗʅɸʀɸ-
10,6
961,9
2170
ʔʑʂʖɸʆ
ɪʂʍʆ
ʑʂʍɻ ʍʌʏʙʀ
ʔʑʂʖɸʆ-
7,133
419,5
906,2
ɼʗʆʍɸɺʏʙʌʍ
ɼʗɸʍɺʏʕ
ɗʅʏʙʋɹ
ʑʂʍɻ ʍʌʏʙʀ
ɻɼʉʂʍ
2,07
119,3
444,6
ɯʏʔʝʏʗ
ʑʂʍɻ ʍʌʏʙʀ
ʔʑʂʖɸʆ
1,82
44,1
287,3
ʆɸʗʋʂʗ
2,34
590
*ʑʂʍɻ ʍʌʏʙʀɼʗʂ ʞ ʇɼʉʏʙʆʍɼʗʂ ʇɸʋɸʗɵ ɺ/ʔʋ3, ɺɸɽɼʗʂ ʇɸʋɸʗɵ ɺ/ʃ
ՀԱՇՎԱՐԿԱՅԻՆ ԽՆԴԻՐՆԵՐԻ ՊԱՏԱՍԽԱՆՆԵՐ
Գլուխ 1։ 8-րդ դասարանի քիﬕայի դասընթացի կարևորագույն
հասկացությունների կրկնություն
1.1.
7. 14,89 %, 10. 11,2 գ, 11. 3,01.1023 ատոմ։
1.2.
1. 108 գ, 2. 5,6 լ, 3. 75 %, 4. 55,5 գ, 5. 0,135 մոլ, 6. 128 գ, 7. 4,2 գ,
8. 0,65 մոլ, 9. 0,8 մոլ։
Գլուխ 2։ Էլեկտրոլիտային դիսոցում
2.2. 7. 3, 8. 0,912 %։
2.3. 8. 0,3 մոլ Ba2+ և 0,6 մոլ (NO3)-, 9. 200 գ/մոլ, 10. 50 գ։
2.4. 4. 0,08 մոլ, 5. 5 %, 6. 0.0172 մոլ/լ։
2.5. 3. 0,0015 մոլ CH3COO¯, 0,0015 մոլ H+, 0,0485 մոլ CH3COOH, 4. 0,2
մոլ H+, 5. 46 գ։
2.6. 12. 1 մոլ/լ, 13. 6, 14. 44,8 լ։
2.7. 4. 3,75 %, 5. 2%։
2.9. 5. 174 գ MnO2, 6. 52,8 գ FeS, 7. 16 գ Fe2O3, 8,4 գ CO:
Գլուխ 3։ Ոչ ﬔտաղներ
3.1.
6. 2,448, 7. 34, 8. 160 գ/մոլ, 9. 0,99 %, 10. 98,87 %։
3.2. 7. 162,5 գ, 8. 89,6 լ, 9. 0,0935 մոլ և 7,48 գ, 10. 15,5 գ։
3.3. 7. 76 %, 8. 3,36 լ, 22,35 գ, 9. 300 լ, 50 լ ջրածին, 10. 50 գ։
3.4. 4. 508 գ, 5. 105 գ, 6. 0,00096
%։
3.5. 6. 110, 656 լ, 7. ա) 242,5, բ) 19,4 գ։
3.6. 4. 2,8 լ, 5. 5,6 լ, 6. ա) 2,24 լ, բ) 4,48 լ։
3.7. 6. 122,45 գ, 7. 95%, 8. 48 գ։
3.8. 6. 1 մոլ KHSO4, 7. 30գ NaHSO4 և 35,5 գ Na2SO4, 8. 300 գ։
3.9. 4. V1/V2 =3, 5. V1/V2 = 1,25, 6. 81 անգամ։
3.10. 3. 7500 գ, 4. 12,99 կգ։
3.11.
6. 1824 լ, 7. 4,48 լ NH3, 8. 79 %:
3.12. 5. 100 լ, 6. 16,47 լ, 7. 146,4 լ։
3.13. 6. 1 մոլ, 7. 0,75 մոլ, 8. 1,2 մոլ։
3.14. 4. 90 %, 5. 4,48 լ NO2, 6. ա) NO բ) NO2 գ) N2O5:
Լ.Ա. ՍԱՀԱԿՅԱՆ, Հ.Գ. ԽԱՉԱՏՐՅԱՆ,
Ք.Հ. ԲԴՈՅԱՆ
ՔԻՄԻԱ
9-րդ դասարան
ՎԵՐԱՀՐԱՏԱՐԱԿՈՒԹՅՈՒՆ
ՄԱՍ 1
Խմբագիր՝ Ազատուհի Սահակ ան
Սրբագրիչ՝ Անահիտ Պապան
Ձևավորումը՝ Նվարդ Հայրապետյանի
Շապիկի ձևավորումը՝ Արամ Ուռուտյանի
Շարվածքը՝ Քնարիկ Սիսակ անի
Պատվեր՝ 998: Տպաքանակ՝ 25780:
Թուղթը՝ օֆսեթ: Չափսը՝ 70x100/16: 7,5 տպ. մամուլ:
Տառատեսակը՝ GHEA Arpi Sans:
Տպագրված է «Տիգրան Մեծ» հրատարակչություն ՓԲԸ տպարանում