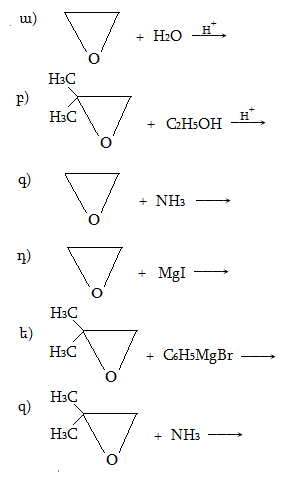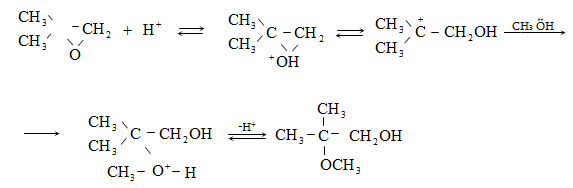ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ
ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐԱՈՒԹՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
(ՊՈԼԻՏԵԽՆԻԿ)
Քիմաիական տեխնեոլոգիաների և
Բնապահպանական Ճարտարագիտության
դեպարտամենտ
Օրգանական քիմիայի և բնապահպանության
Ճարտարագիտական ամբիոն
Ա.Հ.Չերքեզյան, Գ.Հ.Թորոսյան
ՕՐԳԱՆԱԿԱՆ ՔԻՄԻԱ
Դասագիրք
ԵՐԵՎԱՆ
ՃԱՐՏԱՐԱԳԵՏ
2009

Չերքեզյան Ա.Հ., Թորոսյան Գ.Հ.
Թ 822 Օրգանական քիմիա: Դասագիրք.-Եր.: Ճարտարագետ,2009.-408էջ:
Դասագիրքը նախատեսված է Հայաստանի Հանրապետության բարձրագույն ուսումնական հաստատությունների ուսանողների, մագիստրանտների, ասպիրանտների և օրգանական քիմիա ուսումնասիրողների համար:
Դասագրքում օրգանական միացությունները մանրամասն դիտարկվում են իրենց քիմիական կառուցվածքով, իզոմերիայով, ֆիզիկական հատկություններով, թունավորությամբ, բնապահպանական խնդիրներով, արտադրանքի համաշխարհային ծավալով՝ 1999-2004թթ. Տվյալներով, ստացման եղանակներով և քիմիական հատկություններով:
Կարևորոգույն փոփոխարկումների համար բերված են ռեակցիաների մեխանիզմները: Յուրաքանչյուր դասի համար, համապատասխանաբար, տրված են խնդիրներ:
Գրախոսներ՝
ԵՊՀ Օրգ. քիմ. ամբ. վարիչ,
ք. գ. դ, պրոֆ.՝ Վ.Ս.Հարությունյան,
ԵՊԲՀ Դեղ. և թուն. քիմ. ամբ. վարիչ, մանկ.
գ. դ, պրոֆ.՝ Լ.Ա.Սահակյան,
ԵՊԱՀ Ընդհ. քիմ. ամբ. վարիչ,
ք. գ. դ, պրոֆ.՝ Հ.Հ. Մխիթարյան,
ՀՀ ԱԱԳ Օրգ. և դեղ. քիմ. ԳՏԿ տնօրեն,
ք. գ. դ, պրոֆ.՝ Վ.Օ.Թոփուզյան,
Կենսատեխ. ԳՀԻ փոխտնօրեն,
ք. գ. դ, պրոֆ.՝ Ղ.Պ.Հալաբյան
ԳՄԴ 24.2ց7
ISBN 978-9939-55-186-9

1. ՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԷԼԵԿՏՐՈՆԱՅԻՆ ԿԱՌՈՒՑՎԱԾՔ
1.2. Դոնոր-ակցեպտորային (կոորդինացիոն) կապ
2. ԱԾԽԱԾՆԻ ԱՏՈՄԻ ՎԱԼԵՆՏԱՅԻՆ ՎԻՃԱԿՆԵՐ` ՀԻԲՐԻԴԱՑՈՒՄ
3. ՕՐԳԱՆԱԿԱՆ ՄՈԼԵԿՈՒԼՈՒՄ ԱՏՈՄՆԵՐԻ ՓՈԽԱԶԴԵՑՈՒԹՅՈՒՆ
4. ՕՐԳԱՆԱԿԱՆ ՌԵԱԿՑԻԱՆԵՐԻ ԴԱՍԱԿԱՐԳՈՒՄ
5. ՕՐԳԱՆԱԿԱՆ ՄՈԼԵԿՈՒԼՆԵՐԻ ՌԵԱԿՑԻՈՆ ԿԵՆՏՐՈՆՆԵՐ
6. ՔԻՄԻԱԿԱՆ ՌԵԱԿՑԻՈՆՈՒՆԱԿՈՒԹՅՈՒՆ ԵՎ ՔԱՆԱԿԱԿԱՆ ԲՆՈՒԹԱԳՐԵՐ (ՄԵԽԱՆԻԶՄ, ԿԻՆԵՏԻԿԱ, ԿԱՏԱԼԻԶ)
7. ՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԱՆՋԱՏՈՒՄ, ՄԱՔՐՈՒՄ, ԿԱՌՈՒՑՎԱԾՔԻ ՊԱՐԶԱԲԱՆՈՒՄ
8. ՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԴԱՍԱԿԱՐԳՈՒՄ
9. ԱԼԿԱՆՆԵՐ (ՀԱԳԵՑԱԾ ԱԾԽԱՋՐԱԾԻՆՆԵՐ)
9.3. Կիրառման բնագավառներ, թունավորություն
10. ԱԼԿԵՆՆԵՐ (ՕԼԵՖԻՆՆԵՐ, ԷԹԻԼԵՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐ)
10.2. Ֆիզիկական հատկություններ
10.3. Կիրառման բնագավառներ, թունավորություն
10.4.1.Հագեցած ածխաջրածինների կատալիզային դեհիդրոգենացում
10.4.2. Սպիրտների դեհիդրատացում
10.4.3. Հալոգենածանցյալների դեհիդրոհալոգենացում
10.4.4. Վիցինալ դիհալոգենածանցյալներից հալոգենի մոլեկուլի պոկում
10.4.5. Ալկինների հիդրոգենացում
10.4.6. Չորրորդային ամոնիումային միացությունների ճեղքում
10.5.5. Հալոգենացում ալիլ դիրքում
11. ԱԼԿԻՆՆԵՐ (ԱՑԵՏԻԼԵՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐ)
11.2. Ֆիզիկական հատկություններ
11.3.Կիրառման բնագավառներ, թունավորություն
(ԴԻԵՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐ, ԱԼԻՖ1ԱՏԻԿ ԴԻԵՆՆԵՐ)
12.2. Ֆիզիկական հատկություններ
12.3. Կիրառման բնագավառներ, թունավորություն
12.4. Զուգորդված դիենների ստացման եղանակներ
12.5.2. Դիենային սինթեզ (Դիլս-Ալդերի ռեակցիա)
13.2. Անվանակարգում, իզոմերիա
13.3. Ֆիզիկական հատկություններ
13.4. Կիրառման բնագավառներ, թունավորություն
13.5.4. Ստացում արոմատիկ ածխաջրածիններից
13.6.2. Բենզոլի և հոմոլոգների օքսիդացում
14. ԱՐՈՄԱՏԻԿ ՕՂԱԿՈՒՄ ԷԼԵԿՏՐՈՖԻԼ ՏԵՂԱԿԱԼՄԱՆ ՌԵԱԿՑԻԱՅԻ ՄԵԽԱՆԻԶՄ
14.1. SE ռեակցիաների օրինակներ
14.1.2. Ացիլում (Ֆրիդլ-Կրաֆտս)
14.1.5. Սուլֆուրացում
14.2. Կողմնորոշման կանոնը տեղակալված բենզոլային օղակում
14.3. Տեղակալիչների կողմնորոշիչ ազդեցության մեխանիզմ
15. ՀԱԼՈԳԵՆԱԼԿԱՆՆԵՐ (ԱԼԿԻԼՀԱԼՈԳԵՆԻԴՆԵՐ)
15.2. Ֆիզիկական հատկություններ
15.3. Կիրառման բնագավառներ, թունավորություն
15.6. Ալկիլհալոգենիդների նուկլեոֆիլ տեղակալման ռեակցիաներ
15.6.1. Բիմոլեկուլային նուկլեոֆիլ տեղակալում`SN2
15.6.2. Մոնոմոլեկուլային նուկլեոֆիլ տեղակալում` SN1
15.6.3. Սուբստրատի կառուցվածքի ազդեցությունը
15.6.4. Տեղակալվող խմբի բնույթը
15.6.5. Նուկլեոֆիլ ռեագենտի ազդեցությունը
15.7.1. Մոնոմոլեկուլային պոկում (E1)
15.7.2. Բիմոլեկուլային պոկում (E2)
15.8. Տեղակալման և պոկման ռեակցիաների որոշ օրինաչափություններ
16. ՍԱՀՄԱՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐԻ ԴԻ- ԵՎ ՊՈԼԻՀԱԼՈԳԵՆԱԾԱՆՑՅԱԼՆԵՐ
16.3. Ֆիզիկական և քիմիական հատկություններ
16.4. Առանձին ներկայացուցիչներ
17. ՉՀԱԳԵՑԱԾ ԱԾԽԱՋՐԱԾԻՆՆԵՐԻ ՀԱԼՈԳԵՆԱԾԱՆՑՅԱԼՆԵՐ
17.2. Ֆիզիկական հատկություններ
17.3. Կիրառման բնագավառներ, թունավորություն
17.5. Առանձին ներկայացուցիչներ
18. ԱՐՈՄԱՏԻԿ ՀԱԼՈԳԵՆԱԾԱՆՑՅԱԼՆԵՐ
18.2. Ֆիզիկական հատկություններ
18.3. Կիրառման բնագավառներ, թունավորություն
18.4.ա. Քիմիական հատկություններ
18.5. Նուկլեոֆիլ տեղակալման ռեակցիայի մեխանիզմ
18.6. Բիմոլեկուլային նուկլեոֆիլ տեղակալում արոմատիկ օղակում (SN2)
18.6. Արիլհալոգենիդների ռեակցիաներ
19.1. Միատոմ հագեցած սպիրտներ, անվանակարգում, իզոմերիա
19.2. Ֆիզիկական հատկություններ
19.3./19.4. Կիրառման բնագավառներ, թունավորություն
20.2. Ֆիզիկական հատկություններ
20.3. Կիրառման բնագավառներ, թունավորություն
20.4.2. Էթիլենքլորիդի հիդրոլիզ
23. ԱՐՈՄԱՏԻԿ ՕՔՍԻՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
23.1. Ֆիզիկական հատկություններ
23.2. Կիրառման բնագավառներ, թունավորություն
23.3. Ֆենոլների ստացում
Խնդիրներ
26.2. Ֆիզիկական հատկություններ
26.3. Կիրառման բնագավառներ, թունավորություն
27. ՄԱԿՐՈՑԻԿԼԱՅԻՆ ՊԱՐԶ ԵԹԵՐՆԵՐ (ԿՐԱՈՒՆ ԵԹԵՐՆԵՐ)
28. ԷՊՕՔՍԻԴԱՅԻՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
29.1. Կիրառման բնագավառներ, թունավորություն
ՆԵՐԱԾՈՒԹՅՈՒՆ
Օրգանական բազմաթիվ միացություններ մարդկությանը հայտնի են եղել դարերի ընթացքում: Նախապատմական մարդկային հասարակությունն իր կարիքների համար շաքարանյութերից խմորման միջոցով ստացել է ալկոհոլային խմիչքներ: Հպարտանալու տեղիք ունենք մենք` հայերս. խաղողից գինու և գարուց գարեջրի ստացման հնադարյան լավագույն տեխնոլոգիաները մշակվել են մեր նախնիների կողմից: Ալկոհոլ անվանումը, որ գալիս է հին արաբերենից (al-Kohol), նշանակում է «ընդհանրապես ցնդող միացությունների ամբողջություն»: Այդ անվանումն առաջին անգամ 16-րդ դարում օգտագործել է աշխարհում քիմիայի առաջին «պրոֆեսոր» Պարացելսը` սպիրտներն անվանելու համար: Հպարտանալու տեղիք ունենք մենք` հայերս. խաղողից գինու և գարուց գարեջրի ստացման հնադարյան լավագույն տեխնոլոգիաները մշակվել են մեր նախնիների կողմից: Ալկոհոլ անվանումը, որ գալիս է հին արաբերենից (al-Kohol), նշանակում է «ընդհանրապես ցնդող միացությունների ամբողջություն»: Այդ անվանումն առաջին անգամ 16-րդ դարում օգտագործել է աշխարհում քիմիայի առաջին «պրոֆեսոր» Պարացելսը` սպիրտներն անվանելու համար: Գինիների թթվեցման արդյունքում մարդիկ ստացել են քացախաթթու: 16-րդ դարից սկսած` մեկը մյուսի ետևից հայտնաբերվեցին զանազան օրգանական թթուներ` գինեթթու, թրթնջկաթթու, խնձորաթթու և այլն:
Հնում մարդիկ օգտագործում էին բնական ներկանյութեր, որոնք մեզ հասած հնագույն պատկերներում պահպանել են իրենց վառ գունավորումը: Դրա լավագույն օրինակն է որդան կարմիրը, որը վաղ միջնադարում իշխել է հայկական անկրկնելի մանրանկարչությունում:
Մարդկությունը վաղուց կիրառում է բազմազան օծանելիքներ: Հին Եգիպտոսում այդ նպատակի համար օգտագործում էին օրգանական ծագում ունեցող բազմաթիվ միջոցներ: Այդ նյութերը ոչ միայն պճնանքի առարկա էին, այլ նաև չէին վնասում առողջությանը: Հայտնի է, որ Կլեոպատրան Մեռյալ ծովի ափին ստեղծել է յուրատեսակ «արտադրություն», որտեղ արտադրվել են բազմաթիվ հոտավետ նյութեր, քսուքներ, խյուսեր, մազի և դեմքի ներկեր և այլն:
Քիմիայում լուրջ հեղաշրջում սկսվեց միջնադարից, երբ մարդիկ ամեն ինչում «ոսկի» փնտրելու խելահեղության էին հասել: Հետագայում «ալքիմիան» դարձավ մեծահարուստների, բարձրաշխարհիկ հասարակության զբաղմունքը: Պատահական չէ, որ 17-րդ դարից սկսած` իրար էին հաջորդում քիմիական բացահայտումներ, իսկ լավագույն սրահներում արվեստի քննարկումներին զուգակցում էին քիմիական հրաշագործությունների հայտարարությունները:
Օրգանական քիմիան որպես գիտություն իր ծնունդով պարտական է գերմանացի գիտնական Վյոլերի հայտնագործություններին: Նա 1824 թվականին դիցիանից ստացավ թրթնջկաթթու, իսկ 1828 թ. ցիանաթթվական ամոնիումը վերածեց միզանյութի: Այս հայտնագործությունները շրջադարձորեն հերքեցին այն պատկերացումը, ըստ որի օրգանական նյութերը գոյանում են «կենսական ուժի» շնորհիվ, և անօրգանական նյութերը չեն կարող փոխարկվել օրգանական միացությունների (Բերցելիուսի «վիտալիստական» տեսություն):
Օրգանական քիմիան գիտության մեջ աստիճանաբար հաստատվեց որպես առանձին և ինքնուրույն ուղղություն: 19-րդ դարում հայտնըվեցին դասագրքեր` նվիրված օրգանական քիմիային, որտեղ հաստատապես նշվում էր, որ օրգանական միացությունների հիմնական տարրերն ածխածինն ու ջրածինն են: Քիմիան բաժանվեց երկու ինքնուրույն ուղղությունների` անօրգանական և օրգանական: Օրգանական քիմիա տերմինն առաջարկել է շվեդ հռչակավոր քիմիկոս և հանքագետ Բերցելիուսը` գիտություն, որն ուսումնասիրում է ածխածնի միացությունների փոխազդեցություններն այլ տարրերի հետ, ինչպես նաև այդ միացությունների փոխարկման օրենքները:
Ներկայումս օրգանական քիմիան հիմնարար գիտություն է, քանի որ այն քիմիայի մյուս բնագավառների, ինչպես նաև կենսաբանության, ֆիզիկայի և մաթեմատիկայի հետ կազմում է նյութական աշխարհի վերաբերյալ գիտելիքների հիմքը: Օրգանական քիմիան կուտակել է գիտական պատկերացումների, տեսությունների, վարկածների հսկայական զանգված` ստեղծելով 10 միլիոնից ավելի միացությունների «պահեստ», որը յուրաքանչյուր տարի հարստանում է 300 հազարից ավելի նոր անվանումներով:
Օրգանական միացությունների առանձնահատուկ բազմազանությունը կապված է ածխածնի ատոմների այն յուրահատկության հետ, որ դրանք կարող են իրար միանալ հասարակ, կրկնակի, եռակի կապերով` գործնականում գոյացնելով անհաշիվ թվով ատոմներ պարունակող նոր մոլեկուլներ` իրենց մեջ ընդգրկելով պարբերական համակարգի բոլոր տարրերը: Այս առումով օրգանական քիմիան մոտենում է մարդկության մի այնպիսի նվաճման, ինչպիսին ճարտարապետությունն է` դառնալով ճարտարապետություն մոլեկուլային մակարդակով:
Օրգանական քիմիան որպես առարկայական ծրագիր խիստ կարևորվում է հատկապես քիմիական, նավթաքիմիական տեխնոլոգիաների, կենսաբանական, բժշկական և բնապահպանական գիտելիքներ ստանալու ակնկալիք ունեցող մարդկանց համար:
Վերջին տասնամյակներում օրգանական քիմիայից անջատվել են նոր ձևավորված մեծածավալ մասնագիտական ուղղություններ, որոնք անվանվում են ըստ իրենց գիտական կամ կիրառական բնույթի, օրինակ` բարձրամոլեկուլային միացությունների քիմիա, տարրօրգանական միացությունների քիմիա, հետերոցիկլիկ միացությունների քիմիա և այլն: Բարձրագույն նվաճում է համակարգչային օրգանական քիմիայի զարգացումը, որը հնարավորություն է տալիս ուսումնասիրել ոչ միայն հայտնի սինթեզվող օրգանական միացություններ, այլև ուսումնասիրում է գոյություն չունեցող օրգանական միացություններ, որոնք դեռևս անհնար է ստանալ: Յուրաքանչյուր բնագավառ հանդես է գալիս նաև իր ուսումնակրթական ծրագրերով: Քիմիական կրթության համաշխարհային «հսկաները» պատրաստում են բակալավրեր և մագիստրոսներ վերը նշված ուղղություններով:
Օրգանական քիմիան հասու է բավարարելու ոչ միայն գիտական և տեխնիկական հետազոտությունները, այլև արդյունաբերության պահանջները: Բուռն զարգացում ապրած հիմնական և նուրբ օրգանական սինթեզի տեխնոլոգիաներն աշխարհը հեղեղել են բազմաթիվ նյութերով, գրեթե բոլոր բնական միացությունների փոխարինիչներով: Հատկապես խիստ կարևորվում են նվաճումները նավթավերամշակման և կենսաքիմիական ոլորտներում:
Վերջին տասնամյակներում մարդկության կյանքում դիտվում են արագ և համընդհանուր փոփոխություններ` կապված ժամանակակից տեխնոլոգիաների զարգացման և համաշխարհային տնտեսության տարբեր ճյուղերում արդյունաբերական արտադրության ծավալների մեծացման հետ: Առաջատար երկրների արդյունաբերության աճը հանգեցրեց ոչ միայն բարձր կենսամակարդակի, այլ նաև աղետաբեր դարձավ գոյության միջավայրի համար` խախտելով կենսոլորտի հավասարակշռությունը:
Քիմիական տեխնոլոգիաների ասպարեզում բարձրագույն կրթության կարևորագույն խնդիրն է պատրաստել այնպիսի մասնագետներ, որոնք նեղ մասնագիտական գործունեության հետ մեկտեղ ուսումնասիրում են հարակից գիտությունները, մասնավորապես` շրջակա միջավայրի պաշտպանության, ամբողջ հասարակության կայուն զարգացման հետ առնչվող բնագավառները:
Ներկայացվող դասագիրքն ստեղծվել է օրգանական քիմայի բնագավառում հեղինակների երկարատև ակտիվ աշխատանքային գործունեության հիման վրա: Այն նախատեսվում է ինչպես քիմիական կրթության բակալավրական և մագիստրական մակարդակների, այնպես էլ օրգանական քիմիա ուսումնասիրող մյուս ուսանողների համար:
1. ՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԷԼԵԿՏՐՈՆԱՅԻՆ ԿԱՌՈՒՑՎԱԾՔ
1.1. Կովալենտ կապ
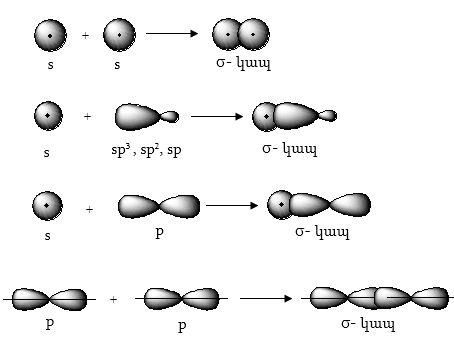
Օրգանական միացություններին հիմնականում բնորոշ են կովալենտ քիմիական կապեր: Համաձայն քվանտամեխանիկական պատկերացման, կովալենտ կապն առաջանում է միատեսակ կամ տարբեր ատոմների հակառակ սպիններով էլեկտրոնների ատոմային օրբիտալների վերածածկման արդյունքում` տեղի է ունենում կապ առաջացնող ատոմների վալենտային էլեկտրոնների ընդհանրացում: Կովալենտ կապը բնութագրվում է մոլեկուլում ատոմների միջև էլեկտրոնային ամպի խտության մեծացմամբ` համեմատած նույն ատոմներում էլեկտրոնային ամպի խտության բաշխման հետ:
Կովալենտ
կապը, ի տարբերություն
իոնականի, տարածության
մեջ ունի կապի
առաջացմանը մասնակից
ատոմային օրբիտալների
սիմետրիային համապատասխան
որոշակի տեղայնացում
(լոկալացում):
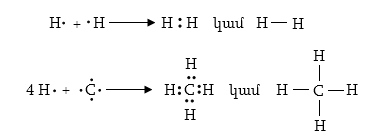
1915-1916թթ. ձևակերպվեց
«օկտետի» կանոնը
(Վ. Կոսել և Գ. Լյուիս),
ըստ որի յուրաքանչյուր
ատոմ ձգտում է
իր շուրջն ստեղծել
իներտ գազի կայուն
թաղանթ: Ջրածնի
ատոմի համար այդպիսի
թաղանթ է հելիումի
երկէլեկտրոնային
օրբիտալը, երկրորդ
պարբերության
տարրերի համար`
նեոնի ութ էլեկտրոն
ունեցող օրբիտալը:
Կովալենտ կապի
առաջացման ժամանակ
կատարվում
է յուրաքանչյուր
ատոմի մեկական
ատոմային օրբիտալի
անցում երկու ատոմների
համար ընդհանուր
մոլեկուլային
օրբիտալի (թերմոդինամիկորեն
առավել կայուն,
ամրացնող օրբիտալ):
Եթե ատոմային օրբիտալների
վերածածկումը
կատարվում է ատոմների
միջուկները միացնող
առանցքի ուղղությամբ,
առաջացած մոլեկուլային
օրբիտալը կոչվում
է ![]() իսկ
կովալենտ կապը`
իսկ
կովալենտ կապը`
![]()
Պարզության համար կովալենտ կապն արտահայտվում է երկու կետով (Լյուիսի բանաձև) կամ գծիկով (կառուցվածքային բանաձև)`
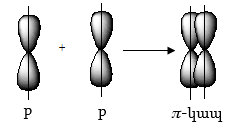
Ատոմային
p-օրբիտալների
կողմնային վերածածկումով
առաջացող օրբիտալը
կոչվում է ![]() իսկ
կապը`
իսկ
կապը`![]()
Կատարյալ կովալենտ կապ առաջանում է հոմոմիջուկային համակարգերում` H2, N2, Cl2 և այլ միանման ատոմների միջև: Եթե մոլեկուլում ատոմները տարբեր են, ապա էլեկտրոնային ամպի խտությունը տեղաշարժվում է դեպի առավել էլեկտրաբացասական ատոմը, կատարվում է կապի բևեռացում, որի սահմանային վիճակն իոնական կապն է:
1.2. Դոնոր-ակցեպտորային (կոորդինացիոն) կապ
Կապի առաջացման համար անհրաժեշտ էլեկտրոնային զույգը տրամադրում է ատոմներից մեկը (դոնոր), իսկ մյուսը` (ակցեպտոր) դատարկ օրբիտալ:
Կոորդինացիոն կապը բնորոշ է կոմպլեքս միացություններին, երբ մեկ կամ մի քանի ատոմներ առաջացնում են ավելի շատ կապեր, քան թույլ է տալիս իրենց վալենտականությունը: Կապը կովալենտ կապի տարատեսակ է: Երբ կոորդինացիոն կապը երկկենտրոն է, տեղի է ունենում էլեկտրոնային զույգի անցում լիգանդից կամ որ նույնն է` դոնորից կոմպլեքսագոյացնողի (ակցեպտոր) դատարկ օրբիտալի վրա: Առաջացած մոլեկուլային օրբիտալում երկու էլեկտրոնները, ինչպես կովալենտ կապի դեպքում, հավասարաչափ պատկանում են կապ առաջացնող ատոմներին:
Որպես
դոնոր կարող են
հանդես գալ ինչպես
չբաշխված էլեկտրոնային
զույգով, այնպես
էլ ![]() օրբիտալով
մոլեկուլներ:
օրբիտալով
մոլեկուլներ:
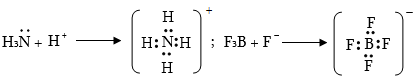
Նմանատիպ կապ գերազանցապես առաջացնում են անցողիկ մետաղները` շնորհիվ իրենց ազատ (d) և (f) օրբիտալների: Իրականացվում է նաև բազմակենտրոն կովալենտ կամ կոորդինացիոն կապ, երբ լիգանդները (դոնորները) փոխազդելով զուգորդված համակարգերի` ակցեպտորների հետ, առաջացնում են բազմաթիվ կամրջակային կապեր:
Համաձայն Լյուիսի տեսության` էլեկտրոնային զույգով օժտված մոլեկուլները, որոնք տրամադրում են այդ էլեկտրոնները դատարկ օրբիտալին կապ առաջացնելու համար, կոչվում են հիմքեր, իսկ այն միացությունները, որոնք ունեն դատարկ օրբիտալ և ընդունում են էլեկտրոնային զույգ, կոչվում են թթուներ:
1.3. Սեմիպոլյար կապ
Եթե դոնոր-ակցեպտորային մեխանիզմով կապի առաջացումն ուղեկցվում է ատոմների վրա տարանուն լիցքերի առաջացմամբ, կապը կոչվում է սեմիպոլյար` էլեկտրոնային զույգ տրամադրողը լիցքավորվում է դրական, օրբիտալ տրամադրողը` բացասական լիցքով:
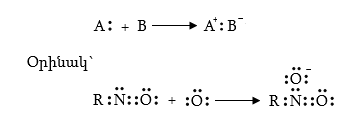
1.4. Ջրածնական կապ
Ջրածնական կապ առաջանում է ջրածնի ատոմ և էլեկտրաբացասական տարր (ֆտոր, թթվածին, ազոտ) պարունակող մոլեկուլների միջև: Նման պարագայում ջրածինը փոխազդում է մյուս ատոմի կամ իոնի չբաշխված էլեկտրոնային զույգիհետ` այն դարձնելով ընդհանուր (կոորդինացիոն կապի տարատեսակ):
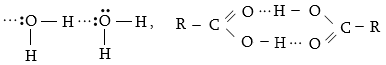
Միջմոլեկուլային ջրածնական կապերը պայմանավորում են մոլեկուլների ասոցումը, ազդում են ֆիզիկական հատկությունների վրա:
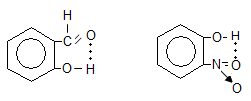
Ջրածնական կապ կարող է առաջանալ նաև միևնույն մոլեկուլի ներսում`
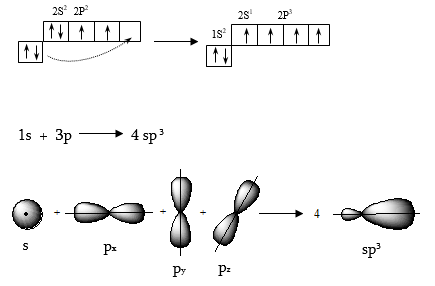
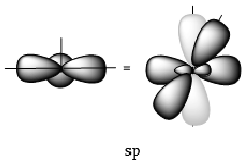
2. ԱԾԽԱԾՆԻ ԱՏՈՄԻ ՎԱԼԵՆՏԱՅԻՆ ՎԻՃԱԿՆԵՐ` ՀԻԲՐԻԴԱՑՈՒՄ
2.1. ![]() հիբրիդացում
հիբրիդացում
Օրգանական
միացություններում
ածխածինը քառավալենտ
է: Համաձայն ածխածնի
ատոմի էլեկտրոնային
կոնֆիգուրացիայի`![]() այն
պետք է ցուցաբերեր
երկվալենտություն
(CO): Մեթանում ածխածինը
քառավալենտ է,
գոյացրած չորս
կովալենտ կապերը`
համարժեք: Համաձայն
մոլեկուլում ատոմային
օրբիտալների քվանտաքիմիական
պատկերացումների`
ածխածնում կատարվում
է էլեկտրոններից
մեկի անցում 2s օրբիտալից
2p դատարկ օրբիտալ
(ածխածնի գրգռված
ատոմ): Առաջացած
չորս էլեկտրոնային
օրբիտալների հիբրիդացման
արդյունքում ածխածնի
ատոմն անցնում
է քառավալենտ վիճակի
(Պոլինգ 1931թ), միևնույն
էներգիայով օժտված
չորս հիբրիդային
օրբիտալներով,
որոնք ունեն ձգված
ությակի տեսք և
առաջացնում են
այն
պետք է ցուցաբերեր
երկվալենտություն
(CO): Մեթանում ածխածինը
քառավալենտ է,
գոյացրած չորս
կովալենտ կապերը`
համարժեք: Համաձայն
մոլեկուլում ատոմային
օրբիտալների քվանտաքիմիական
պատկերացումների`
ածխածնում կատարվում
է էլեկտրոններից
մեկի անցում 2s օրբիտալից
2p դատարկ օրբիտալ
(ածխածնի գրգռված
ատոմ): Առաջացած
չորս էլեկտրոնային
օրբիտալների հիբրիդացման
արդյունքում ածխածնի
ատոմն անցնում
է քառավալենտ վիճակի
(Պոլինգ 1931թ), միևնույն
էներգիայով օժտված
չորս հիբրիդային
օրբիտալներով,
որոնք ունեն ձգված
ությակի տեսք և
առաջացնում են ![]()
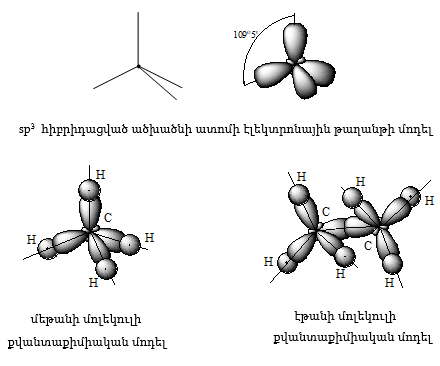
Հագեցած
ածխաջրածիններում
ածխածնի ատոմը
գտնվում է sp3 հիբրիդացված
վիճակում. հիբրիդային
օրբիտալները տեղաբաշխված
են կանոնավոր քառանիստի
կենտրոնից դեպի
գագաթները ![]() անկյան
տակ:
անկյան
տակ:
![]() երկարությունը
երկարությունը
![]() խզման
էներգիան` 350 կՋ/մոլ:
Հագեցած ածխաջրածիններում
հնարավոր է ազատ
պտույտ C C կապի շուրջը
խզման
էներգիան` 350 կՋ/մոլ:
Հագեցած ածխաջրածիններում
հնարավոր է ազատ
պտույտ C C կապի շուրջը
![]() Առաջացած
վիճակները կոչվում
են շրջադարձային
իզոմերներ կամ
կոնֆորմերներ,
որոնք ցածրամոլեկուլային
շարքի ածխաջրածիններում
խիստ անկայուն
են, և դրանց բաժանումն
անհնար է: Այսպես,
էթանում բազմաթիվ
կոնֆորմերներից
երկուսը` սահմանային
երկու հակադիր
վիճակները, հարմար
է նկարագրել Նյումենի
կառուցվածքային
բանաձևերով`
Առաջացած
վիճակները կոչվում
են շրջադարձային
իզոմերներ կամ
կոնֆորմերներ,
որոնք ցածրամոլեկուլային
շարքի ածխաջրածիններում
խիստ անկայուն
են, և դրանց բաժանումն
անհնար է: Այսպես,
էթանում բազմաթիվ
կոնֆորմերներից
երկուսը` սահմանային
երկու հակադիր
վիճակները, հարմար
է նկարագրել Նյումենի
կառուցվածքային
բանաձևերով`
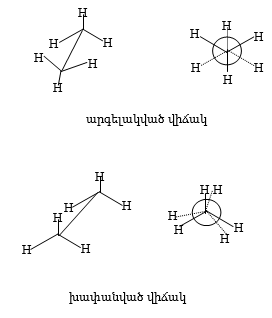
Արգելակված վիճակը խափանված վիճակից թերմոդինամիկորեն ավելի կայուն է:
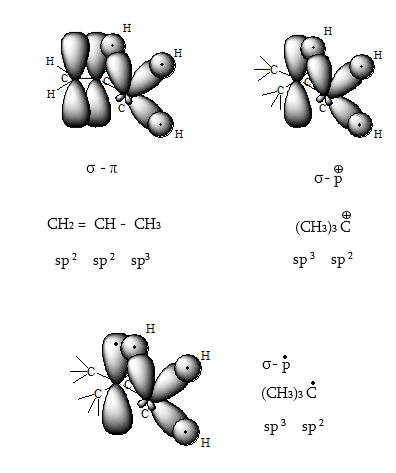
2.2. ![]() հիբրիդացում
հիբրիդացում
Կրկնակի կապի առաջացման դեպքում` չհագեցած ախաջրածիններում, տեղի է ունենում ածխածնի ատոմի ![]() ատոմային
օրբիտալների հիբրիդացում:
Արդյունքում ստացվում
են միմյանց նկատմամբ
ատոմային
օրբիտալների հիբրիդացում:
Արդյունքում ստացվում
են միմյանց նկատմամբ
![]() անկյան
տակ գտնվող երեք
համարժեք
անկյան
տակ գտնվող երեք
համարժեք ![]() օրբիտալներ:
օրբիտալներ:
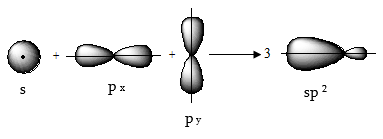
Չորրորդ` չհիբրիդացված, ազատ ատոմային p օրբիտալի առանցքն ուղղահայաց է հիբրիդային օրբիտալների հարթությանը:
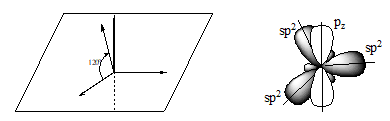
Էթիլենում
հիբրիդային ![]() օրբիտալները,
վերածածկվելով
կից ածխածնի և
ջրածինների ատոմային
օրբիտալներով,
առաջացնում են
միևնույն հարթության
մեջ գտնվող
օրբիտալները,
վերածածկվելով
կից ածխածնի և
ջրածինների ատոմային
օրբիտալներով,
առաջացնում են
միևնույն հարթության
մեջ գտնվող ![]() Յուրաքանչյուր
ածխածնի չհիբրիդացված
p oրբիտալները կողմնային
վերածածկումով
առաջացնում են
Յուրաքանչյուր
ածխածնի չհիբրիդացված
p oրբիտալները կողմնային
վերածածկումով
առաջացնում են
![]() հարթությանն
ուղղահայաց հարթության
մեջ:
հարթությանն
ուղղահայաց հարթության
մեջ:
![]() էներգիան
ավելի փոքր է, քան
էներգիան
ավելի փոքր է, քան ![]() (կողմնային
վերածածկումն
արդյունավետ չէ):
Կրկնակի կապի էներգիան
(կողմնային
վերածածկումն
արդյունավետ չէ):
Կրկնակի կապի էներգիան
![]() կազմում
է 607,1 կՋ/մոլ,
կազմում
է 607,1 կՋ/մոլ, ![]() էներգիան`
257,1 կՋ/մոլ: Կրկնակի
կապի երկարությունն
(C = C) ավելի փոքր է,
քան C-C կապինը և կազմում
է 0,134 նմ: Որքան մեծ
է միջուկների միջև
էլեկտրոնային
ամպի խտությունը,
այնքան մեծ է դրանց
փոխձգումը և փոքր`
կապի երկարությունը:
էներգիան`
257,1 կՋ/մոլ: Կրկնակի
կապի երկարությունն
(C = C) ավելի փոքր է,
քան C-C կապինը և կազմում
է 0,134 նմ: Որքան մեծ
է միջուկների միջև
էլեկտրոնային
ամպի խտությունը,
այնքան մեծ է դրանց
փոխձգումը և փոքր`
կապի երկարությունը:
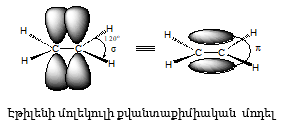
2.3. sp հիբրիդացում
Եռակի
կապ ունեցող օրգանական
միացությունների
համար բնորոշ է
sp հիբրիդացում.
ածխածնի ատոմի
2s և 2p օրբիտալների
հիբրիդացումով
առաջանում են երկու
համարժեք օրբիտալներ,
որոնց առանցքները
գտնվում են միևնույն
գծի վրա, ունեն
հակադիր ուղղություններ,
միմյանց հետ կազմում
են ![]() Չհիբրիդացված
երկու օրբիտալները
գտնվում են փոխուղղահայաց
հարթություններում:
Չհիբրիդացված
երկու օրբիտալները
գտնվում են փոխուղղահայաց
հարթություններում:
Ացետիլենում
յուրաքանչյուր
ածխածնի ատոմ իր
երկու հիբրիդային
օրբիտալներով
առաջացնում է երկու
![]() ` կից ածխածնի
sp հիբրիդացված
օրբիտալի և ջրածնի
ատոմային օրբիտալի
հետ: Չհիբրիդացված
օրբիտալների վերածածկումով
առաջանում են
` կից ածխածնի
sp հիբրիդացված
օրբիտալի և ջրածնի
ատոմային օրբիտալի
հետ: Չհիբրիդացված
օրբիտալների վերածածկումով
առաջանում են ![]() կապեր.
կապեր.
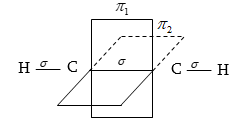
Այսպիսով,
համաձայն քվանտաքիմիական
տեսության, եռակի
կապը ացետիլենում
նկարագրվում է
որպես մեկ ![]() կապերի
համակցում:
կապերի
համակցում:
Ացետիլենում
եռակի կապն ավելի
թույլ է (822,7 կՋ/մոլ),
երկրորդ ![]() էներգիան
ընդամենը 215,6 կՋ/մոլ
է: Եռակի կապի երկարությունը
կազմում է 0,12 նմ:
էներգիան
ընդամենը 215,6 կՋ/մոլ
է: Եռակի կապի երկարությունը
կազմում է 0,12 նմ:
3. ՕՐԳԱՆԱԿԱՆ ՄՈԼԵԿՈՒԼՈՒՄ ԱՏՈՄՆԵՐԻ ՓՈԽԱԶԴԵՑՈՒԹՅՈՒՆ
Օրգանական մոլեկուլում ատոմների փոխադարձ ազդեցության տեսության հիմնադիրը Ա.Մ. Բուտլերովն է: Տարբերում են երկու տեսակ ներմոլեկուլային փոխազդեցություն` ինդուկտիվ էֆեկտ (I) և զուգորդման կամ մեզոմեր էֆեկտ (M):
Ինդուկտիվ էֆեկտը պայմանավորված է ատոմների կամ դիպոլների էլեկտրաստատիկ լիցքերի ազդեցությամբ ռեակցիոն կենտրոնների կամ որևէ դիտարկվող ատոմի վրա: Ինդուկտիվ էֆեկտի ազդեցությունը նշանակվում է սլաքով` կովալենտ կապի առանցքի ուղղությամբ դեպի առավել էլեկտրաբացասական ատոմը, որի հետևանքով կապ առաջացնող ատոմները լիցքավորվում են մասնակի դրական և բացասական լիցքերով ![]() Ինդուկտիվ էֆեկտի մեծությունը պայմանավորված է կովալենտ կապով միացած ատոմների էլեկտրաբացասականությունների տարբերությամբ: C-H կապի ինդուկտիվ էֆեկտի մեծությունն ընդունված է 0:
Ինդուկտիվ էֆեկտի մեծությունը պայմանավորված է կովալենտ կապով միացած ատոմների էլեկտրաբացասականությունների տարբերությամբ: C-H կապի ինդուկտիվ էֆեկտի մեծությունն ընդունված է 0:
Ինդուկտիվ էֆեկտի ազդեցությունը ռեակցիոն կենտրոնի վրա կարող է լինել դրական (+I) կամ բացասական (-I)`պայմանավորված տեղակալիչի բնույթով:
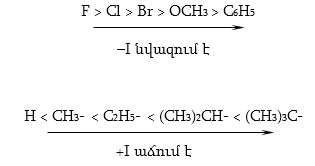
Ինդուկտիվ էֆեկտի ազդեցության փոխանցումը հագեցած ածխածնային շղթայում նվազում է:
![]()
Մի քանի տեղակալիչների ինդուկտիվ էֆեկտը գումարվում է, որով բացատրվում է երրորդային, երկրորդային և առաջնային ալկիլ խմբերի ազդեցության տարբերությունը:
Մեզոմեր
էֆեկտը մոլեկուլում
կամ իոնում ատոմների
փոխադարձ ազդեցության
այնպիսի ձև է, որի
արդյունքում կատարվում
է զուգորդված համակարգի
բևեռացում: Այն
պայմանավորված
է զուգորդված ![]() կապերի
կամ էլեկտրոնային
զույգի տեղաշարժով
դեպի առավել էլեկտրաբացասական
ատոմը կամ խումբը,
ինչպես նաև առավել
էլեկտրոնադոնոր
խմբից դեպի համակարգի
վերջին ատոմը կամ
ատոմային խումբը:
Մեզոմեր էֆեկտը
ցույց է տրվում
կորասլաքով:
կապերի
կամ էլեկտրոնային
զույգի տեղաշարժով
դեպի առավել էլեկտրաբացասական
ատոմը կամ խումբը,
ինչպես նաև առավել
էլեկտրոնադոնոր
խմբից դեպի համակարգի
վերջին ատոմը կամ
ատոմային խումբը:
Մեզոմեր էֆեկտը
ցույց է տրվում
կորասլաքով:
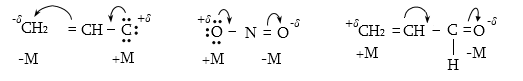
Այլ կերպ
ասած, մեզոմեր
էֆեկտը ![]() էլեկտրոնների
փոխազդեցությունն
է
էլեկտրոնների
փոխազդեցությունն
է![]() բաժանված
հարևան
բաժանված
հարևան ![]() էլեկտրոնների
էլեկտրոնների
![]() չբաշխված
էլեկտրոնային
զույգի
չբաշխված
էլեկտրոնային
զույգի ![]() ազատ
ազատ
![]() կամ
կամ ![]() պարունակող
պարունակող
![]() ատոմային
p օրբիտալների
հետ: Փոխազդեցության
հետևանքով տեղի
է ունենում մոլեկուլի
հարթությունից
դուրս (տարածության
մեջ) ատոմային
օրբիտալների մասնակի
կողմնային վերածածկում,
որը նպաստում է
էլեկտրոնային
խտությունների
բաշխմանը և, հետևաբար`
համակարգի կայունացմանը:
Փոխազդող ատոմները
և ատոմային խմբերը
պետք է գտնվեն
միևնույն հարթության
մեջ, իսկ
ատոմային
p օրբիտալների
հետ: Փոխազդեցության
հետևանքով տեղի
է ունենում մոլեկուլի
հարթությունից
դուրս (տարածության
մեջ) ատոմային
օրբիտալների մասնակի
կողմնային վերածածկում,
որը նպաստում է
էլեկտրոնային
խտությունների
բաշխմանը և, հետևաբար`
համակարգի կայունացմանը:
Փոխազդող ատոմները
և ատոմային խմբերը
պետք է գտնվեն
միևնույն հարթության
մեջ, իսկ ![]() օրբիտալները
լինեն հարթությանն
ուղղահայաց, հետևաբար`
միմյանց զուգահեռ
և բաժանված լինեն
մեկ
օրբիտալները
լինեն հարթությանն
ուղղահայաց, հետևաբար`
միմյանց զուգահեռ
և բաժանված լինեն
մեկ ![]()
Մեզոմեր էֆեկտը նշանակում են M տառով և արտահայտում հետևյալ երեք պայմանական նշաններով.
ա) կորասլաքներով.
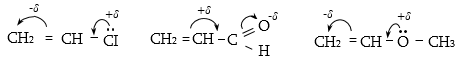
բ) սահմանային (ռեզոնանսային) կառուցվածքային բանաձևերի տեսքով.
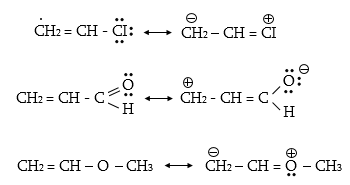
գ) մեզոմերների տեսքով, որոնցում ատոմները միացնում են կետագծերով.
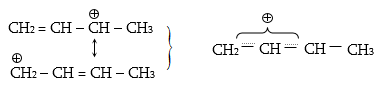
Տարբերում են դրական և բացասական մեզոմեր էֆեկտներ (+M, -M): Դրական մեզոմեր էֆեկտն արտահայտվում է էլեկտրոնադոնորությամբ օժտված այն ատոմների և ատոմային խմբերի մոտ, որոնք մեզոմերման արդյունքում լիցքավորվում են դրական լիցքով: Բացասական մեզոմեր էֆեկտ են ցուցաբերում էլեկտրաբացասականությամբ օժտված ատոմները և ատոմային խմբերը` լիցքավորվելով բացասական լիցքով:

Մեզոմեր
էֆեկտն առավել
արտահայտված է
արոմատիկ համակարգերում:
Դրական մեզոմեր
էֆեկտով օժտված
խմբերը մեծացնում
են համակարգի էլեկտրոնային
ամպի խտությունը,
իսկ բացասականները`
փոքրացնում: Եթե
արոմատիկ օղակին
(ինչպես նաև չհագեցած
խմբին) անմիջապես
միացած է ջրածին
պարունակող ածխածին
(օրինակ, մեթիլ
կամ այլ առաջնային
և երկրորդային
ալկիլ տեղակալիչ),
ապա ի հայտ է գալիս
զուգորդման հատուկ
տեսակ, որը կոչվում
է գերզուգորդում
կամ Նաթան-Բեկերի
էֆեկտ ![]() Գերզուգորդմամբ
է բացատրվում պրոպենում
մեթիլ խմբի ջրածինների
թթվայնությունը,
երրորդային կարբկատիոնների
և ռադիկալների
կայունությունը:
Գերզուգորդմամբ
է բացատրվում պրոպենում
մեթիլ խմբի ջրածինների
թթվայնությունը,
երրորդային կարբկատիոնների
և ռադիկալների
կայունությունը:
4. ՕՐԳԱՆԱԿԱՆ ՌԵԱԿՑԻԱՆԵՐԻ ԴԱՍԱԿԱՐԳՈՒՄ
Օրգանական ռեակցիաները հիմնականում դասակարգվում են համաձայն մոլեկուլայնության` կինետիկական բնորոշումների, կապերի խզման, գրգռման եղանակի և այլն:
ա) ըստ ռեակցիայի կինետիկական բնորոշման
Ռեակցիայի կինետիկական դասակարգումը հաշվի է առնում մոլեկուլայնությունը` յուրաքանչյուր տարրական ակտում մասնակցող մոլեկուլների թիվը: Օրգանական ռեակցիաները գերազանցապես լինում են մոնոմոլեկուլային, բիմոլեկուլային, հազվադեպ բնութագրվում են նաև տրիմոլեկուլային ռեակցիաներ:
բ) ըստ վալենտային կապի խզման
Ռեակցիայի պայմաններից կախված` կապի խզումը կարող է կատարվել հոմոլիտիկ կամ հետերոլիտիկ:
Հոմոլիտիկ խզման ժամանակ էլեկտրոնային զույգը բաժանվում է այնպես, որ յուրաքանչյուր մասնիկի մոտ մնում է մեկ չզույգված վալենտային էլեկտրոն. առաջանում են երկու ազատ ռադիկալներ (ազատ վալենտային էլեկտրոն կրող ատոմը կամ ատոմային խումբը կոչվում է ռադիկալ):
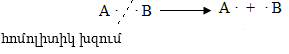
Հետերոլիտիկ խզման ժամանակ էլեկտրոնային զույգը մնում է կովալենտ կապ առաջացնող ատոմներից մեկի մոտ. մասնիկներից մեկը ստանում է դրական (կատիոն), մյուսը` բացասական (անիոն) լիցք:
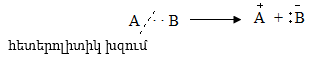
գ) ըստ ռեագենտի բնույթի
Քիմիական ռեակցիաների ժամանակ այն մոլեկուլը, որում կատարվում է վերափոխում (հին կապի խզում, նորի առաջացում և այլն)` կոչվում է սուբստրատ, իսկ սուբստրատի վրա հարձակվողը` ռեագենտ: Անօրգանական քիմիայում ռեագենտները դասակարգվում են ըստ բարդության կարգի, էլեկտրոնային բնույթի` թթուներ և հիմքեր, օքսիդիչներ և վերականգնիչներ, կոմպլեքսագոյացնողներ և լիգանդներ և այլն: Օրգանական քիմիայում պահպանվում է այս դասակարգումը և լրացուցիչ մտցվում են այլ հասկացություններ: Ռեագենտները բաժանվում են նուկլեոֆիլների, էլեկտրոֆիլների և էլեկտրաչեզոքների:
1) Նուկլեոֆիլ ռեագենտ - Nu (մի- և բազմատոմ անիոններ, չբաշխված էլեկտրոնային զույգ ունեցող մոլեկուլներ, որոնք կարող են ցանկացած տարրի տրամադրել էլեկտրոնային զույգ (բացառությամբ ջրածնի): Լինում են`

2) Էլեկտրոֆիլ ռեագենտ - E (կատիոններ են, որոնք ունեն բարձր ակտիվություն էլեկտրոնային զույգի կամ մոլեկուլի բացասական կենտրոնի նկատմամբ): Լինում են`
ա) բարձր ակտիվության` H+, NO+2, SO+3H,
բ) միջին ակտիվության` p և d դատարկ օրբիտալներով միացություններ` BF3, AICI3, FeCI3,
գ) թույլ ակտիվության` CI2, Br2, F2, I2:
3) Էլեկտրաչեզոք ռեագենտ - R (մոլեկուլներ առանց դոնորակցեպտորային կենտրոնների և ազատ ռադիկալներ, որոնք ունեն չզույգված վալենտային էլեկտրոն):
դ) ըստ ռեագենտի և տարրական ակտերի բնույթի
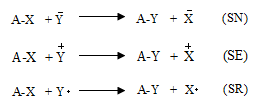
Տեղակալման` SN (նուկլեոֆիլ մեխանիզմ), SE (էլեկտրոֆիլ մեխանիզմ), SR (ռադիկալային մեխանիզմ ) (S-substitution).
Միացման` AdN (նուկլեոֆիլ մեխանիզմ), AdE (էլեկտրոֆիլ մեխանիզմ), AdR (ռադիկալային մեխանիզմ) (Ad-addiition).
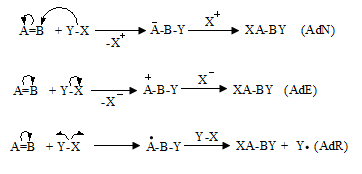
Պոկման` E սուբստրատի մոլեկուլից պոկվում է որևէ մոլեկուլ կամ մասնիկ (E-elimination).
![]()
Ինչպես միացման, այնպես էլ պոկման ռեակցիաներում X-ի և Y-ի միացման կամ պոկման միաժամանակությունը և հաջորդականությունը բնութագրվում են կինետիկական գործոններով:
Վերախմբավորման ` R, սուբստրատի կառուցվածքը փոխվում է այնպիսի արգասիքի առաջացմամբ, որն իզոմեր է սկզբնական միացությանը, (R-rearrangement): Վերախմբավորման ռեակցիաներում տեղի է ունենում որևէ ատոմի կամ խմբի տեղաշարժ մի ատոմից մյուսին: Խումբը կարող է տեղաշարժվել էլեկտրոնային զույգով, ազատ ռադիկալով կամ դատարկ օրբիտալով:
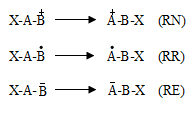
ե) ըստ վերջնական արգասիքների
1) Հիդրման (հիդրոգենացման):
2) Դեհիդրման (դեհիդրոգենացման):
3) Հիդրատացման:
4) Դեհիդրատացման:
5) Օքսիդացման:
6) Հալոգենացման:
7) Դեհալոգենացման:
8) Նիտրացման:
9) Սուլֆուրացման:
Եթերացման և այլն
5. ՕՐԳԱՆԱԿԱՆ ՄՈԼԵԿՈՒԼՆԵՐԻ ՌԵԱԿՑԻՈՆ ԿԵՆՏՐՈՆՆԵՐ
Մոլեկուլների ռեակցիոն կենտրոնները դրանց կառուցվածքում եղած այն ատոմներն ու ատոմների փոքր խմբավորումներն են, որոնք ունեն մինչև վերջ չօգտագործված քիմիական համակցություն դեպի ռեագենտ հանդիսացող մյուս մոլեկուլները կամ մասնիկները: Չհագեցած քիմիական համակցության աղբյուր են դատարկ և չկապված մոլեկուլային օրբիտալները, որոնք ունեն ցածր էներգիա:
Օրգանական գործընթացներում փոխազդման կենտրոնները` միջանկյալ մասնիկները, գոյանում են ռեակցիայի ընթացքում, որոնց բնութագրումն օրգանական ռեակցիաների արտահայտման առանցքային խնդիրն է: Սրանք ապահովում են ռեակցիայի անցողիկ վիճակը, որին համապատասխանում է առավելագույն էներգիա: Միջանկյալ առաջանում են նաև միացություններ, որոնք հայտնաբերվում և ուսումնասիրվում են փորձերի ընթացքում:
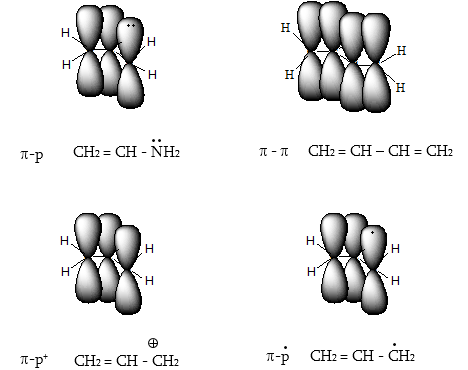
Միջանկյալ մասնիկները (ռադիկալներ, կարբկատիոններ, կարբանիոններ, իոն-ռադիկալներ) գոյանում են օրգանական ռեակցիաների ընթացքում հին կապերի խզման և նոր կապերի առաջացման գործընթացում: Յուրաքանչյուր մասնիկի կայունությունը և ռեակցիոնունակությունը պայմանավորված է իր կառուցվածքով: Միջանկյալ մասնիկի կայունության աստիճանը պայմանավորված է չզույգված էլեկտրոնի, դատարկ օրբիտալի կամ էլետրոնային զույգի փոխազդեցությամբ ածխածնին հարևան C H կապերի հետ (գերզուգորդում):
Դիտարկենք առանձին դեպքեր.
ա) ռադիկալներ`
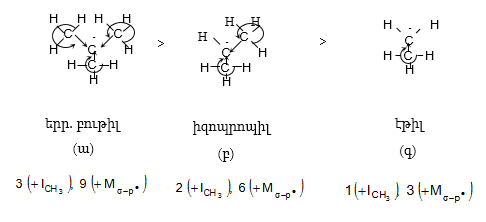
Շնորհիվ +I և +M փոխազդեցությունների (ածխածնի և հարևան ատոմային խմբերի միջև) տեղի է ունենում ածխածնի ատոմի ազատ վալենտային էլեկտրոնի լիցքի ցրում: Այդ պատճառով երրորդային բութիլ ռադիկալն առավել կայուն է իզոպրոպիլից, վերջինս էլ` էթիլ ռադիկալից:
բ) կարբկատիոններ`
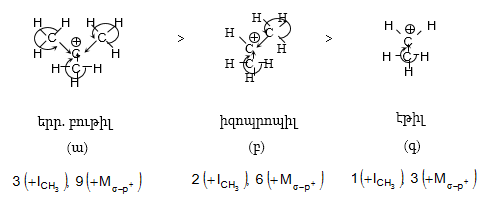
Համաձայն վերը նշված դատողությունների, (ա) կատիոնն առավել կայուն է, քան (բ) և (գ) կատիոնները: Փոխազդեցության շնորհիվ կատիոնի դրական լիցքը բաշխվում է կից ատոմների և ատոմային խմբերի վրա:
գ) կարբանիոններ`
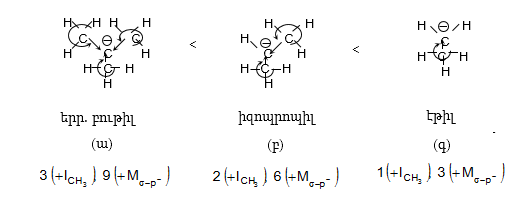
Բերված դեպքերում +I և +M էֆեկտների շնորհիվ տեղի է ունենում վերոհիշյալի հակառակ ազդեցությունը. դրական ինդուկտիվ և մեզոմեր էֆեկտների պատճառով կատարվում է կարբանիոնի ածխածնի բացասական լիցքի մեծացում (ա): Ի տարբերություն քննարկված նախորդ դեպքերի, այստեղ կատարվում է լիցքի ապակայունացում:
դ) իոն-ռադիկալ`
Անվանումից հետևում է, որ այս դեպքում միջանկյալ մասնիկը միաժամանակ կրում է ամբողջական լիցք և ազատ վալենտային էլեկտրոն:
Օրինակ. ամոնիումի պերսուլֆատի ջրային լուծույթի տաքացումից գոյանում է իոն-ռադիկալ
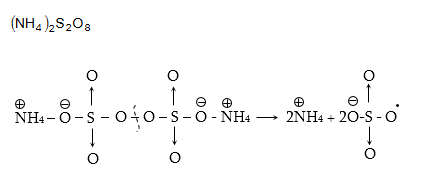
6. ՔԻՄԻԱԿԱՆ ՌԵԱԿՑԻՈՆՈՒՆԱԿՈՒԹՅՈՒՆ ԵՎ ՔԱՆԱԿԱԿԱՆ ԲՆՈՒԹԱԳՐԵՐ
(ՄԵԽԱՆԻԶՄ, ԿԻՆԵՏԻԿԱ, ԿԱՏԱԼԻԶ)
Ռեակցիոնունակությունն ատոմի կամ քիմիական միացության այլ ատոմների կամ նյութերի հետ փոխազդեցության մեջ մտնելու հատկություն է: Հետևապես, եթե ելանյութերը ոչ մի պայմանով չեն վերածվում ցանկալի արգասիքների, նշանակում է, որ տվյալ նյութերն անտարբեր են միմյանց նկատմամբ կամ ռեակցիոնունակ չեն: Նման գործընթացը պայմանավորված է թերմոդինամիկական գործոններով կամ կինետիկական ոչ բարենպաստ իրավիճակով: Որևէ միացության ռեակցիոնունակությունը մյուսի նկատմամբ կարող է լինել շատ ցածր, ցածր, բարձր կամ շատ բարձր: Սրանցից յուրաքանչյուրն ունի իր քանակական մեկնաբանումը` համաձայն թերմոդինամիկական բնութագրերի: Դրանց հենքի վրա կատարվում է ռեակցիայի արագության հաշվարկ, փոխազդեցության կարգի, մոլեկուլայնության և անցողիկ վիճակի հաստատագրում: Այս ամենի հիման վրա օրգանական քիմիայում բացահայտվում են ռեակցիաների մեխանիզմները:
Ռեակցիայի մեխանիզմը մեկնաբանում է ամբողջ փոխազդեցության ընթացքը` իր բոլոր տարրական փուլերով: Օրինակ, երրորդային ալկիլհալոգենիդները ջրային լուծույթում ենթարկվում են հիդրոլիզի` առաջացնելով համապատասխան սպիրտներ: Հաստատված է, որ ռեակցիան ընթանում է մոնոմոլեկուլային նուկլեոֆիլ տեղակալման մեխանիզմով (SN1), որը ներառում է երկու տարրական փուլ.
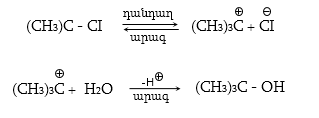
ՈՒսումնասիրվող դեպքում հիդրոլիզի արագությունը պայմանավորված կլինի բացառապես առաջին փուլի արագությամբ: Բոլոր գործոնները (սուբստրատի կառուցվածք, լուծիչ, նուկլեոֆիլ, կատալիզատոր, ջերմաստիճան), որոնք նպաստում են կովալենտ կապի հետերոլիտիկ խզմանը, կնպաստեն ռեակցիայի արագության մեծացմանը: Մեխանիզմի հստակ իմացությունը հնարավորություն է ստեղծում ճիշտ կազմակերպելու տվյալ փոխազդեցության գործընթացը, ընտրելու օպտիմալ բնութագրերը, հատկապես` քիմիական տեխնոլոգիաներում:
Քիմիական ռեակցիաների արագությունն արտահայտվում է կինետիկական հավասարումով: Վերոհիշյալ SN1 մեխանիզմով ռեակցիայի արագությունը բնութագրվում է առաջին կարգի հավասարումով:
![]()
որտեղ` v-ն ռեակցիայի արագությունն է,
![]() -ն` արագության
հաստատունը (արագությունն
է միավոր ծավալում):
-ն` արագության
հաստատունը (արագությունն
է միավոր ծավալում):
Իր հերթին` արագության հաստատունը կախված է տվյալ ռեակցիայի բնույթից, ակտիվացման էներգիայից (E), ջերմաստիճանից (T):
Արագության հաստատունի կախումը ջերմաստիճանից և ակտիվացման էներգիայից արտահայտվում է Արենիուսի հավասարումով`
![]()
որտեղ` T- ն բացարձակ ջերմաստիճանն է,
K - ն` արագության հաստատունը,
A - ն` նախաէքսպոնենցիալ հաստատունը,
E - ն` ակտիվացման էներգիան,
R - ը` գազային հաստատունը:
Ռեակցիայի արագությունը կատալիզատորի ներկայությամբ անհամեմատ մեծանում է:
Քիմիական ռեակցիաների ժամանակ մոլեկուլների ոչ բոլոր հանդիպումներն են բերում արգասիքի առաջացման: Գլխավոր նախապայմանն այն է, որ հանդիպող մոլեկուլները կամ մասնիկներն օժտված լինեն անհրաժեշտ էներգիայով, որը կոչվում է ակտիվացման էներգիա (E): Ելանյութերի և արգասիքի միջև ընկած է անցողիկ վիճակ, որի էներգիան մեծ է ելանյութերի և արգասիքների ներքին էներգիաներից:
Ռեակցիայի ընթացքը կոորդինատային առանցքի վրա ունի հետևյալ տեսքը.
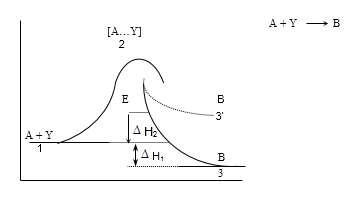
Եթե ռեակցիան ընթանում է 1,2,3 կորով (այսինքն` ռեակցիայի արգասիքի ներքին էներգիան ավելի փոքր է, քան ելանյութերինը), ռեակցիան կլինի էկզոթերմ, իսկ 1,2,3 ընթացքի դեպքում` էնդոթերմ:
7. ՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ
ԱՆՋԱՏՈՒՄ, ՄԱՔՐՈՒՄ, ԿԱՌՈՒՑՎԱԾՔԻ ՊԱՐԶԱԲԱՆՈՒՄ
Յուրաքանչյուր օրգանական միացություն օժտված է որոշակի հալման և եռման ջերմաստիճաններով, լուծիչներում տարբեր լուծելիությամբ և այլն: Բյուրեղային միացությունների բաժանման համար լաբորատոր պայմաններում օգտվում են տարբեր լուծիչներում դրանց լուծելիությունից:
Գործնականում թե լաբորատոր, թե արտադրական պայմաններում, հեղուկ արգասիքների բաժանման համար լայնորեն կիրառվում է թորումը (նաև` բազմաստիճան թորումը) քրոմատոգրաֆիական բաժանումը: Գազային միացությունների բաժանման համար լայն կիրառություն ունեն զանգվածափոխանակման եղանակները (ադսորբում-դեսորբում, քրոմատո-գրաֆիական և այլ եղանակներ):
Մաքրվող օրգանական միացության բաղադրությունը հաստատվում է տարրական անալիզով, երբ որոշում են յուրաքանչյուր տարրի պարունակությունը նմուշում, ապա ֆիզիկական որևէ եղանակով որոշելով մոլեկուլային զանգվածը` պարզում են միացության պարզագույն բանաձևը: Նախկինում օրգանական միացության կառուցվածքը հաստատում էին քիմիական եղանակով` կառուցվածքը հաստատող համապատասխան ռեակցիաների օգնությամբ: Ավելի արդյունավետ են սպեկտրալ անալիզի ժամանակակից եղանակները` ուլտրամանուշակագույն (ՈՒՄ), ինֆրակարմիր (ԻԿ), զանգվածասպեկտրային (ԶՍ) անալիզներ, միջուկամագնիսական ռեզոնանս (ՄՄՌ) և այլն:
8. ՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԴԱՍԱԿԱՐԳՈՒՄ
Ըստ ածխածնային շղթայի կառուցվածքի` օրգանական միացությունները բաժանվում են երկու հիմնական խմբի. բաց շղթայով (ացիկլիկ կամ ալիֆատիկ) և ցիկլային կառուցվածքով միացություններ: Վերջիններս բաժանվում են երկու խմբի` կարբոցիկլիկ (ցիկլի բոլոր ատոմները ածխածիններ են) և հետերոցիկլիկ միացություններ (ցիկլում բացի ածխածնից կան նաև այլ ատոմներ` O,N,S և այլն): Կարբոցիկլիկ միացությունները բաղկացած են երկու շարքից` ալիցիկլիկ և արոմատիկ: Վերոհիշյալ յուրաքանչյուր շարք բաժանվում է դասերի: Ածխաջրածիններում ջրածինը փոխարինելով այլ ատոմով կամ ատոմային խմբերով (ֆունկցիոնալ կամ բնորոշիչ), առաջանում է այլ դասի օրգանական միացությունների շարք: Միևնույն տեղակալիչով ածխաջրածինները կազմում են հոմոլոգիական շարք: Հոմոլոգիական շարքի միացությունների քիմիական հատկությունների նմանությունը զգալիորեն հեշտացնում է դրանց ուսումնասիրումը:
Օրգանական միացությունների հիմնական դասերն են.
1) Ածխաջրածիններ` ալկաններ, ալկեններ, ալկիններ, դիեններ, պոլիեններ, ցիկլիկ և արոմատիկ,
2) Ածխաջրածինների ածանցյալներ`
ա) հալոգենածանցյալներ,
բ) սպիրտներ, ֆենոլներ, պարզ եթերներ,
գ) սպիրտների, ֆենոլների, պարզ եթերների ծծմբային նմանակներ,
դ) ալդեհիդներ, կետոններ, խինոններ,
ե) կարբոնաթթուներ և ածանցյալներ,
զ) ազոտ պարունակող օրգանական միացություններ (նիտրո-, ամինո-, դիազո- և ազոմիացություններ) և այլն,
3) Տարրօրգանական (ֆոսֆոր, բոր և այլն) միացություններ,
4) Մետաղօրգանական միացություններ,
5) Հետերոցիկլիկ միացություններ,
6) Շաքարներ,
7) Ալկալոիդներ,
8) Բնական միացություններ:
Խնդիրներ
1. Ինչպիսի՞ կառուցվածք ունի ածխածնի ատոմը գրգռված վիճակում, ինչպիսի՞ հիբրիդացված վիճակներ են բնորոշ դրան:
2. Ինչպիսի՞ն
է հիբրիդացումը
![]() մասնիկներում:
Նկարել կառուցվածքային
մոդելները:
մասնիկներում:
Նկարել կառուցվածքային
մոդելները:
3. Ցույց տալ ածխածնի ատոմների հիբրիդացումը 1,2-պենտադիենում և նկարել մոլեկուլի կառուցվածքային մոդելը:
4. Ի՞նչ տիպի ատոմային օրբիտալների վերածածկումով է առաջանում կապի օրբիտալը HF մոլեկուլում և ինչպիսի՞ կապ է առաջանում:
5. Բնութագրել կովալենտ կապը:
6. Բերված միացություններում որոշել կապերի տեսակները.
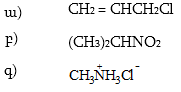
7. Գնահատել
ածխածնի ատոմի
վալենտային վիճակները ![]() Օրինակներով
ցույց տալ հիբրիդային
օրբիտալների վալենտային
անկյունները:
Օրինակներով
ցույց տալ հիբրիդային
օրբիտալների վալենտային
անկյունները:
8. Ինչպիսի՞ն է թթվածնի ատոմի էլեկտրոնային կառուցվածքը: Նկարել հետևյալ միացությունների էլեկտրոնային բանաձևերը.
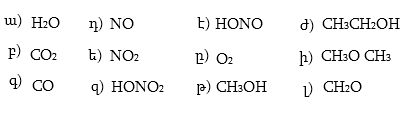
9. Ինչպիսի՞ կովալենտ կապեր կան հետևյալ թթուների մոլեկուլներում. մրջնաթթու, քացախաթթու, կարագաթթու, իզոկարագաթթու: Նշել C - C կապի երկարությունը, կառուցել տարածական մոդելները:
10. Գնահատել կոորդինացիոն և սեմիպոլյար կապերի տարբերությունը: Բերել օրինակներ:
11. Ինչպիսի՞ կովալենտ կապեր են առաջանում էթիլենի և ացետիլենի մոլեկուլներում:
12. Բացատրել բերված ռադիկալների կայունությունը.
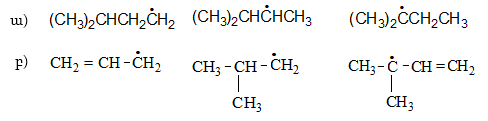
13. Գրել հետևյալ միացությունների էլեկտրոնային բանաձևերը, ցույց տալ վալենտային էլեկտրոնները: Նշել կապերի տեսակները.
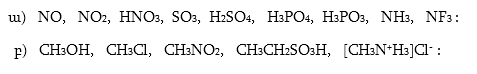
14. Գրված կառուցվածքներից որո՞նք են իոններ.

15. Բերված միացությունները գրել Լյուիսի բանաձևի տեսքով.
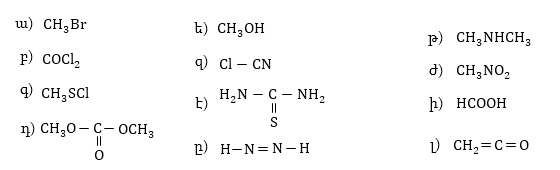
16. Լյուիսի բանաձևով արտահայտել հետևյալ միացությունները, մասնիկները և անվանել.
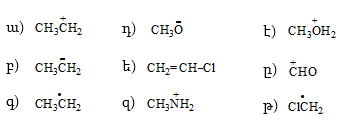
17. Ի՞նչ
կապեր կան մոլեկուլներում՝![]()
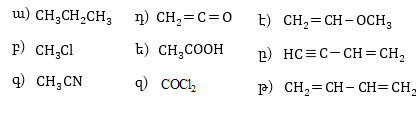
18. Հետևյալ մոլեկուլներում ածխածնի ատոմները ո՞ր վալենտային վիճակում են գտնվում.
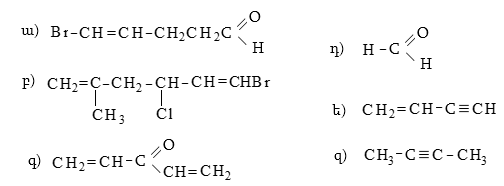
19. Հետևյալ միացություններում պայմանական նշաններով ցույց տալ ինդուկտիվ և մեզոմեր էֆեկտները: Ո՞ր խմբերն են էլեկտրոնադոնոր, որոնք` էլեկտրոնակցեպտոր.
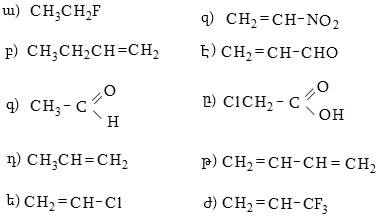
20. Հետևյալ զույգ կառուցվածքներից որո՞նք են ռեզոնանսային.
9. ԱԼԿԱՆՆԵՐ
(ՀԱԳԵՑԱԾ ԱԾԽԱՋՐԱԾԻՆՆԵՐ)
Հագեցած ածխաջրածինները (սահմանային կամ ալիֆատիկ, հնում` պարաֆիններ) ածխածնի և ջրածնի ատոմների այն միացություններն են, որոնց ընդհանուր բանաձևն է CnH2n+2: Ալկաններում ածխածնի ատոմը հարևան յուրաքանչյուր ածխածնի հետ միացման համար ծախսում է մեկ վալենտական էլեկտրոն, իսկ մնացած երկու կամ երեք (ծայրային ածխածնի ատոմների մոտ) վալենտական էլեկտրոններով միանում է ջրածնի ատոմներին: Այս միացություններում ածխածնի ատոմները գտնվում են sp3 հիբրիդացված վիճակում:
9.1. Անվանակարգում, իզոմերիա
Հագեցած ածխաջրածիններից առաջին չորս անդամն ունեն վաղուց ընդունված հին անվանում, իսկ մյուսները կոչվում են հունարեն կամ լատիներեն թվերին ավելացնելով ան վերջավորություն.
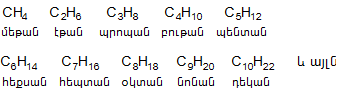
Բնության մեջ յուրաքանչյուր առարկա ունի իր ներքին կառուցվածքը: Մոլեկուլների և այլ մոլեկուլային մասնիկների համար տարբերակում են երկրաչափական և էլեկտրոնային կառուցվածք: Քիմիայում կառուցվածքային պատկերացումները խիստ կարևորում են նյութի ագրեգատային վիճակը, կայունությունը, փոխազդեցության հնարավորությունն այլ մասնիկների հետ: Օրգանական միացությունների համար կարևորվում են նաև մոլեկուլի երկրաչափական կառուցվածքը, մոլեկուլում ատոմների և խմբերի դասավորման հաջորդականությունը: Այսպես, որոշ օրգանական մոլեկուլներ ունեն նույն բաղադրությունը, հետևապես նույն մոլեկուլային զանգվածը, բայց տարբեր կառուցվածք: Տարածական և կառուցվածքային այս երևույթը կոչվում է իզոմերիա (Ա.Մ. Բուտլերով, 1861 թ.):
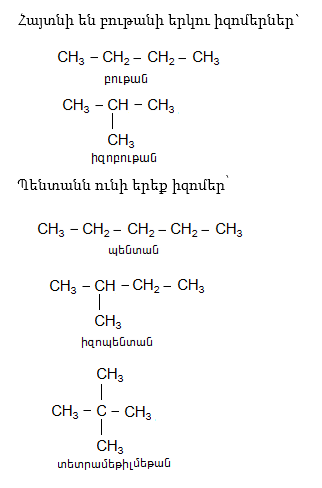
Ալկանների իզոմերիան պայմանավորված է ածխածնի ատոմի դիրքերով և կոչվում է շղթայի կամ ածխաջրածնային կմախքի իզոմերիա: Հոմոլոգիական շարքում ածխածնի ատոմների թվի մեծացումով աճում է իզոմերների թիվը: Յուրաքանչյուր հաջորդ անդամ նախորդից տարբերվում է մեկ -CH2- խմբով (հոմոլոգիական շարքի տարբերություն):
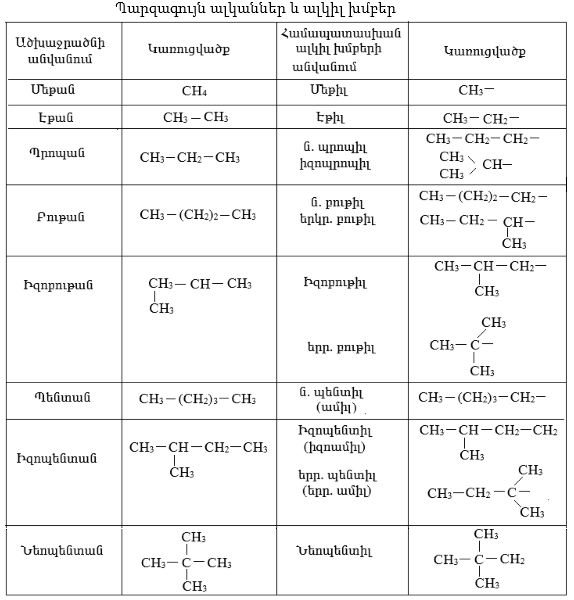
Ածխաջրածինների համար գործում են անվանակարգման հետևյալ համակարգերը.
1. Հին անվանակարգում: Օրգանական նյութերի անվանումները ցույց են տալիս դրանց ծագման բնական աղբյուրը, օրինակ, մրջնաթթու, գինեթթու, միզանյութ, կոֆեին և այլն, կամ որևէ հատկությունը` քացախաթթու, լիմոնաթթու, պիկրինաթթու, կակոդիլ և այլն, կամ ստացման եղանակը` օրինակ, ծծմբային եթեր, աղաթթվային եթեր և այլն, կամ հայտնաբերողի անունը`Դիլս-Ալդերի արգասիք, Չիչիբաբինի ածխաջրածին, Միխլերի կետոն և այլն:
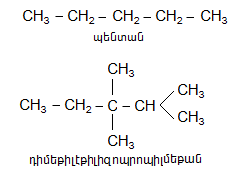
2. Ռացիոնալ անվանակարգում: Հիմնված է Բերցելիուսի ռադիկալների տեսության վրա, երբ ածխաջրածինները դիտվում են որպես մեթանի ածանցյալներ` հիմք ընդունելով ամենաճյուղավորված ածխածինը.
3. Համակարգված (IUPAC) կամ Ժնևյան անվանակարգում: Ժամանակակից անվանակարգման հիմնական սկզբունքներն ընդունվել են 1892թ. Ժնևում, քիմիկոսների միջազգային համագումարում:
Ճյուղավորված շղթայով իզոմերներն անվանվում են հետևյալ կերպ. դիտարկվող ալկանում հիմք է ընդունվում այն ածխաջրածնի անվանումը, որին համապատասխանում է ամենաերկար ածխածնային շղթան: Շղթան համարակալվում է այն ծայրից, որին մոտ է ճյուղավորումը` թվերով նշվում են ռադիկալ-տեղակալիչների դիրքերը, կարդացվում են տեղակալիչները: Տեղակալիչների հերթականությունը` ավագությունը, պայմանավորված է լատինական այբբենակարգով. բութիլ, էթիլ, մեթիլ, պրոպիլ: Վերջում կարդացվում է գլխավոր շղթային համապատասխանող ածխաջրածնի անվանումը: Ռադիկալ-տեղակալիչները միավալենտ օրգանական մնացորդներ են, որոնք առաջանում են ածխաջրածնի մոլեկուլից ջրածնի ատոմի պոկման արդյունքում` լինում են առաջնային, երկրորդային, երրորդային: Եթե ազատ վալենտականություն ունեցող ածխածնի ատոմն անմիջապես միացած է մեկ ածխածնի ատոմի (մեթանի դեպքում ջրածնի) հետ` ռադիկալը կոչվում է առաջնային`
![]()
Եթե ածխածնի ատոմը միացած է երկու ածխածնի ատոմի հետ, ռադիկալը կոչվում է երկրորդային.

Երեք նման կապի դեպքում, համապատասխանաբար, երրորդային`

Ռադիկալներն անվանում են` ալկանների ան վերջավորությունը փոխելով իլ-ով (ալկիլ):
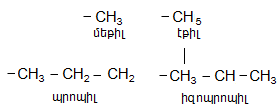
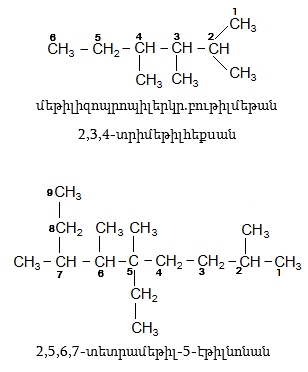
Հետևյալ ածխաջրածինները ներկայացնենք ռացիոնալ և IUPAC անվանակարգումով.
9.2. Ֆիզիկական հատկություններ
Ալկանների, ինչպես և մյուս օրգանական միացությունների ֆիզիկական հատկությունները պայմանավորված են դրանց բաղադրությամբ և կառուցվածքով: Ալկանների եռման և հալման ջերմաստիճանները կախված են մոլեկուլային զանգվածից: Նորմալ շղթայով ածխաջրածինների հոմոլոգիական շարքում առաջին չորս անդամները գազեր են, մինչև տասնհինգերորդը` հեղուկներ, սկսած C16H34 ից` պինդ նյութեր: Եռման ջերմաստիճանները շարքում աճում են, ընդ որում, ջերմաստիճանի տարբերությունը մոտակա հոմոլոգների մոտ անընդհատ փոքրանում է: ՈՒղիղ շղթայով հոմոլոգների եռման ջերմաստիճանն ավելի բարձր է, քան ճյուղավորված իզոմերներինը: Այս հանգամանքը կարելի է բացատրել վերջիններիս մոլեկուլների միջև, ճիշտ է աննշան, սակայն որոշակի փոխազդեցության աճով` ի տարբերություն ուղիղ շղթայով ալկանների: Ճյուղավորված ածխաջրածինները նվազագույն ձգտում ունեն կոմպլեքսագոյացման նկատմամբ, մինչդեռ ուղիղ շղթայով իզոմերները հեշտությամբ գոյացնում են կոմպլեքսներ, օրինակ, միզանյութի հետ (ալկանների բաժանման արտադրական եղանակ): Հալման ջերմաստիճանները հոմոլոգիական շարքում դանդաղ աճում են: Այստեղ դիտարկվում է հետաքրքիր օրինաչափություն` ածխածնի ատոմների զույգ թիվ ունեցող նյութերի հալման ջերմաստիճանն ավելի բարձր է, քան դրանց հաջորդող կենտ թվով ալկաններինը: Խտությունը շարքում սկզբում դանդաղ, ապա արագ աճում է մինչև 0,78 գ/սմ3:
Ալկաններն անհոտ, անգույն նյութեր են, հեշտ բոցավառվում են օդում, պայթյունավտանգ են:
Ալկանները ոչ բևեռային և դժվար բևեռացող միացություններ են, լուծելիությունը ջրում աննշան է: Ալկանների ուլտրամանուշակագույն ճառագայթների կլանման տիրույթը 200 նմ-ի սահմաններում է: ԻԿ սպեկտրում բնորոշ են կլանումներ 2800 3000 սմ-1 տիրույթում, C-H կապերի վալենտային տատանումները համապատասխանում են 1380 1470 սմ-1 տիրույթին: C-C հասարակ կապերի կլանումներն ինտենսիվ չեն և չեն գրանցվում: Կարճ շղթաներում C-C կապի շուրջը հնարավոր է ազատ կամ համարյա ազատ պտույտ:
9.3. Կիրառման բնագավառներ, թունավորություն
Հագեցած ածխաջրածինները բնության մեջ շատ տարածված են: Հոմոլոգիական շարքի փոքր մոլեկուլային զանգվածով անդամները (հիմնականում մեթանը) պարունակվում են բնական գազում: Դրանք նաև նավթային գազերի հիմնական բաղադրամասերն են: Միջին և բարձր մոլեկուլային զանգվածով սահմանային ածխաջրածինների հսկայական քանակություն ամփոփված է տարբեր նավթերում: Այդպիսին են ԱՄՆ-ի նավթային պաշարները, իսկ Բաքվի նավթը աղքատ է ալկաններից: Բարձրամոլեկուլային հագեցած ածխաջրածինները բնական մոմերի հիմնական բաղադրամասն են:
Հայտնի են միլիոնավոր օրգանական նյութեր, որոնք կիրառվում են տնտեսության բազմազան բնագավառներում: Դրանցից մի մասը բնական միացությունների նմանակներ են և յուրացվում են օրգանիզմի կողմից` փոխազդելով ֆերմենտների և ճարպային հյուսվածքների հետ: Կան այնպիսի միացություններ, որոնք չեն յուրացվում օրգանիզմի կողմից, մետաբոլիզմի չեն ենթարկվում և խաթարում են նյութափոխանակային գործընթացը:
Այստեղ և այսուհետև կբերվեն օրգանական տարբեր դասերի միացությունների թունավորության վերաբերյալ կարևոր տվյալներ, որոնք գնահատում են դրանց ազդեցությունը մարդու և շրջակա միջավայրի վրա: Օրգանական միացությունների թունավորությունն ընդհանուր առմամբ կարելի է ներկայացնել հետևյալ դրույթներով.
ա) ուղիղ շղթայով ածխաջրածիններն ավելի թունավոր են, քան ճյուղավորվածները,
բ) թունավորությունը հոմոլոգիական շարքում աճում է ածխածնի ատոմների թվի ավելացմամբ (Ռիչարդսոնի կանոն),
գ) ցիկլային ածխաջրածիններն ավելի թունավոր են, քան ացիկլային նմանակները,
դ) հիդրօքսիլ խմբերի առկայությունը նվազեցնում է միացության թունավորության աստիճանը,
ե) հալոգենների կամ այլ քիմիապես ակտիվ խմբերի ներմուծումը օրգանական մոլեկուլ մեծացնում է թունավորությունը,
զ) ածխաջրածնային շղթայի չհագեցածությունը մեծացնում է թունավորությունը,
է) միացության թունավորությունը աճում է մաքրության աստիճանի նվազման և խառնուրդների առկայության դեպքում:
Սահմանային ածխաջրածինների կարևորագույն ներկայացուցիչը մեթանն է: Բնության մեջ մեթանը գոյացել և գոյանում է ցելյուլոզի կենսաքիմիական քայքայումից (մեթանային խմորում): Այն ստացվում է նաև գյուղատնտեսական և պարենային պինդ թափոնների խմորումից: Մի շարք երկրներ, օրինակ, Շվեյցարիան, իրենց գազի կարիքների մի մասը համալրում են այդ ճանապարհով:
Մեթանն
անհոտ, անգույն,
թույլ բոցով այրվող
գազ է: Մեթանի խառնուրդը
թթվածնի կամ օդի
հետ կայծի առկայությամբ
պայթում է, սակայն,
այն ավելի դժվար
այրվող է, քան ջրածինը
կամ այլ ածխաջրածիններ:
Մեթանը վատ է լուծվում
ջրում, ջրի հետ
առաջացնում է հիդրատ`![]()
Հետաքրքիր են մեթանի զանազան անվանումները: Այսպես, քանի որ մեթանը հանդիպում է քարածխային շերտերում, այն կոչվում է «հանքագազ»: Այն գոյանում է նաև ճահիճներում, հետևաբար, կոչվում է «ճահճագազ», նաև «փայտային գազ», քանզի առաջանում է փայտի չոր թորման, ինչպես նաև տորֆի և ածխի տաքացման ժամանակ (լուսագազ):
Մեթանի արդյունաբերական կիրառման բնագավառներն են.
ա) որպես հիմնական էներգակիր,
բ) մեթանոլի և մրջնալդեհիդի արտադրություն (ֆենոլ-ֆորմալդեհիդային խեժերի ստացում),
գ) ացետիլենի արտադրություն (դիենային ածխաջրածինների ստացում` պոլիմերների արտադրության համար),
դ) կապտաթթվի արտադրություն (ակրիլոնիտրիլ և արհեստական մանրաթելեր),
ե) մեթանի նիտրոածանցյալների ստացում` պայթուցիկ նյութեր,
զ) մեթանի քլոր և ֆտորածանցյալների ստացում (սառնագենտ ֆրեոնների արտադրություն),
է) ժամանակակից քսայուղերի, մասնավորապես, սիլիկոնների արտադրութուն:
Հագեցած ածխաջրածինները հիմնականում թունավոր չեն, մեթանից հեքսան ՍԹԿ-ն աշխատանքային գոտում 300 մգ/մ3 է և բարձրանում է մոլեկուլային զանգվածի աճի հետ: Մաշկի վրա հեղուկ պրոպանն ու բութանն առաջացնում են խոր այրվածքներ: Ածխաջրածիններն ազդում են նյարդային համակարգի վրա, գրգռում և թմրեցնում են շնչառական ուղիները:
Մեթանով թունավորումը պայմանավորված է թթվածնի անբավարարությամբ: Սուր թունավորման դեպքերը հազվադեպ են, հիմնականում տեղի են ունենում հանքահորերում: Թունավորման ժամանակ իջնում է օրգանիզմի արյան ճնշումը, առաջանում է ընդհանուր թուլություն, վատթարանում է սրտի գործունեությունը: Պրոպան-բութանային խառնուրդով ծանր թունավորվելու դեպքում ախտահարվում է նյարդային համակարգը, բորբոքվում է աչքի ցանցաթաղանթը: Հեքսանը թմրեցնում է վերին շնչառական ուղիները, առաջացնում է տևական թունավորում, որի հետևանքով փոփոխություններ են տեղի ունենում նյարդային համակարգում, աչքի կառուցվածքում, աղավաղվում է գունային ընկալումը:
9.4. Ստացման եղանակներ
Գոյություն ունեն ածխաջրածինների ստացման երեք ընդհանրացված եղանակներ`
ա) ելանյութերն ունեն նույն թվով ածխածնի ատոմներ, ինչ արգասիքները,
բ) ելանյութերն ունեն ավելի քիչ թվով ածխածնի ատոմներ, քան արգասիքները,
գ) ելանյութերն ունեն ավելի շատ թվով ածխածնի ատոմներ, քան արգասիքները:
9.4.1. Մինչև տասնմեկ ածխածնի ատոմ ունեցող ալկանները, հիմնականում, ստացվում են բնական գազի բաժանարար թորումով կամ նավթի բենզինային բաժնեմասից:
9.4.2. Արտադրությունում մեծ կիրառություն ունի Ni կամ Co կատալիզատորների ներկայությամբ ածխածնի օքսիդի հիդրոգենացումը ճնշման տակ, որի արդյունքում գոյանում է մեթան և ածխաջրածինների խառնուրդ.
![]()
Այս եղանակը կիրառվում է արհեստական հեղուկ վառելանյութի (սինտին) ստացման համար, որը փոխարինում է բենզինին:
Որպես կատալիզատոր կիրառվում են նաև կիզելգուրի մակերևույթին նստեցված կոբալտ կամ ThO2 և MgO, ինչպես նաև կոբալտից և երկաթից պատրաստված կատալիզատոր (Ֆիշեր-Տրոպշ). կատ
![]()
Կատալիզատորին տարբեր նյութեր ավելացնելով (ձևափոխելով), հնարավոր է կարգավորել ածխաջրածնային շղթայի երկարությունը և ճյուղավորված միացությունների թիվը:
9.4.3. Լաբորատոր պայմաններում պենտանից բարձր մոլեկուլային զանգվածով ածխաջրածիններն ստանում են էթիլենային կամ ացետիլենային ածխաջրածինների հիդրոգենացմամբ կատալիզատորների ներկայությամբ (փոշի, կոլոիդ կամ մանր դիսպերս վիճակում պլատին, պալադիում և նիկել).
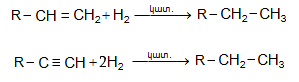
Գործընթացը
կատարվում է նորմալ
պայմաններում:
Արտադրությունում
կիրառվում է նաև
պղնձի քրոմիտ
(![]() ):
):
9.4.4. Հալոգենածանցյալների վերականգնում ջրածնով կատալիզատորների ներկայությամբ, ջրածնով անջատման պահին կամ վերականգնիչներով, ինչպիսին է յոդաջրածինը, որն ակտիվանում է կարմիր ֆոսֆորի ներկայությամբ.
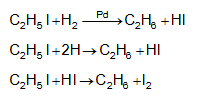
9.4.5. Մետաղօրգանական միացությունների հիդրոլիզ, որն ունի գործնական նշանակություն`
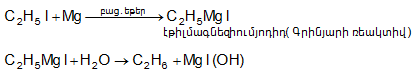
9.4.6. Վյուրցի սինթեզ. հալոգենածանցյալների փոխազդեցություն մետաղական նատրիումի հետ.
![]()
Մետաղական ցինկի ներկայությամբ (Ֆրանկլանդ) տարբեր հալոգենալկանների փոխազդեցության դեպքում ռեակցիայի արդյունքում ստացվում է ալկանների խառնուրդ.
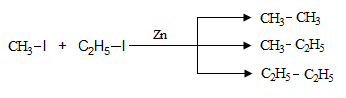
Այս գործընթացի ժամանակ բարձր ելքեր են ստացվում միայն առաջնային ալկիլհալոգենիդներից: Երկրորդային և երրորդային ալկիլհալոգենիդների դեպքում տեղի են ունենում կողմնակի ռեակցիաներ (հիմնականում հալոգենաջրածնի պոկում):
9.4.7. Հալոգենածանցյալների մշակում մետաղական լիթիումով: Ռեակցիան իրականացվում է եթերում` առաջանում է Li-օրգանական միացություն, որը պղնձի աղի ազդեցությամբ վերածվում է լիթիումալ-կիլկուպրատի: Վերջինս հետագայում փոխազդում է ալկիլհալոգենիդի հետ (Կորի-Հաուսի ռեակցիա):
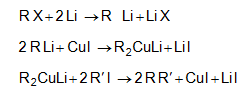
Առաջնային հալոգենածանցյալների դեպքում ելքը քանակական է, իսկ երկրորդային և երրորդային հալոգենիդների դեպքում 30 50% :
9.4.8. Կարբոնաթթուների աղերի ջրային լուծույթների էլեկտրոլիզ` թթուների անիոններն անոդի վրա լիցքաթափվում են ազատ ռադիկալների առաջացումով, որոնք միանում են, առաջացնելով ածխաջրածնի մոլեկուլներ (Կոլբեի ռեակցիա):
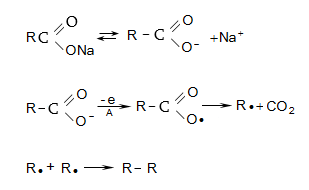
9.4.9. Օրգանական թթուների աղերի և ալկալիների ճեղքման (տրոհման) ռեակցիա` պիրոլիզ (մեթանի ստացման լաբորատոր եղանակ)
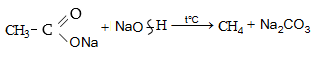
9.5. Քիմիական հատկություններ
Հագեցած ածխաջրածինները ցածր ռեակցիոնունակությամբ օրգանական միացություններ են, սակայն քիմիապես այնքան էլ իներտ չեն: Առավել չեզոք են մեթանն ու էթանը:
Սահմանային ածխաջրածինների համար բնորոշ են տեղակալման, օքսիդացման, ճեղքման (խզման) ռեակցիաները:
Ալկաններում C-C կապի խզման էներգիան (350 կՋ/մոլ) ավելի փոքր է, քան C-H կապի խզման էներգիան (413,7 կՋ/մոլ): Սակայն քիմիական ռեակցիաները հիմնականում ընթանում են C-H կապերի խզման արդյունքում, քանի որ վերջիններս տարածականորեն ավելի մատչելի են ռեագենտի հարձակման համար: C-C և C-H կապերի խզումն ազատ ռադիկալների գոյացումով պահանջում է ակտիվացման մեծ էներգիա: Սովորական պայմաններում նշված ռեակցիաներն ընթանում են միայն կատալիզատորի ներկայությամբ:
9.5.1. Տեղակալման ռեակցիաներ
Տեղակալման ռեակցիաները տեղի են ունենում ռադիկալային (SR) և իոնական (SE) մեխանիզմներով:
Տեղակալման ռեակցիաների ժամանակ տեղակալման դիրքը կամ տեղակալվող խմբի տեղն առաջին հերթին պայմանավորված է սուբստրատում հոմոլիտիկ խզումից առաջացած ռադիկալի կայունությամբ. երրորդային ռադիկալներն առավել կայուն են, քան երկրորդայինները, իսկ վերջիններս ավելի կայուն են առաջնային ռադիկալներից: Այս բնորոշումը համապատասխանում է առաջնային, երկրորդային և երրորդային ածխածնի ատոմների C-H կապերի խզման էներգիաներին.
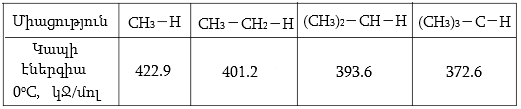
ՈՒսումնասիրությունները ցույց են տվել, որ երրորդային, երկրորդային և առաջնային ջրածնի ատոմների համեմատական ռեակցիոնունակությունը քլորի նկատմամբ սենյակային ջերմաստիճանում համապատասխանաբար կազմում է 5:4:1:
Վերը նշվածը պարզորոշ երևում է 2-մեթիլպրոպանի օրինակով: Մոլեկուլում առկա են ինը հատ առաջնային C-H կապեր և մեկ երրորդային C-H կապ: Եթե բոլոր ջրածիններն օժտված լինեին միևնույն ռեակցիոնունակությամբ, ապա պետք է սպասվեր 90% իզոբութիլքլորիդի և 10% երրբութիլքլորիդի գոյացում: Իրականում առաջանում է միայն 64% իզոբութիլքլորիդ և 36% երրբութիլքլորիդ, որը քլորի հարձակման արդյունքն է միակ երրորդային ածխածնի ատոմի վրա.
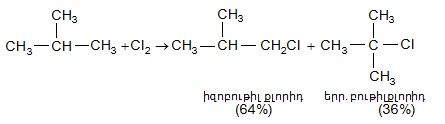
Բարձր ջերմաստիճանում (>450oC) քլորը ռեակցում է ոչ ընտրողաբար:
9.5.1.1. Հալոգենացում: Հալոգենները հեշտությամբ փոխազդում են հագեցած ածխաջրածինների հետ` առաջացնելով մոնո և պոլիհալոգենածանցյալներ: Հալոգենացման արագությունը կտրուկ նվազում է հետևյալ ուղղությամբ` F > CI > Br: Յոդը, որպես կանոն, ածխաջրածինների հետ չի փոխազդում: Ֆտորը ռեակցում է պայթյունով, տեղի է ունենում ածխաջրածնի քայքայում (կրեկինգ).
![]()
Ազոտի միջավայրում (իներտ գազ) կատարվում է ածխաջրածնի լրիվ ֆտորացում.
![]()
Գործնական նշանակություն ունեն քլորացումը և բրոմացումը:
Քլորը փոխազդում է միայն լույսի ազդեցությամբ, տաքացմամբ (3000C) կամ կատալիզատորի ներկայությամբ, ընդ որում` բոլոր ջրածինները հաջորդաբար տեղակալվում են քլորով: Առավել հեշտությամբ տեղակալում կատարվում է պակաս հիդրոգենացված ածխածնի մոտ: Ջերմային քլորացման դեպքում առաջանում են բոլոր հնարավոր մոնո և պոլիհալոգենածանցյալները: Մոնոհալոգենածանցյալների ստացման համար անհրաժեշտ է ածխաջրածնի մեծ ավելցուկ:
Քլորացման կատալիզատորներ են սուլֆուրիլքլորիդը, երրբութիլհիպոքլորիդը, դիքլորյոդբենզոլը: Թթվային միջավայրում օգտագործվում են պղնձի, անագի, ալյումինի քլորիդներ:
Ֆոտոքիմիական քլորացման բազմաթիվ աշխատանքների ուսումնասիրությամբ պարզաբանվել է ռեակցիայի շղթայական ռադիկալային մեխանիզմը (Ն.Ն. Սեմյոնով): Ռեակցիան կատարվում է երեք փուլով` հարուցում, շղթայի աճ և խզում: Ամենադանդաղ` ռեակցիայի արագությունը բնորոշող փուլը հարուցումն է, որը խթանվում է ուլտրամանուշակագույն ճառագայթներով, տաքացումով կամ հարուցիչով (ինիցիատոր):
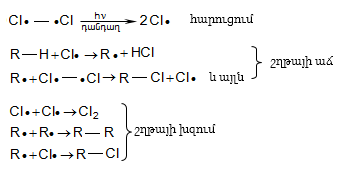
Կատալիզատորների ներկայությամբ քլորացման ռեակցիան ընթանում է շղթայական իոնական մեխանիզմով.
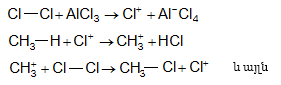
Բրոմացման մեխանիզմը նույնպես շղթայական ռադիկալային է, տեղի է ունենում առավել ընտրողաբար, քան քլորացումը`
9.5.1.2. ՍուլՖաքլորացում և սուլֆաօքսիդացում: Սովորական պայմաններում ծծմբական թթուն ալկանների վրա չի ազդում, տաքացման դեպքում գործում է որպես օքսիդիչ: Ծխացող ծծմբական թթուն բարձրամոլեկուլային ալկանների հետ առաջացնում է սուլֆաթթուներ.
Գործնական մեծ նշանակություն ունեն սուլֆաքլորացման և սուլֆօքսիդացման ռեակցիաները`
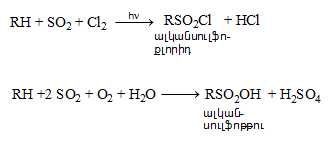
Այս ռեակցիաներն ընթանում են լույսի կամ հարուցիչների ազդեցությամբ: Բոլոր ածխաջրածինները սենյակային ջերմաստիճանում ենթարկվում են սուլֆաքլորացման: Ջրածնի ատոմի տեղակալումը սուլֆաքլորիդային խմբով ընտրողական է. հեշտ տեղակալվում է երկրորդային, ապա առաջնային ածխածնի ջրածինը: Երրորդային ածխածնի մոտ տեղակալում չի կատարվում, հավանաբար, տարածական դժվարության պատճառով: Որպես կողմնակի միացություն առաջանում են ալկիլհալոգենիդներ: Սուլֆաքլորացման մեխանիզմը ռադիկալային է (SR).
Ռեակցիայի արդյունքը մշակվում է սոդայով կամ սիլիկատներով, փոխարկվում է սուլֆաթթուների աղերի, որոնք մակերևութային ակտիվ նյութեր են և օգտագործվում են լվացող նյութերի արտադրությունում:
![]()
Սուլֆօքսիդացումը տեղի է ունենում SR մեխանիզմով.
9.5.1.3. Նիտրացում: Խիտ ազոտական թթվով կամ ազոտական և ծծմբական թթուների խառնուրդով ալկաններն օքսիդանում են: Նիտրացում կատարվում է ազոտական թթվով կամ ազոտի դիօքսիդով գազային ֆազում տաքացնելիս (Մ. Ի. Կոնովալով): Բոլոր ածխաջրածինները ենթարկվում են հեղուկային ֆազի նիտրացման ռեակցիայի, բայց ելքերը ցածր են, քանի որ գործընթացն ուղեկցվում է պոլինիտրացման և օքսիդացման ռեակցիաներով:
Արտադրությունում մեծ կիրառություն ունի գազաֆազ նիտրացումը ազոտական թթվի գոլորշիներով 250...5000C: Ջերմաստիճանի ընտրությունը պայմանավորված է ածխաջրածնի կառուցվածքով.
![]()
Ռեակցիան ուղեկցվում է ածխաջրածնի կրեկինգով` ստացվում է նիտրոալկանների խառնուրդ: Թթվի միայն 40%-ն է մասնակցում նիտրացման ռեակցիային, մնացած մասը ծախսվում է որպես օքսիդիչ: Նիտրացմանը զուգընթաց կատարվում է ածխածնային շղթայի ճեղքում. առաջանում են ցածրամոլեկուլային նիտրոմիացություններ:
Պրոպանի նիտրացման արդյունքում ստացվում են հետևյալ նիտրոմիացությունները.
![]()
Ռեակցիան ռադիկալային է` SR, որի առաջին փուլն ազոտի դիօքսիդի փոխազդեցությունն է ածխաջրածնի հետ: Դիօքսիդը գտնվում է ազոտական թթվում, այն կարող է առաջանալ նաև ազոտական թթվից ածխաջրածնի օքսիդացման ժամանակ: Նիտրացման գործընթացում նիտրոմիացություններին զուգընթաց ստացվում են նաև իզոմեր ազոտային թթվի եթերներ.
Արտադրությունում նիտրոմիացություններ ստանում են 50 70-ոց ազոտական թթվով 400 700օC-ում:
9.5.2. Օքսիդացում
Օդի թթվածնով և սովորական օքսիդիչներով (KMnO4, K2Cr2O7, K2Cr2O4 և այլն) ալկաններն օքսիդանում են միայն բարձր ջերմաստիճանում` ածխածնային շղթայի խզումով (կրեկինգ), հիմնականում գոյանում են օրգանական թթուներ:
Մեծ կիրառություն ունի բարձրամոլեկուլային ալկանների օքսիդացումը ճարպային թթուների ստացման համար (օճառի արտադրություն): Օքսիդացումը կատարվում է ~1500Cում մանգանի միացությունների ներկայությամբ: Ռեակցիայի արդյունքում ստացվում են զանազան թթուներ, օքսիթթուներ, կետոթթուներ, բարդ եթերներ, սպիրտներ, կետոններ և այլն:
Սահմանային ածխաջրածինների օքսիդացման գործընթացում որպես միջանկյալ միացություն գոյանում են օրգանական հիդրոպերօքսիդներ: Բարձր ջերմաստիճանում ածխաջրածինը ենթարկվում է խզման` ազատ ռադիկալների գոյացումով, որոնք միացնում են մոլեկուլային թթվածին: Առաջացած պերօքսիդային ռադիկալը ջրածնի ատոմ է պոկում ածխաջրածնի մոլեկուլից` վերածվելով հիդրոպերօքսիդի:
Մեխանիզմ.
![]()
Հիդրոպերօքսիդները
խզվում են O-O պերօքսիդային
կապից` առաջացնելով
ազատ ռադիկալներ,
որոնք ջրածնի ատոմ
են պոկում այլ
մոլեկուլից կամ
մասնիկից` առաջացնելով
սպիրտ կամ խզվում
են ![]() կապից`
առաջացնելով ալդեհիդ
կամ կետոն: R-O-O-H հիդրոպերօքսիդի
կառուցվածքից
կախված` ռեակցիայի
արդյունքում ստացվում
են տարբեր միացություններ:
կապից`
առաջացնելով ալդեհիդ
կամ կետոն: R-O-O-H հիդրոպերօքսիդի
կառուցվածքից
կախված` ռեակցիայի
արդյունքում ստացվում
են տարբեր միացություններ:
Երրորդային ալկիլհիդրոպերօքսիդների հետագա փոխարկումը կատարվում է հետևյալ ձևով.
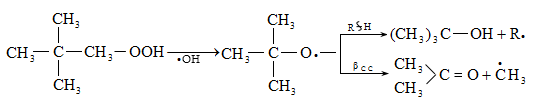
Երկրորդային ալկիլհիդրոպերօքսիդները փոխարկվում են սպիրտների, ալդեհիդների, կետոնների հետևյալ սխեմայով.
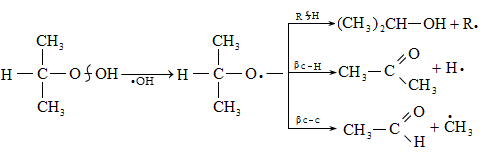
Բարձր ջերմաստիճանում գերակշռում են սպիրտները և ալդեհիդները:
Առաջնային ալկիլհիդրոպերօքսիդների փոխարկումներն են.
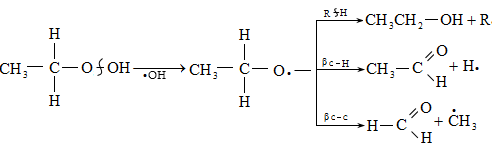
Սպիրտների և ալդեհիդների հետագա օքսիդացումը հանգեցնում է թթուների գոյացման:
9.5.3. Կրեկինգ
Հագեցած ածխաջրածինները 4500C-ից բարձր ջերմաստիճանում ենթարկվում են ջերմային քայքայման: Արդյունաբերական նշանակություն ունի թեթև նավթային բաժնեմասի պիրոլիզը էթիլենի ստացման համար: Կիրառվում է նաև կատալիզային կրեկինգ, որը ծառայում է ծանր նավթային բաժնեմասերից բարձր օկտանային թվով բենզինների ստացման համար: Ալկանները 10000Cից բարձր ջերմաստիճանում ճեղքվում են ածխածնի և ջրածնի (ջրածնի և գազային մրի ստացման եղանակ): Կրեկինգի ջերմաստիճանը կախված է նյութի մոլեկուլային զանգվածից և կառուցվածքից: 300 7000C-ում առաջանում են հագեցած, չհագեցած և արոմատիկ ածխաջրածիններ: Ինչքան բարձր է ջերմաստիճանը, այնքան մեծ է փոխարկման խորությունը:
Կրեկինգի ժամանակ հիմնականում տեղի են ունենում դեհիդրոգե-նացում և ածխածնային շղթայի խզում, ինչպես նաև իզոմերացում և ցիկլացում: Գոյանում են միջանկյալ ալիֆատիկ ածխաջրածնային ռադիկալներ, որոնք ենթարկվում են հետևյալ փոխարկումների.
ա) ճեղքում.
![]()
բ) անհամամասնում.
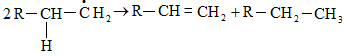
գ) միացում (վերադասավորում).
![]()
Հիմնականում կատարվում են (ա) և (բ) գործընթացները:
Բութիլ ռադիկալի փոխարկումներն են`
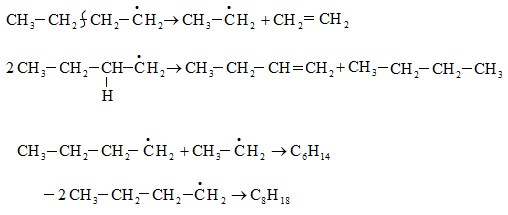
Խնդիրներ
1. Հետևյալ ածխաջրածիններն անվանել ռացիոնալ և IUPAC անվանակարգումով.
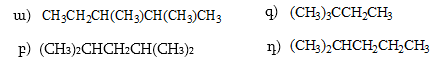
2. Գրել C4H10, C5H12, C6H14 ընդհանուր բանաձևով ածխաջրածինների իզոմերները:
3. Գրել C3H7-, C4H9-, C5H11- ռադիկալների իզոմերները և կարդալ` նշելով առաջնային, երկրորդային, երրորդային ռադիկալները:
4. Գրել հետևյալ ալկիլ ռադիկալների կառուցվածքը` իզոպրոպիլ, իզոբութիլ, իզոպենտիլ:
5. Ստանալ 2-մեթիլպենտան համապատասխան էթիլենային և ացետիլենային ածխաջրածիններից:
6. Կարբոնաթթուների աղերից ստանալ 2,3-դիմեթիլբութան /երկու եղանակով/: Քննարկել Կոլբեի ռեակցիայի մեխանիզմը:
7. Ստանալ ածխաջրածիններ` ազդելով մետաղական նատրիումով հետևյալ հալոգենածանցյալների վրա.
ա) իզոպրոպիլբրոմիդ և երրբութիլբրոմիդ,
բ) պրոպիլբրոմիդ և իզոբութիլբրոմիդ,
գ) էթիլյոդիդ և երկր.բութիլյոդիդ,
դ) մեթիլյոդիդ և իզոպրոպիլյոդիդ,
ե) պրոպիլբրոմիդ և երրբութիլբրոմիդ,
զ) էթիլբրոմիդ և իզոբութիլբրոմիդ:
8. Ինչպիսի՞ կառուցվածք ունի կարբոնաթթուն, որի աղի ջրային լուծույթի էլեկտրոլիզով ստացվում է C10H22 ածխաջրածին, իսկ աղի և NaOH-ի միահալումով առաջանում է 2,2-դիմեթիլպրոպան:
9. Ինչպիսի՞ մոնոքլորածանցյալներ են ստացվում իզոպենտանի քլորացման արդյունքում: Քննարկել ռեակցիայի մեխանիզմը և որոշել հիմնական ուղղությունը:
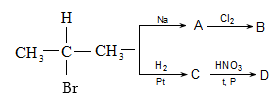
10. Իրականացնել հետևյալ փոխարկումները.
11. Ինչպիսի՞ կառուցվածք ունի C5H12 բաղադրությամբ ածխաջրածինը, որի օքսիդացումից ստացվում է երրորդային սպիրտ, իսկ նիտրացումից` երրորդային նիտրոալկան:
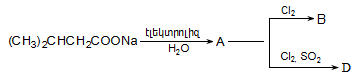
12. Իրականացնել հետևյալ փոխարկումները.
13. Որոշել C8H18 ածխաջրածնի կառուցվածքը, եթե այն ստացվում է առաջնային ալկիլհալոգենիդից որպես միակ արգասիք, և որի նիտրացումից առաջանում է երրորդային նիտրոմիացություն:
14. Երեք տարբեր ալկենների հիդրոգենացումով (կատալիզատորի ներկայությամբ) ստացվում է 2-մեթիլբութան: Գրել ալկենների կառուցվածքային բանաձևերը:
15. C5H12 բանաձևով ալկանն ստացվում է չորս տարբեր պենտիլքլորիդները մշակելով ցինկով` թթվային միջավայրում: Գրել C5H12 ալկանի և ալկիլքլորիդների կառուցվածքը:
16. 20% ջրածնից և 80% ածխածնից բաղկացած գազային նյութի այրումից առաջացած 5,6 լ գազը, որի հարաբերական խտությունն ըստ ջրածնի 15 է, անցկացվում է լուծույթով, որն առաջացել է մետաղի փոխազդեցությամբ ջրի հետ: Որոշել առաջացած աղի զանգվածը և բաղադրությունը, եթե հայտնի է, որ 20 գ այդ մետաղի և ջրի փոխազդեցությամբ առաջանում է երկվալենտ մետաղի հիդրօքսիդ և անջատվում է 11,2 գ գազ:
17. 41 գ անջուր նատրիումի ացետատի և ավելցուկ նատրիումի հիդրօքսիդի խառնուրդը շիկացվել է: Անջատված գազը լույսի ազդեցությամբ փոխազդել է քլորի հետ, որի հետևանքով առաջացել է 50% ելքով տետրաքլորմեթան: Հաշվել ստացված տետրաքլորմեթանի զանգվածը:
18. 0,1 մոլ հագեցած ածխաջրածնի լրիվ այրումից առաջացած ածխածնի օքսիդը (IV) անցկացվել է ավելցուկ կրաջրի միջով, ստացվել է 60 գ նստվածք: Պարզել ածխաջրածնի մոլեկուլային բանաձևը և կառուցվածքը, եթե այն պարունակում է մեկ չորրորդային ածխածնի ատոմ:
19. Բութանի և բութենի խառնուրդի հիդրոգենացման արդյունքում կատալիզատորի ներկայությամբ առաջացել է 22,4 լ բութան: Պարզել խառնուրդում գազերի բաղադրությունը (ծավալային %) և կառուցվածքը, եթե հայտնի է, որ բութենի հիդրատացումով առաջանում է 37 գ սպիրտ, որը կազմում է տեսական ելքի 74%-ը: Ո՞րն է այդ սպիրտը:
20. 7,2 գ օրգանական նյութի (խտությունն ըստ ջրածնի 36 է) այրումից առաջանում են 22 գ ածխածնի օքսիդ (IV) և 10,8 գ ջուր: Որոշել ելանյութի կառուցվածքը, եթե դրա ռադիկալային քլորացման արդյունքում ստացվում է միայն մեկ մոնոքլորածանցյալ:
21. Միևնույն թվով ածխածնի ատոմ ունեցող հագեցած և չհագեցած գազային ածխաջրածինների համարժեք քանակների խառնուրդը գունազրկում է 80 գ 20%-ոց բրոմի լուծույթը տետրաքլորածխածնում: Նույն զանգվածով խառնուրդի այրումից առաջանում է 134,4 լ ածխաթթու գազ: Պարզել ածխաջրածինների բաղադրությունը և կառուցվածքը:
22. Գրել հետևյալ ածխաջրածինների կառուցվածքային բանաձևերը. էթիլերկրբութիլմեթան, դիմեթիլդիերրբութիլմեթան, մեթիլիզոպրոպիլ-իզոբութիլմեթան, տրիմեթիլիզոպրոպիլմեթան, դիիզոպրոպիլմեթան, պրոպիլերկրբութիլմեթան:
23. Գրել C9H20 բաղադրությամբ ածխաջրածնի այն իզոմերները, որոնք գլխավոր շղթայում ունեն ածխածնի հինգ ատոմ:
24. Գրել հետևյալ ածխաջրածինների կառուցվածքային բանաձևերը. 3-մեթիլ-3-էթիլհեպտան, 3-մեթիլ-4-էթիլհեքսան, 2,4,6-տրիմեթիլ-3,5-դիէթիլհեպտան, 2,5-դիմեթիլհեքսան, 2,2,3-տրիմեթիլ-3-էթիլօկտան:
25. Գրել C8H18 ածխաջրածնի ամենաշատ մեթիլ խումբ ունեցող իզոմերի կառուցվածքային բանաձևը: Կարդալ ռացիոնալ և IUPAC անվանակարգումով:
26. Կարբոնաթթուների աղերից ստանալ 2,4-դիմեթիլհեքսան, 2,2-դիմեթիլբութան, 3,4-դիմեթիլհեքսան /երկու եղանակով/:
27. Ինչպիսի՞ էթիլենային ածխաջրածինների հիդրոգենացման ռեակցիայով կարելի է ստանալ 2-մեթիլպենտան, 2,2,4-տիմեթիլպենտան:
28. Ո՞ր ալկանները կստացվեն հետևյալ հալոգենածանցյալների վերականգնումով.

29. Ինչպիսի՞ ալկաններ կստացվեն պրոպիոնաթթվի, կարագաթթվի, իզոկարագաթթվի նատրիումական աղի ջրային լուծույթի էլեկտրոլիզով:
30. Իզոբութիլբրոմիդից ստանալ ալկան.

31. Վյուրցի ռեակցիայով ստանալ.

32. Ալկանների բոլոր ստացման եղանակներով ստանալ.

33. 2,2,3-տրիմեթիլպենտանի քլորացման ժամանակ ի՞նչ մոնոքլորածանցյալներ են ստացվում: Քննարկել ռեակցիայի մեխանիզմը և ցույց տալ գործընթացի հիմնական ուղղությունը:
34. Նշել 2-մեթիլբութանի քլորացման ժամանակ առաջացող հնարավոր միջանկյալ ռադիկալները և բացատրել դրանց կայունությունը: Ո՞րը կլինի ռեակցիայի հիմնական ուղղությունը:
35. Բերել 3-էթիլհեքսանի նիտրացման (Կոնովալով) և օդի թթվածնով օքսիդացման ռեակցիաների մեխանիզմները:
36. Իզոօկտանի (CH3)2CHCH2C(CH3)3 կրեկինգից ի՞նչ արգասիքներ են ստացվում:
37. Իրականացնել հետևյալ փոխարկումները.
10. ԱԼԿԵՆՆԵՐ
(ՕԼԵՖԻՆՆԵՐ, ԷԹԻԼԵՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐ)
Ալկեններն այն ածխաջրածիններն են, որոնց կազմում կա մեկ կրկնակի կապ: Ընդհանուր բանաձևն է CnH2n: Հաճախ կոչվում են օլեֆիններ կամ էթիլենային շարքի ածխաջրածիններ` հոմոլոգիական շարքի առաջին անդամ` էթիլենի (CH2 = CH2) անունով:
10.1. Անվանակարգում, իզոմերիա
Ալկենները նախկինում անվանվում էին ալկիլ մնացորդին (ռադիկալին) կցելով «իլեն» վերջավորությունը: Այսպիսի անվանակարգումը պահպանվել է ցածրամոլեկուլային ածխաջրածինների համար` օրինակ, էթիլեն, պրոպիլեն և այլն:
Ալկենները IUPAC կամ Ժնևյան անվանակարգումով կարդացվում են համապատասխան ալկանի ան վերջավորությունը փոխարինելով ենով` նշելով կրկնակի կապի դիրքը ածխածնային շղթայում: Որպես գլխավոր ածխածնային շղթա ընդունվում է կրկնակի կապ պարունակող ամենաերկար շղթան: Համարակալումը կատարվում է շղթայի այն ծայրից, որին մոտ է կրկնակի կապը:

Չհագեցած ածխաջրածինների ռադիկալներն անվանվում են IUPAC-ով անվանակարգված ածխաջրածնի արմատին ավելացնելով ենիլ վերջավորությունը:

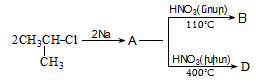
Ալկենների կառուցվածքային իզոմերիան պայմանավորված է ածխածնային կմախքի կառուցվածքով և կրկնակի կապի դիրքով: Այս միացություններին բնորոշ է նաև տարածական (երկրաչափական) իզո-մերիա` ցիս-տրանս: Ցիս-իզոմերներն ունեն որոշակի (մասնավոր դեպքում` միանման) խմբեր կամ ատոմներ կրկնակի կապի մի ուղղությամբ, իսկ տրանս-իզոմերներում այդ խմբերը տեղաբաշխվում են կրկնակի կապի հարթության տարբեր ուղղություններով:
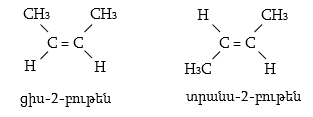
Ցիս-տրանս
իզոմերիայի առկայությունն
ալկեններում պայմանավորված
է նրանով, որ ![]() արգելակում
է ազատ պտույտը
արգելակում
է ազատ պտույտը
![]() շուրջը:
Մի երկրաչափական
իզոմերի անցումը
մյուսին հնարավոր
է միայն բարձր
ջերմաստիճանում
կամ կատալիզատորի
ներկայությամբ,
երբ
շուրջը:
Մի երկրաչափական
իզոմերի անցումը
մյուսին հնարավոր
է միայն բարձր
ջերմաստիճանում
կամ կատալիզատորի
ներկայությամբ,
երբ ![]() թուլանում
է:
թուլանում
է:
10.2. Ֆիզիկական հատկություններ
Առաջին երեք անդամները (էթիլեն, պրոպիլեն, բութիլեն) գազեր են, C4-C17` անգույն հեղուկ, ապա` պինդ նյութեր: Ուղիղ շղթայով ալկեններն ավելի բարձր եռման ջերմաստիճան ունեն, քան` ճյուղավորված իզոմերները: Կրկնակի կապի տեղաշարժը դեպի կենտրոն բարձրացնում է ալկենի եռման և հալման ջերմաստիճանները: Ալկենների ցիս-իզոմերներն ունեն ավելի բարձր եռման և ավելի ցածր հալման ջերմաստիճաններ, քան` տրանս-իզոմերները: Օդի հետ ցածր կոնցենտրացիաներում ալկեններն ինքնաբռնկվող և պայթյունավտանգ են:
Ալկենների խտությունը փոքր է մեկից, բայց ավելի մեծ, քան համապատասխան ալկանների խտությունը, ունեն ավելի մեծ լույսի բեկման ցուցիչ, քան ալկանները: Ջրում վատ են լուծվում, սակայն լավ են լուծվում որոշ ծանր մետաղների աղերի լուծույթներում` առաջացնելով կոմպլեքս միացություններ:
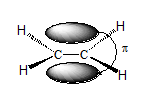
Ածխածնի
ատոմները -C
=
C-
կրկնակի կապում
գտնվում են sp2
հիբրիդային վիճակում:
Հիբրիդային օրբիտալներն
առաջացնում են
երեքական ![]() 1200
անկյան տակ` C-C և
C-H կապերի միջև միևնույն
հարթության մեջ:
Մոլեկուլի հարթությանն
ուղղահայաց հարթության
մեջ չհիբրիդացված
p օրբիտալները
վերածածկվում
են` առաջացնելով
1200
անկյան տակ` C-C և
C-H կապերի միջև միևնույն
հարթության մեջ:
Մոլեկուլի հարթությանն
ուղղահայաց հարթության
մեջ չհիբրիդացված
p օրբիտալները
վերածածկվում
են` առաջացնելով
![]() Կրկնակի
կապի
Կրկնակի
կապի ![]() ամպերը տեղաբաշխվում
են մոլեկուլի հարթության
վերևում և ներքևում:
Համեմատելով
ալկանների և ալկենների
կառուցվածքային
և էներգետիկական
բնութագրերը, երևում
է, որ կրկնակի կապն
ավելի կարճ է և
ամուր, քան
ամպերը տեղաբաշխվում
են մոլեկուլի հարթության
վերևում և ներքևում:
Համեմատելով
ալկանների և ալկենների
կառուցվածքային
և էներգետիկական
բնութագրերը, երևում
է, որ կրկնակի կապն
ավելի կարճ է և
ամուր, քան ![]()

Կրկնակի
կապի էներգիան
92,1 կՋ/մոլով փոքր
է երկու ![]() էներգիայից,
հետևաբար այն հեշտ
փոխարկվում է երկու
էներգիայից,
հետևաբար այն հեշտ
փոխարկվում է երկու
![]() միացնելով
երկու ատոմ կամ
ատոմային խմբեր:
միացնելով
երկու ատոմ կամ
ատոմային խմբեր:
Ալկեններին
բնորոշ են նաև
տեղակալման ռեակցիաներ.
կրկնակի կապի նկատմամբ
![]() հիբրիդային
ածխածնին կից ջրածինները
տեղակալվում են
ավելի հեշտ, քան
ալկաններում` շնորհիվ
հիբրիդային
ածխածնին կից ջրածինները
տեղակալվում են
ավելի հեշտ, քան
ալկաններում` շնորհիվ
![]() զուգորդման:
զուգորդման:
Ալկեններն ԻԿ սպեկտրում ունեն վինիլային խմբի վալենտային տատանումներ` 1650 սմ-1 մարզում, CH2 = C = խմբավորման կլանումները` 890 և 1660 սմ-1 տիրույթում է, իսկ կրկնակի կապ առաջացնող ածխածինների բնութագրական C-H կապերի տատանումների տիրույթը` 670 սմ-1 (ցիս-իզոմերի համար) և 920 ու 980 սմ-1 (տրանսի համար): Կրկնակի կապին կից C-H կապերի վալենտային տատանումների տիրույթը` 3100 3000 սմ-1 է: Սպեկտրի ՈՒՄ մասում կլանվում են 180 200 նմ ալիքների մարզում: ՄՄՌ սպեկտրները նույնպես բնորոշ են ալկեններին: Կրկնակի կապի պրոտոնները շեղում են տալիս մոտ 4,5 6 մկմ ավելի թույլ դաշտում, քան հագեցած ածխածնի ատոմին կից պրոտոնները:
Բնության մեջ ալկենները տարածված չեն, հիմնականում հանդիպում են նավթում: Էթիլենը բնության մեջ գործնականում չի հանդիպում, ունի ֆիտոհորմոնների` բույսերի կողմից արտադրվող ցածրամոլեկուլային օրգանական միացությունների, հատկություն: Ալկեններ են գոյանում օրգանական միացությունների հրածնային քայքայման ժամանակ:
10.3. Կիրառման բնագավառներ, թունավորություն
Ալկենները լայնորեն կիրառվում են պոլիմերների արտադրությունում` պոլիէթիլենային, էթիլեն-պրոպիլենային, պրոպիլենային կաուչուկների, էպօքսիդային, ակրիլոնիտրիլային և այլ տեսակի պոլիմերների ստացման համար: Լայն կիրառություն ունեն օրգանական սինթեզի տեխնոլոգիաներում բազմաթիվ նյութերի ստացման համար: Էթիլենից ստանում են էթիլսպիրտ, էթիլենգլիկոլ, քացախաթթու, քացախալդեհիդ, դիքլորէթան և այլն, պրոպիլենից` իզոպրոպիլսպիրտ, ակրոլեին, ակրիլոնիտրիլ, քլորհիդրին, գլիցերին, իզոպրոպիլբենզոլ: ՈՒղիղ շղթայով բութիլեններից և իզոպենտենից (մեթիլբութեն) ստանում են համապատասխանաբար բութադիեն և իզոպրեն` հետագա պոլիմերային փոխարկումների համար:
Էթիլենի համաշխարհային արտադրությունը կազմում է 57 մլն տոննա/տարի (1998թ.), պրոպիլենինը` 25,5 մլն տոննա/տարի (2001թ.): Ընդհանուր առմամբ ալկենների համաշխարհային արտադրությունը 2002 թվականին կազմել է 83 միլիոն տոննա:
Ալկեններն առավել թունավոր են, քան համապատասխան ալկանները: Էթիլենի ՍԹԿ-ն մթնոլորտում կազմում է 3 մգ/մ3, աշխատանքային գոտում` 100 մգ/մ3: Պրոպիլենի ՍԹԿ-ն աշխատանքային գոտում կազմում է 30 մգ/մ3, իսկ բութեններինը և պենտեններինը` 50 մգ/մ3: Պենտենները (ամիլենները) գրգռում են լորձաթաղանթը և շնչառական ուղիները, ունեն թույլ թմրեցնող և ցավազրկող հատկություն: Բութեններում այդ հայտանիշներն ավելի քիչ են ընդգծված:
10.4. Ստացման եղանակներ
Արդյունաբերական մասշտաբներով ալկեններն ստանում են, հիմնականում, նավթամթերքների և բնական գազի քայքայման գործընթացում (կրեկինգ և պիրոլիզ): Նավթի կրեկինգի արդյունքում ստացվում են հոմոլոգիական շարքի առաջին չորս անդամները (750...900oC) ճնշման տակ` բաժանարար թորմամբ: Որոշ ալկեններ տեխնիկական նպատակների համար ունեն մեծ պահանջարկ: Արդյունաբերությունում կիրառվում են դրանց ստացման մի շարք եղանակներ:
10.4.1.Հագեցած ածխաջրածինների կատալիզային դեհիդրոգենացում
Որպես կատալիզատոր օգտագործվում է հատուկ պատրաստված քրոմի օքսիդ (քրոմային կոնտակտ).
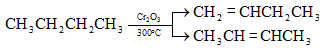
10.4.2. Սպիրտների դեհիդրատացում
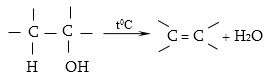
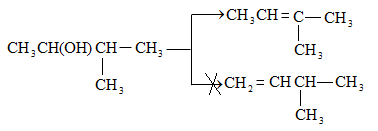
Ռեակցիան տարվում է թթուների (ծծմբական, ֆոսֆորական) կամ ջուր խլող միջոցների (Al2O3, ThO2, P2O5, ալյումինի աղեր) ներկայությամբ: Ռեակցիայի պայմանները պայմանավորված են սպիրտի կառուցվածքով: Առավել հեշտ դեհիդրատանում են երրորդային, ապա երկրորդային, առաջնային սպիրտները: Ջրի պոկումը սպիրտի մոլեկուլից բնորոշվում է Զայցևի կանոնով` ջրածնի ատոմը պոկվում է պակաս հիդրոգենացված ածխածնի ատոմից: Երկու հնարավոր ալկեններից առաջանում է ավելի ճյուղավորված, այսինքն` թերմոդինամիկորեն առավել կայուն մոլեկուլը.
Գործընթացի կարևորությունը և քիմիական հետաքրքրությունն ակնկալում են մեխանիզմի քննարկում: Նման ռեակցիաները, կախված սուբստրատի կառուցվածքից և ռեակցիայի պայմաններից, իրականանում են մոնոմոլեկուլային (E1) կամ բիմոլեկուլային (E2) մեխանիզմով: E1 և E2 ռեակցիաներն ընթանում են թթուների ներկայությամբ: Քննարկենք երրորդային սպիրտի E1 պոկման մեխանիզմը:
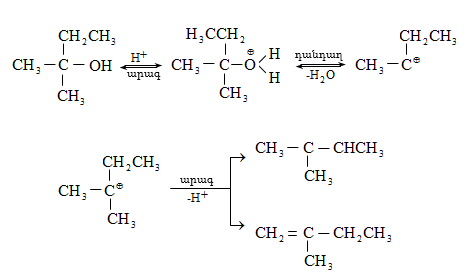
Փոխազդեցության
սկզբում առաջանում
է հիդրօքսոնիում
կատիոն, որը նպաստում
է C-O կապի հետերոլիտիկ
խզմանը, առաջանում
է կարբկատիոն
(դանդաղ փուլ), որը
կայունանում է
![]() ջրածնի
պրոտոնացմամբ`
համապատասխան
ալկենի առաջացումով:
Ռեակցիայի ուղղությունը
պայմանավորված
է թերմոդինամիկական
գործոնով` գոյանում
է առավել կայուն,
ճյուղավորված
ալկենը: Գործընթացում
երբեմն տեղի է
ունենում կրկնակի
կապի տեղաշարժ
(ածխածնային շղթայի
իզոմերացում),
և ստացված ալկենի
կառուցվածքը չի
համապատասխանում
ելանյութի կառուցվածքին:
Այսպես, իզոամիլ
սպիրտի դեհիդրատացումից
ստացվում է երեք
ալկենի խառնուրդ.
ջրածնի
պրոտոնացմամբ`
համապատասխան
ալկենի առաջացումով:
Ռեակցիայի ուղղությունը
պայմանավորված
է թերմոդինամիկական
գործոնով` գոյանում
է առավել կայուն,
ճյուղավորված
ալկենը: Գործընթացում
երբեմն տեղի է
ունենում կրկնակի
կապի տեղաշարժ
(ածխածնային շղթայի
իզոմերացում),
և ստացված ալկենի
կառուցվածքը չի
համապատասխանում
ելանյութի կառուցվածքին:
Այսպես, իզոամիլ
սպիրտի դեհիդրատացումից
ստացվում է երեք
ալկենի խառնուրդ.
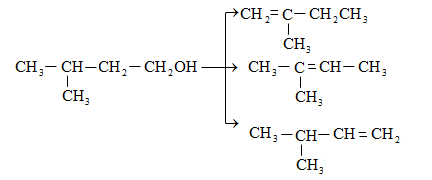
Այս երևույթը բացատրվում է անիոնոտրոպ վերախմբավորումով (վերախմբավորում հիդրիդային տեղաշարժով): Դանդաղ փուլում գոյացող կարբոնիում կատիոնի հետագա կայունացումն առաջնայինից երկրորդայինի, ապա` երրորդայինի, բերում է վերախմբավորման արգասիքների առաջացման.
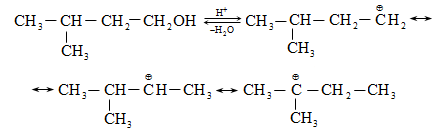
10.4.3. Հալոգենածանցյալների դեհիդրոհալոգենացում
Ռեակցիան իրականացվում է KOHի կամ NaOHի սպիրտային լուծույթում տաքացմամբ (տես «Ածխաջրածինների հալոգենածանցյալներ»).
![]()
Տեղի է ունենում նաև կողմնակի գործընթաց` պարզ եթերի գոյացում.
Նպատակահարմար է դեհիդրոհալոգենացում կատարել փոշի ալկալու կամ օրգանական հիմքերի (դիմեթիլանիլին կամ խինոլին) օգնությամբ, քանի որ այս պայմաններում կանխվում է կողմնակի ռեակցիան:
Դեհիդրոհալոգենացման ուղղությունը համապատասխանում է Զայցևի կանոնին.
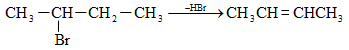
10.4.4. Վիցինալ դիհալոգենածանցյալներից հալոգենի մոլեկուլի պոկում
Նախկինում կիրառվում էր ջրասպիրտային միջավայրում լուծված ցինկի փոշի կամ ցինկի խարտվածք: Ալկենը ցինկի հալոգենիդի ներկայությամբ ենթարկվում է իզոմերացման, և բարդություն է ստեղծվում արգասիքների հետագա անջատնան համար, այդ պատճառով որպես դեհալոգենացման ռեագենտներ կիրառում են նատրիումի յոդիդ մեթանոլում կամ ացետոնում, քրոմի (II) աղեր, նատրիումի թիոսուլֆատ դիմեթիլսուլֆօքսիդում, լիթիումալյումինհիդրիդ (LiAIH4)
10.4.5. Ալկինների հիդրոգենացում
Ալկեններն ստացվում են նաև ալկինների մասնակի կատալիզային ընտրողական հիդրումով. որպես կատալիզատոր օգտագործվում է իզոխինոլինով թունավորված պալադիում (հետագա հիդրոգենացումը կանխելու նպատակով).
![]()
10.4.6. Չորրորդային ամոնիումային միացությունների ճեղքում
Ալկեններ (հատկապես ծայրային կրկնակի կապով) կարելի է ստանալ չորրորդային ամոնիումային աղերի ջերմային կամ ջրահիմնային ճեղքումով (Հոֆման), ինչպես նաև ֆոսֆոնիումային, սուլֆոնիումային աղերի նմանօրինակ փոխակերպմամբ կամ Ֆիտիգի ռեակցիայով:
Հոֆմանի ռեակցիա.
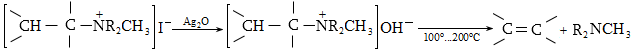
Ֆիտիգի ռեակցիա
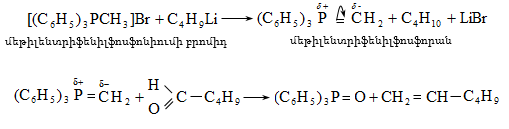
10.5. Քիմիական հատկություններ
Ալկենների քիմիական հատկությունները գերազանցապես բնորոշվում են ածխածին-ածխածին կրկնակի կապի փոխակերպումներով: Կրկնակի կապը ցուցաբերում է քիմիական մեծ խնամակցություն այն ռեագենտների նկատմամբ, որոնք բևեռացնում են կրկնակի կապը դեպի ածխածիններից մեկը և օժտված են էլեկտրոֆիլ հատկություններով: Ալկենների համար բնորոշ են միացման ռեակցիաներ, հիմնականում շարժուն ջրածին պարունակող տարբեր միացությունների հետ: Դրանք ենթարկվում են նաև օքսիդացման և պոլիմերացման: Կրկնակի կապի ![]() 73 կՋ/մոլ-ով ամուր է
73 կՋ/մոլ-ով ամուր է ![]() հետևաբար` քիմիական փոխարկումներում հեշտությամբ խզվում է
հետևաբար` քիմիական փոխարկումներում հեշտությամբ խզվում է ![]()
10.5.1. Միացման ռեակցիաներ
Կրկնակի կապը միացման ռեակցիաներում հանդես է գալիս որպես էլեկտրոնադոնոր: Ալկեններին բնորոշ են էլեկտրոֆիլ միացման ռեակցիաները (AdE), որոնք իրականացվում են բիմոլեկուլային մեխանիզմով` կարբկատիոնի կամ կամրջակային իոնների գոյացմամբ: Կախված ալկենի կառուցվածքից և փոխազդեցության պայմաններից` միացման ռեակցիաները կարող են իրականացվել երեք տարբեր մեխանիզմով. էլեկտրոֆիլ (AdE), ռադիկալային (AdR) և նուկլեոֆիլ (AdN):
10.5.1.1. Հիդրոգենացում:Արդյունաբերական կարևորագույն գործնթացներից է. իրականացվում է յուղերի հիդրոգենացում, նավթային բարձրաեռ բաժնեմասերի հիդրոկրեկինգ և այլն: Սովորաբար, ալկենները ջրածին են միացնում հոմոգեն կամ հետերոգեն կատալիզի պայմաններում (Pd, Pt, Ni).
![]()
Ռեակցիան
էկզոթերմ է, H-H և ![]() խզման
էներգիան ավելի
փոքր է, քան երկու
C-H կապերի առաջացման
ժամանակ անջատված
էներգիան: Ենթադրվում
է, որ կատալիզատորի
մակերևույթին
նախ տեղի է ունենում
ալկենի
խզման
էներգիան ավելի
փոքր է, քան երկու
C-H կապերի առաջացման
ժամանակ անջատված
էներգիան: Ենթադրվում
է, որ կատալիզատորի
մակերևույթին
նախ տեղի է ունենում
ալկենի ![]() քայքայում,
ապա` փոխազդեցություն
ջրածնի հետ: Սովորաբար
որպես կատալիզատոր
կիրառվում են չլրացված
d օրբիտալով տարրեր`
հիմնականում ութերորդ
խմբի մետաղներ
(Pd, Pt, Ni), ինչպես նաև մետաղների
օքսիդներ, սուլֆիդներ
կամ այլ բազմաբնույթ
կատալիզատորներ:
Կատալիզատորով
ակտիվացված ջրածնի
մոլեկուլը միանում
է ալկենին բազմափուլ
մեխանիզմով, որտեղ
ռեակցիայի արագությունը
բնորոշող փուլը
ջրածնի անցումն
է սուբստրատին:
Հիդրման ռեակցիայի
արագությունը
պայմանավորված
է հիդրվող կապին
կից խմբերի ստեղծած
տարածական դժվարությամբ:
Կրկնակի կապի շուրջ
տարածական բարդություն
ստեղծող տեղակալիչները
դժվարացնում են
միացության կոորդինացումը
մետաղի մակերեսին
և ջրածնի «մուտքը»
դեպի մոլեկուլ:
Հոմոգեն կատալիզատորների
ներկայությամբ
հիդրումը բարդ
է ընթանում, որը
բացատրվում է կատալիզատորի
կոմպլեքսում ջրածնի
և սուբստրատի ընդգրկման
դժվարությամբ: Կատալիզատորի
հետ ամուր կապ
առաջացնող ալկենները
չեն հիդրվում հոմոգեն
կատալիզի պայմաններում:
Սակայն բարձր ակտիվության
հետևանքով հոմոգեն
կատալիզը տեղի
է ունենում ավելի
մեղմ պայմաններում,
քան հետերոգեն
կատալիզը: Օրգանական
սինթեզում կիրառվում
են նաև որոշ կատալիզային
հոմոգեն համակարգեր`
ջրածնի դոնոր սպիրտներ
կամ օրգանական
թթուներ մետաղների
հետ, ամոնիակ, ամիններ,
մետաղների հիդրիդային
կոմպլեքսներ, բորաններ:
Իրականացվում
է նաև էլեկտրոֆիլ
իոնական հիդրում,
որը կիրառվում
է դեղանյութերի
արտադրությունում,
հետերոցիկլիկ
միացությունների
քիմիայում:
քայքայում,
ապա` փոխազդեցություն
ջրածնի հետ: Սովորաբար
որպես կատալիզատոր
կիրառվում են չլրացված
d օրբիտալով տարրեր`
հիմնականում ութերորդ
խմբի մետաղներ
(Pd, Pt, Ni), ինչպես նաև մետաղների
օքսիդներ, սուլֆիդներ
կամ այլ բազմաբնույթ
կատալիզատորներ:
Կատալիզատորով
ակտիվացված ջրածնի
մոլեկուլը միանում
է ալկենին բազմափուլ
մեխանիզմով, որտեղ
ռեակցիայի արագությունը
բնորոշող փուլը
ջրածնի անցումն
է սուբստրատին:
Հիդրման ռեակցիայի
արագությունը
պայմանավորված
է հիդրվող կապին
կից խմբերի ստեղծած
տարածական դժվարությամբ:
Կրկնակի կապի շուրջ
տարածական բարդություն
ստեղծող տեղակալիչները
դժվարացնում են
միացության կոորդինացումը
մետաղի մակերեսին
և ջրածնի «մուտքը»
դեպի մոլեկուլ:
Հոմոգեն կատալիզատորների
ներկայությամբ
հիդրումը բարդ
է ընթանում, որը
բացատրվում է կատալիզատորի
կոմպլեքսում ջրածնի
և սուբստրատի ընդգրկման
դժվարությամբ: Կատալիզատորի
հետ ամուր կապ
առաջացնող ալկենները
չեն հիդրվում հոմոգեն
կատալիզի պայմաններում:
Սակայն բարձր ակտիվության
հետևանքով հոմոգեն
կատալիզը տեղի
է ունենում ավելի
մեղմ պայմաններում,
քան հետերոգեն
կատալիզը: Օրգանական
սինթեզում կիրառվում
են նաև որոշ կատալիզային
հոմոգեն համակարգեր`
ջրածնի դոնոր սպիրտներ
կամ օրգանական
թթուներ մետաղների
հետ, ամոնիակ, ամիններ,
մետաղների հիդրիդային
կոմպլեքսներ, բորաններ:
Իրականացվում
է նաև էլեկտրոֆիլ
իոնական հիդրում,
որը կիրառվում
է դեղանյութերի
արտադրությունում,
հետերոցիկլիկ
միացությունների
քիմիայում:
10.5.1.2. Հալոգենացում: Ալկենների հալոգենացման ռեակցիայի արագությունը կախված է հալոգենի բնույթից և ալկենի կառուցվածքից: Ֆտորը փոխազդում է բոցավառումով, յոդը` դանդաղ: Ռեակցիան արագանում է կրկնակի կապին կից տեղակալիչների առկայությամբ: Սա բացատրվում է տեղակալիչների ազդեցությամբ կրկնակի կապի բևեռացման վրա և առաջացող միջանկյալ ռադիկալների կամ իոնների կայունությամբ` շնորհիվ գերզուգորդման:
Հալոգեններն ալկեններին միանում են ռադիկալային և էլեկտրոֆիլ մեխանիզմներով:
Ռադիկալային միացում (AdR): Ռեակցիան ընթանում է հարուցիչների (պերօքսիդներ, լույս) ներկայությամբ.
Մեխանիզմ.
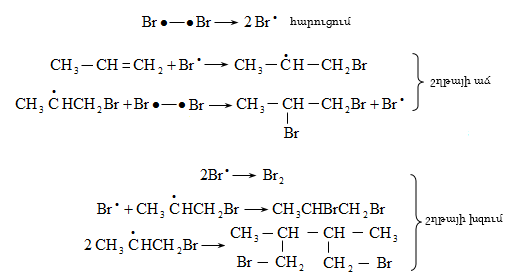
Ռեակցիայի հարուցման փուլում առաջացած բրոմ ռադիկալը գրոհում է ալկենի մոլեկուլին և միանում ավելի մատչելի ածխածնի ատոմին` առաջացնելով հնարավոր միջանկյալ ռադիկալներից առավել կայունը: Եթե բրոմ ռադիկալը հարձակվում է պրոպենի մոլեկուլի վրա, առաջանում է ոչ թե (բ) ռադիկալը, այլ (ա)-ն, քանի որ վերջինս ավելի կայուն է. ազատ էլեկտրոնը զուգորդված է հինգ հատ C-H կապերի հետ.
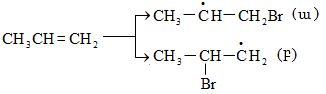
Էլեկտրոֆիլ
միացում (AdE): Ռեակցիան
ընթանում է մթության
մեջ: Հալոգենի
մոլեկուլը բևեռանում
է էլեկտրոններով
հարուստ ![]() ազդեցությամբ:
Մասնակի դրական
լիցք ստացած հալոգենի
ատոմը ռեակցում
է
ազդեցությամբ:
Մասնակի դրական
լիցք ստացած հալոգենի
ատոմը ռեակցում
է ![]() հետ`
առաջացնելով անկայուն
հետ`
առաջացնելով անկայուն
![]() , որը վերածվում
է
, որը վերածվում
է ![]() կամ կարբկատիոնի:
կամ կարբկատիոնի:
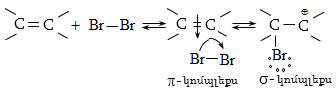
sp2 հիբրիդային ածխածնի ատոմի ազատ p օրբիտալը վերածածկվում է բրոմի ատոմի չբաշխված էլեկտրոնային զույգի հետ` առաջացնելով կամրջակային ցիկլային բրոմոնիում իոն (կատիոն է, որի դրական լիցքը կենտրոնացված է բրոմի ատոմի վրա): Հալոգենները նման կապ առաջացնելու ունակությամբ դասակարգվում են հետևյալ հաջորդականությամբ` F << CI < Br < I: Վերոհիշյալ կատիոնի առաջացումը բերում է հալոգենի տարածաընտրողական միացման.
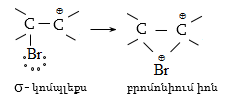
Բրոմի
անիոնը ![]() որպես
նուկլեոֆիլ հարձակվում
է ցիկլային բրոմոնիում
իոնի այն ածխածնի
ատոմին, որին
որպես
նուկլեոֆիլ հարձակվում
է ցիկլային բրոմոնիում
իոնի այն ածխածնի
ատոմին, որին ![]() հաղորդում
է մասնակի դրական
լիցք: Ռեակցիայի
այս փուլը կարելի
է համարել SN2 գործընթաց,
որտեղ հեռացող
խումբ է
հաղորդում
է մասնակի դրական
լիցք: Ռեակցիայի
այս փուլը կարելի
է համարել SN2 գործընթաց,
որտեղ հեռացող
խումբ է ![]() .
.
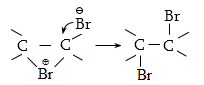
Այս մեխանիզմը չի կարելի ընդհանրացնել ալկենների հալոգենացման բոլոր գործընթացների համար:
Կարբկատիոնի կառուցվածքը շատ դեպքերում չի բացատրում դիտարկվող տրանսմիացումը, այնուամենայնիվ, հիմնվելով կարբկատիոնի կառուցվածքի վրա, կարելի է կանխագուշակել միացման ուղղությունը:
10.5.1.3. Հիդրոհալոգենացում: Ալկենները միացնում են հալոգենաջրածիններ.
![]()
Յոդաջրածինը փոխազդում է ավելի հեշտ, քան բրոմաջրածինը: Հալոգենաջրածինների ռեակցիոնունակությունն աճում է հետևյալ շարքում` HF < HCI < HBr < HI: Ֆտորաջրածնի միացումն ալկենին (մանավանդ խոնավության ներկայությամբ) ուղեկցվում է միաժամանակյա պոլիմերացումով:
Ալկենների հիդրոհալոգենացումն իրականացվում է էլեկտրոֆիլ և ռադիկալային մեխանիզմներով: Ոչ սիմետրիկ ալկենների իոնական մեխանիզմով հիդրոհալոգենացումը (AdE) կատարվում է համաձայն Մարկովնիկովի կանոնի. ջրածինը միանում է առավել հիդրոգենացված ածխածնին: Իզոմերը գոյանում է ցածր ելքով:
Համաձայն առաջարկված մեխանիզմի` պրոտոնի միացումն ալկենին կատարվում է առավել կայուն կատիոնի առաջացումով.
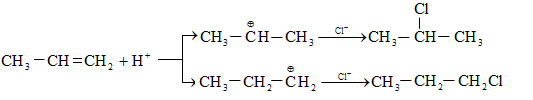
Մարկովնիկովի կանոնը պահպանվում է միայն HHaI-ի իոնական մեխանիզմով միացման դեպքում:
Ոչ ծայրային կրկնակի կապով ածխաջրածիններին HHaI-ի միացման կողմնորոշումն իրականացվում է ըստ Զայցև-Վագների կանոնի. ոչ սիմետրիկ ալկեններին թթուների միացման ժամանակ ջրածինը միանում է առավել մեծ ալկիլ խմբեր ունեցող ածխածնին.
![]()
Այս կանոնն արտահայտված է Մարկովնիկովի կանոնից պակաս հստակ, և երբեմն տեղի է ունենում հակառակը: Ալկենի ռեակցիոն ունակությունը բարձրանում է մոլեկուլում էլեկտրոնակցեպտոր խմբերի առկայության դեպքում, իսկ գործընթացն ընթանում է հակառակ Մարկովնիկովի կանոնի.
![]()
Ռադիկալային մեխանիզմով (AdR) հալոգենաջրածնի միացումը ոչ սիմետրիկ ալկեններին կատարվում է հակառակ Մարկովնիկովի կանոնի: Ռեակցիան իրականացվում է հարուցիչների (պերօքսիդներ կամ թթվածին) ներկայությամբ: Այս գործընթացը կոչվում է Հարաշի էֆեկտ.
![]()
Ռեակցիան շղթայական է. շղթայի աճ փուլում ալկենի մոլեկուլի վրա գրոհում է պերօքսիդի ազդեցությամբ առաջացած բրոմ ռադիկալը: Հաջորդ փուլում ռադիկալը ռեակցում է HBr-ի հետ` առաջացնելով վերջնանյութ և բրոմի ատոմ, որը հետագայում մասնակցում է շղթայի աճի հաջորդ ցիկլին (փուլն անվանվում է շղթայի փոխանցման փուլ).
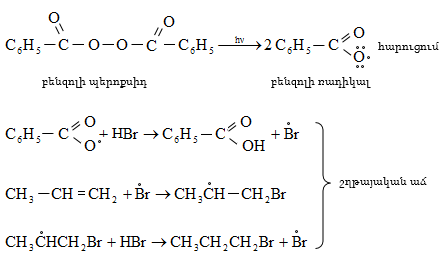
Շղթայական ռեակցիայի շղթայի խզում կարող է կատարվել ցանկացած փուլում հետևյալ հավասարումներով.
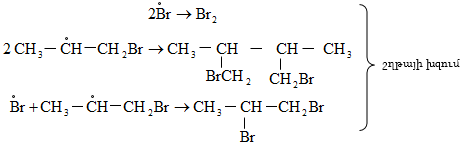
Ռադիկալային միացումը նույնպես կատարվում է կայուն միջանկյալ վիճակի առաջացումով:
10.5.1.4. Հիպոհալոգենացում:Այս գործընթացը քիմիական սինթեզում կիրառվում է քլոր պարունակող լուծիչների և մոնոմերների ստացման համար: Հիպոհալոգենիտներն ալկեններին միանում են հետևյալ կերպ. էլեկտրաբացասական հիդրօքսիլ խումբը միանում է պակաս հիդրոգենացված ածխածնի ատոմին.
![]()
Նույն գործընթացն իրականացվում է քլորաջրով.
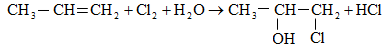
Ռեակցիայի մեխանիզմը կարելի է պատկերել հետևյալ սխեմայով.
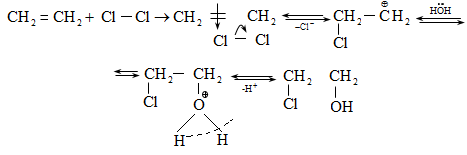
10.5.1.5. Հիդրատացում: Կարևոր արտադրական նշանակություն ունեցող ռեակցիա է: Ալկենի փոխազդեցությամբ թթվի նոսր ջրային լուծույթի հետ առաջանում է համապատասխան սպիրտ.
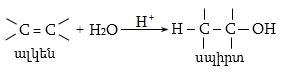
Միացումը տեղի է ունենում ըստ Մարկովնիկովի կանոնի` կարբկատիոնային մեխանիզմով.
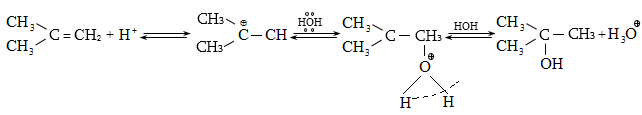
Ռեակցիան սկսվում է ալկենի պրոտոնացումով` առաջացած կարբկատիոնը ջրի հետ տալիս է Օ-պրոտոնացված սպիրտ` օքսոնիում, որից ջրի հաջորդ մոլեկուլի օգնությամբ պոկվում է պրոտոն:
Ալկենների հիդրատացումն արտադրության մեջ իրականացվում է խիտ ծծմբական թթվում, ստացվում է ալկիլբիսուլֆատ, որի հետագա հիդրոլիզն առաջացնում է համապատասխան սպիրտ.
![]()
Տարբեր ալկեններ կլանվում են տարբեր խտության ծծմբական թթվով: Այս եղանակը հնարավորություն է ստեղծում դրանց բաժանել միմյանցից, սակայն այն ունի նաև թերություններ` ծծմբական թթվի մեծ ծախս և դժվար վերականգնում, մետաղական սարքավորման կոռոզիա: Այժմ էթիլենի հիդրատացումը տարվում է բարձր ճնշման տակ, 300...3500C ում սիլիկագելի վրա նստեցված ֆոսֆորական և վոլֆրամական թթուներով:
10.5.2. Օքսիդացում
Ալկեններն oքսիդանում են օդի թթվածնով և այլ օքսիդիչներով: Որոշ ալկեններ ենթարկվում են ինքնաօքսիդացման նույնիսկ մոլեկուլային թթվածնով: Ռեակցիայի ուղղությունը պայմանավորված է օքսիդիչի բնույթով, ռեակցիայի պայմաններով և ալկենի կառուցվածքով: Կալիումի պերմանգանատի սառը լուծույթը ծառայում է կրկնակի կապի որակական բնութագրման համար` պերմանգանատի լուծույթն անմիջապես գունաթափվում է չհագեցած միացության ներկայությամբ:
10.5.2.1.
Ալկեններն
օդի թթվածնով առանց
կատալիզատորի
վերածվում են հիդրոպերօքսիդների,
որոնք փոխարկվում
են սպիրտների և
կարբոնիլային
միացությունների:
Թթվածնի ազդեցությանը
ենթարկվում է կրկնակի
կապի նկատմամբ
![]() շարժունակ
ջրածինը.
շարժունակ
ջրածինը.
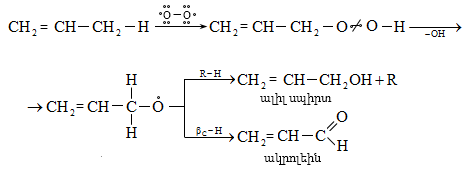
10.5.2.2. Պերօքսիդային միացություններով (պերթթուներ) ալկենները փոխարկվում են էպօքսիդների (Պրիլեժաևի ռեակցիա).
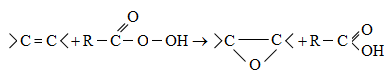
Գործընթացն ընթանում է հետևյալ մեխանիզմով`
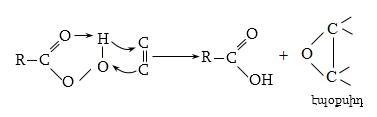
Էպօքսիդի մոլեկուլում երկու ածխածին-թթվածին կապերն առաջանում են միաժամանակ, արդյունքում էպօքսիդն ունենում է նույն կոնֆիգուրացիան, ինչ ելային ալկենը: Օքսիդացումը տարածականորեն յուրահատուկ է. ցիս-ալկենից ստացվում է ցիս-էպօքսիդ, տրանս-ալկենից` տրանս-էպօքսիդ:
Արդյունաբերական նշանակություն ունեցող էթիլենօքսիդն ստացվում է օդով օքսիդացմամբ կատալիզի պայմաններում: Որպես կատալիզատոր կիրառվում է մետաղական արծաթ.
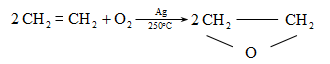
10.5.2.3. Կալիումի պերմանգանատի 1%-ոց լուծույթով, հիմնային կամ թթվային միջավայրերում (Վագների ռեակցիա):
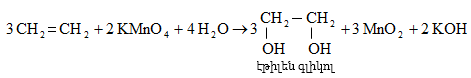
Ջրածնի
պերօքսիդով կատալիզատորի
ներկայությամբ
(CrO3, OsO4) 0...10օC-ում
ալկեններն օքսիդանում
են ![]()
Ռեակցիայի հավանական մեխանիզմը հետևյալն է.
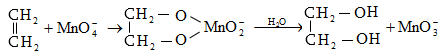
Ալկենների հիդրօքսիլացումը գլիկոլների ստացման ամենատարածված արտադրական եղանակն է, կիրառվում է որպես ալկենների հայտնաբերման որակական ռեակցիա (Բայերի ռեակցիա):
Կալիումի պերմանգանատով թթվային կատալիզատորների ներկայությամբ ալկեններն օքսիդանում են` առաջացնելով թթուների և կետոնների խառնուրդ.
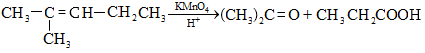
10.5.2.4. Օքսիդիչների խիտ լուծույթներով (KMnO4, HCrO4, HNO3) ալկենի մոլեկուլը խզվում է կրկնակի կապից` առաջացնելով կետոններ և թթուներ:
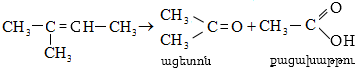
Այս ռեակցիան կիրառվում է օրգանական միացությունում կրկնակի կապի տեղը հայտնաբերելու համար:
10.5.2.5. Գործնական կարևոր նշանակություն ունի ալկենների օքսիդացումն օզոնով (Հարիես, օզոնոլիզ): Օզոնն արագ և քանակապես միանում է կրկնակի կապին բիմոլեկուլային մեխանիզմով: Այս գործընթացը կարևորվում է որպես ալկենի կառուցվածքը պարզելու եղանակ: Օզոնոլիզը բաղկացած է երկու փուլից` առաջին փուլում օզոնի մոլեկուլը միանում է կրկնակի կապին` առաջացնելով անկայուն, պայթուցիկ օզոնիդ, երկրորդ փուլում կատարվում է օզոնիդի հիդրոլիզ: Օզոնացումն իրականացվում է իներտ լուծիչներում (CCI4, հեքսան և այլն):
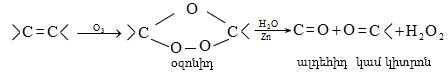
Օզոնիդի հիդրոլիզը սովորաբար կատարվում է վերականգնիչի ներկայությամբ (Zn): Ստորև բերված է պրոպիլենի օզոնացման ռեակցիան`
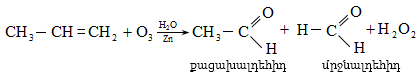
10.5.3. Ալկիլում
Լյուիսի և այլ թթուների ներկայությամբ (հանքային, թթվածնավոր թթուներ, հեղուկ HF, BF3, AlCl3) ալկեններն ալկիլում են հագեցած միացությունները` գոյացնելով հիմնականում ճյուղավորված ալկաններ: Այս փոխազդեցությունը կիրառվում է շարժիչային վառելիքի համար բարձր օկտանային թիվ ունեցող հավելանյութերի ստացման գործընթացում: Որպես կատալիզատոր օգտագործվում են ծծմբական կամ ֆոսֆորական թթուներ: Իզոբութիլենի և իզոբութանի փոխազդեցությունը թթվային կատալիզատորի ներկայությամբ բերում է 2,2,4-տրիմեթիլպենտանի (իզոօկտան) գոյացման: Ստացված իզոօկտանը շարժիչային վառելիքի արժեքավոր հավելանյութ է ներքին այրման շարժիչներում, արգելակում է անդրպայթյունը (դետոնացում):
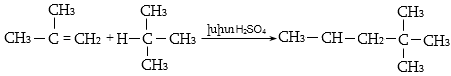
Ռեակցիայի մեխանիզմը հետևյալն է.
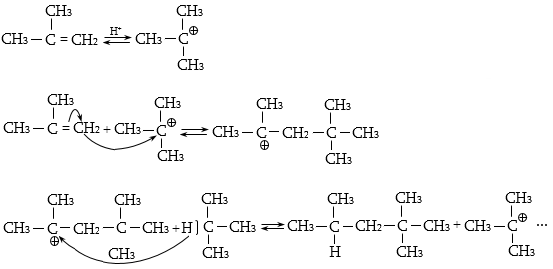
Առաջին
փուլում իզոբութիլենի
մոլեկուլին միանում
է պրոտոն` երրորդային
կարբոնիում իոնի
գոյացումով: Երկրորդ
փուլում կարբկատիոնը
միանում է իզոբութիլենի
մոլեկուլին` առաջացնելով
կայուն երրորդային
կարբկատիոն, որը
երրորդ փուլում
իզոբութանի մոլեկուլից
պոկում է ջրածին
էլեկտրոնային
զույգի հետ միասին
(![]() հիդրիդ
իոն)` ստեղծելով
կայուն երրորդային
բութիլ կատիոն,
որը շարունակում
է շղթան:
հիդրիդ
իոն)` ստեղծելով
կայուն երրորդային
բութիլ կատիոն,
որը շարունակում
է շղթան:
10.5.4. Պրինսի ռեակցիա
Կարևոր արտադրական նշանակություն ունի ֆորմալդեհիդի միացումը ալկենին: Ռեակցիան տարվում է թթվային միջավայրում (ծծմբական և ֆոսֆորական թթուներ, BF3, ZnCI2, SnCI4 և այլն): Առավել հեշտ ռեակցում են ոչ սիմետրիկ ալկենները: Սովորական պայմաններում գազային ֆազում գտնվող ալկենները փոխազդում են ճնշման տակ: Գործընթացը կիրառվում է 1,3-գլիկոլների, չհագեցած սպիրտների, 1,3-դիօքսանի, բութադիենի և իզոպրենի ստացման համար:
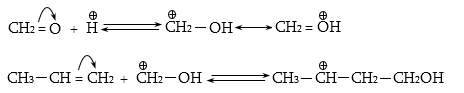
Առաջացած կարբկատիոնը կայունանում է` միացնելով հիդրօքսիդ իոն կամ կորցնելով պրոտոն, ընդ որում` հաճախ առաջանում է անցողիկ ցիկլային վիճակ:
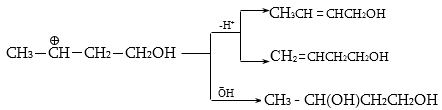
Կարբկատիոնի կայունացման մյուս ուղին հետևյալն է`
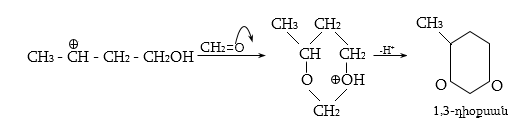
Ստացված միացությունները հեշտ փոխարկվում են բութադիենի (դիվինիլի).
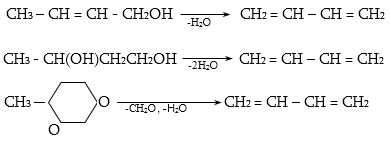
Պրինսի ռեակցիայի ընթացքում միջանկյալ կարբկատիոնի վերախմբավորման հետևանքով ստացվում են իզոմերային արգասիքներ:
10.5.5. Հալոգենացում ալիլ դիրքում
Բարձր
ջերմաստիճաններում
(450...500°C) պրոպիլենը
քլորանում է ալիլ
դիրքում (կրկնակի
կապի նկատմամբ
![]() ): Ստացվում
է ալիլքլորիդ (Լվովի
ռեակցիա): Ռեակցիան
շղթայական է և
հարուցվում է ազատ
ռադիկալներ առաջացնող
նյութերով (պերօքսիդներ).
): Ստացվում
է ալիլքլորիդ (Լվովի
ռեակցիա): Ռեակցիան
շղթայական է և
հարուցվում է ազատ
ռադիկալներ առաջացնող
նյութերով (պերօքսիդներ).
![]()
Ռեակցիայի հնարավոր մեխանիզմն է`
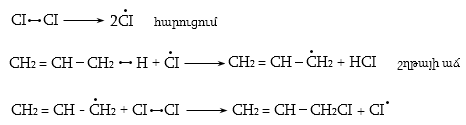
Հարուցման
փուլում առաջացած
քլորի ատոմը մեթիլ
խմբից պոկում է
ջրածին. ստացվում
է կայուն ալիլ
ռադիկալ: Վերջինիս
կայունությունը
բացատրվում է չզույգված
էլեկտրոնի բաշխումով
(փոխազդեցություն
կից ![]() հետ).
հետ).
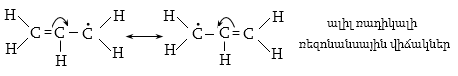
Այս ռեակցիան առավել դյուրին է ընթանում բրոմի հետ: Ալիլ դիրքի բրոմացումն իրականացվում է հիմնականում N-բրոմսուկցինիմիդով (Ցիգլեր): Քանի որ N-բրոմսուկցինիմիդը հեշտությամբ է ենթարկվում հոմոլիզի, ուստի հարուցիչի անհրաժեշտություն չի զգացվում.
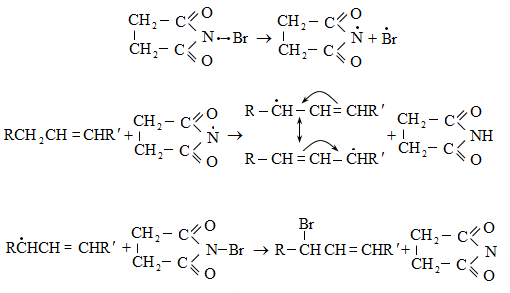
10.5.6. Պոլիմերացում
Պոլիմերացումը բարձրամոլեկուլային միացությունների ստացման գործընթաց է, երբ կատարվում է ցածրամոլեկուլային նյութերի միացում մոնոմերի ակտիվ կենտրոնին, որը գտնվում է աճող շղթայի վերջում: Միևնույն մոնոմերից առաջանում է պոլիմեր, իսկ տարբեր մոնոմերներից` համապոլիմեր: Ըստ ակտիվ կենտրոնի բնույթի` պոլիմերացումը լինում է ռադիկալային (ակտիվ կենտրոնն ազատ ռադիկալ է), էլեկտրոֆիլ (ակտիվ կենտրոնն էլեկտրոֆիլ է) և նուկլեոֆիլ (ակտիվ կենտրոնը նուկլեոֆիլ է):
10.5.6.1.Կատիոնային
պոլիմերացում:
Իոնական պոլիմերացման
տեսակ է, երբ շղթայի
աճող վերջնամասն
ունի դրական լիցք:
Ակտիվ են այն մոնոմերները,
որոնք կրկնակի
կապի ![]() ունեն էլեկտրոնադոնոր
տեղակալիչներ
(իզոբութիլեն,
վինիլալկիլեթերներ,
իզոպրեն, ստիրոլ
և այլն): Ռեակցիան
ընթանում է պրոտոնային
կատալիզատորների`
անօրգանական և
Լյուիսի թթուների
(H+, BF3, AICI3 և այլն),
հալոգենների, մետաղօրգանական
միացությունների,
օքսոնիումային
աղերի ներկայությամբ,
ինչպես նաև բարձր
էներգիայով օժտված
հարուցիչների
ազդեցությամբ:
ունեն էլեկտրոնադոնոր
տեղակալիչներ
(իզոբութիլեն,
վինիլալկիլեթերներ,
իզոպրեն, ստիրոլ
և այլն): Ռեակցիան
ընթանում է պրոտոնային
կատալիզատորների`
անօրգանական և
Լյուիսի թթուների
(H+, BF3, AICI3 և այլն),
հալոգենների, մետաղօրգանական
միացությունների,
օքսոնիումային
աղերի ներկայությամբ,
ինչպես նաև բարձր
էներգիայով օժտված
հարուցիչների
ազդեցությամբ:
Կատիոնային պոլիմերացումը կարևոր է ցածրամոլեկուլային պոլիմերների, հատկապես օլիգոմերների ստացման համար (իզոբութիլենային, պոլիվինիլիզոբութիլենային և այլ կաուչուկներ): Ռեակցիան սկսվում է ալկենի (Լյուիսի հիմք) և Լյուիսի թթվի թթվահիմնային փոխազդեցությամբ, որի սկզբնական փուլը նման է կրկնակի կապին էլեկտրոֆիլի միացմանը.
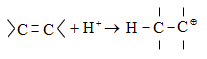
Կատիոնի փոխազդեցությունն ալկենի հետ, հետևաբար նաև շղթայի աճը կշարունակվի այնքան ժամանակ, որքան կարբկատիոնը կայուն է, և միջավայրում կա ալկեն: Շղթան կարող է խզվել, եթե քայքայվի կատիոնային կենտրոնը` միանա որևէ անիոն կամ պրոտոնի կորստով առաջանա կրկնակի կապ.
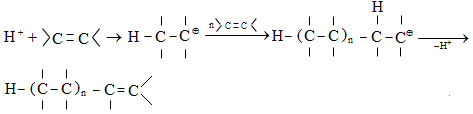
Այս ռեակցիան կիրառվում է իզոբութիլենի և օրթոմեթիլստիրոլի պոլիմերացման համար:
Ներկայացված է իզոբութիլենի պոլիմերացման սխեման.
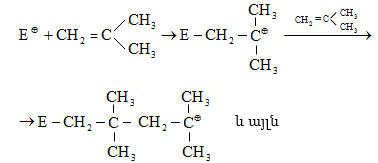
10.5.6.2.
Անիոնային պոլիմերացում:
Իոնական պոլիմերացման
տեսակ է, երբ
պոլիմերային շղթայի
վերջում առկա է
բացասական լիցք:
Այսպիսի պոլիմերացման
են ենթարկվում
այն մոնոմերները,
որոնք կրկնակի
կապի նկատմամբ
![]() ունեն
էլեկտրոնակցեպտոր
խմբեր: Արտադրությունում
պոլիմերացման
այս եղանակը կիրառվում
է էլաստոմերների,
պոլիկապրամիդի,
պոլիէթիլենօքսիդի,
պոլիֆորմալդեհիդի,
պոլիսիլօքսանների
ստացման համար:
ունեն
էլեկտրոնակցեպտոր
խմբեր: Արտադրությունում
պոլիմերացման
այս եղանակը կիրառվում
է էլաստոմերների,
պոլիկապրամիդի,
պոլիէթիլենօքսիդի,
պոլիֆորմալդեհիդի,
պոլիսիլօքսանների
ստացման համար:
Անիոնային պոլիմերացման կատալիզատորներ են ալկալիական մետաղները, ալկալիական մետաղների ամիդները: Պարզագույն ալկեններն անիոնների հետ չեն փոխազդում, հետևաբար, նշված մեխանիզմով չեն կարող պոլիմերանալ:
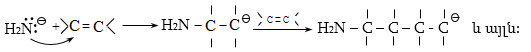
Եթե միջանկյալ անիոնը համեմատաբար կայուն է, հնարավոր է իրականացնել այդպիսի փոխարկում: Օրինակ, ակրիլոնիտրիլը հիմքի հետ պոլիմերանում է պոլիակրիլոնիտրիլի, որից ստացվում է արհեստական մանրաթել` օրլոն.
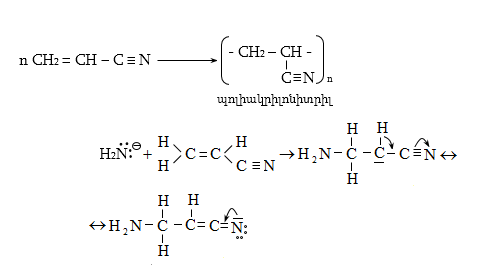
Միջանկյալ կարբանիոնը կայուն է, քանի որ բացասական լիցքը բաշխված է ածխածնի ատոմի և հարևան ցիան խմբի միջև.
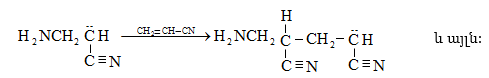
10.5.6.3. Ռադիկալային պոլիմերացում: Ռեակցիան հարուցվում է ջերմության կամ լույսի ազդեցությամբ, և ազատ ռադիկալներ առաջացնող միացությունների ներկայությամբ (պերօքսիդներ, դիազոամինոմիացություններ և այլն).
![]()
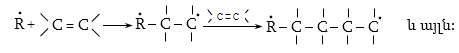
Շղթան խզվում է, երբ բախվում է մոնոմերի մոլեկուլի հետ (ա), հանդիպում է շղթայի աճի կարգավորիչի մոլեկուլին (հավելանյութ), որը հեշտությամբ տրամադրում է ջրածնի կամ հալոգենի ատոմ (բ), կատարվում է ռադիկալի անհամամասնում (գ) կամ բախվում է որևէ ռադիկալի հետ (դ).
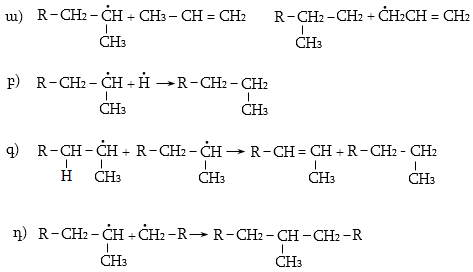
10.5.6.4. Կոորդինացիոն-իոնային պոլիմերացում: Պոլիմերացումն իրականացվում է մետաղօրգանական միացություններով: Այս գործընթացի ժամանակ պոլիմերային կառույցշղթա մոնոմերի հերթական մոլեկուլի մուտքին նախորդում է խմբերի կոորդինացում շղթայի ծայրի ակտիվ կենտրոնին:
Կոորդինացիոն պոլիմերացման եղանակն առաջարկել է Ջ. Նաթթը և զարգացրել է Կ. Ցիգլերը: Որպես կատալիզատոր կիրառվում են կոմպլեքս միացություններ` բաղկացած վերականգնիչներից և անցողիկ մետաղի աղից: Առավել տարածված է տրիէթիլալյումինի կոմպլեքսը տիտանի քլորիդի հետ [AI(OC2H5)3TiCI4]: Կատալիզատորի օգնությամբ մոնոմերը մուտք է գործում մետաղի և պոլիմերի աճող շղթայի ալկիլ խմբերի մեջ:
Քննարկենք պրոպիլենի պոլիմերացումը.
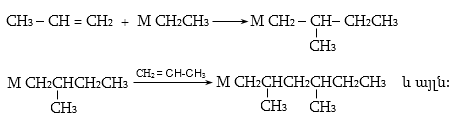
Պոլիմերի հետագա հիդրոլիզն առաջացնում է մաքուր պոլիպրոպիլեն: Ցիգլեր-Նաթթի կատալիզատորի կիրառությունն արագացնում է պոլիմերացումը և հնարավորություն ստեղծում վերահսկելու ստացվող պոլիմերի կառուցվածքը: Ոչ սիմետրիկ ալկեններից ստացվում են տարածականորեն կարգավորված (ստերեոռեգուլյար) պոլիմերներ, որոնք առավել ամուր են, քան չկարգավորված (ատակտիկ) պոլիմերները.
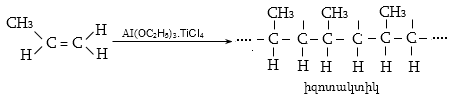
Իզոտակտիկ պոլիմերում բոլոր մեթիլ խմբերը դասավորված են հիմնական պոլիմերային շղթայի մի կողմում, իսկ սինդիոտակտիկ պոլիմերում մեթիլ խմբերը գտնվում են շղթայի երկու կողմերում.
Կոորդինացիոն սինդիոտակտիկ պոլիմերացումը պոլիէթիլենի ստացման արտադրական եղանակ է:
10.5.7. Անհամամասնում
Ցիգլերի կատալիզատորի ներկայությամբ, որն ստացվում է WCI6 և MoCI5 փախազդեցությամբ էթիլալյումինդիքլորիդի հետ, ալկենները ենթարկվում են անհամամասնման.
![]()
Ռեակցիան ունի արտադրական նշանակություն. էթիլենից և 2-բութենից ստացվում է պրոպիլեն.
![]()
Դեյտերացված ալկենների փոխազդեցության փորձնական տվյալներից ելնելով` ենթադրվում է, որ ռեակցիան իրականանում է միջանկյալ քառանդամ ցիկլի առաջացումով:
10.5.8. Իզոմերացում
Բարձր ջերմաստիճաններում կամ կատալիզատորների ներկայությամբ ալկեններն իզոմերանում են կրկնակի կապի տեղաշարժով կամ ածխածնային շղթայի կառուցվածքի փոփոխությամբ.
Խնդիրներ
1. Անվանել հետևյալ կառուցվածքով ալկենները IUPAC և ռացիոնալ անվանակարգումով.
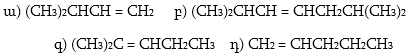
2. Անվանել հետևյալ ռադիկալները.
![]()
3. Հետևյալ սպիրտների դեհիդրատացումով գերազանցապես որ ալկենը կստացվի.
ա) (CH3)2C (OH)CH2CH2CH3
բ) (CH3)2C(OH)CH2CH3
գ) CH3CH2CH(OH)CH(CH3)CH2CH3
4. Ալկենի օզոնոլիզով ստացվել են քացախալդեհիդ և իզոկարագալդեհիդ: Որոշել ելանյութի կառուցվածքը:
5. Կալիումի պերմանգանատի նոսր ջրային լուծույթով ալկենի օքսիդացման արդյունքում ստացվել է գլիկոլ: Պարզել ալկենի կառուցվածքը:
(CH3)2CHCH(OH)CH(OH)CH2CH3
6. Ինչպիսի՞ ռեակցիաների օգնությամբ 1-պենտենից կստացվի 2-պենտեն:
7. Իրականացնել հետևյալ փոխարկումները.
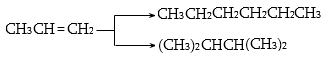
8. Ինչպե՞ս բաժանել պենտանը 1-պենտենից:
9. Ո՞ր ռեակցիայի միջոցով է հնարավոր տարբերել հետևյալ իզոմեր ածխաջրածինները.
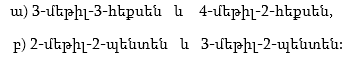
10. Պարզել ալկիլ բրոմիդի կառուցվածքը, որն ստացվել է 3-մեթիլ-3-հեքսենից HBr-ի էլեկտրոֆիլ միացման արդյունքում:
11. Անվանել այն բրոմածանցյալը, որն ստացվում է իզոբութիլենի և բրոմի փոխազդեցությամբ էթիլսպիրտում:
12. C8H16 բաղադրությամբ ածխաջրածինը գունազրկում է բրոմաջուրը, լուծվում է խիտ ծծմբական թթվում, հիդրվում է` առաջացնելով օկտան, KMnO4ի խիտ լուծույթով օքսիդանում է` վերածվելով հետևյալ կարբոնաթթուների խառնուրդի.
![]()
Գրել ածխաջրածնի կառուցվածքային բանաձևը:
13. Գրել հետևյալ ալկենների կառուցվածքային բանաձևերը.
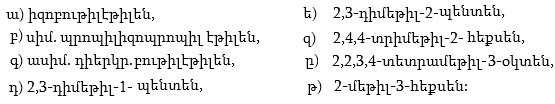
14. Առաջարկել հետևյալ նյութերի սինթեզի եղանակներ` պրոպանի և այլ անհրաժեշտ ռեագենտների օգնությամբ`
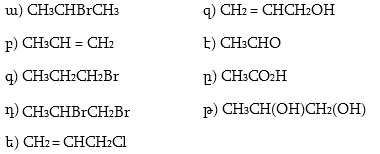
15. Ի՞նչ նյութեր կառաջանան ներքոհիշյալ միացությունների հիդրատացումով թթվային միջավայրում.

16. A միացության հիդրատացումով ստացվում են B և C արգասիքները, իսկ D-ն չի ստացվում, ինչու՞:
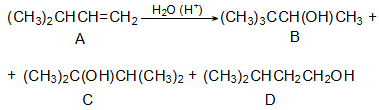
17. Լրացնել հետևյալ ռեակցիաները: Անվանել ստացված միացությունները.
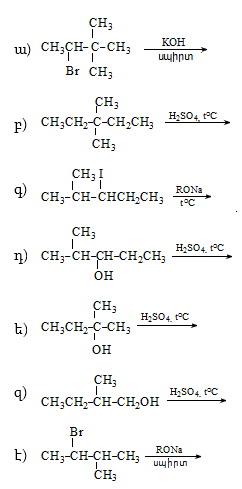
18. Բացատրել էլեկտրոնային խտության բաշխումը էթիլենում, պրոպիլենում, բութիլենում: Կառուցել մոլեկուլների տարածական մոդելը:
19. Ստանալ 3-մեթիլ-1-պենտեն ալկենների ստացման հնարավոր եղանակներով: Գրել դրա փոխազդեցությունը բրոմաջրածնի հետ պերօքսիդի ներկայությամբ և առանց պերօքսիդի: Գրել ռեակցիաների մեխանիզմը:
20. Գրել հետևյալ արգասիքների ստացման մեխանիզմը.
![]()
21. C7H15Br միացությունը հիմքի սպիրտային լուծույթով տաքացնելիս գոյանում է C7H14 բաղադրությամբ երկու ալկենների խառնուրդ, որոնց հիդրումով ստացվում է 3-էթիլպենտան: Ի՞նչ կառուցվածք ունեն ալկիլհալոգենիդը և ալկենները:
22. 3,3-դիմեթիլ-1-բութենի և բրոմաջրածնի փոխազդեցությամբ առաջանում են 9:1 հարաբերությամբ երկու միացություն C6H13Br (Ա և Բ):
Ա միացությունը հիմքի սպիրտային լուծույթում տաքացնելիս փոխարկվում է Գ ալկենի, իսկ Բ-ն` Դ և Ե ալկենների խառնուրդի: Գրել Ա-Ե միացությունների կառուցվածքը:
23. Լրացնել հետևյալ ռեակցիաները.
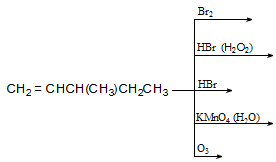
24. 5,28 գ բութանի և բութենի խառնուրդը գունազրկվել է 32 գ 10%-ոց բրոմի լուծույթով: Գտնել խառնուրդում բութանի զանգվածային բաժինը:
25. Էթիլենային ածխաջրածնի փոխազդեցությամբ 16,2 գ բրոմաջրածնի հետ առաջանում է երկրորդային ալկիլբրոմիդ, որը նատրիումի հիդրօքսիդի ջրային լուծույթի հետ առաջացնում է 6գ համապատասխան սպիրտ: Ինչպիսի՞ կառուցվածք ունեն ելային ածխաջրածինը և ստացվող սպիրտը, եթե սպիրտի ելքը կազմում է տեսական զանգվածային բաժնի 50%-ը:
26. Պարզել բաց շղթայով չհագեցած ածխաջրածնի կառուցվածքը, եթե դրա 1,62 գ կատալիզային հիդրոգենացման համար ծախսվում է 1,344 լ ջրածին: Ելանյութի խտությունն ըստ ջրածնի 17 է: Այն լայն կիրառություն ունի կաուչուկի արտադրությունում:
27. Ինչպիսի՞ կառուցվածք ունի էթիլենային ածխաջրածինը, եթե դրա 7 գ-ը գունազրկում է 80 գ 20%-ոց բրոմի լուծույթը տետրաքլորածխածնում և ունի ցիս- և տրանս-իզոմերներ:
28. Լրացնել հետևյալ ռեակցիաները.
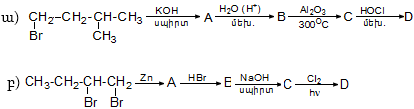
29.Գրել պրոպիլենի պոլիմերացման ռեակցիան և մեխանիզմը բենզոիլպերօքսիդի, ալյումինի քլորիդի և HCl ի ներկայությամբ:
30. Քանի՞ գրամ KMnO4 կպահանջվի 10 գ պրոպիլենը մինչև պրոպիլենգլիկոլ օքսիդացնելու համար:
31. Քանի՞ գրամ KMnO4 կպահանջվի 5,6 լ էթիլենը նորմալ պայմաններում մինչև էթիլենգլիկոլ օքսիդացնելու համար:
11. ԱԼԿԻՆՆԵՐ
(ԱՑԵՏԻԼԵՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐ)
Ալկինները
CnH2n-2
ընդհանուր
բանաձևով ածխաջրածիններ
են, որոնք իրենց
կառուցվածքում
ունեն մեկ եռակի
կապ: Հոմոլոգիական
շարքի առաջին անդամն
ացետիլենն
է` ![]()
11.1. Անվանակարգում, իզոմերիա
Պարզագույն ացետիլենային ածխաջրածինները հաճախ անվանվում են ռացիոնալ անվանակարգումով, որպես ացետիլեն, որի մեկ կամ երկու H-ի ատոմները տեղակալված են ալկիլ խմբերով: Ալկինները IUPAC կամ Ժնևյան անվանակարգումով անվանվում են նույն համակարգով, ինչ ալկենները, այն տարբերությամբ, որ են վերջավորության փոխարեն օգտագործվում է եռակի ածխածին-ածխածին կապը բնորոշող ին վերջավորություն: Որպես գլխավոր ածխածնային շղթա ընդունվում է եռակի կապ պարունակող ամենաերկար շղթան, համարակալումը կատարվում է շղթայի այն ծայրից, որին մոտ է եռակի կապը:
Ալկինների շարքում կառուցվածքային իզոմերիան պայմանավորված է ածխածնային կմախքի կառուցվածքով և շղթայում եռակի կապի դիրքով: Ացետիլենային շարքի ածխաջրածինները նույն թվով ածխածնի ատոմներ պարունակող էթիլենային ածխաջրածիններից տարբերվում են ավելի քիչ թվով կառուցվածքային իզոմերներով: Կառուցվածքային առանձնահատկությունների պատճառով ալկիններում բացակայում է երկրաչափական (ցիս-տրանս) իզոմերիան: Կառուցվածքային իզոմերիան սկսվում է բութինից.

Ալկիններից առաջացած միավալենտ ռադիկալներն ըստ IUPAC անվանակարգման ստանում են «ինիլ» վերջավորություն (ալկինիլ):
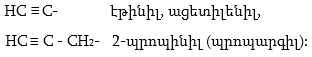
11.2. Ֆիզիկական հատկություններ
Համաձայն
քվանտամեխանիկական
տեսության, ացետիլենն
ունի հետևյալ կառուցվածքը.
մոլեկուլում կան
երկու ![]() որոնք առաջանում
են ածխածնի
sp
և ջրածնի s օրբիտալների,
իսկ
որոնք առաջանում
են ածխածնի
sp
և ջրածնի s օրբիտալների,
իսկ ![]() ածխածինների
sp օրբիտալների
վերածածկումով:
Հիբրիդացմանը
չմասնակցող երկու
p օրբիտալները
փոխուղղահայաց
հարթություններում
առաջացնում են
երկու
ածխածինների
sp օրբիտալների
վերածածկումով:
Հիբրիդացմանը
չմասնակցող երկու
p օրբիտալները
փոխուղղահայաց
հարթություններում
առաջացնում են
երկու![]() Քվանտամեխանիկական
պատկերացումներն
ապացուցված են
էլեկտրոնների
դիֆրակցիայի և
սպեկտրալ եղանակներով:
Ցույց է տրվել,
որ ացետիլենն ունի
գծային կառուցվածք:
Քվանտամեխանիկական
պատկերացումներն
ապացուցված են
էլեկտրոնների
դիֆրակցիայի և
սպեկտրալ եղանակներով:
Ցույց է տրվել,
որ ացետիլենն ունի
գծային կառուցվածք:
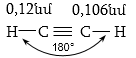
Եռակի
կապն ավելի ամուր
է (828,98 կՋ/մոլ), քան կրկնակի
կապը էթիլենում
(607,09 կՋ/մոլ) և պարզ
կապը` էթանում
(347,46 կՋ/մոլ): Հետևաբար
եռակի կապն ավելի
կարճ է, քան դրանցից
յուրաքանչյուրը:
![]() եռակի
կապի կարճության,
ինչպես նաև ածխածնի
sp հիբրիդացված
ատոմների բարձր
էլեկտրոնակցեպտորության
հետևանքով
եռակի
կապի կարճության,
ինչպես նաև ածխածնի
sp հիբրիդացված
ատոմների բարձր
էլեկտրոնակցեպտորության
հետևանքով ![]() բևեռացումը փոքրացված
է: Քանի որ
բևեռացումը փոքրացված
է: Քանի որ
![]() կապի էլեկտրոններն
ավելի ամուր են
կապված ածխածնի
միջուկների հետ,
քան C = C
կապի
կապի էլեկտրոններն
ավելի ամուր են
կապված ածխածնի
միջուկների հետ,
քան C = C
կապի ![]() ացետիլենային
կապը դժվար է մասնակցում
էլեկտրոֆիլ միացման
ռեակցիաներին:
Շնորհիվ գծային
կառուցվածքի` փոխազդում
են նուկլեոֆիլ
ռեագենտների հետ:
Ալկիններն ավելի
հեշտ են փոխազդում
նուկլեոֆիլի հետ,
քան ալկենները:
Ալկենները և ալկիններն
ավելի հեշտ փոխազդում
են էլեկտրոֆիլ
ռեագենտի, քան
նուկլեոֆիլի հետ:
ացետիլենային
կապը դժվար է մասնակցում
էլեկտրոֆիլ միացման
ռեակցիաներին:
Շնորհիվ գծային
կառուցվածքի` փոխազդում
են նուկլեոֆիլ
ռեագենտների հետ:
Ալկիններն ավելի
հեշտ են փոխազդում
նուկլեոֆիլի հետ,
քան ալկենները:
Ալկենները և ալկիններն
ավելի հեշտ փոխազդում
են էլեկտրոֆիլ
ռեագենտի, քան
նուկլեոֆիլի հետ:
Վերը քննարկված փաստարկներով բացատրվում է նաև եռակի կապի ածխածնին կից ջրածնի ատոմի թթվայնությունը. sp հիբրիդային ածխածնին կից ջրածնի ատոմն ավելի թթվային է, քան sp2 կամ sp3 ածխածնի ատոմին կապված ջրածնի ատոմը:
Ալկինները եռման և հալման ջերմաստիճանների փոփոխության հիմնական օրինաչափություններով նման են ալկեններին: Ալկինների խտությունը և բեկման ցուցիչը նկատելիորեն ավելի բարձր է, քան ալկեններինը և ալկաններինը:
Ալկինները փոքր բևեռայնություն ունեցող միացություններ են, ջրում չեն լուծվում, լավ են լուծվում ցածր բևեռայնությամբ լուծիչներում` եթերում, բենզոլում, տետրաքլորածխածնում:
ԻԿ սպեկտրում ալկիններին բնորոշ եռակի կապի վալենտային տատանումները գտնվում են 4,75...4,2 մկմ (2100...2300 սմ-1) կլանման տիրույթում: ՈՒՄ ճառագայթները կլանվում են 200 նմ-ից ցածր տիրույթում: ՄՄՌ սպեկտրում C CH խմբավորման պրոտոնները, համեմատած կրկնակի կապին կից պրոտոնների հետ, ազդանշան են տալիս ավելի ուժեղ դաշտում:
Ալկինները բնության մեջ գրեթե չեն հանդիպում: Շատ քիչ քանակությամբ պոլիացետիլեններ կան բարդ գունային արտահայտչականություն ունեցող որոշ բույսերի բաղադրության մեջ:
11.3.Կիրառման բնագավառներ, թունավորություն
Ացետիլենային ածխաջրածիններից կարևորագույն արդյունաբերական նշանակություն ունի ացետիլենը: Թթվածնում ացետիլենի այրման ժամանակ մեծ ջերմություն է անջատվում. ռեակցիան կիրառվում է մետաղների զոդման և կտրման համար (30000C): Հեղուկ ացետիլենը պայթունավտանգ է: Ացետիլենի քայքայման ջերմությունը 226,9 կՋ/մոլ է, էթիլենինը` 52,6 կՋ/մոլ, իսկ էթանինը` 84,6 կՋ/մոլ: Հեղուկ ացետիլենը պահվում է ացետոնով ներծծված ադսորբենտով լցված տարաներում 25 մթն ճնշման տակ: Կարևոր է ացետիլենի դերը հիմնական օրգանական սինթեզում: Ացետիլենի արդյունաբերական կիրառությունը պայմանավորված է արհեստական կաուչուկի և մանրաթելի, քլորոպրենի, բութադիենի, վինիլացետիլենի և պոլիքլորոպրենի, վինիլացետատի և պոլիվինիլացետատի, վինիլքլորիդի և պոլիվինիլքլորիդի, ակրիլոնիտրիլի, միատոմ և բազմատոմ սպիրտների (էթանոլ, պրոպարգիլ սպիրտ, 1,4-բութինդիոլ, 1,4-բութանդիոլ, գլիցերին), քացախաթթվի, օրգանական կարևոր լուծիչների (տետրաքլորէթան, դիքլորէթիլեն) արտադրություններով: Ացետիլենի համաշխարհային տարեկան արտադրությունը 6 մլն տոննա է:
Ացետիլենի ՍԹԿ-ն մթնոլորտում 3 մգ/մ3 է, շնչելիս առաջացնում է ջղաձգումներ: Ացետիլենն օժտված է թույլ թմրեցնող հատկությամբ, ինքնաբոցավառվում է 3350C-ում: Գործնականում ացետիլենով թունավորումը պայմանավորված է նրանում գտնվող խառնուրդներով (ֆոսֆին, ծծմբաջրածին, ամոնիակ, արսին և այլն): Բացառիկ դեպքերում ` վթարների ժամանակ, թունավորումը կարող է լինել նաև ացետիլենով:
11.4. Ստացման եղանակներ
Արդյունաբերական կարևոր նշանակություն ունեցող ացետիլենի, ինչպես նաև մյուս ալկինների ստացման համար գոյություն ունեն մի շարք եղանակներ:
11.4.1. Ացետիլենի ստացման արտադրական հին եղանակ է կալցիումի կարբիդի հիդրոլիզը (Վյոլեր, 1862 թ.): Կարբիդն ստացվում է կալցիումի օքսիդը հալելով ածխում, էլեկտրական վառարաններում 2500...3000օC-ում: Ռեակցիան էկզոթերմ է, պահանջում է ջերմաստիճանային խիստ հսկողություն, գերտաքացնելիս կարող է տեղի ունենալ պայթյուն: Ստացվող գորշ շագանակագույն զանգվածն արագ քայքայվում է ջրով:
![]()
11.4.2. Ացետիլենի ստացման արտադրական ժամանակակից եղանակ է մեթանի և մյուս ցածրամոլեկուլային ալկանների պիրոլիզը 1500...25000C ջերմաստիճանում, ինչն այս էնդոթերմ ռեակցիայի համար ապահովվում է մաքուր թթվածնում ածխաջրածինների այրումով`
![]()
կամ էլեկտրական աղեղով`
![]()
Առաջին դեպքում հրակայուն մակերևույթի վրայով անցկացվում է մեթանի և օդի խառնուրդ, որի այրումից ապահովվում է 15000C և սկսվում է մեթանի պիրոլիզը: Այս գործընթացը նման է ջերմօքսիդային կրեկինգին այն տարբերությամբ, որ օգտագործվում է անմիջապես տրվող թթվածնի անհրաժեշտ քանակ (CH4 : O2 = 1 : 0.65)
![]()
Երկրորդ դեպքում մեթանը սովորական ճնշման տակ անցկացվում է մետաղական էլեկտրոդների միջով` 16000C-ում: Գոյացած գազերի խառնուրդն արագ սառեցվում է ջրով: Գազային խառնուրդում լինում է 12...15% ծավալային ացետիլեն: Ստացվում են նաև էթիլեն, մուր, ջրածին:
Բարձր ջերմաստիճանում մեթանից գոյանում են ռադիկալներ` մեթիլ, մեթիլեն, մեթին, որոնք հետագայում առաջացնում են զանազան ածխաջրածիններ` այդ թվում նաև` ացետիլեն:
11.4.3. Ալկինների ընդհանուր ստացման եղանակ է ալկանների հեմինալ և վիցինալ դիհալոգենածանցյալների, ինչպես նաև վինիլհալոգենիդների դեհիդրոհալոգենացումը: Հալոգենաջրածնի պոկումն իրականացվում է կծու կալիումի սպիրտային լուծույթով, փոշի KOHով կամ նատրիումի ամիդով:
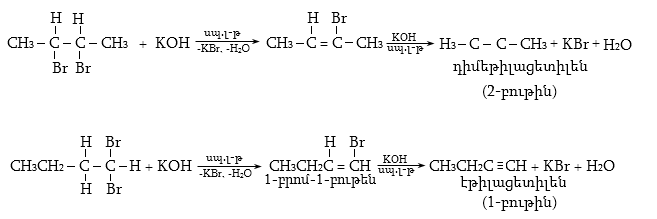
Վիցինալ դիհալոգենածանցյալներն ստանում են ալկենների հալոգենացումով, իսկ հեմինալը` ալդեհիդներից և կետոններից PCI5-ի հետ փոխազդեցության արդյունքում:
11.4.4. Հոմոլոգիական շարքի մյուս անդամներն ստացվում են ացետիլենից կամ ծայրային եռակի կապ ունեցող ալկիններից: Նախ դրանք վերածվում են մետաղօրգանական միացությունների, շատ հաճախ` նատրիումի ացետիլենիդների կամ ալկինիլմագնեզիումհալոգենիդների: Առաջին դեպքում ռեակցիան տարվում է հեղուկ ամոնիակում նատրիումի ամիդով, երկրորդ դեպքում ազդում են Գրինյարի ռեակտիվով բացարձակ եթերում կամ տետրահիդրոֆուրանում (Ժ.Ի. Իոցիչ).
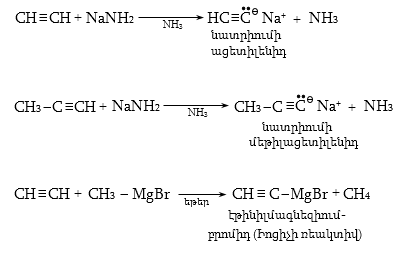
Ալկինների թթվայնության պատճառը Csp-H կապին մասնակցող sp օրբիտալի արտահայտված s բնույթն է (s-ի բաժինը 1/2 է): Եռակի կապում էլեկտրոններն ավելի մոտ են տեղաբաշխված ածխածնի ատոմի միջուկին, որը հեշտացնում է ջրածնի պոկումը հիմքի ազդեցությամբ: Csp-H կապի ջրածինների թթվայնությունն ալկիններին հնարավորություն է տալիս փոխազդել ուժեղ հիմքերի հետ` առաջացնելով մետաղօրգանական միացություններ: Ստացված ացետիլենիդները և ալկիլմագնեզիում-հալոգենիդները ռեակցում են ալկիլհալոգենիդների հետ` առաջացնելով ացետիլենի տարբեր հոմոլոգներ.
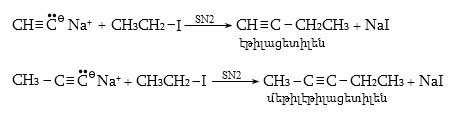
Առաջնային ալկիլ հալոգենիդները մեծ ելքով առաջացնում են ացետիլենային միացություններ, իսկ երկրորդային և երրորդային ալկիլհալոգենիդների դեպքում գերակշռում են պոկման արգասիքները:
11.5. Քիմիական հատկություններ
Ալկինների քիմիական հատկությունները պայմանավորված են ինչպես ածխածին-ածխածին եռակի կապի փոխարկումներով, այնպես էլ ծայրային ջրածնի շարժունակությամբ: Եռակի կապը քիմիական մեծ խնամակցություն է ցուցաբերում հատկապես այն ռեագենտների նկատմամբ, որոնք բևեռացնում են այն և օժտված են էլեկտրոֆիլ հատկություններով: Այդ պատճառով ալկինները ենթարկվում են զանազան միացման ռեակցիաների` առաջին փուլում առաջացնելով էթիլենային շարքի ածխաջրածիններ: Ալկինները ենթարկվում են նաև օքսիդացման և պոլիմերացման:
11.5.1. Միացման ռեակցիաներ
Ջրածնի, հալոգենների, հալոգենաջրածինների միացումը եռակի կապին կատարվում է ալկենների միացման ռեակցիաների նման, այն տարբերությամբ, որ եռակի կապը կարող է միացնել ռեագենտի երկու մոլեկուլ: Հնարավոր է ռեակցիան դադարեցնել առաջին փուլում` ընտրելով համապատասխան պայմաններ:
11.5.1.1. Հիդրոգենացում: Ալկինները ջրածին են միացնում մետաղական կատալիզատորների ներկայությամբ (Pt, Pd)` առաջացնելով ալկան: Միջանկյալ ալկենը հնարավոր չէ անջատել, քանի որ այն արագ փոխարկվում է ալկանի
![]()
Որոշ կատալիզային համակարգերի (Pd, PdO և CaCO3) կիրառմամբ վերականգնումը հնարավոր է կանգնեցնել ալկենի առաջացման փուլում: Կախված ռեակցիայի պայմաններից` ալկինների հիդրման արդյունքում կարող են ստացվել ցիս- և տրանս-ալկեններ: Օգտագործելով կապարի միացություններով թունավորված պալադիում` ստացվում են ցիս-ալկեններ, իսկ ալկալիական մետաղներով ամոնիակում (կամ ամիններում)` տրանս-ալկեններ.
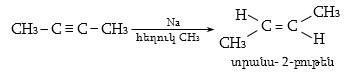
11.5.1.2. Հալոգենացում: Հալոգեններն ալկիններին միանում են ցածր ջերմաստիճաններում: Կախված ռեակցիայի պայմաններից` ալկինները կարող են միացնել մեկ կամ երկու մոլեկուլ հալոգեն (քլոր, բրոմ, յոդ) էլեկտրոֆիլ կամ ռադիկալային մեխանիզմներով.
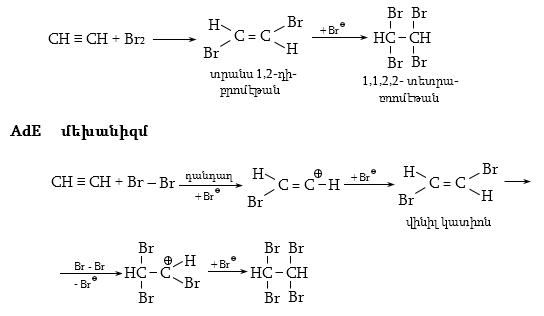
Հալոգենների միացումն ալկիններին էլեկտրոֆիլ մեխանիզմով համեմատած ալկենների հետ, ընթանում է ավելի դանդաղ, քանի որ միջանկյալ առաջացող վինիլ կատիոնը չափազանց անկայուն է (լիցքը համակարգում բաշխված չէ):
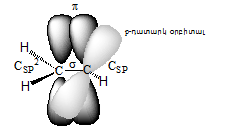
Վինիլ կատիոնի առաջացման ակտիվացման էներգիան ավելի մեծ է, քան ալկիլ կատիոնինը:
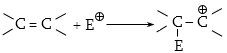
Այդ պատճառով վինիլ կատիոնն առաջանում է ավելի դանդաղ, և ալկինի միացման ռեակցիան ընդհանուր առմամբ դանդաղում է:
Հարուցիչների կամ լույսի (hn) ազդեցությամբ հալոգենները միանում են ռադիկալային մեխանիզմով (AdR):
11.5.1.3. Հիդրոհալոգենացում: Հալոգենաջրածիններն ացետիլենային ածխաջրածիններին միանում են անմիջականորեն կամ կատալիզատորների ներկայությամբ (Cu2CI2, HgCI2 և այլն).
![]()
Հալոգենաջրածինների միացումը ոչ սիմետրիկ ալկիններին իոնական ռեակցիայի պայմաններում (AdE) կատարվում է համաձայն Մարկովնիկովի կանոնի.
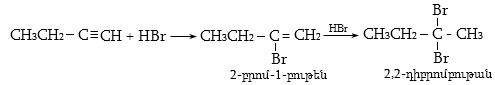
Հարուցիչների ներկայությամբ հալոգենաջրածնի միացումն ալկիններին (AdR) ընթանում է հակառակ Մարկովնիկովի կանոնի (Հարաշի էֆեկտ).
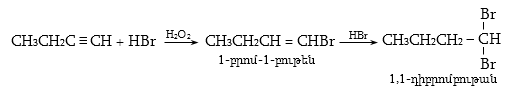
11.5.1.4. Հիդրատացում: Ացետիլենային ածխաջրածինները թթվային միջավայրում Hg2+ կատալիզատորի ներկայությամբ միացնում են ջուր (Կուչերովի ռեակցիա)` առաջացնելով ենոլներ, որոնք լինելով չափազանց անկայուն, անմիջապես իզոմերանում են կարբոնիլային միացության (Էլտեկովի կանոն): Ըստ Էլտեկովի կանոնի, կրկնակի կապին կից հիդրօքսիլ խումբն անկայուն է` վերախմբավորվում է համապատասխան կարբոնիլային միացության: Գործընթացն իրականացվում է ջրային կամ ջրասպիրտային միջավայրում: Որպես թթու օգտագործվում են ծծմբական թթու, քացախաթթու ացետանհիդրիդում կամ սնդիկի օքսիդ և տրիֆտորբորատ տրիֆտորքացախաթթվում.
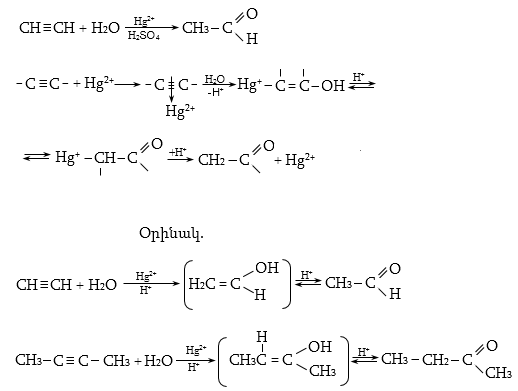
Նախ` առաջանում է ալկինի միջանկյալ կոմպլեքս սնդիկի երկվալենտ կատիոնի հետ, ապա` առաջացած կոմպլեքսը ջրի մոլեկուլի կողմից ենթարկվում է նուկլեոֆիլ գրոհման` միջանկյալ ենոլի առաջացումով, որն ուժեղ թթվի կատալիզով իզոմերվում է կարբոնիլային միացության: Հիդրատացումը կատարվում է ծծմբական թթվի նոսր լուծույթում երկվալենտ սնդիկի սուլֆատի ներկայությամբ` համաձայն Մարկովնիկովի կանոնի: Սնդիկի իոնները (նաև պղնձի և նիկելի) յուրահատուկ կատալիզատոր են ալկինների ռեակցիաների համար` եռակի կապի հետ առաջացնում են կոմպլեքսներ, որոնք մեծացնում են ալկինի լուծելիությունը ջրում և դյուրին դարձնում նուկլեոֆիլի հարձակումը: Արտադրությունում այս ռեակցիան օգտագործվում է քացախալդեհիդի ստացման համար: Ներկայումս մշակված է անմիջական հիդրատացման եղանակ. ացետիլենի և ջրային գոլորշու խառնուրդն անցկացվում է ծանր մետաղների ֆոսֆատների վրայով 300...400օC-ում:
11.5.1.5. Վինիլացում: Բնորոշ նուկլեոֆիլ ռեագենտներն (սպիրտներ, ֆենոլներ, թիոլներ, առաջնային և երկրորդային ամիններ, կարբոնաթթուներ, ամիդներ, կապտաթթու) ացետիլենային եռակի կապին միանում են AdN մեխանիզմով հիմնային կատալիզատորների (հիդրօքսիդներ, ալկալիական մետաղների ալկոհոլատներ կամ պղնձի (I) և սնդիկի (II) աղեր) ներկայությամբ` առաջացնելով վինիլային միացություններ, որոնք արժեքավոր մոնոմերներ են.
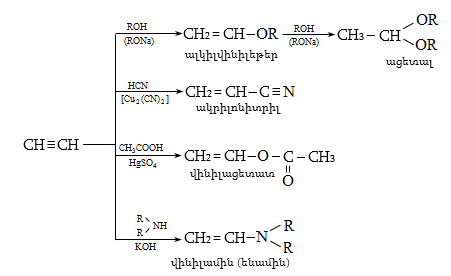
Նուկլեոֆիլ միացման մեխանիզմ.
![]()
11.5.1.6. Կարբոնիլացում: Ճնշման տակ մետաղների կարբոնիլների (նիկելի տետրակարբոնիլ) ներկայությամբ ացետիլենը փոխազդում է ածխածնի օքսիդի և շարժուն ջրածնի ատոմ ունեցող միացությունների հետ, ինչպիսիք են ջուրը, սպիրտները, առաջնային և երկրորդային ամինները, ամոնիակը (Վ. Ռեպպե): Այս ռեակցիաների օգնությամբ ստացվում են արժեքավոր մոնոմերներ պլաստիկ զանգվածների արտադրության համար (Ֆավորսկի):
11.5.2. Տեղակալման ռեակցիաներ
Ացետիլենի և ծայրային եռակի կապով ալկինների համար բնութագրական են տեղակալման ռեակցիաները, որոնք պայմանավորված են ացետիլենային ջրածնի թթվայնությամբ:
ա) ացետիլենային ջրածնի ատոմները տեղակալվում են մետաղներով.
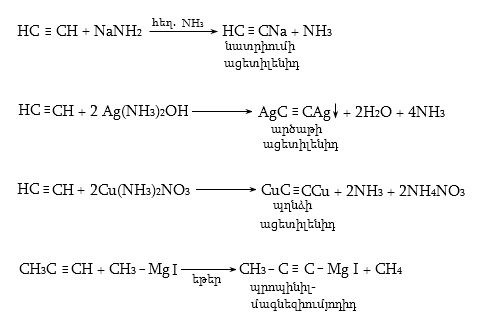
Հիմնականում գոյանում են երկտեղակալված ացետիլենիդներ, որոնք պայթյունավտանգ են: Նատրիումի և կալիումի ացետիլենիդներն աղանման նյութեր են, ջրում լավ են լուծվում: Ծանր մետաղների (արծաթ, պղինձ) ացետիլենիդները կովալենտ կառուցվածք ունեն և ջրում անլուծելի են: Արծաթի ացետիլենիդը սպիտակ բյուրեղային նյութ է, իսկ պղնձի ացետիլենիդը` կարմրագորշ: Չոր վիճակում պայթուցիկ են, օգտագործվում են ացետիլենի հայտնաբերման համար: Առավել հեշտությամբ գոյանում են մագնեզիումհալոգենածանցյալների ացետիլենիդները (Իոցիչի ռեակտիվ):
Ացետիլենիդները լայն կիրառություն ունեն օրգանական սինթեզում` մոլեկուլում եռակի կապ ներմուծելու համար: Որպես նուկլեոֆիլ ռեագենտներ կարող են մասնակցել նուկլեոֆիլ տեղակալման և միացման ռեակցիաներում (հալոգենալկանների, ալդեհիդների, կետոնների, ածխածնի դիօքսիդի հետ), առաջացնելով ացետիլենի հոմոլոգներ, ացետիլենային սպիրտներ և թթուներ: Այս նպատակների համար կիրառվում են ալկինիլմագնեզիումհալոգենիդներ (Իոցիչի կոմպլեքս).
Էթինիլկարբինոլներ
կարելի է միանվագ
ստանալ կարբոնիլային
միացությունների
կոնդենսացումով
ացետիլենների
հետ փոշի KOH-ի ներկայությամբ
![]() (Ֆավորսկի).
(Ֆավորսկի).
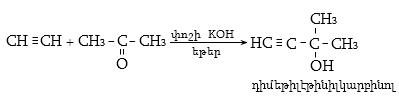
Այս ռեակցիաները կարելի է իրականացնել նաև հեղուկ ամոնիակում նատրիումի ացետիլենիդով:
Ացետիլենի ավելցուկի դեպքում կոնդենսացումն իրականանում է երկու մոլեկուլ կետոնի մասնակցությամբ: Առաջանում են ացետիլենային գլիկոլներ (Ա.Ե.Ֆավորսկի, Ա.Թ. Բաբայան).
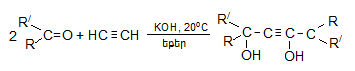
բ) արտադրական նշանակություն ունի ացետիլենի կոնդենսացումը մրջնալդեհիդի հետ բիսմուտի միացություններով կայունացված պղնձի ացետիլենիդի ներկայությամբ (Վ. Ռեպպե).
11.5.3. Օքսիդացում
Ալկինները սովորական օքսիդիչներով (KMnO4, O3, CrO3) օքսիդանում են եռակի կապի խզումով` առաջացնելով համապատասխան կարբոնաթթուներ.
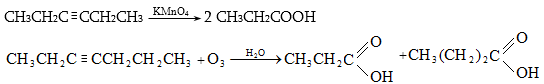
11.5.4. Պոլիմերացում
Տեսական և տեխնիկական հետաքրքրություն է ներկայացնում ացետիլենի կարգավորված պոլիմերացումը:
ա) Ակտիվացած ածխի վրա 5000C-ում ացետիլենը ենթարկվում է ցիկլային տրիմերացման` առաջացնելով բենզոլ (Բերտլո): Բենզոլի ելքը մեծանում է 60...700C-ում Ռեպպեի կատալիզատորի (նիկելի դի-կարբոնիլտրիֆենիլֆոսֆին) ներկայությամբ.
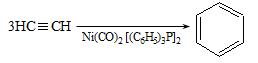
բ) Պղնձի (I) աղերի կատալիզային ազդեցությամբ ամոնիումի քլորիդի ներկայությամբ տեղի է ունենում ացետիլենի գծային դիմերացում և տրիմերացում. համապատասխանաբար առաջանում են վինիլացետիլեն և դիվինիլացետիլեն (Ռեպպե).
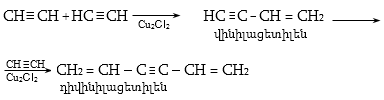
գ) Ացետիլենը տետրահիդրոֆուրանում նիկելի ցիանիդի ներկայությամբ առաջացնում է 8-, 10- և 12- անդամ չհագեցած ածխաջրածիններ (Ռեպպե).
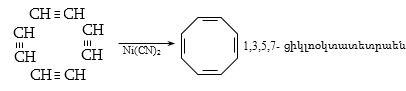
Այս բոլոր ռեակցիաներն ունեն գործնական նշանակություն:
11.5.5. Իզոմերացում
Ացետիլենային ածխաջրածիններն իզոմերանում են եռակի կապի տեղաշարժով. ալկալիական մետաղների ալկոհոլատների ազդեցությամբ ծայրային եռակի կապով ալկինները վերածվում են մեջտեղում եռակի կապով ալկինների և հակառակը` ալկալիական մետաղների ներկայությամբ տեղի է ունենում եռակի կապի տեղաշարժ մեջտեղից դեպի ծայր (պրոտոնի թռիչքով իզոմերացում): Այս փոխարկումներում միջանկյալ միացություններ են ալենային ածխաջրածինները (Ֆավորսկի).
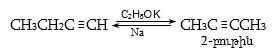
Պրոտոնի թռիչքով իզոմերացումը կարելի է նկարագրել հետևյալ կերպ.
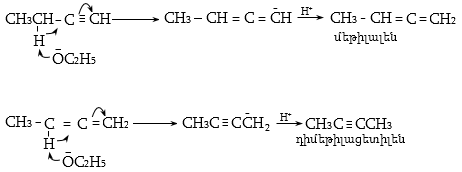
Որոշ կատալիզատորների ներկայությամբ ալկինները կարող են փոխարկվել զուգորդված դիենային ածխաջրածինների: Այս գործընթացում, որպես միջանկյալ միացություններ, առաջանում են ալենային ածխաջրածիններ.
![]()
Խնդիրներ
1.Գրել հետևյալ ալկինների կառուցվածքային բանաձևերը.
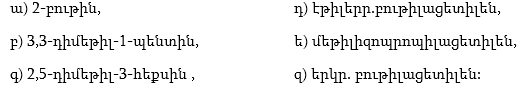
2. Գրել C8H14 բաղադրությամբ ալկինների կառուցվածքային բանաձևերը, որոնց գլխավոր շղթան բաղկացած է վեց ածխածնի ատոմից: Անվանել ռացիոնալ և IUPAC անվանակարգումով:
3. Անվանել այն ացետիլենային ածխաջրածինները, որոնց հիդրոգենացումով ստացվում են 2-մեթիլպենտան, 2,2-դիմեթիլհեքսան:
4. Հետևյալ ալկիններն անվանել IUPAC անվանակարգումով.
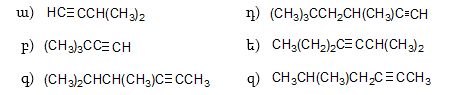
5. Իրականացնել հետևյալ փոխարկումները.

6. Ինչպիսի՞ ռեագենտներով կարելի է իրականացնել հետևյալ փոխարկումները.
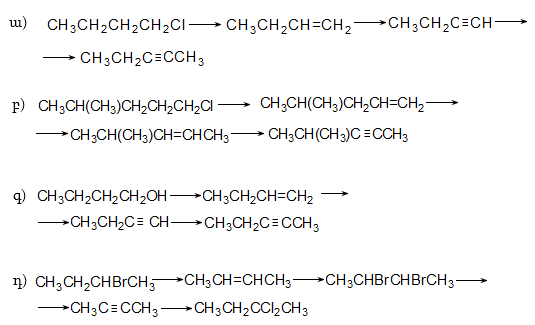
7. C6H10 ածխաջրածինը միացնում է բրոմ, արծաթի օքսիդի ամոնիակային լուծույթի հետ առաջացնում է նստվածք, օքսիդացման ժամանակ ստացվում են իզոպրոպիլքացախաթթու և ածխաթթու: Գրել ածխաջրածնի կառուցվածքը և ռեակցիաների հավասարումները:
8. Գրել Կուչերովի ռեակցիան ացետիլենի, էթիլացետիլենի, մեթիլացետիլենի համար: Բերել ռեակցիայի մեխանիզմը:
9. Համեմատել 1-բութինի և 2-բութինի վարքը հետևյալ ռեագենտների հետ փոխազդեցության ժամանակ.
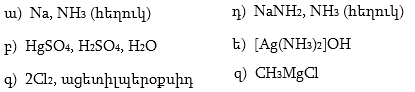
10. Իրականացնել հետևյալ փոխարկումները.
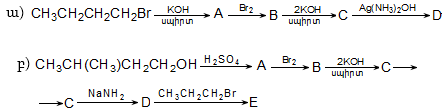
11. Ացետիլենից ստանալ քացախաթթու, վինիլացետատ, վինիլքլորիդ, վինիլացետիլեն, պրոպարգիլսպիրտ, 1,4-բութանդիոլ:
12. C6H10 բաղադրությամբ ածխաջրածնի հիդրոգենացումով ստացվում է 2-մեթիլպենտան, հիդրատացումով առաջանում է կետոն: Այդ ածխաջրածինը չի փոխազդում արծաթի օքսիդի ամոնիակային լուծույթի հետ: Պարզել դրա կառուցվածքը:
13. Իրականացնել հետևյալ փոխարկումները.
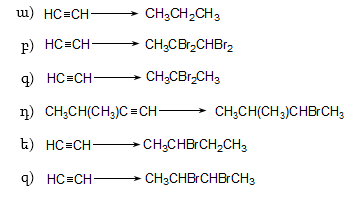
14. Գրել հետևյալ ռեակցիաները.
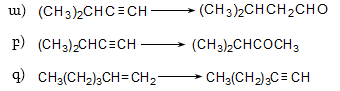
15. Գրել հետևյալ միացությունների կոնդենսացման ռեակցիաները.

16. Հետևյալ ալկիններն անվանել ռացիոնալ և IUPAC անվանակարգումով.
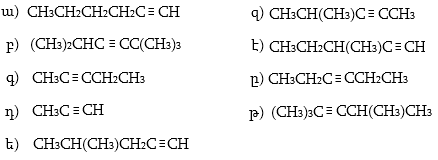
17. Իրականացնել հետևյալ փոխարկումները և անվանել ստացված միացությունները.
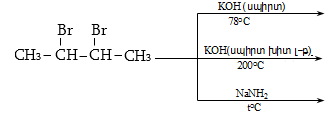
18. Լրացնել ռեակցիաները, անվանել ստացվող միացությունները.
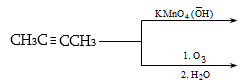
19. Լրացնել հետևյալ փոխարկումները և անվանել արգասիքները.

20. Գրել պրոպինի փոխազդեցության ռեակցիաները հետևյալ ռեագենտների հետ, անվանել արգասիքները.
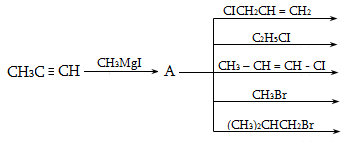
21. 2-հեքսինի մշակումով HgSO4 և H2SO4 խառնուրդով ստացվում են C6H12O բաղադրությամբ երկու միացություն: Գրել դրանց կառուցվածքային բանաձևերը:
22. Իրականացնել հետևյալ փոխարկումները, նշել ռեագենտները.

23. Ացետիլենից (էթին) ստանալ.
24. Գրել ացետիլենի ռեակցիան հետևյալ ռեագենտների հետ` նշելով կիրառվող կատալիզատորները.
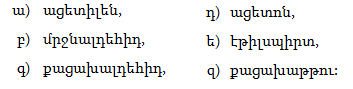
25. Իրականացնել հետևյալ փոխարկումները.
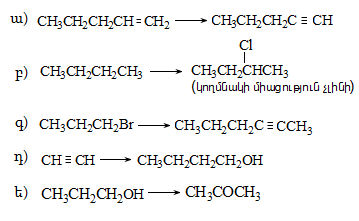
26. 20 գ տեխնիկական կարբիդը ջրով մշակելիս առաջանում է գազ, որը բրոմաջրի ավելցուկի միջով անցկացնելիս առաջանում է 86,5գ 1,1,2,2 - տետրաբրոմէթան: Որոշել կալցիումի կարբիդի զանգվածային բաժինը տեխնիկական նմուշում:
27. 80% կալցիումի կարբիդ պարունակող ի՞նչ զանգվածով տեխնիկական կարբիդ է անհրաժեշտ 12,5 գ վինիլքլորիդի առաջացման համար, եթե յուրաքանչյուր փուլի ելքը 80% է:
28. Կալցիումի կարբիդից ստացված 1,12 լ անգույն գազը փոխազդել է 2,925 գ կերակրի աղից և ծծմբական թթվից ստացված քլորաջրածնի հետ: Առաջացած միացությունից ստացվել է 2,2 գ պոլիմեր: Որոշել պոլիմերի ելքը (ըստ տեսականի) մոնոմերից պոլիմերի ստացման փուլում: Որքա՞ն կալցիումի կարբիդ է ծախսվել:
29. Գլխավոր շղթայում հինգ ածխածնի ատոմ ունեցող ացետիլենային ածխաջրածինը միացնում է 80 գ բրոմ, ստացվում է 114 գ նյութ: Պարզել ածխաջրածնի կառուցվածքը, եթե այն արծաթի օքսիդի ամոնիակային լուծույթի հետ չի փոխազդում:
30. 33,6 լ մեթանի ջերմային քայքայումից առաջացած գազային խառնուրդն անցկացվում է արծաթի օքսիդի ամոնիակային լուծույթի ավելցուկի միջով: Գազերի ծավալը փոքրանում է 20%-ով: Ինչքա՞ն քացախալդեհիդ կստացվի անջատված ացետիլենից Կուչերովի ռեակցիայով, եթե ռեակցիայի ելքը 70% է:
31. Որոշել C8H6 ածխաջրածնի կառուցվածքը, եթե այն գունազրկում է բրոմաջուրը, օքսիդանում է բենզոյական թթվի և արծաթի օքսիդի ամոնիակային լուծույթում առաջացնում է նստվածք:
32. Միևնույն ածխածնի ատոմների թիվ ունեցող 7,84 լ էթիլենային և ացետիլենային ածխաջրածինների խառնուրդը կարող է միացնել 80 գ բրոմ: Առաջացած արգասիքների խառնուրդը 94,4 գ է: Որոշել ելային խառնուրդի կառուցվածքը և բաղադրությունը(զանգվածային %):
12. ԱԼԿԱԴԻԵՆՆԵՐ
(ԴԻԵՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐ, ԱԼԻՖԱՏԻԿ ԴԻԵՆՆԵՐ)
Ալկադիենները երկու կրկնակի կապ ունեցող ածխաջրածիններ են, որոնց ընդհանուր բանաձևն է` CnH2n-2: Հաճախ դրանք կոչվում են նաև դիենային շարքի ածխաջրածիններ կամ ալիֆատիկ դիեններ:
12.1. Անվանակարգում, իզոմերի
Այս բաժնում քննարկվող ածխաջրածինները կոչվում են համապատասխան ալկանի անվանը կցելով դիեն վերջավորությունը` նշելով կրկնակի կապերի դիրքերը:
Որպես գլխավոր ածխածնային շղթա ընդունվում է կրկնակի կապեր պարունակող ամենաերկար շղթան: Համարակալումը կատարվում է շղթայի այն ծայրից, որին մոտ է կրկնակի կապը:
Կրկնակի կապերի փոխադարձ դասավորությամբ պայմանավորված` տարբերում են երեք տիպի ալկադիեններ.
ա)
կումուլացված
կամ ալենային`
![]() կից
են.
կից
են.

Կումուլացված կրկնակի կապերով դիենի քվանտաքիմիական մոդելը ենթադրում է ծայրային երկու ածխածինների sp2 հիբրիդացում, իսկ կենտրոնական ածխածնի ատոմի` sp հիբրիդացում: Կենտրոնական ածխածնի ատոմից հեռացող կապերը գծային են և ծայրային ածխածնի տեղակալիչները գտնվում են փոխուղղահայաց հարթություններում: Ալենային միացություններին բնորոշ էլեկտրոֆիլ և ռադիկալային միացման ռեակցիաներն ավելի հեշտ են ընթանում, քան ալկեններում: Արդյունքում գոյանում են վինիլային և ալիլային միացություններ: Ալենային ածխաջրածինների ածխածնի ատոմների խառը հիբրիդային կառուցվածքն անկայուն է, և միացությունը որոշակի պայմաններում վերածվում է ալկինի կամ զուգորդված ալկադիենի:
բ)
զուգորդված կրկնակի
կապերով դիեններ՝![]() կապերը
բաժանված են մեկ
կապերը
բաժանված են մեկ
![]() կապով.
կապով.

Զուգորդված
դիեններում![]() կապերը
միմյանցից բաժանված
են մեկ
կապերը
միմյանցից բաժանված
են մեկ ![]() առկա
է
առկա
է ![]() զուգորդում
(
զուգորդում
(![]() կապերի
էլեկտրոնային
ամպերի լրացուցիչ
փոխազդեցություն),
որը գնահատվում
է զուգորդման էներգիայով:
Բութադիենի զուգորդման
էներգիան
կապերի
էլեկտրոնային
ամպերի լրացուցիչ
փոխազդեցություն),
որը գնահատվում
է զուգորդման էներգիայով:
Բութադիենի զուգորդման
էներգիան ![]() կՋ/մոլ է:
կՋ/մոլ է:
գ)
առանձնացված կրկնակի
կապերով դիեններ.
![]() կապերը
հեռացված են երկու
կամ ավելի
կապերը
հեռացված են երկու
կամ ավելի ![]() կապերով.
կապերով.
![]()
Այս միացություններն իրենց քիմիական հատկություններով չեն տարբերվում ալկեններից:
Զուգորդված և կումուլացված կրկնակի կապերով դիեններն իրենց հատկություններով էապես տարբերվում են ալկեններից և միմյանցից, այդ պատճառով կքննարկվեն ավելի հանգամանորեն:
12.2. Ֆիզիկական հատկություններ
Բութադիենը`
դիվինիլը, սովորական
պայմաններում
բնորոշ հոտով գազ
է ![]() իզոպրենը
իզոպրենը
![]() և մյուս
պարզագույն ալկադիենները`
հեղուկ: Ածխաջրածիններին
բնորոշ օրինաչափությունները
գործում են նաև
այս հոմոլոգիական
շարքում: Ալկադիենները
ՈՒՄ ճառագայթներ
կլանում են ավելի
երկար ալիքի տիրույթում
(ցածր էներգիայով),
քան ալկենները:
Այսպես, բութադիենի
կլանման տիրույթը
217 նմ է, իսկ էթիլենինը`
187 նմ: Զուգորդված
կրկնակի կապերի
թվի մեծացմամբ
կլանման առավելագույն
կետը ՈՒՄ դաշտից
տեղաշարժվում
է տեսանելի դաշտ.
չորս հատ զուգորդված
և մյուս
պարզագույն ալկադիենները`
հեղուկ: Ածխաջրածիններին
բնորոշ օրինաչափությունները
գործում են նաև
այս հոմոլոգիական
շարքում: Ալկադիենները
ՈՒՄ ճառագայթներ
կլանում են ավելի
երկար ալիքի տիրույթում
(ցածր էներգիայով),
քան ալկենները:
Այսպես, բութադիենի
կլանման տիրույթը
217 նմ է, իսկ էթիլենինը`
187 նմ: Զուգորդված
կրկնակի կապերի
թվի մեծացմամբ
կլանման առավելագույն
կետը ՈՒՄ դաշտից
տեղաշարժվում
է տեսանելի դաշտ.
չորս հատ զուգորդված
![]() կապերի
առկայության դեպքում
արտահայտվում
է դեղին գունավորմամբ:
կապերի
առկայության դեպքում
արտահայտվում
է դեղին գունավորմամբ:
ԻԿ սպեկտրում 1,3-դիեններին բնորոշ է կրկնակի կապերի վալենտային տատանումների հաճախականության փոքրացում և ինտենսիվության մեծացում (1500...1600 սմ-1):
12.3. Կիրառման բնագավառներ, թունավորություն
Դիենային ածխաջրածինները հումք են արհեստական կաուչուկների և խեժերի ստացման համար: Դիենների արդյունաբերական կիրառությունը պայմանավորված է նաև պոլիամիդային թելերի, պլաստիֆիկատորների, լաքերի, ներկերի, ինսեկտիցիդների, անտիպիրենների, դեղանյութերի արտադրություններով:
Բութադիենը քիչ քանակությամբ գտնվում է լուսատու գազում, իզոպրենը` տերպենային տեսակի ածխաջրածիններում, նաև լիմոնենի, սկիպիդարի, դիպենտենի բաղադրության մեջ: Վերջինս ստացվել է բնական կաուչուկի չոր թորմամբ: Դիեններ կան նաև տերպեններում` միրցենում, օցիմենում և այլն:
Արհեստական
կաուչուկների
հիմնական հումք
հանդիսացող բութադիենի
համաշխարհային
տարեկան արտադրությունը
կազմում է![]() մլն տոննա,
իսկ իզոպրենինը`
մլն տոննա,
իսկ իզոպրենինը`
![]() մլն
տոննա: Դիենային
ածխաջրածինների
արտադրությունը
2002 թ. կազմել է 20 մլն
տոննա:
մլն
տոննա: Դիենային
ածխաջրածինների
արտադրությունը
2002 թ. կազմել է 20 մլն
տոննա:
Դիենային ածխաջրածինները վտանգավոր են կենտրոնական նյարդային համակարգի համար, ազդում են լորձաթաղանթի վրա: Մշտական թունավորման դեպքում սկսվում է արյունատար անոթների խաթարում: Բութադիենը թունավոր գազ է, ՍԹԿ-ն մթնոլորտում 0,1 մգ/մ3 է, գրգռում է աչքի լորձաթաղանթը, շնչուղիները: Իզոպրենի ՍԹԿ-ն 0,04 մգ/մ3 է:
Իզոպրենը բարձր խտությամբ թմրանյութ է, իսկ ցածր խտությամբ` գրգռում է շնչառական ուղիները, լորձաթաղանթները:
12.4. Զուգորդված դիենների ստացման եղանակներ
12.4.1. Զուգորդված 1,3-դիենների ստացման ժամանակակից արդյունաբերական եղանակ է ալկանների և ալկենների կատալիզային դեհիդրոգենացումը: Բութադիեն և իզոպրեն ստացվում են, համապատասխանաբար, նավթի թորման գործընթացում առաջացող բութան-բութիլենային և իզոպենտան-ամիլենային խառնուրդների դեհիդրոգենացումով Cr2O3 կատալիզատորի ներկայությամբ: Դեհիդրոգենացման գործընթացն իրականացվում է միափուլ կամ երկփուլ.
12.4.1.1. Միափուլ գործընթացի ժամանակ վերը նկարագրված խառնուրդամասերն անցկացվում են ալյումինքրոմային կատալիզատորի անշարժ շերտի վրայով, 5..10 րոպեի ընթացքում, 550...6500C-ում: Բութադիենի ելքը 15% է, իզոպրենինը` 35%:
12.4.1.2. Երկփուլ գործընթացի առաջին փուլում բութանն անցկացվում է ալյումինքրոմային կատալիզատորի վրայով` «եռացող շերտում» 500...6000C-ում: Ստացվում է բութեն 30% ելքով, որը գազ-գոլորշային խառնուրդից արտահանվում է ջրային ացետոնով կամ դիմեթիլֆորմամիդով: Երկրորդ փուլում բութենը նոսրացնում են գերտաք գոլորշով և դեհիդրոգենացնում քրոմկալցիումֆոսֆատային կատալիզատորի ներկայությամբ ադիաբատ ռեակտորում 600...6600C-ում (ելքը 40%): Բութադիենի անջատումը կատարվում է ացետոնիտրիլով, դիմեթիլֆորմամիդով կամ պղնձի ացետատով ամոնիակի ջրային լուծույթում (քեմոսորբում).
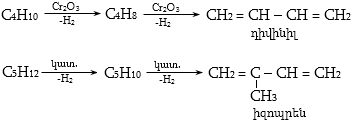
Իրականացվում
է նաև վերոհիշյալ
ածխաջրածնային
խառնուրդների
օքսիդացում-դեհիդրոգենացում`
ջրային գոլորշու
և տաք օդի խառնուրդով`
երկաթի օքսիդների
անշարժ շերտի ներկայությամբ:
Արգասիքներն ստացվում
են բարձր ելքերով
![]()
12.4.2. 1,2-, 1,3- կամ 1,4-դիոլների դեհիդրատացում (արտադրական եղանակ)

12.4.3.![]() կամ
-
կամ
- ![]() չհագեցած
սպիրտների դեհիդրատացում
չհագեցած
սպիրտների դեհիդրատացում
![]()
Պոկման ռեակցիայի մեխանիզմն է.
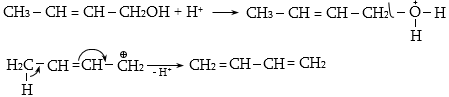
12.4.4. Արտադրական եղանակ է էթիլսպիրտից դիվինիլի ստացումը 400...5000C-ում, AI2O3-ZnO կատալիզատորների ներկայությամբ (Ի.Վ. Լեբեդև, 1933թ.): Ռեակցիայի մեխանիզմը ներառում է հետևյալ փուլերը. սպիրտի դեհիդրում, ալդեհիդի ալդոլ կոնդենսացում, օքսիալդեհիդի դեհիդրատացում` կրոտոնային ալդեհիդի առաջացմամբ, վերջինիս վերականգնում կրոտիլսպիրտի և դեհիդրատացում (Յու.Ա. Գորին).
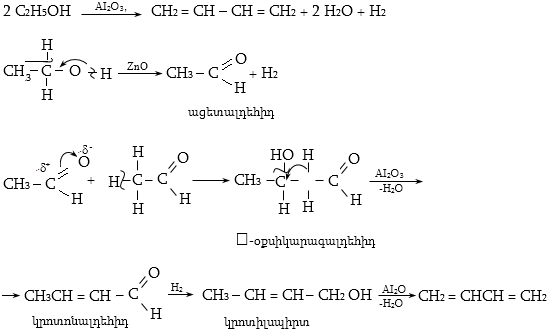
12.4.5.Ռեպպեի եղանակ (տես «Ալկիններ»)
![]()
12.4.6.Պրինսի ռեակցիա (տես «Ալկեններ»)
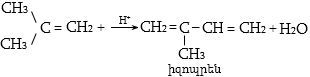
12.5. Քիմիական հատկություններ
Զուգորդված համակարգով պայմանավորված` ալկադիենները, ի տարբերություն ալկենների, ավելի կայուն են և ռեակցիոնունակ: Դրանց բնորոշ են AdE, AdR, դիմերացման, պոլիմերացման ռեակցիաներ:
12.5.1. Միացման ռեակցիաներ
Մոլեկուլները զուգորդված դիեններին միանում են ինչպես ծայրային` 1,4-դիրքերում, այնպես էլ` 1,2 կամ 3,4 դիրքերում: Ռեակցիայի ուղղությունը պայմանավորված է դիենային ածխաջրածնի կառուցվածքով, ռեագենտի, կատալիզատորի բնույթով և ռեակցիայի միջավայրով:
Ստորև բերված են միացման ռեակցիաների օրինակներ`
12.5.1.1. Հիդրոգենացում
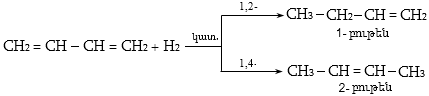
12.5.1.2. Հալոգենացում
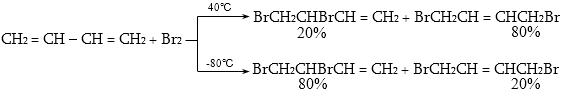
AdE մեխանիզմով միացման ռեակցիայի առաջին փուլում առաջանում է p-կոմպլեքս, որը վերածվում է զուգորդված(մեզոմեր) կարբկատիոնի, իսկ վերջինս արագ փոխազդում է նուկլեոֆիլի հետ:
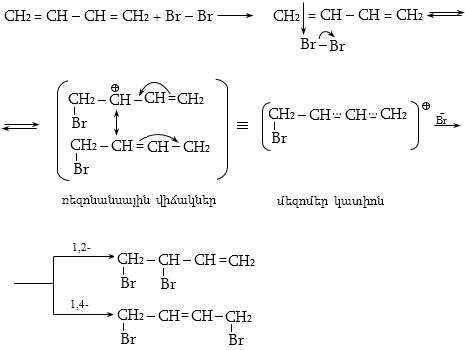
Ստացվող միացությունների ելքը պայմանավորված է դիենի կառուցվածքով, հալոգենի բնույթով և ռեակցիայի պայմաններով: 1,4-արգասիքի ելքը մեծանում է ջերմաստիճանի բարձրացումով: Եթե համակարգը մոտ է հավասարակշռային վիճակին, գերակշռում է էներգիապես առավել շահավետ 1,4-ը, հակառակ դեպքում` հիմնականում ստացվում է 1,2- միացություն:
AdR մեխանիզմով հալոգենի միացման ժամանակ առաջանում է զուգորդված ռադիկալ, որն օժտված է երկակի ռեակցիոնունակությամբ, սակայն հիմնականում ստացվում է 1,4-արգասիք, քանի որ ռադիկալի միացումով ծայրային ածխածիններից մեկին առաջանում է կայուն ալիլ ռադիկալ:
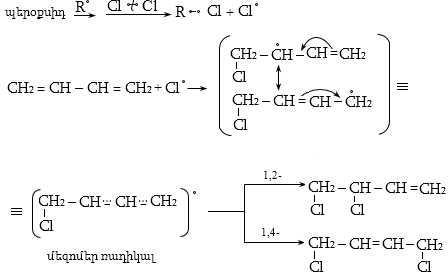
12.5.1.3. Հիդրոհալոգենացում: Հալոգենաջրածինների միացման ռեակցիաներում գործում են նույն օրինաչափությունները, ինչ հալոգենների միացման ռեակցիաներում.
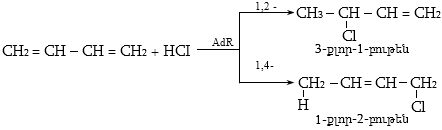
12.5.1.4. Հիպոհալոգենացում: Հիպոհալոգենաթթուները և դրանց եթերները գերազանցապես միանում են 1,2-դիրքերում: Ռեակցիայի պահին համակարգը հեռու է հավասարակշռային վիճակից (CO կապն ավելի կայուն է CHaI կապից), իսկ 1,2-արգասիքների առաջացման ակտիվացման էներգիան 1,4-միացման ռեակցիայի ակտիվացման էներգիայից փոքր է:
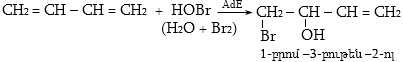
Ռեակցիայի մեխանիզմը հետևյալն է.
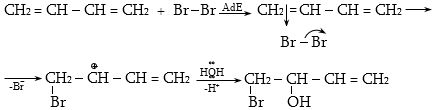
12.5.2. Դիենային սինթեզ (Դիլս-Ալդերի ռեակցիա)
Էլեկտրոնակցեպտոր խմբերով ակտիվացված կրկնակի կապով միացության (դիենոֆիլ) և դիենային ածխաջրածնի 1,4-միացման արդյունքում առաջանում են քանակական ելքով վեցանդամանի ցիկլային միացություններ: Գործընթացի խիստ կարևորությունը բնութագրում է այն փաստը, որ ռեակցիայի հայտնագործման և զարգացման համար Օտտո Դիլսը և Կուրտ Ալդերը 1950 թվականին արժանացել են Նոբելյան մրցանակի:
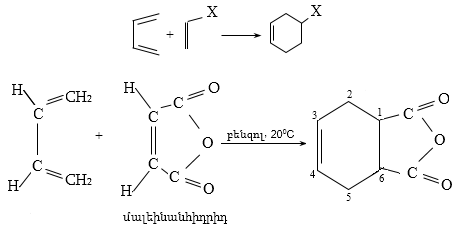
Ցիկլացման
գործընթացում
պահպանվում է դիենի
և ալկենի (դիենոֆիլի)
տարածական դասավորությունը:
Միացումը տեղի
է ունենում մեկ
փուլով. դիենոֆիլը
փոխազդում է դիենի
երկու ծայրերի
հետ միաժամանակ:
Ենթադրվել և հետագայում
հաստատվել է, որ
դիենը գտնվում
է s-ցիս-կոնֆորմացիայում,
և կրկնակի կապերը
տեղաբաշխված են
դրանց միացնող
![]() կապի նկատմամբ
հարթության մի
կողմում:
կապի նկատմամբ
հարթության մի
կողմում:
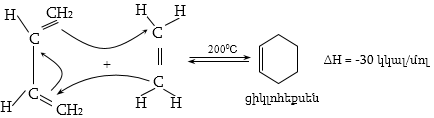
Դիլս-Ալդերի ռեակցիան հեշտ է ընթանում, եթե դիենում առկա են էլեկտրոնադոնոր (+I , +M), իսկ դիենոֆիլում` էլեկտրոնակցեպտոր խմբեր (-I,-M). նորմալ կամ ուղիղ դիենային սինթեզի ռեակցիա: Երբ դիենում կան էլեկտրոնակցեպտոր, իսկ դիենոֆիլում` էլեկտրոնադոնոր խմբեր` կատարվում է հակառակ դիենային սինթեզի ռեակցիա: Գոյություն ունի նաև չեզոք դիենային սինթեզի ռեակցիա, երբ ռեակցիայի արագությունը և ուղղությունը կախված չեն տեղակալիչներից:
Ոչ սիմետրիկ դիենի և ոչ սիմետրիկ դիենոֆիլի փոխազդեցության ժամանակ հնարավոր է երկու տարբեր միացության առաջացում:
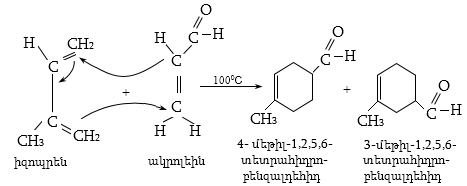
Այսպիսի տեղընտրողականությունը, երբ «օրթո» և «պարա» միացությունների գոյացումն առավել գերադասելի է «մետա» իզոմերի գոյացումից, բացատրվում է ՄՕ հաշվարկների հիման վրա:
Ս.Վ. Լեբեդևը հայտնաբերել է իզոպրենի (բութադիենի) դիմերացման ռեակցիան, որտեղ մոլեկուլներից մեկը դիեն է, մյուսը` դիենոֆիլ: Այս ռեակցիան դիենային սինթեզի նախատիպն է: Տաքացման պայմաններում տեղի է ունենում 1,4-1,2 ցիկլացում: Քիչ քանակներով ստացվում է նաև 1,4-1,4 միացման արգասիք.
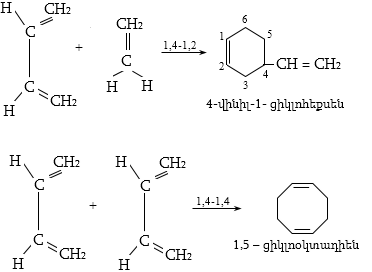
12.6.3. Պոլիմերացում
Ալիֆատիկ դիենները պոլիմերանում և համապոլիմերանում են զանազան վինիլային մոնոմերների հետ` առաջացնելով կաուչուկներ, կաուչուկանման նյութեր, էլաստոմերներ: Ալկենների պոլիմերացման ընդհանուր օրինաչափությունները ռադիկալային և իոնական մեխանիզմներով առկա են նաև ալկադիեններում: Պոլիմերացումը նույնպես կատարվում է 1,2- և 1,4-դիրքերում (գերակշռում է 1,4-պոլիմերացումը): Դիենային ածխաջրածինների շղթայական պոլիմերացումը կատալիզատորների կամ հարուցիչների ներկայությամբ ունի արդյունաբերական նշանակություն: Որպես կատալիզատոր օգտագործվում են ալկալիական մետաղներ, մետաղօրգանական միացություններ, օրգանական և անօրգանական պերօքսիդներ.
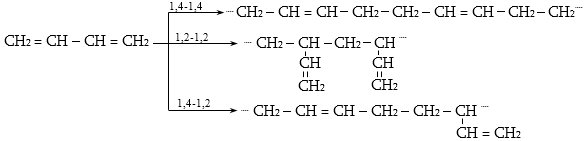
Տեղակալված դիենների պոլիմերացումը վերաբերում է «գլուխը պոչին» տեսակին: Առավել արժեքավոր միացություններ են ստացվում տարածականորեն կարգավորված պոլիմերացման գործընթացում. միացումը կատարվում է 1,4-դիրքերում յուրաքանչյուր մնացորդի ցիս-կոնֆիգուրացիայով: Այսպես, ցիս-պոլիիզոպրենն ունի բնական կաուչուկի կառուցվածքը.
Կաուչուկի կառուցվածքն ապացուցված է օզոնացումով, որի արդյունքում ստացվում են օքսոմիացություններ`
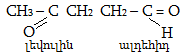
1955 թվականին Հուդյիրը և Ֆատերստոնը Նաթթի-Ցիգլերի կատալիզատորով (տրիէթիլալյումինի և տիտանի քլորիդի կոմպլեքս` մանրացված մետաղական լիթիումի հետ) իզոպրենի տարածական կարգավորված պոլիմերացումով սինթեզել են ցիս-պոլիիզոպրեն:
Արժեքավոր համապոլիմեր է բութադիենի և ստիրոլի (C6H5 CH = CH2) պոլիմերը` ավտոդողային կաուչուկ: Բութադիենի և ակրիլոնիտրիլի (CH2 = CH CN) համապոլիմերացումով ստացվում են բենզինի և յուղերի նկատմամբ կայուն կաուչուկներ: Իզոբութիլենի և բութադիենի կամ իզոպրենի համապոլիմերները քիմիապես կայուն կաուչուկներ են:
Կաուչուկները պլաստիկ նյութեր են, որոնց առաձգականություն, ամրություն, ջերմության, լուծիչների և քիմիական ռեագենտների նկատմամբ կայունություն հաղորդելու համար ենթարկում են վուլկանացման` տաքացնելով ծծմբի կամ դրա միացությունների հետ, խառնելով լցանյութի հետ: Վուլկանացման ժամանակ կատարվում է կաուչուկի գծային մոլեկուլների «լայնակի կարում» ցանցային կառուցվածքի առաջացումով, և ստացվում է ռետին:
Խնդիրներ
1.Պարզել ածխաջրածնի կառուցվածքը, որն ստացվում է CH3CH2CH(OH)CH2CH(OH)CH3 երկատոմ սպիրտի դեհիդրատացման արդյունքում: Գրել ռեակցիայի պայմանները:
2.Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը և անվանել IUPAC անվանակարգումով.
3.Անվանել հետևյալ ածխաջրածինները.

4. Իզոբութիլենից և ֆորմալդեհիդից ստանալ իզոպրեն: Գրել ռեակցիայի պայմանները:
5. Հաստատել C6H10 բաղադրությամբ դիենային ածխաջրածնի կառուցվածքը, եթե այն միացնում է բրոմի մոլեկուլ` վերածվելով C6H10Br2-ի, որի օզոնոլիզով ստացվում է բրոմացետոն:
6. Ացետիլենից ստանալ դիվինիլ, եթե միջանկյալ փուլում առաջանում է` ա) քացախալդեհիդ, բ) պրոպարգիլ սպիրտ:
7. Պատկերել 1,3-բութադիենի ատոմաօրբիտալային կառուցվածքը: Բացատրել զուգորդված դիենների քիմիական հատկությունները` պայմանավորված դրանց յուրահատուկ կառուցվածքով: Ի՞նչ է զուգորդման էներգիան:
8. Գրել իզոպրենի փոխազդեցության ռեակցիան բրոմի և բրոմաջրի հետ.
ա) պերօքսիդների և թթվածնի բացակայության դեպքում,
բ) պերօքսիդների և թթվածնի ներկայության դեպքում:
9. Գրել C5H8 ածխաջրածնի կառուցվածքային բանաձևը, եթե դրա օզոնոլիզի արդյունքում ստացվում են ֆորմալդեհիդ, քացախալդեհիդ և գլիօքսալ:
10. Հետևյալ սխեմայում գրել միջանկյալ և վերջնական արգասիքների կառուցվածքային բանաձևերը.
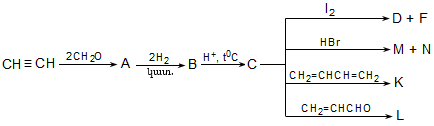
11. Հետևյալ միացություններից ստանալ դիենային ածխաջրածին, նշել ռեակցիաների պայմանները.
12. Հնարավոր
եղանակներով ստանալ
դիվինիլ և գրել
վերջինիս հիդրոգենացման,
յոդացման ![]() օզոնոլիզի, պոլիմերացման
ռեակցիաները:
օզոնոլիզի, պոլիմերացման
ռեակցիաները:
13. Իրականացնել հետևյալ փոխարկումները.
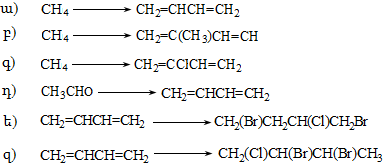
14. Լրացնել սխեման, գրել ռեակցիաների մեխանիզմները.
![]()
15. Դիլս-Ալդերի ռեակցիայի պայմաններում գրել ակրոլեինի փոխազդեցությունը բութադիենի և իզոպրենի հետ: Անվանել ստացվող միացությունները:
16. Լրացնել հետևյալ ռեակցիաները: Անվանել ստացվող արգասիքները.

17. Հետևյալ կատիոնների համար գրել բոլոր ռեզոնանսային կառուցվածքները.
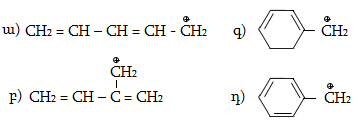
18. Հետևյալ զույգ ռեզոնանսային կառուցվածքներում ո՞րն ավելի մեծ ներդրում ունի ռեզոնանսային հիբրիդում.
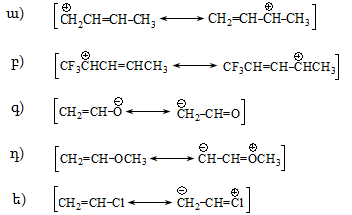
19. Լրացնել հետևյալ ռեակցիաները.
20. Պատկերել
հետևյալ միացությունների
ատոմաօրբիտալային
մոդելը: Ո՞ր մոլեկուլում
կա զուգորդում
(![]() փոխազդեցություն).
փոխազդեցություն).
21. Հետևյալ միացություններից ստանալ 1,3-բութադիեն.
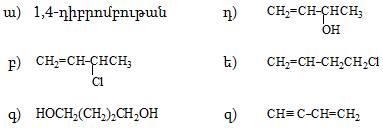
22. Լրացնել հետևյալ փոխարկումները.
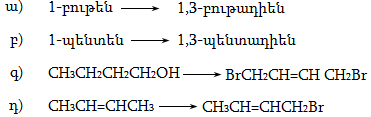
23. 16,8 լ բութադիենի կատալիզային հիդրոգենացումով ստացված բութանի և իզոմեր բութենների խառնուրդը գունազրկում է 800 գ 10%-ոց բրոմի լուծույթը քլորոֆորմում: Որքա՞ն ջրածին է ծախսվել հիդրոգենացման համար:
24. Պարզել C8H14 բաղադրությամբ մոլեկուլի կառուցվածքը, եթե այն օքսիդանում է` առաջացնելով ացետոն և թրթնջկաթթու:
25. Լրացնել հետևյալ ռեակցիաները.
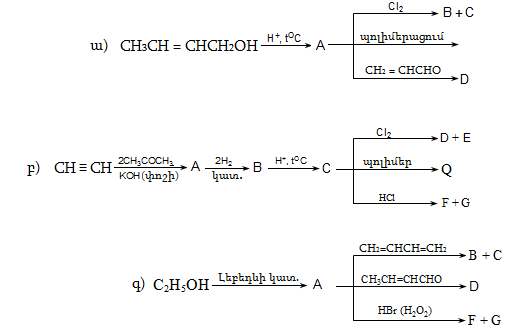
13. ԱՐՈՄԱՏԻԿ ԱԾԽԱՋՐԱԾԻՆՆԵՐ
XIX դարի սկզբում, առանց որոշակի տարբերակման, արոմատիկ անվանվում էին զանազան հոտավետ միացություններ, որոնք ստացվում և անջատվում էին բնական նյութերից: Սակայն ժամանակի ընթացքում այս անվանումը կորցրեց իր նշանակությունը, իսկ արոմատիկ միացությունների քիմիան վերափոխվեց բենզոլի և դրա նմանակների (որոնք այս կամ այն չափով ունեն արտահայտված «բենզոլային» բնութագիր) քիմիայի:
Մինչև 18-րդ դարի երկրորդ կեսը հայտնի էին քիչ թվով արոմատիկ միացություններ` բենզոյական թթու, ֆենոլ, անիլին, բենզոլ, սալիցիլաթթու, անտրանիլաթթու: Ենթադրվում էր, որ նշված միացությունների հենքում ընկած է նույն՝ C6H5- ֆենիլ ռադիկալը: Հետագայում այս ենթադրությունը հաստատվեց:
19-րդ դարի երկրորդ կեսը, նշանավորվելով արտադրության բուռն զարգացմամբ, դարձավ քիմիական արդյունաբերության շեշտակի աճի ժամանակաշրջան: Անշեղորեն սկսեց զարգանալ արոմատիկ միացությունների քիմիան՝ ի հայտ բերելով նոր, բազմաթիվ միացություններ: Քարածխային խեժը դարձավ նման միացությունների ստացման անսպառ աղբյուր, իսկ բուռն զարգացող ներկանյութերի արտադրությունը նպաստեց օրգանական քիմիայի այդ ճյուղի զարգացմանը:
Բենզոլի և դրա ածանցյալների տարանջատումն արդեն հայտնի ածխաջրածիններից, օրգանական քիմիայի նոր բնագավառի ստեղծումը միանգամայն արդարացված էր: Արդեն XIX դարի երկրորդ կեսին, Կեկուլեն, Լադենբուրգը, Կլաուսը, Արմստրոնգը և այլ գիտնականներ գտնում էին, որ բենզոլում և դրա նմանակներում չեն իրականացվում ալիֆատիկ ածխաջրածիններին հատուկ ածխածին-ածխածին կապեր, այլ մոլեկուլը ինչ-որ ձևով առավել «սեղմված» է: Ուսումնասիրվող միացությունները տարբերվում էին մյուսներից նաև իրենց քիմիական հատկություններով:
Բենզոլում և այդ շարքի մյուս ածխաջրածիններում ածխածինը հարաբերում է ջրածնին ինչպես 1:1, և ընդհանուր բանաձևը համապատասխանում է CnHn-ին: Այս առումով բենզոլն առավել նման է չհագեցած, նույնիսկ գերչհագեցած միացություններին, սակայն քիմիական հատկություններով այն խիստ տարբերվում է վերջիններից: Ավելին, բենզոլը բարձր կայունությամբ օժտված քիմիական միացություն է: Այն կարելի է պահպանել երկար ժամանակ, նույնիսկ` բաց վիճակում: Իսկ չհագեցած միացությունները, հատկապես գերչհագեցածները, խիստ անկայուն են և պահանջում են պահպանման հատուկ պայմաններ:
13.1. Բենզոլի կառուցվածք
Բենզոլը հայտնաբերել է Ֆարադեյը 1825 թ. լուսագազի սառեցման ժամանակ: 1834 թվականին Միտչերլիխը բենզոլ է անջատել բենզոյական թթուն կրի հետ թորելիս: Այդ շրջանում հետազոտողները չէին կարող ենթադրել, որ հայտնաբերել են այնպիսի միացություն, որը դառնալու է օրգանական քիմիայի նոր բնագավառի հիմնաքարը: Արդեն 19-րդ դարի 60-ականներին Ֆրակլանդը, Վիլյամսոնը, Կեկուլեն և այլք բենզոլի ֆիզիկաքիմիական հատկությունների հիման վրա սահմանեցին բենզոլի տարրական և կառուցվածքային բանաձևերը:
1865 թ. Կեկուլեն առաջարկեց բենզոլի ցիկլային բանաձևը մեկընդմեջ կրկնակի կապերով, որը բացատրում էր արոմատիկ միացությունների միացման ռեակցիաները: Կրկնակի կապերի առկայությունը ցույց է տալիս մոլեկուլի բարձր չհագեցվածությունը, որը բնորոշ չէ բենզոլին: Այս բանաձևը չի բացատրում նաև բենզոլի ռեակցիոնունակությունը էլեկտրոֆիլ տեղակալման ռեակցիաներում:
Կեկուլեի բանաձևը ենթադրում է ավելի մեծ թվով իզոմերների գոյություն, քան կան իրականում. այսպես, օ-երկտեղակալված իզոմեր չհաջողվեց ստանալ.
Կեկուլեն սա բացատրեց բենզոլում կրկնակի կապերի ենթադրական տեղաշարժով (հիպոթետիկ օսցիլացում).
![]()
Նման տեղաշարժի ապացույց էին համարվում օ-քսիլոլի օզոնացման արգասիքները.
Կեկուլեի կրկնակի կապերի երևակայական տեղաշարժի կանխադրույթը հանճարեղ առաջարկ էր, որը հնարավորություն տվեց քիմիկոսներին 150 տարի առաջ օգտագործել բենզոլի նշագրման ձևը վեցանկյան տեսքով, իսկ կրկնակի կապերի տեղաշարժը ներկայացնել վեցանկյան ներսում ընկած շրջանագծով:
Այսպիսով, քիմիայի բուռն զարգացումը հաստատեց Կեկուլեի համարձակ, ժամանակի համար խիստ հեղափոխական առաջարկը: Այն հաստատվեց բենզոլի և դրա նմանակների սինթեզման բազմաթիվ եղանակներով, ինչպես նաև ֆիզիկաքիմիական հետազոտման միջոցներով: Սակայն, ինչպես բոլոր հայտնագործությունները, այնպես էլ Կեկուլեի արտահայտչամիջոցը ենթարկվեց ժամանակի շատ քիմիկոսների քննադատություններին, հատկապես, երբ դիտարկվում էր միացման ռեակցիաներում բենզոլի շատ ավելի պակաս ակտիվությունը չհագեցած ածխաջրածինների նկատմամբ: Լադենբուրգը, Կլաուսը, Բայերը, Արմստրոնգը և այլք, առաջարկում էին բենզոլի կառուցվածքային այլ բանաձևեր: Սակայն, այդ առաջարկները չդիմացան հետագա փորձություններին` մնալով որպես պատմական հետաքրքրություն:
Բենզոլի կառուցվածքի վերաբերյալ առավել հաջող էր Թիլեի մեկնաբանությունը (1898թ.), ըստ որի բենզոլի օղակում իրար հաջորդող հասարակ և կրկնակի կապերը մտնում են «զուգորդման» մեջ` նպաստելով էլեկտրոնային ամպի համահավասար բաշխմանը վեց ածխածնի ատոմների միջև:
Թիլեի բանաձևը բացահայտում է բենզոլային օղակի սիմետրիկությունը և կայունությունը: Այս բացատրությունը մեկ անգամ ևս հաստատում էր Կեկուլեի «երևակայական տեղաշարժի» կանխադրույթի հանճարեղությունը: Կեկուլեի բանաձևը կատարելագործվեց օրգանական քիմիայի տեսության այնպիսի հսկաների կողմից, ինչպիսիք են Կոուլսոնը, Ինգոլդը, Պոլինգը և ՈՒելանդը:
20-րդ դարի
առաջին 30 տարիները
նշանավորվեցին
վալենտականության
էլեկտրոնային,
կովալենտ կապի
ֆիզիկական բնույթի,
զուգորդման տեսությունների
զարգացումով: Այս
տեսությունները
հիմք հանդիսացան
բենզոլի և ընդհանրապես
արոմատիկության
տեսական զարգացման
համար: 1931 թ. Հյուկելը
ձևակերպեց «4n+2» կանոնը
(n=0,1,2,
)՝ հիմնված մոլեկուլային
օրբիտալների ![]() -էլեկտրոնային
եղանակի վրա:
-էլեկտրոնային
եղանակի վրա:
Հյուկելի
կանոն. բարձր
թերմոդինամիկական
կայունությամբ
կարող են օժտված
լինել միայն այնպիսի
կարբոցիկլերը,
որոնք ունեն հարթ
կառուցվածք և փակ
զուգորդված համակարգում
պարունակում են
(4n+2) ![]() -էլեկտրոններ:
-էլեկտրոններ:
Բենզոլի կառուցվածքի պարզաբանման համար կարևոր դեր խաղաց քիմիական և ֆիզիկական հատկությունների համադրումը: Կիրառվեցին ուսումնասիրման ֆիզիկական եղանակներ. ռեֆրակտոմետրիա, մագնիսականություն, դիպոլային մոմենտի որոշում, ՈՒՄ, ԻԿ, լույսի կոմբինացիոն ցրման սպեկտրներ, ռենտգենագիր և էլեկտրոնագիր, թերմոդինամիկական հատկություններ:
Բենզոլը մոլեկուլային ռեֆրակցիայի էկզալտացիա չի ցուցաբերում (լույսի բեկման ցուցիչը հաշվարկայինից փոքր է), բևեռային չէ, մոլեկուլը հարթ է, ածխածնի ատոմների միջև հեռավորությունները հավասար են 0,140 նմ, մինչդեռ C C կապի երկարությունը 0,154 նմ է, իսկ C=C կապի երկարությունը` 0,134 նմ: Բենզոլը թերմոդինամիկորեն ավելի կայուն է, քան կարելի է ենթադրել` հիմք ընդունելով Կեկուլեի բանաձևը: Ցիկլոհեքսենի հիդրման ջերմությունը 119,7 կՋ/մոլ է, հետևաբար, բենզոլի հիդրման ժամանակ պետք է անջատվեր երեք անգամ ավելի էներգիա, որպես ցիկլոհեքսատրիեն: Իրականում անջատվում է 150,7 կՋ/մոլ-ով պակաս էներգիա: Այրման ջերմությունը նույնպես 150,7 կՋ/մոլ-ով փոքր է հաշվարկայինից: Այս մեծությունը կոչվում է բենզոլի մոլեկուլի կայունացման (ռեզոնանսային) էներգիա:
Բենզոլի
քվանտաքիմիական
մոդելում ածխածնի
վեց ատոմներն ունեն
![]() հիբրիդացում,
միմյանց հետ կապված
են միևնույն հարթության
մեջ գտնվող
հիբրիդացում,
միմյանց հետ կապված
են միևնույն հարթության
մեջ գտնվող ![]() կապերով,
երրորդ
կապերով,
երրորդ ![]() կապն առաջացնում
են ջրածնի ատոմների
հետ: Յուրաքանչյուր
ածխածնի մոտ ությակաձև
օրբիտալների վրա
գտնվող p էլեկտրոնները
(ությակաձև օրբիտալների
առանցքն ուղղահայաց
է օղակի հարթությանը)
վերածածկվում
են մեկը մյուսի
հետ` տեղաբաշխվելով
օղակի շուրջը:
Բենզոլի օղակի
վեց
կապն առաջացնում
են ջրածնի ատոմների
հետ: Յուրաքանչյուր
ածխածնի մոտ ությակաձև
օրբիտալների վրա
գտնվող p էլեկտրոնները
(ությակաձև օրբիտալների
առանցքն ուղղահայաց
է օղակի հարթությանը)
վերածածկվում
են մեկը մյուսի
հետ` տեղաբաշխվելով
օղակի շուրջը:
Բենզոլի օղակի
վեց ![]() էլեկտրոնները
կոչում են «արոմատիկ
վեցյակ»: Էլեկտրոնների
հավասարաչափ բաշխումը
օղակում հնարավորություն
է տալիս դրանց
տեղաշարժվել այս
կամ այն ուղղությամբ:
Օղակի հարթությանն
ուղղահայաց մագնիսական
դաշտում p էլեկտրոնները
շարժվում են մի
ուղղությամբ, նշանակում
է` բենզոլը ցուցաբերում
է դիամագնետիզմ:
Բենզոլի օղակը
փակվում է առանց
լարվածության,
այն դիտվում է
որպես փակ գերհաղորդիչ,
որտեղ էլեկտրոնները
շարժվում են ազատ,
առանց դիմադրության:
Արոմատիկ համակարգերում
զուգորդման անհրաժեշտ
պայման է p էլեկտրոնների
օրբիտալների զուգահեռությունը,
այլապես խախտվում
է զուգորդումը,
նաև` արոմատիկությունը:
Այսպես, ցիկլոօկտատետրաենի
մոլեկուլի
էլեկտրոնները
կոչում են «արոմատիկ
վեցյակ»: Էլեկտրոնների
հավասարաչափ բաշխումը
օղակում հնարավորություն
է տալիս դրանց
տեղաշարժվել այս
կամ այն ուղղությամբ:
Օղակի հարթությանն
ուղղահայաց մագնիսական
դաշտում p էլեկտրոնները
շարժվում են մի
ուղղությամբ, նշանակում
է` բենզոլը ցուցաբերում
է դիամագնետիզմ:
Բենզոլի օղակը
փակվում է առանց
լարվածության,
այն դիտվում է
որպես փակ գերհաղորդիչ,
որտեղ էլեկտրոնները
շարժվում են ազատ,
առանց դիմադրության:
Արոմատիկ համակարգերում
զուգորդման անհրաժեշտ
պայման է p էլեկտրոնների
օրբիտալների զուգահեռությունը,
այլապես խախտվում
է զուգորդումը,
նաև` արոմատիկությունը:
Այսպես, ցիկլոօկտատետրաենի
մոլեկուլի ![]() էլեկտրոնների
թիվը չի բավարարում
4n+2 պայմանին, մոլեկուլում
մեծ լարվածության
պատճառով ածխածնի
ատոմները չեն կարող
գտնվել միևնույն
հարթության մեջ
(135°), չի
ապահովվում p օրբիտալների
զուգահեռությունը
և հետևաբար, այն
արոմատիկ միացություն
չէ:
էլեկտրոնների
թիվը չի բավարարում
4n+2 պայմանին, մոլեկուլում
մեծ լարվածության
պատճառով ածխածնի
ատոմները չեն կարող
գտնվել միևնույն
հարթության մեջ
(135°), չի
ապահովվում p օրբիտալների
զուգահեռությունը
և հետևաբար, այն
արոմատիկ միացություն
չէ:
Համաձայն
վերը քննարկվածի,
միացությունը
համարվում է արոմատիկ,
եթե մոլեկուլը
հարթ է և պարունակում
է բաշխված ![]() էլեկտրոնների
ցիկլային համակարգ:
Բենզոլում առկա
է բոլոր
էլեկտրոնների
ցիկլային համակարգ:
Բենզոլում առկա
է բոլոր ![]() -կապերի
կատարյալ զուգորդում,
որը հանգեցնում
է օղակի կայունության:
Զուգորդման խախտումն
օղակի որևէ տեղում
բերում է կայունության
կորստի, այդ պատճառով
հնարավոր չէ ստանալ
միացման արգասիքներ
միայն մեկ կրկնակի
կապի խզման արդյունքում:
-կապերի
կատարյալ զուգորդում,
որը հանգեցնում
է օղակի կայունության:
Զուգորդման խախտումն
օղակի որևէ տեղում
բերում է կայունության
կորստի, այդ պատճառով
հնարավոր չէ ստանալ
միացման արգասիքներ
միայն մեկ կրկնակի
կապի խզման արդյունքում:
Էլեկտրոնային զույգերի եղանակով քվանտաքիմիական հաշվարկների դեպքում հաշվի են առնվում բենզոլի մոլեկուլի հինգ սահմանային կառուցվածքներ, որոնք տարբեր չափով են մասնակցում ռեզոնանսին.
Բենզոլի մոլեկուլի կայունությունն արտահայտվում է որպես երկու գլխավոր սահմանային կառուցվածքների էներգետիկական հավասարարժեքության հետևանք.
Մոլեկուլի հավանական իրական կառուցվածքն ունի հետևյալ տեսքը.

13.2. Անվանակարգում, իզոմերիա
Մոնոմեթիլտեղակալված բենզոլն իզոմեր չունի
համապատասխան ռադիկալները.
Երկտեղակալված բենզոլն ունի երեք իզոմեր, որոնք կոչվում են օրթո (1,2-դիրքեր), մետա (1,3-դիրքեր), պարա (1,4-դիրքեր).

Քսիլոլներին իզոմեր է էթիլբենզոլը.
Արոմատիկ ածխաջրածինների իզոմերիան պայմանավորված է ինչպես ռադիկալների թվով և մեծությամբ, այնպես էլ դրանց դիրքով.
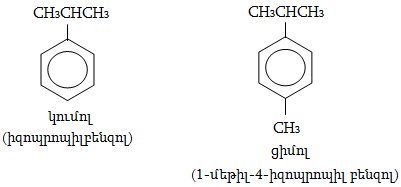
13.3. Ֆիզիկական հատկություններ
Արոմատիկ
ածխաջրածինները
յուրահատուկ հոտով
հեղուկ (հազվադեպ՝
պինդ) նյութեր
են: Բենզոլի եռման
ջերմաստիճանը
մթնոլորտային
ճնշման տակ՝ 80,1օC
է: Իզոմերներն
ունեն եռման ջերմաստիճանների
չնչին տարբերություն:
Մի քանի ռադիկալ
ունեցող իզոմերների
եռման ջերմաստիճանն
ավելի բարձր է,
քան մեկ ուղիղ
ռադիկալով իզոմերինը:
Օրթո իզոմերներն
ունեն ավելի բարձր
եռման ջերմաստիճան,
քան պարա իզոմերները:
Ճյուղավորված
կառուցվածքով
տեղակալիչ ունեցող
իզոմերն ունի ավելի
ցածր tեռ, քան նորմալ
կառուցվածքով
տեղակալիչ ունեցողը:
Յուրաքանչյուր
նոր CH2 խումբ եռման
ջերմաստիճանը
բարձրացնում է
մոտավորապես ![]() ով: Սիմետրիկ
կառուցվածքով
իզոմերներն ունեն
ավելի բարձր հալման
ջերմաստիճան: Երկտեղակալվածներից
ամենաբարձր հալման
կետն ունի պարա
իզոմերը: Արոմատիկ
ածխաջրածինների
խտությունն ու
բեկման ցուցիչն
ավելի բարձր են,
քան ալիֆատիկ և
ալիցիկլային շարքերում:
Արոմատիկ ածխաջրածինները
համարյա անլուծելի
են ջրում, գոլորշիները
երկար ժամանակ
շնչելիս հնարավոր
է թունավորվել:
Արոմատիկ օղակի
բնորոշ կլանումները
լույսի սպեկտրի
ՈՒՄ մարզում գտնվում
են 180
300 նմ տիրույթում,
ԻԿ մարզում` 1500
1600 սմ-1
տիրույթում, իսկ
ՄՄՌ սպեկտրներում
բենզոլային օղակի
պրոտոնները բնորոշվում
են 6,04
8,2 մկմ քիմիական
սահքով:
ով: Սիմետրիկ
կառուցվածքով
իզոմերներն ունեն
ավելի բարձր հալման
ջերմաստիճան: Երկտեղակալվածներից
ամենաբարձր հալման
կետն ունի պարա
իզոմերը: Արոմատիկ
ածխաջրածինների
խտությունն ու
բեկման ցուցիչն
ավելի բարձր են,
քան ալիֆատիկ և
ալիցիկլային շարքերում:
Արոմատիկ ածխաջրածինները
համարյա անլուծելի
են ջրում, գոլորշիները
երկար ժամանակ
շնչելիս հնարավոր
է թունավորվել:
Արոմատիկ օղակի
բնորոշ կլանումները
լույսի սպեկտրի
ՈՒՄ մարզում գտնվում
են 180
300 նմ տիրույթում,
ԻԿ մարզում` 1500
1600 սմ-1
տիրույթում, իսկ
ՄՄՌ սպեկտրներում
բենզոլային օղակի
պրոտոնները բնորոշվում
են 6,04
8,2 մկմ քիմիական
սահքով:
13.4. Կիրառման բնագավառներ, թունավորություն
Բենզոլը կիրառվում է էթիլբենզոլի, կումոլի, ցիկլոհեքսանի, անիլինի, մալեինանհիդրիդի ստացման արտադրություններում, որպես լուծիչ` մակերևութային ակտիվ նյութերի (ՄԱՆ), ներկերի և այլ արտադրույուններում: Կարևոր բաղադրամաս է շարժիչային վառելիքում` օկտանային թվի բարձրացման համար:
Մեծ կիրառություն ունի տոլուոլը` ֆենոլի, կապրոլակտամի, բջջանյութի (ցելյուլոզ) և բազմաթիվ այլ արտադրություններում: Հիանալի օրգանական լուծիչ է, շարժիչային վառելանյութի հավելանյութ: Բենզոլի և տոլուոլի համաշխարհային արտադրությունը հասնում է միլիոնավոր տոննաների: Կիրառական նմանատիպ ոլորտներ ունեն քսիլոլները, որոնք քիմիական և նավթաքիմիական սինթեզի հիմնական արգասիքներ են:
Արոմատիկ միացությունների լայն տարածումը կարևորում է դրանց թունավորության գնահատումը:
Բենզոլը և հոմոլոգները` տոլուոլը, քսիլոլը և այլն, թունավոր են, ազդում են մարդու շնչառական օրգանների վրա, առաջացնում են նյարդային գրգռում, սրտխառնոց, ընդհուպ մինչև գիտակցության կորուստ: Սահմանային թույլատրելի արժեքները (ՍԹԱ) տատանվում են 0,05 0,1 մգ/լ ջրում և 6 50 մգ/մ3` օդում: Խիստ աճում է թունավորության աստիճանը կոնդենսված արոմատիկ համակարգերում, որոնք հայտնի են որպես քաղցկեղածին միացություններ:
Բենզոլը հրեշածին և քաղցկեղածին նյութ է, վնասում է նյարդային և աղեստամոքսային համակարգերը, խախտում է B6, B12, C վիտամինների հաշվեկշիռը: ՈՒնի գրգռող, ջղաձգող, վարակաթունավոր, ալերգիկական ազդեցություն, առաջացնում է շնչառական կենտրոնի կաթված, դադարեցնում է սրտանոթային գործունեությունը: Տոլուոլը թմրանյութ է, ազդում է նյարդային համակարգի, արյունատար անոթների վրա, առաջացնում է ներզատիչ (էնդոկրին) փոփոխություններ, գանգուղեղի բորբոքում: Քսիլոլն ազդում է արյունատար, նյարդային, սրտանոթային համակարգերի վրա, խախտում է սպիտակուցային փոխանակությունը և վերարտադրական գործընթացը: ՈՒնի թունավոր, գրգռող, պտղահատու ազդեցություն, առաջացնում է տևական թունավորում:
13.5. Ստացման եղանակներ
13.5.1. Արոմատիկ ածխաջրածիններ ստացվում են քարածխի խեժից, նավթից, նաև մեծ թվով ալիֆատիկ ածխաջրածիններից:
Ալկանները որոշ կատալիզատորների (քրոմի օքսիդ) ներկայությամբ ենթարկվում են արոմատացման (Բ.Ա. Կազանսկի և ուրիշներ).
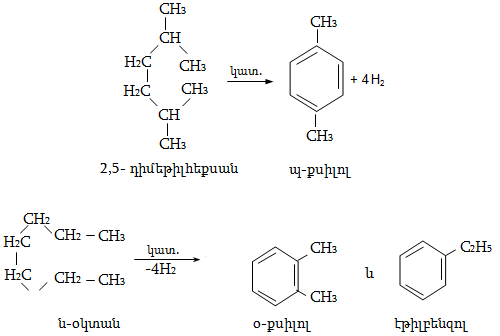
13.5.2. Առաջին
անգամ բենզոլ ստացել
է Բերտլոն 1866 թ. ացետիլենի
բարձրջերմաստիճանային
ցիկլոտրիմերացումով:
Հետագայում այս
նույն գործընթացն
իրականացրել է
Զելինսկին` կիրառելով
ակտիվացած ածուխ:
Ավելի բարձր ելքեր
են ստացվում Ռեպպեի
կատալիզատորի`
![]() ներկայությամբ:
Գործընթացի ժամանակ
ստացվում են նաև
այլ արոմատիկ ածխաջրածիններ.
ներկայությամբ:
Գործընթացի ժամանակ
ստացվում են նաև
այլ արոմատիկ ածխաջրածիններ.
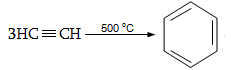
13.5.3. Ալիցիկլիկ ածխաջրածինները պալադիում կամ պլատին կատալիզատորների ներկայությամբ 300օC-ում հեշտությամբ փոխարկվում են արոմատիկ միացությունների (Ն.Դ. Զելինսկի).
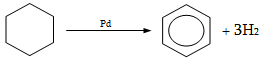
13.5.4. Ստացում արոմատիկ ածխաջրածիններից
13.5.4.1. Բենզոյական թթվի աղերի միահալում ալկալիների հետ.
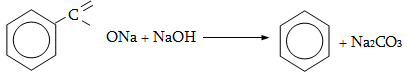
13.5.4.2.Վյուրցի-Ֆիտիգի ռեակցիայով` հալոգենածանցյալների և մետաղական նատրիումի փոխազդեցություն.
![]()
Կողմնակի միացությունները (C2H5C2H5, C6H5C6H5) հիմնական արգասիքից հեշտությամբ են առանձնացվում (ունեն եռման ջերմաստիճանների մեծ տարբերություն):
13.5.4.3. Ֆրիդել- Կրաֆտս- Գուստավսոնի ռեակցիա.
![]()
Որպես կատալիզատոր կիրառվում են AlCl3, նմանատիպ այլ d մետաղների անջուր քլորիդներ, նաև HF: Ռեակցիան կիրառվում է արտադրական և լաբորատոր պայմանններում: Կարող են առաջանալ ինչպես պոլիտեղակալված բենզոլներ, այնպես էլ` իզոմերներ: Այսպես, բենզոլի և պրոպիլքլորիդի փոխազդեցությունից առաջանում է կումոլ, իսկ բենզոլի և իզոբութիլքլորիդի փոխազդեցությունից` երրբութիլբենզոլ (տեղի է ունենում միջանկյալ ռադիկալների իզոմերացում).
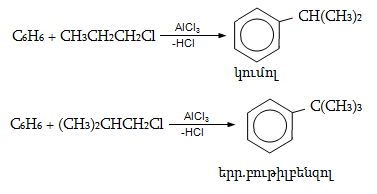
Բենզոլի ալկիլումը կարելի է իրականացնել նաև ալկեններով և սպիրտներով (որպես կատալիզատոր օգտագործում են թթուներ` H3PO4, H2SO4, HF):
13.5.4.4. Մաքուր արոմատիկ ածխաջրածիններ ստացվում են արոմատիկ կետոնների վերականգնումով ցինկի ամալգամով աղաթթվում (Կլեմենսեն).
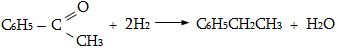
13.6. Քիմիական հատկություններ
Արոմատիկ ածխաջրածիններն առավել հակված են տեղակալման, քան միացման ռեակցիաների: Բենզոլային օղակը կայուն է օքսիդացման նկատմամբ:
13.6.1. Միացման ռեակցիաներ
13.6.1.1. Ջրածնի միացումը տեղի է ունենում միայն բարձր ջերմաստիճանում` կատալիզատորների ներկայությամբ: Ստացվում են ցիկլոհեքսան և հոմոլոգները.
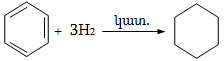
13.6.1.2. ՈՒլտրամանուշակագույն ճառագայթումով բենզոլը միացնում է քլոր և բրոմ` առաջացնելով հեքսահալոգենիդներ: Վերջիններս տաքացնելիս կորցնում են երեք մոլեկուլ հալոգենաջրածին` փոխարկվելով տրիհալոգենբենզոլների.
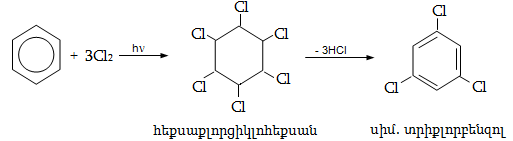
13.6.1.3. Չհագեցած միացությունների նման բենզոլն օզոնի հետ առաջացնում է չափազանց պայթուցիկ տրիօզոնիդ, որը ջրով քայքայվում է երեք մոլեկուլ գլիօքսալի (տես «Ալկեններ»).
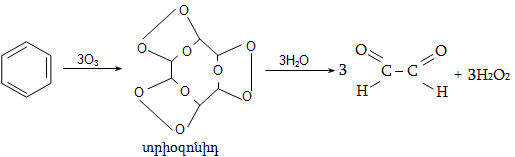
13.6.2. Բենզոլի և հոմոլոգների օքսիդացում
Բենզոլային օղակը դժվար է օքսիդանում: ՈՒժեղ օքսիդիչները սառը պայմաններում չեն ազդում բենզոլի վրա:
Բենզոլը օդի թթվածնով վանադիումի պենտօքսիդի ներկայությամբ օքսիդանում է մալեինանհիդրիդի.
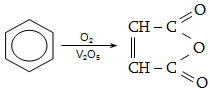
Բենզոլի հոմոլոգները սովորական օքսիդիչներով օքսիդանում են արոմատիկ թթուների, ընդ որում, անկախ կողմնային շղթայի երկարությունից, առաջանում է բենզոլական թթու:
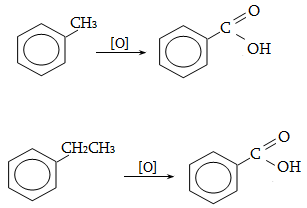
Օդի թթվածնով
ալկիլ բենզոլներն
օքսիդանում են
հիդրոպերօքսիդների.
ռեակցում է օղակի
նկատմամբ ![]() -դիրքում
գտնվող ածխածնի
ատոմը.
-դիրքում
գտնվող ածխածնի
ատոմը.
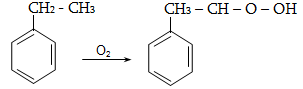
13.6.3. Տեղակալման ռեակցիաներ
Բենզոլային օղակի ջրածնի ատոմը տեղակալվում է էլեկտրոֆիլ ռեագենտներով կատալիզատորների ներկայությամբ (SE):
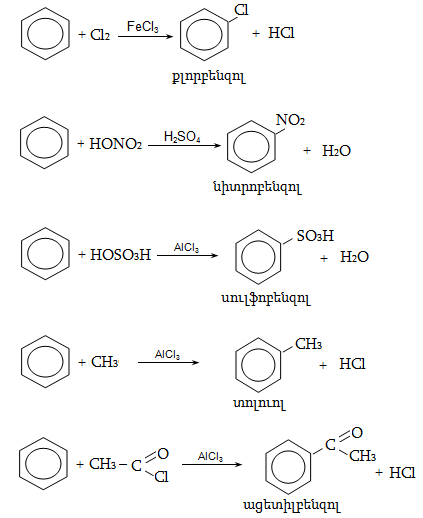
14. ԱՐՈՄԱՏԻԿ ՕՂԱԿՈՒՄ ԷԼԵԿՏՐՈՖԻԼ ՏԵՂԱԿԱԼՄԱՆ ՌԵԱԿՑԻԱՅԻ ՄԵԽԱՆԻԶՄ
Ալիֆատիկ ածխաջրածինների տեղակալման ռեակցիաները հիմնականում նուկլեոֆիլ բնույթի են, իսկ արոմատիկ ածխաջրածիններինը` էլեկտրոֆիլ բնույթի: Պատճառն արոմատիկ օղակի էլեկտրոնային ամպի խտությունն է, որը դեպի իրեն է ձգում դրական մասնիկներ:
Էլեկտրոֆիլ տեղակալման ռեակցիաները բազմաթիվ են. նիտրացում, հալոգենացում, սուլֆուրացում, Ֆրիդել-Կրաֆտսի ռեակցիաներ, որոնք բնորոշ են համարյա բոլոր արոմատիկ միացություններին: Դեսուլֆուրացումը, իզոտոպային փոխանակումը, ցիկլացման բազմաթիվ ռեակցիաներ նույնպես կարելի է վերագրել էլեկտրոֆիլ տեղակալման: Այս ռեակցիաները բազմաթիվ արոմատիկ միացությունների ստացման աղբյուր են, հնարավորություն են ստեղծում արոմատիկ օղակ ներմուծել մեծ թվով տեղակալիչներ, որոնք հետագայում կարող են փոխարինվել այլ խմբերով:
ՈՒսումնասիրությունները
ցույց են տվել,
որ բենզոլային
օղակում SE տեղակալման
ռեակցիան աստիճանական
գործընթաց է. առաջին
փուլը ներառում
է դրական լիցքի
կամ դիպոլի գրոհի
արդյունքում ![]() կոմպլեքսի
գոյացում, որը
փոխարկվում է
կոմպլեքսի
գոյացում, որը
փոխարկվում է ![]() կոմպլեքսի
(արենոնիում իոն):
Վերջինս արոմատիկությունից
զուրկ կատիոն է`
չորս
կոմպլեքսի
(արենոնիում իոն):
Վերջինս արոմատիկությունից
զուրկ կատիոն է`
չորս ![]() էլեկտրոններով,
որոնք բաշխված
են օղակի հինգ
ածխածնի ատոմների
ազդեցության ոլորտում:
Օղակի վեցերորդ
ածխածնի ատոմը
sp2 հիբրիդացումը
փոխում է sp3 -ի.
էլեկտրոններով,
որոնք բաշխված
են օղակի հինգ
ածխածնի ատոմների
ազդեցության ոլորտում:
Օղակի վեցերորդ
ածխածնի ատոմը
sp2 հիբրիդացումը
փոխում է sp3 -ի.
էլեկտրոֆիլ տեղակալման առաջին փուլ .
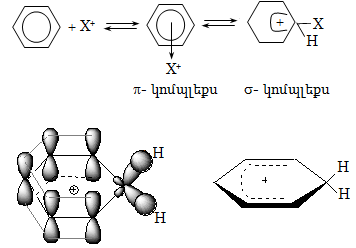
Բենզոնիում իոնը, որն ստացվում է բենզոլի պրոտոնացմամբ, մոտավորապես ունի լիցքի բաշխման հետևյալ մոդելը.
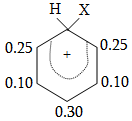
Միջանկյալ
կարբկատիոնը ռեզոնանսային
հիբրիդ է, որն արտահայտված
է ներքոհիշյալ
կառուցվածքներով`
1 կամ 2 : Այսպիսի իոններին
անվանում են ՈՒելանդի
ինտերմեդիատ
(միջանկյալ ![]() կոմպլեքս)
կամ արենոնիում
իոն.
կոմպլեքս)
կամ արենոնիում
իոն.
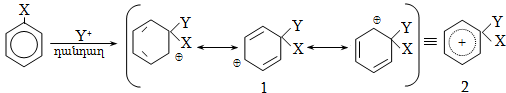
![]() կոմպլեքսի
գոյացումը մեծ
էներգիա չի պահանջում,
քանի որ զուգորդման
էներգիան (108,7 կՋ/մոլ)
շատ չի տարբերվում
բենզոլային համակարգի
զուգորդման էներգիայից
(150,7 կՋ/մոլ), այն ոչ
թե անցողիկ վիճակ
է, այլ միջանկյալ
միացություն: Որոշ
դեպքերում
կոմպլեքսի
գոյացումը մեծ
էներգիա չի պահանջում,
քանի որ զուգորդման
էներգիան (108,7 կՋ/մոլ)
շատ չի տարբերվում
բենզոլային համակարգի
զուգորդման էներգիայից
(150,7 կՋ/մոլ), այն ոչ
թե անցողիկ վիճակ
է, այլ միջանկյալ
միացություն: Որոշ
դեպքերում ![]() կոմպլեքսն
առանձնացվել և
ուսումնասիրվել
է: Այսպես, մեզիտիլենի
մշակումով էթիլֆտորիդով
բորֆտորիդի ներկայությամբ
առաջանում է
կոմպլեքսն
առանձնացվել և
ուսումնասիրվել
է: Այսպես, մեզիտիլենի
մշակումով էթիլֆտորիդով
բորֆտորիդի ներկայությամբ
առաջանում է![]() հալման
ջերմաստիճանով
հալման
ջերմաստիճանով
![]() կոմպլեքս,
որի կառուցվածքը
պարզվել է սպեկտրաչափական
եղանակներով, կինետիկական
չափումներով և
իզոտոպային էֆեկտով.
կոմպլեքս,
որի կառուցվածքը
պարզվել է սպեկտրաչափական
եղանակներով, կինետիկական
չափումներով և
իզոտոպային էֆեկտով.
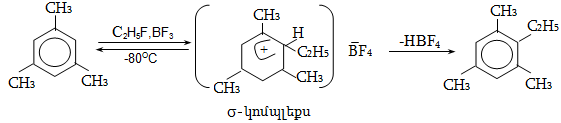
Էլեկտրոֆիլ
տեղակալման երկրորդ`
ավելի արագ փուլում
![]() կոմպլեքսը
կորցնում է պրոտոն`
փոխարկվելով տեղակալված
կայուն բենզոլի.
կոմպլեքսը
կորցնում է պրոտոն`
փոխարկվելով տեղակալված
կայուն բենզոլի.
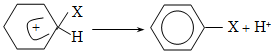
14.1. SE ռեակցիաների օրինակներ
14.1.1.Ալկիլման ռեակցիաներ
14.1.1.1. Ալկիլում հալոգենածանցյալներով (Ֆրիդել-Կրաֆտս).
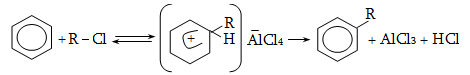
14.1.1.2. Սպիրտներով ալկիլումը տեղի է ունենում միայն կատալիզատորների հետ կոմպլեքս առաջացնելուց հետո (թույլ էլեկտրոֆիլ են).
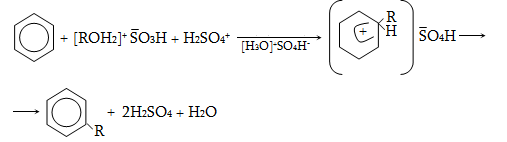
14.1.1.3. Ալկիլում ալկեններով.
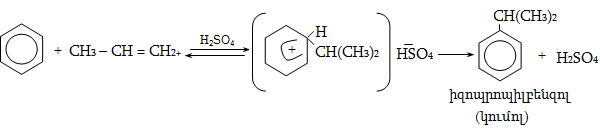
14.1.2. Ացիլում (Ֆրիդել-Կրաֆտս)
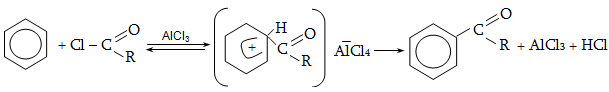
14.1.3. Հալոգենացում
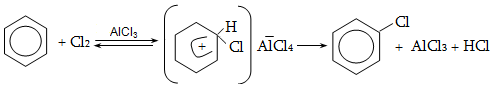
14.1.4.Նիտրացում
Նիտրացնող խառնուրդով (H2SO4, HNO3) նիտրացման մեխանիզմը ներառում է հետևյալ ռեակցիաների հաջորդականությունը.
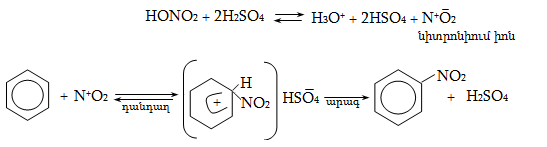
14.1.5. Սուլֆուրացում
Սուլֆուրացումը ներառում է հետևյալ փուլերը.
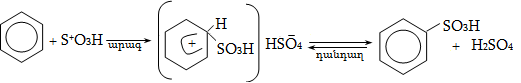
14.2. Կողմնորոշման կանոնը տեղակալված բենզոլային օղակում
Բենզոլային օղակում տեղակալիչը` խումբ կամ ատոմ, ազդում է օղակի ռեակցիոնունակության վրա և պայմանավորում հետագա էլեկտրոֆիլ տեղակալման ուղղությունը: Բենզոլային օղակում տեղակալման ռեակցիայի ուղղությունը որոշող օրինաչափությունները կոչվում են կողմնորոշման կանոններ: Բենզոլային օղակի այս կամ այն ածխածնի ատոմի ռեակցիոնունակությունը բնորոշվում է հետևյալ գործոններով. 1)տեղակալիչի դիրքով և բնույթով, 2)հարձակվող էլեկտրոֆիլի բնույթով, 3)ռեակցիայի պայմաններով: Որոշիչ են առաջին երկու գործոնները:
Բենզոլային օղակի տեղակալիչները բաժանվում են երկու խմբի.
ա) առաջին կարգի տեղակալիչներ. էլեկտրոններ տրամադրելու ընդունակ ատոմների խմբեր` օժտված չբաշխված էլեկտրոնային զույգով (էլեկտրոնադոնոր). -OH, -OR, -OCOR, -NH2, -NHR, -NR2, -NHCOR, -CH3, -CH2R, -CHR2, -CR3, - N=N -, -F, -Cl, -Br, -I:
բ) երկրորդ կարգի տեղակալիչներ. էլեկտրոններ ձգելու ընդունակ ատոմների խմբեր (էլեկտրոնակցեպտոր). -SO3H, -NO2, -CHO, -COR, -COOH, -COOR, -CN, -CCl3, -N+H3 և այլն:
Առաջին կարգի տեղակալիչները (բացի հալոգեններից) մեծացնում են բենզոլային օղակի էլեկտրոնային ամպի խտությունը և հեշտացնում ռեակցիան էլեկտրոֆիլ ռեագենտների հետ` կողմնորոշելով նոր տեղակալիչին օրթո- և պարա- դիրքեր: Երկրորդ կարգի տեղակալիչները դժվարացնում են ռեակցիան և տեղակալիչին կողմնորոշում դեպի մետադիրք:
Քննարկենք տեղակալիչների կողմնորոշման ազդեցությունը SE ռեակցիաներում:
Առաջին կարգի տեղակալիչ, որը հեշտացնում է էլեկտրոֆիլի հարձակումը և այն կողմնորոշում օրթո- և պարա- դիրքեր.
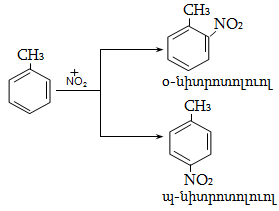
Երկրորդ կարգի տեղակալիչ, որը դժվարացնում է էլեկտրոֆիլի հարձակումը և վերջինիս կողմնորոշում մետադիրք.
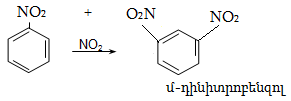
Կարևորագույն տեղակալիչները, ըստ իրենց ընտրողական կողմնորոշման ազդեցության, կարելի է դասակարգել հետևյալ շարքով.
![]()
Վերը նշված օրինաչափություններն օրենքի ուժ չունեն: Խոսքը ռեակցիաների հիմնական ուղղության մասին է: Ռեակցիայի արդյունքում կարող են առաջանալ բոլոր հնարավոր իզոմերները, սակայն կգերակշռի այն իզոմերը, որը գոյանում է կողմնորոշման կանոնին համապատասխան: Այսպես, տոլուոլի նիտրացումից առաջանում է օ-, պ-, մ- նիտրոտոլուոլների խառնուրդ 62%, 33.5% և 4.5% հարաբերությամբ: Ջերմաստիճանի բարձրացումն ազդում է տեղակալիչների կողմնորոշման վրա (փոխվում է ռեակցիայի մեխանիզմը): Լուծիչի ազդեցությունն աննշան է: Կատալիզատորները կարող են փոխել ռեակցիայի ուղղությունը. քլորբենզոլի անմիջական բրոմացման ժամանակ առաջանում է 1% մ-իզոմեր, իսկ AlCl3 -ի ներկայությամբ՝ 13%:
14.3. Տեղակալիչների կողմնորոշիչ ազդեցության մեխանիզմ
Բենզոլի մոլեկուլում էլեկտրոնային ամպի խտությունը բաշխված է հավասարաչափ: Տեղակալիչի ներկայությունը խախտում է այդ հավասարաչափությունը` ստեղծելով ածխածնի ատոմների հաջորդաբար փոխանցվող բևեռացում ամբողջ օղակում: Տեղակալիչը բենզոլային օղակի հետ փոխազդեցության մեջ է մտնում ինդուկտիվ (I) և զուգորդման էֆեկտներով (II):
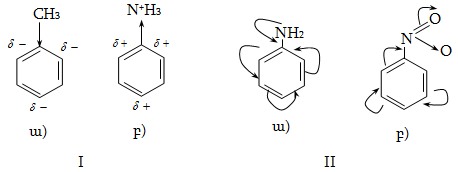
Առաջին
դեպքում միջուկում
էլեկտրոնային
ամպի խտության
փոփոխությունը
կապված է ![]() կապի
բևեռացումով, իսկ
երկրորդ դեպքում՝
տեղակալիչի p էլեկտրոնների
և բենզոլային օղակի
զուգորդումով:
Հնարավոր է երկու
դեպք. էլեկտրոնների
տեղաշարժ դեպի
օղակը (ա), երբ մեծանում
է բենզոլային օղակի
ռեակցիոնունակությունը
էլեկտրոֆիլ ռեագենտի
նկատմամբ, և էլեկտրոնային
ամպի տեղաշարժ
դեպի տեղակալիչը
(բ), երբ բենզոլային
օղակի ռեակցիոնունակությունը
մեծանում է նուկլեոֆիլ
ռեագենտի նկատմամբ:
կապի
բևեռացումով, իսկ
երկրորդ դեպքում՝
տեղակալիչի p էլեկտրոնների
և բենզոլային օղակի
զուգորդումով:
Հնարավոր է երկու
դեպք. էլեկտրոնների
տեղաշարժ դեպի
օղակը (ա), երբ մեծանում
է բենզոլային օղակի
ռեակցիոնունակությունը
էլեկտրոֆիլ ռեագենտի
նկատմամբ, և էլեկտրոնային
ամպի տեղաշարժ
դեպի տեղակալիչը
(բ), երբ բենզոլային
օղակի ռեակցիոնունակությունը
մեծանում է նուկլեոֆիլ
ռեագենտի նկատմամբ:
Նման փոխազդեցության մասին ճիշտ պատկերացում է տալիս դիպոլային մոմենտների համեմատությունը. դիպոլային մոմենտը փոքրանում է, երբ ինդուկտիվ և զուգորդման էֆեկտները գործում են հակառակ ուղղություններով, և մեծանում, երբ ուղղված են միևնույն ուղղությամբ.

Նշանակում
է, տեղակալիչի
բնույթով պայմանավորված`
բենզոլային օղակի
էլեկտրոնային
ամպի խտությունը
հարստանում է կամ
աղքատանում, այսինքն`
այն դառնում է
առավել կամ պակաս
ռեակցիոնունակ
էլեկտրոֆիլ ռեագենտի
նկատմամբ: Էլեկտրոֆիլ
տեղակալման ուղղությունը
որոշող գործոն
է միջանկյալ ![]() կոմպլեքսի
կայունությունը:
Տեղակալումը կարող
է իրականանալ բենզոլային
օղակի ցանկացած
դիրքում, սակայն
տարբեր արագությամբ՝
պայմանավորված
տարբեր ակտիվացման
էներգիաներով:
Ակտիվացման էներգիան
փոքր է այնքանով
(ռեակցիայի արագությունը՝
մեծ), որքանով մեծ
է
կոմպլեքսի
կայունությունը:
Տեղակալումը կարող
է իրականանալ բենզոլային
օղակի ցանկացած
դիրքում, սակայն
տարբեր արագությամբ՝
պայմանավորված
տարբեր ակտիվացման
էներգիաներով:
Ակտիվացման էներգիան
փոքր է այնքանով
(ռեակցիայի արագությունը՝
մեծ), որքանով մեծ
է ![]() կոմպլեքսի
կայունությունը,
այսինքն` քիչ էներգիա
է պահանջվում համապատասխան
անցողիկ վիճակի
առաջացման համար:
Հետևաբար, յուրաքանչյուր
տեղակալիչի կողմնորոշիչ
ազդեցությունը
գնահատվում է դրա
ազդեցությամբ
կոմպլեքսի
կայունությունը,
այսինքն` քիչ էներգիա
է պահանջվում համապատասխան
անցողիկ վիճակի
առաջացման համար:
Հետևաբար, յուրաքանչյուր
տեղակալիչի կողմնորոշիչ
ազդեցությունը
գնահատվում է դրա
ազդեցությամբ
![]() կոմպլեքսի
կայունության
վրա:
կոմպլեքսի
կայունության
վրա: ![]() կոմպլեքսի
առաջացումը հաշվի
չի առնվում, քանի
որ այս փուլն արագ
հավասարակշռվող
փուլ է (ռեակցիայի
արագության վրա
չի ազդում): Տեղակալման
բնորոշիչ փուլը
կոմպլեքսի
առաջացումը հաշվի
չի առնվում, քանի
որ այս փուլն արագ
հավասարակշռվող
փուլ է (ռեակցիայի
արագության վրա
չի ազդում): Տեղակալման
բնորոշիչ փուլը
![]() կոմպլեքսի
առաջացման փուլն
է, որը հաստատվել
է նաև նշված ատոմների
եղանակով: Բոլոր
այն գործոնները,
որոնք կնպաստեն
կոմպլեքսի
առաջացման փուլն
է, որը հաստատվել
է նաև նշված ատոմների
եղանակով: Բոլոր
այն գործոնները,
որոնք կնպաստեն
![]() կոմպլեքսի
կայունացմանը,
կարագացնեն SE ռեակցիան:
Այս ռեակցիաներում
դեյտերիումը կամ
տրիտիումը տեղակալվում
են նույն արագությամբ,
ինչ ջրածինը. իզոտոպային
էֆեկտ չի նկատվում:
Ուստի ածխածին
ջրածին կապի խզման
փուլը ռեակցիայի
արագության վրա
չի ազդում: Բացառություն
է սուլֆուրացման
ռեակցիան, որտեղ
ռեակցիայի արագության
բնորոշիչ փուլը
կոմպլեքսի
կայունացմանը,
կարագացնեն SE ռեակցիան:
Այս ռեակցիաներում
դեյտերիումը կամ
տրիտիումը տեղակալվում
են նույն արագությամբ,
ինչ ջրածինը. իզոտոպային
էֆեկտ չի նկատվում:
Ուստի ածխածին
ջրածին կապի խզման
փուլը ռեակցիայի
արագության վրա
չի ազդում: Բացառություն
է սուլֆուրացման
ռեակցիան, որտեղ
ռեակցիայի արագության
բնորոշիչ փուլը
![]() կոմպլեքսից
արգասիքի առաջացումն
է (նկատվում է իզոտոպային
էֆեկտ):
կոմպլեքսից
արգասիքի առաջացումն
է (նկատվում է իզոտոպային
էֆեկտ):
Քննարկենք
I և II կարգի տեղակալիչների
ազդեցությունը
![]() կոմպլեքսի
կայունության
վրա` օգտվելով
ռեզոնանսային
կառուցվածքներից:
կոմպլեքսի
կայունության
վրա` օգտվելով
ռեզոնանսային
կառուցվածքներից:
Առաջին կարգի տեղակալիչներ, որոնք արագացնում են SE ռեակցիան.
էլեկտրոֆիլի հարձակում օրթո դիրքի վրա.
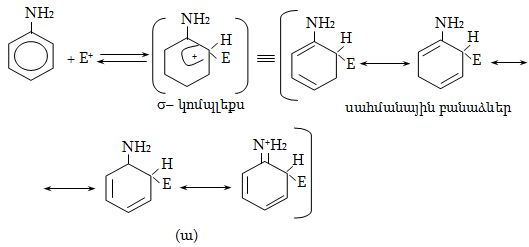
էլեկտրոֆիլի հարձակում պարա դիրքի վրա.
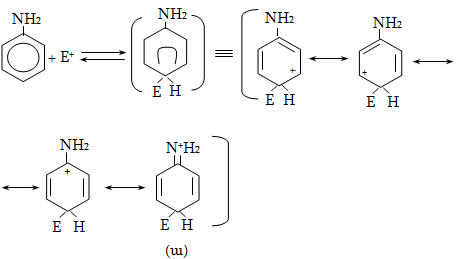
էլեկտրոֆիլի հարձակում մետա դիրքի վրա.

Սահմանային
բանաձևերից երևում
է, որ զուգորդումով
կայունացված են
միայնօրթո և պարա
դիրքերի վրա էլեկտրոֆիլի
հարձակման դեպքում
առաջացող ![]() կոմպլեքսները
(ա չափազանց կայուն
վիճակ):Մետա դիրքի
վրա հարձակման
դեպքում նման կայունացում
գոյություն չունի:
Հալոգենբենզոլներում
ստացվում են
կոմպլեքսները
(ա չափազանց կայուն
վիճակ):Մետա դիրքի
վրա հարձակման
դեպքում նման կայունացում
գոյություն չունի:
Հալոգենբենզոլներում
ստացվում են ![]() կոմպլեքսի
հետևյալ կայուն
սահմանային բանաձևերը.
կոմպլեքսի
հետևյալ կայուն
սահմանային բանաձևերը.
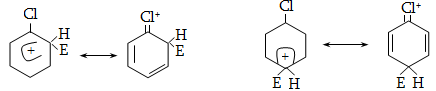
Ի տարբերություն մյուս օ-, պ- կողմնորոշիչների, հալոգենբենզոլները դժվար են փոխազդում էլեկտրոֆիլի հետ, քանի որ օժտված են (-I) էֆեկտով և փոքրացնում են օղակի էլեկտրոնային ամպի խտությունը:
Երկրորդ
կարգի տեղակալիչի առկայության
դեպքում ![]() կոմպլեքսում
զուգորդման հնարավորությունն
անհնար է, քանի
որ նման տեղակալիչը
չի կարող էլեկտրոններ
տրամադրել միջուկի
դրական լիցքի չեզոքացման
համար: Համեմատաբար
շահավետ կոմպլեքս
է (ա)-ն, քանի որ այս
դեպքում գոյություն
չունեն կից ատոմների
վրա երկու դրական
լիցքեր ունեցող
չափազանց անկայուն
(բ) վիճակներ:
կոմպլեքսում
զուգորդման հնարավորությունն
անհնար է, քանի
որ նման տեղակալիչը
չի կարող էլեկտրոններ
տրամադրել միջուկի
դրական լիցքի չեզոքացման
համար: Համեմատաբար
շահավետ կոմպլեքս
է (ա)-ն, քանի որ այս
դեպքում գոյություն
չունեն կից ատոմների
վրա երկու դրական
լիցքեր ունեցող
չափազանց անկայուն
(բ) վիճակներ:
էլեկտրոֆիլի հարձակում օրթո դիրքի վրա.
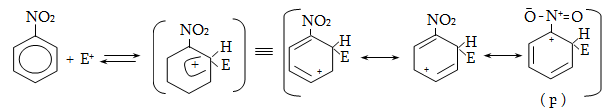
էլեկտրոֆիլի հարձակում պարա դիրքի վրա.
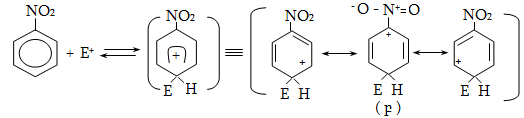
էլեկտրոֆիլի հարձակում մետա դիրքի վրա.
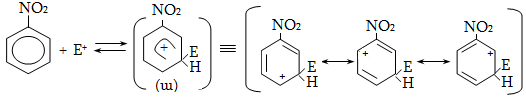
Այսպիսով,
էլեկտրոնային
էֆեկտները հեշտացնում
կամ դժվարացնում
են ռեագենտների
փոխազդեցությունը
բենզոլային օղակի
հետ` փոփոխելով
միջանկյալ ![]() կոմպլեքսի
կայունությունը:
Տեղակալիչի ազդեցությունը
թուլանում է, երբ
այն կողմնային
շղթայում է: Մի
քանի տեղակալիչների
առկայության դեպքում
ավելի արտահայտված
է այն տեղակալիչի
ազդեցությունը,
որը հակված է էլեկտրոնային
ամպի առավելագույն
տեղաշարժի
կոմպլեքսի
կայունությունը:
Տեղակալիչի ազդեցությունը
թուլանում է, երբ
այն կողմնային
շղթայում է: Մի
քանի տեղակալիչների
առկայության դեպքում
ավելի արտահայտված
է այն տեղակալիչի
ազդեցությունը,
որը հակված է էլեկտրոնային
ամպի առավելագույն
տեղաշարժի ![]() կոմպլեքսի
կայունացման համար:
օ- և պ-տեղակալված
արգասիքների հարաբերությունը
կախված է ռեակցիայի
պայմաններից: Օղակում
օրթո դիրքերը երկուսն
են, պարան` մեկը:
Օրթո դիրքում գործում
են տարածական դժվարություններ.
ցիմոլի նիտրացումից
ստացվում է 4-մեթիլ-3-նիտրոկումոլ.
կոմպլեքսի
կայունացման համար:
օ- և պ-տեղակալված
արգասիքների հարաբերությունը
կախված է ռեակցիայի
պայմաններից: Օղակում
օրթո դիրքերը երկուսն
են, պարան` մեկը:
Օրթո դիրքում գործում
են տարածական դժվարություններ.
ցիմոլի նիտրացումից
ստացվում է 4-մեթիլ-3-նիտրոկումոլ.
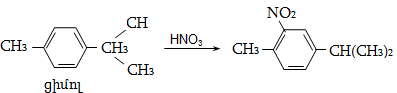
Օրթո դիրքերն ավելի հակված են ինդուկտիվ էֆեկտի ազդեցության, քանի որ այդ էֆեկտը շղթայում նվազում է: Նշանակում է, եթե տեղակալիչը (-I) էֆեկտով պասիվացնում է օղակը, այդ պասիվացումն ավելի ակնհայտ է օրթո դիրքում:
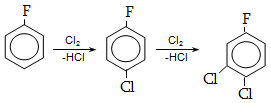
Զուգորդման
էֆեկտն առավել
արտահայտված է
պ-դիրքում (խինոիդային
կառուցվածքով
![]() կոմպլեքսն
ավելի կայուն է):
Զուգորդումն էական
ներդրում ունի
այն դեպքերում,
երբ զուգորդմանը
մասնակցող խմբերը
համահարթ են: Եթե
բենզոլային օղակի
և տեղակալիչի էլեկտրոնային
ամպերի առանցքները
զուգահեռ չեն,
զուգորդումը թուլանում
է, տեղակալիչը
չի ազդում օղակի
վրա: Զուգորդման
էֆեկտի այսպիսի
ազդեցությունը
հաստատված է շատ
օրինակներով:
կոմպլեքսն
ավելի կայուն է):
Զուգորդումն էական
ներդրում ունի
այն դեպքերում,
երբ զուգորդմանը
մասնակցող խմբերը
համահարթ են: Եթե
բենզոլային օղակի
և տեղակալիչի էլեկտրոնային
ամպերի առանցքները
զուգահեռ չեն,
զուգորդումը թուլանում
է, տեղակալիչը
չի ազդում օղակի
վրա: Զուգորդման
էֆեկտի այսպիսի
ազդեցությունը
հաստատված է շատ
օրինակներով:
1. Բերված միացություններից որո՞նք են արոմատիկ: Քննարկել արոմատիկության կանոնը:
2. Անվանել հետևյալ ածխաջրածնային մնացորդները.
3. Ինչպիսի՞ էլեկտրոնային էֆեկտներ են գործում հետևյալ մոլեկուլներում.
4. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.
օ-քսիլոլ, իզոպրոպիլբենզոլ, 1,2,3-տրիմեթիլբենզոլ, 1-բութիլ-3-էթիլ-բենզոլ, երրբութիլբենզոլ, պ-էթիլստիրոլ, 4-պրոպիլ-2-էթիլտոլուոլ:
5. Հետևյալ ալկիններից ինչպիսի՞ արոմատիկ միացություններ կստացվեն.
6. Լրացնել հետևյալ փոխարկումները`

7. Սինթեզել հետևյալ միացությունները Վյուրցի-Ֆիտիգի և Ֆրիդել-Կրաֆտսի ռեակցիաներով`
8. Լրացնել հետևյալ փոխարկումները.
9. Պարզել
![]() ածխաջրածնի
կառուցվածքը, եթե
այն գունազրկում
է բրոմաջուրը,
քրոմական խառնուրդով
օքսիդանում է բենզոյական
թթվի, իսկ
ածխաջրածնի
կառուցվածքը, եթե
այն գունազրկում
է բրոմաջուրը,
քրոմական խառնուրդով
օքսիդանում է բենզոյական
թթվի, իսկ ![]() նոսր
ջրային լուծույթով
փոխարկվում է
3-ֆենիլ-1,2-պրոպանդիոլի:
նոսր
ջրային լուծույթով
փոխարկվում է
3-ֆենիլ-1,2-պրոպանդիոլի:
10. Որոշել
![]() բաղադրությամբ
ածխաջրածնի կառուցվածքը,
եթե այն չի փոխազդում
[Ag(NH3)2]OHի
հետ, հիդրատանում
է` առաջացնելով
բաղադրությամբ
ածխաջրածնի կառուցվածքը,
եթե այն չի փոխազդում
[Ag(NH3)2]OHի
հետ, հիդրատանում
է` առաջացնելով
![]() կետոն,
որն օքսիդանում
է` գոյացնելով
տերեֆտալաթթու:
կետոն,
որն օքսիդանում
է` գոյացնելով
տերեֆտալաթթու:
11. Գրել տոլուոլի քլորացման ռեակցիան Լյուիսի թթվի ներկայությամբ և ճառագայթմամբ:
12. Հետևյալ հաջորդական փոխարկումների միջոցովպարզել A ածխաջրածնի կառուցվածքը: Այն ստանալ մեթանից:
![]()
13. Բենզոլի բրոմացման արդյունքում առաջացած բրոմաջրածինն անցկացվում է արծաթի նիտրատի լուծույթով, առաջանում է 7,52 գ նստվածք: Հաշվել բրոմացված արգասիքի զանգվածը:
14. Ցիկլոհեքսանի և ցիկլոհեքսենի խառնուրդը գունազրկում է 320 գ 10%-ոց բրոմաջուրը: Որոշել ածխաջրածինների խառնուրդի բաղադրությունը (զանգվածային %), եթե հայտնի է, որ խառնուրդի լրիվ դեհիդրոգենացումից առաջացած ջրածնով կարելի է ամբողջությամբ հիդրոգենացնել 11,2 լ դիվինիլ:
15. Ցիկլոհեքսանի և ցիկլոհեքսենի խառնուրդը գունազրկում է 400 գ 8%-ոց բրոմի տետրաքլորածխածնային լուծույթը: Ինչպիսի՞ն է խառնուրդի բաղադրությունը, եթե նույն զանգվածով նմուշից ստացված բենզոլի և ավելցուկով քլորի ռադիկալային փոխազդեցության արդյունքում ստացված արգասիքի զանգվածը 63,9 գ-ով մեծ է բենզոլի զանգվածից:
16. Նեոպենտիլ քլորիդով բենզոլի ալկիլման արդյունքում գերակշռում է 2-մեթիլ-2-ֆենիլբութանը: Գրել ռեակցիայի մեխանիզմը և բացատրել:
17. Հետևյալ միացություների նիտրացման ժամանակ ո՞ր արգասիքն է գերակշռում.
18. Բենզոլից ստանալ 4-բրոմ-2-նիտրոէթիլբենզոլ` ընտրելով ամենակարճ ճանապարհը:
19. Հետևյալ ռեակցիաներն ընթանում են բարձր ելքով, գրել ստացվող արգասիքների կառուցվածքային բանաձևերը.

20. Համեմատել հետևյալ միացությունների ռեակցիոնունակությունը նշված ռեակցիաներում: Ո՞ր արգասիքն է գերակշռում.

21. Հետևյալ միացությունները դասավորել SE ռեակցիաներում ըստ ռեակցիոնունակության աճի` բենզոլ, տոլուոլ, 1,3,5-տրիմեթիլբենզոլ, օ-քսիլոլ, մ- քսիլոլ:
22. Բենզոլից ստանալ հետևյալ միացությունները.

23. Անիզոլից ստանալ հետևյալ միացությունները.
24. Գերազանցապես ո՞ր միացությունը կստացվի հետևյալ ռեակցիաներում: Հիմնավորել.
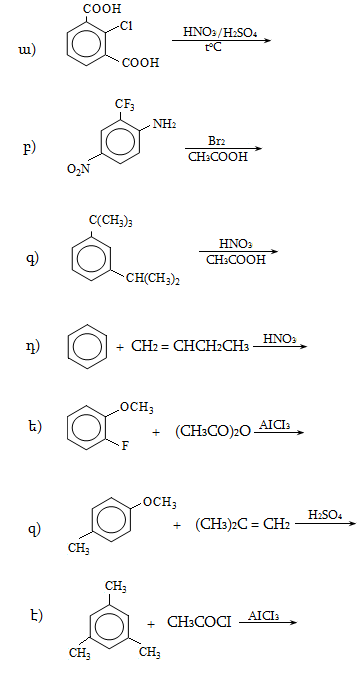
25. Լրացնել հետևյալ փոխարկումները.
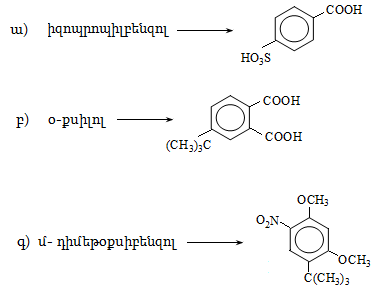
26. Գրել տոլուոլի և քսիլոլի օզոնացման ռեակցիան; Կարելի է՞ տարբերել իզոմեր քսիլոլները օզոնացման ռեակցիայով:
Բենզոլի և տոլուոլի սուլֆուրացման ռեակցիայով ի՞նչ արգասիքներ են ստացվում: Գրել ռեակցիաների մեխանիզմը և բացատրել սուլֆուրացման առանձնահատկությունը:
Բերված ածխաջրածիններից որո՞նք կստացվեն բենզոլից Վյուրցի-Ֆիտիգի, որո՞նք Ֆրիդել-Կրաֆտսի ռեակցիայով, իսկ որո՞նք և΄ այս, և΄ այն եղանակով.

15. ՀԱԼՈԳԵՆԱԿԱՆՆԵՐ ԱԼԿԻԼՀԱԼՈԳԵՆԻԴՆԵՐ
Մոնոհալոգենալկանները RX ընդհանուր բանաձևով միացություններ են, որտեղ R-ը առաջնային, երկրորդային կամ երրորդային ռադիկալ է, իսկ X-ը` հալոգենի ատոմ (F, Cl, Br, I):
15.1. Իզոմերիա, անվանակարգում
Հալոգենալկանների իզոմերիան պայմանավորված է ածխածնային շղթայի ճյուղավորումով և հալոգենի դիրքով: Կարդացվում են ռացիոնալ և IUPAC անվանակարգումով:
IUPAC անվանակարգումով ալկիլհալոգենիդները կարդալու համար հալոգենի ատոմ պարունակող ածխածնային շղթան համարակալվում է, նշվում է հալոգենի դիրքը և ավելացվում համապատասխան ածխաջրածնի անունը, իսկ ռացիոնալ անվանակարգումով ռադիկալի անվանն ավելացվում է համապատասխան հալոգենի անունը.

15.2. Ֆիզիկական հատկություններ
Հալոգենալկանների ֆիզիկական հատկությունները պայմանավորված են հալոգենի ատոմի բնույթով և ածխաջրածնային ռադիկալի կա-ռուցվածքով: Սովորական պայմաններում մեթիլ, էթիլ, պրոպիլ, բութիլ ֆտորիդները, մեթիլ, էթիլքլորիդները և մեթիլբրոմիդը գազեր են: Մնացած հալոգենալկանները հեղուկ են, իսկ բարձրամոլկուլայինները` պինդ նյութեր: Միևնույն կառուցվածքով ալկիլհալոգենիդների եռման ջերմաստիճաններն աճում են ֆտորիդներից դեպի յոդիդները: Իզոմեր հալոգենիդներից ամենացածր եռման ջերմաստիճանն ունի երրորդային ալկիլհալոգենիդը: Ֆտորից յոդ շարքում աճում է ալկիլհալոգենիդների խտությունը: Ցածրամոլեկուլային ալկիլհալոգենիդները գործնականում ջրում անլուծելի, քաղցրահամ նյութեր են, լավ լուծվում են օրգանական լուծիչներում: Ալկիլհալոգենիդներն օժտված են մեծ բևեռայնությամբ: ԻԿ սպեկտրում C-F և C-Cl կապերի վալենտային տատանումների մարզը գտնվում է ալիքների երկարության 1350 950 սմ-1 և 850 500 սմ-1 տիրույթում:
15.3. Կիրառման բնագավառներ, թունավորություն
Ալկանների հալոգենածանցյալները, շնորհիվ իրենց բարձր ռեակցիոնունակության, լայն կիրառություն ունեն քիմիական, թղթի և թեթև արդյունաբերություններում:
Մեթիլ, էթիլքլորիդները լավ ալկիլող միջոցներ են, կիրառվում են բազմաթիվ սինթեզներում: Մեթիլքլորիդը մեծ քանակներով օգտագործվում է տետրաէթիլկապարի (հակադետոնատոր) ստացման համար, ատամնաբուժության մեջ որպես կարճատև անզգայացնող: Էթիլքլորիդը տեղական ցավազրկող միջոց է, արագ գոլորշիանալով` սառեցնում է մաշկը: Քլորոֆորմը և 1,2-դիքլորէթանը քաղցրահամ հեղուկներ են, լավ լուծիչ են օրգանական տարբեր սինթեզների, ճարպերի, կաուչուկի, խեժերի, ֆոսֆորի, յոդի համար, չեն այրվում, օդում պայթունավտանգ չեն:
Քլորոֆորմը
(ՍԹԿ`
20 մգ/մ3) և 1,2-դիքլորէթանն
(ՍԹԿ`
10 մգ/մ3) ուժեղ
թմրամիջոցներ
են, ազդում են օրգանիզմի
նյութափոխանակության
և ներքին օրգանների,
մանավանդ` լյարդի
վրա: Դիքլորէթանը
որպես լուծիչ կիրառվում
է ներկանյութերի,
տեքստիլ արտադրություններում,
հումք է թիոկոլների,
դեղամիջոցների
ստացման գործընթացում:
Պոլիհալոգենածանցյալները
կիրառվում են որպես
միջատասպան միջոցներ`
![]() դիքլորդիֆենիլտրիքլորէթան
(ԴԴՏ), հեքսաքլորան`
հեքսաքլորցիկլոհեքսան:
դիքլորդիֆենիլտրիքլորէթան
(ԴԴՏ), հեքսաքլորան`
հեքսաքլորցիկլոհեքսան:
Քլորօրգանական միացությունները կուտակվում են օրգանիզմի ճարպային հյուսվածքներում: Պատճառն այն է, որ օրգանիզմում այդ միացությունները քայքայող ֆերմենտներ չկան:
Ածխաջրածինների հալոգենածանցյալները բնության մեջ դժվար են ենթարկվում փոխարկումների և ստեղծում են էկոլոգիական խնդիրներ: Ֆտորքլորածանցյալները բացասական ազդեցություն են գործում շրջակա միջավայրի վրա, քայքայում են մթնոլորտի օզոնային շերտը:
Անցյալ դարի 80-ական թթ. մարդկությունն իր ուշադրությունը սևեռեց մեթանի պարզագույն հալոգենածանցյալների վրա, երբ ամբողջ աշխարհը խոսեց օզոնային շերտի քայքայման մասին, որի պաշտպանությունը դարձավ համայն մարդկության ընդհանուր խնդիրը: Ֆտորքլոր-ածխածինները (ֆրեոններ), որոնք թունավոր չեն և չեն այրվում, հսկայան քանակներով արտադրվում և կիրառվում են որպես սառնագենտներ սառնարանային սարքավորումներում: Կայուն են ջերմության և օքսիդացման նկատմամբ, ներքնոլորտում չեն քայքայվում և հասնում են վերնոլորտ, որտեղ ՈՒՄ-ճառագայթմամբ ենթարկվում են հոմոլիտիկ դիսոցման.
![]()
Առաջացած ռադիկալները փոխազդում են օզոնի հետ, որը հանգեցնում օզոնային շերտի վերացման.
![]()
Ըստ միջազգային համաձայնագրի` վերջին տասնամյակում նվազեցվել է ֆրեոնների արտադրությունը և կիրառումը: Որպես ֆտորքլորածխածինների փոխարինիչներ առաջարկվել են ֆտորքլորածխաջրածիններ, որոնք պակաս կայուն են և քայքայվում են ներքնոլորտում, սակայն այս միացություններն առաջացնում են ջերմոցային ազդեցություն:
Մթնոլորտում և օզոնային շերտում հետազոտությունների համար 1995 թ. գիտնականներ Պ.Գրուտցենը, Մ.Մոլինը, Ֆ.Ռոուզենդը արժանացել են Նոբելյան մրցանակի :
Խիստ թունավոր նյութերի շարքին է դասվում ԴԴՏ-ն, որը կայուն է և կուտակվում է կենդանի օրգանիզմում, շատ ուժեղ միջատասպան է, սննդային շղթայով հասնում է մարդուն: Որոշ միջատներ կայունություն են ձեռք բերել այդ թույնի նկատմամբ, ֆերմենտի ազդեցության տակ այն փոխարկում են ոչ ակտիվ ձևի.
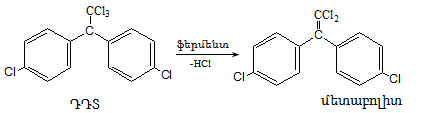
ԴԴՏ-ի և մետաբոլիտի կառուցվածքների համեմատությունը ցույց է տալիս, որ օրգանական մոլեկուլում չնչին փոփոխությունը բավարար է, որպեսզի կտրուկ փոխվի միացության կենսաբանական ակտիվությունը: ԴԴՏ-ն արգելված է 1970 թ., քանի որ խիստ թունավոր է մարդու և կենդանիների համար:
ԴԴՏ-ն առաջին անգամ սինթեզել է Օ. Ցայդլերը 1874 թ., իսկ որպես միջատասպան առաջարկվել է Պ. Մյուլլերի կողմից, որը 1948 թ. ստացել է Նոբելյան մրցանակ:
Դիօքսինը` (2,4,5-T) հերբիցիդ, որն առաջանում է 2,4,5-տրիքլոր-ֆենօքսիքացախաթթվի ստացման գործընթացում որպես կողմնակի միացություն, չափազանց թունավոր է, քաղցկեղածին և մուտագեն, առաջացնում է մաշկային հիվանդություններ: Դիօքսինը 15000 անգամ թունավոր է նատրիումի ցիանիդից: ԱՄՆ-ը (2,4,5-T) հերբիցիդը Վիետնամի պատերազմում կիրառել են որպես քիմիական զենք` «Նարնջագույն գործակալ» անվամբ.
Ընդհանրապես պոլիքլորդիֆենիլային միացություններն ազդում են օրգանիզմի նյութափոխանակության, լյարդի և երիկամների վրա:
Պերֆտորածխաջրածինները` ածխաջրածինների վերջնական ֆտորացման արգասիքները, ընդունակ են լուծելու թթվածինը և այն փոխանցելու արյունատար անոթներով, որը շատ արժեքավոր է մեծ քանակով արյան կորստի դեպքում: Պերֆտորաններն այս հատկության շնորհիվ կիրառվում են որպես արյան փոխարինիչներ ( պերֆտորան կամ «երկնագույն արյուն»):
15.4.Ստացման եղանակներ
15.4.1. Սահմանային ածխաջրածինների հալոգենացում (տես «Ալկաններ»)
![]()
15.4.2.Ալկենների հիդրոհալոգենացում (տես «Ալկեններ»)
![]()
15.4.3.Սպիրտների փոխազդեցություն հալոգենաջրածինների հետ (տես «Սպիրտներ»)
![]()
Գործնականում հալոգենաջրածինը հաճախ ստանում են ռեակցիայի միջավայրում.
![]()
15.4.4.Սպիրտների փոխազդեցություն հալոգենացնող միջոցների հետ
15.4.4.1. Փոխազդեցություն ֆոսֆորի հալոգենիդների հետ.
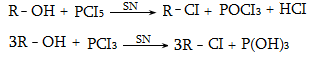
Ֆոսֆորի հալոգենիդները կարելի է ստանալ անմիջապես ռեակցիայի միջավայրում.
![]()
15.4.4.2. Լավագույն հալոգենացնող միջոց է թիոնիլ քլորիդը.
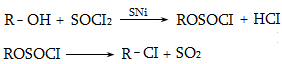
15.4.4.3. Ալկիլհալոգենիդներից` հալոգենի ատոմի փոխանակումով.
![]()
Ալկիլֆտորիդների ստացման համար օգտագործում են ծանր մետաղների ֆտորիդներ.
![]()
15.5. Քիմիական հատկություններ
Հալոգենալկանները ռեակցիոնունակ միացություններ են, ինչը բացատրվում է C-Hal կապի բևեռայնությամբ (-I էֆեկտ): Այս միացություններին բնորոշ են տեղակալման ռեակցիաներ, որոնք իրականացվում են լուծիչներում իոնական նուկլեոֆիլ մեխանիզմով (SN):
15.5.1. Ջրածնով անջատման պահին կամ յոդաջրածնով ազդելիս, ինչպես նաև կատալիզային հիդրումով ալկիլհալոգենիդները փոխարկվում են ալկանների.
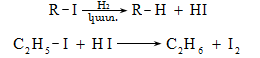
15.5.2. Հալոգենաջրածնական թթուների աղերով սպիրտում կամ ացետոնում մի հալոգենի ատոմը կարելի է փոխարինել մյուսով: Պետք է հաշվի առնել հալոգենիդների լուծելիությունը տվյալ լուծիչում: Նշված լուծիչներում վատ են լուծվում ալկալիական մետաղների քլորիդները և ծանր մետաղների յոդիդները.
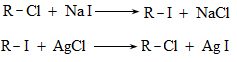
15.5.3. Ալկոհոլատների ազդեցությամբ առաջանում են պարզ եթերներ (Վիլյամսոն).
![]()
15.5.4. Ամոնիակը և ամինները հալոգենալկաններով ալկիլվում են համապատասխան առաջնային, երկրորդային, երրորդային ամինների և ամոնիումային աղերի (տես «Ամիններ»).
![]()
15.5.5. Կապտաթթվի աղերի հետ առաջանում են նիտրիլներ (ալ-կիլցիանիդ) և իզոնիտրիլներ.
![]()
15.5.6. Օրգանական թթուների աղերի հետ տաքացնելիս ստացվում են բարդ եթերներ.
![]()
15.5.7. Արծաթի նիտրիտի հետ առաջանում են նիտրոմիացություններ և ազոտային թթվի եթերներ (տես «Նիտրոմիացություններ»).
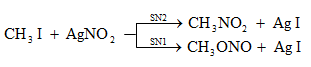
15.5.8. Մետաղօրգանական միացությունների ստացման կարևոր եղանակ է ալկիլհալոգենիդների փոխազդեցությունը մետաղների հետ բացարձակ չոր միջավայրում.
![]()
15.5.9. Ալկալիների կամ օրգանական միացությունների (խինոլին, դիմեթիլանիլին) սպիրտային լուծույթների ազդեցությամբ հալոգեն-ալկանները փոխարկվում են ալկենների.
![]()
15.5.10. Ալկիլհալոգենիդները ենթարկվում են հիդրոլիզի ալկալիների կամ ալկալիական մետաղների կարբոնատների ներկայությամբ տաքացման պայմաններում.
![]()
![]()
15.6. Ալկիլհալոգենիդների նուկլեոֆիլ տեղակալման ռեակցիաներ
Ալկիլհալոգենիդները փոխազդում են մեծ թվով օրգանական և անօրգանական նուկլեոֆիլ ռեագենտների հետ` առաջացնելով բազմաթիվ կարևորագույն միացություններ, ենթարկվում են նաև ալկենների ստացման համար կարևոր պոկման ռեակցիաների: Պոկումը և տեղակալումն իրականացվում են հիմքի առկայությամբ, հետևաբար դրանք մրցակցող ռեակցիաներ են.
![]()
Ալկիլհալոգենիդների նուկլեոֆիլ տեղակալման ռեակցիաները կքննարկվեն ավելի մանրամասն, քանի որ գերազանց լուսաբանում են մոլեկուլի կառուցվածքի ազդեցությունը ռեակցիոնունակության վրա և պարզաբանում ռեակցիաների մեխանիզմները: Կախված փոխարկվող մոլեկուլի, նուկլեոֆիլի, հեռացող խմբի բնույթից և ռեակցիայի պայմաններից` նուկլեոֆիլ տեղակալման ռեակցիաները կարող են իրականացվել տարբեր մեխանիզմներով: Նուկլեոֆիլ տեղակալման ռեակցիաների անվանակարգումն առաջարկել է տեսական օրգանական քիմիայի հիմնադիրԿ.Կ. Ինգոլդը:
15.6.1. Բիմոլեկուլային նուկլեոֆիլ տեղակալում` SN2
Փորձնական տվյալների հիման վրա պարզվել է, որ SN2 ռեակցիայի ժամանակ նուկլեոֆիլ ռեագենտը գրոհում է հալոգենին կից ածխածնի ատոմի վրա (մոլեկուլի առավել դրական մասը) հեռացող խմբի հակառակ կողմից: Արդյունքում նուկլեոֆիլը կապվում է այն ածխածնի ատոմի հետ, որին միացված էր հեռացող խումբը:
Նուկլեոֆիլի հետ կապի առաջացումը և հեռացող խմբի կապի խզումը կատարվում է միաժամանակ, այդ պատճառով ռեակցիան համարվում է «համաձայնեցված» գործընթաց.
![]()
Անցողիկ վիճակում հեռացող խմբին կից ածխածնի ատոմը sp3 հիբրիդացված վիճակից անցնում է sp2-ի, այսինքն` -կապերը գտնվում են միևնույն հարթության մեջ, իսկ Nu, C և X-ը` հարթությանն ուղղահայաց առանցքի վրա: Ռեակցիայի արագությունը բնորոշող փուլը (դանդաղ փուլ) անցողիկ վիճակի առաջացման փուլն է, որի արագությունն է.
![]()
Ռեակցիան երկրորդ կարգի է:
Համակարգի էներգիայի կախվածությունը ռեակցիայի կոորդի-նատներից ունի հետևյալ տեսքը.
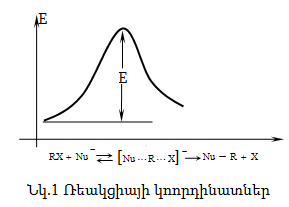
Օպտիկապես ակտիվ (ասիմետրիկ ածխածին ունեցող) մոլեկուլի փոխարկման դեպքում տեղի է ունենում վալդենյան շրջադարձ (ստացվում է ելանյութի հայելային պատկերը` անտիպոդը).

Օպտիկապես ակտիվ մոլեկուլները բևեռացված միագույն լույսի ճառագայթների հարթությունը պտտում են աջ (d-պտտող) կամ ձախ (l-պտտող):
Մոլեկուլի կառուցվածքը պահպանվում է այն դեպքում, երբ ռեակցիայի ժամանակ հաջորդաբար կատարվում է կրկնակի շրջադարձ, այսինքն` իրականացվում է երկու ռեակցիա SN2 մեխանիզմով: Այսպես, քլորհիդրինի հիմնային հիդրոլիզով առաջանում է գլիկոլ, որն ունի նույն կառուցվածքը, ինչ ելային քլորհիդրինը: Սա բացատրվում է նրանով, որ քլորհիդրինը փոխարկվում է գլիկոլի` միջանկյալ օքսիդի առաջացմամբ. կատարվում է մոլեկուլի ուրվապատկերի (կոնֆիգուրացիա) կրկնակի շրջադարձ`
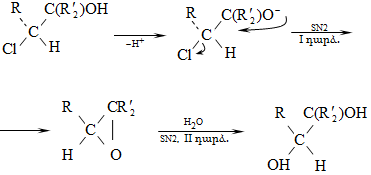
Մոլեկուլի ուրվապատկերը պահպանվում է նաև ներմոլեկուլային նուկլեոֆիլ տեղակալման ժամանակ (SNi): Օրինակ, սպիրտների փոխազդեցությունը թիոնիլքլորիդի հետ (SOCl2) կինետիկորեն ընթանում է որպես SN2 ռեակցիա: Ենթադրվում է միջանկյալ սեղմ իոնական զույգի առաջացում, որում Cl--ը գտնվում է այն կողմում, ինչ SO2 հեռացող խումբը.
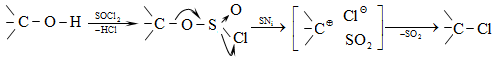
15.6.2. Մոնոմոլեկուլային նուկլեոֆիլ տեղակալում` SN1
Մոնոմոլեկուլային գործընթացի բնորոշիչ փուլը C - X կապի հետերոլիզն է կարբոնիում կատիոնի առաջացումով, որն արագ փոխազդում է միջավայրում գտնվող նուկլեոֆիլի հետ: Կարբկատիոնի առաջացումը կատարվում է հետևյալ փուլերով`
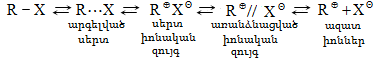
SN1 ռեակցիան ավելի պարզեցված կարելի է պատկերել երկու փուլով. ռեակցիայի արագությունը բնորոշող փուլը մոլեկուլի դիսոցումն է կայուն կարբկատիոնի առաջացումով.
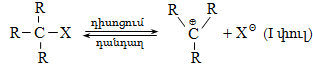
Արագ փուլում կարբկատիոնը փոխազդում է նուկլեոֆիլի հետ: Կարբկատիոնը փորձնականորեն ֆիքսվող (որոշվող), էներգիայով հարուստ «միջանկյալ» արգասիք է, այն կարող է արագ վերածվել ելային միացության` RX, տեղակալման արգասիքի` RNu կամ պոկման և վերախմբավորման արգասիքների.
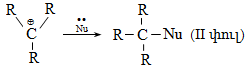
Ռեակցիան համապատասխանում է առաջին կարգի կինետիկական հավասարման.
![]()
SN1 մեխանիզմով համակարգի էներգիայի կախվածությունը ռեակցիայի կոորդինատներից ունի հետևյալ տեսքը.
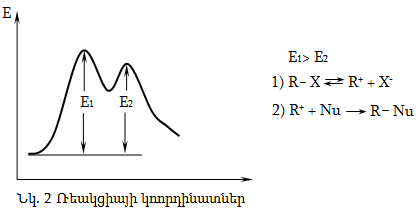
Օպտիկապես ակտիվ (d կամ l) ալկիլհալոգենիդների ռեակցիայի արդյունքում ստացված արգասիքը ռացեմատ է, այսինքն` d և l օպտիկական իզոմերների խառնուրդ, որը լույսի բևեռացված ճառագայթների հարթությունը չի պտտում:
Բիմոլեկուլային ռեակցիայի ակտիվացման էներգիան ավելի ցածր է, քան մոնոմոլեկուլային ռեակցիայինը, իսկ ակտիվացման էնտրոպիան SN1-ի դեպքում ունի բացասական արժեքներ (անցողիկ վիճակը զբաղեցնում է մեծ տարածություն):
Նուկլեոֆիլ տեղակալման ռեակցիայի ուղղությունը պայմանավորված է սուբստրատի, նուկլեոֆիլի, տեղակալվող խմբի, լուծիչի բնույթով: SN ռեակցիայի վրա ազդում են նաև տարածական գործոնները և կատալիզատորները:
15.6.3. Սուբստրատի կառուցվածքի ազդեցությունը
SN1 ռեակցիային
նպաստում են ռեակցիոն
կենտրոնին կից
![]() գտնվող
էլեկտրոնադոնոր
տեղակալիչները,
որոնք իրենց դրական
ինդուկտիվ (+I) և դրական
մեզոմեր (+M) էֆեկտներով
կայունացնում
են միջանկյալ կարբկատիոնը
և նպաստում սուբստրատում
C-X կապի բևեռացմանը:
Ալկիլ խմբերի
+I էֆեկտների մեծացմամբ
հիդրոլիզի արագությունը
մեծանում է հետևյալ
շարքում.
գտնվող
էլեկտրոնադոնոր
տեղակալիչները,
որոնք իրենց դրական
ինդուկտիվ (+I) և դրական
մեզոմեր (+M) էֆեկտներով
կայունացնում
են միջանկյալ կարբկատիոնը
և նպաստում սուբստրատում
C-X կապի բևեռացմանը:
Ալկիլ խմբերի
+I էֆեկտների մեծացմամբ
հիդրոլիզի արագությունը
մեծանում է հետևյալ
շարքում.
![]()
Ըստ
SN2 մեխանիզմի` էլեկտրոնադոնոր
տեղակալիչներն
իրենց +I էֆեկտով
փոքրացնում են
ռեակցիոն կենտրոնի
դրական լիցքը,
տարածականորեն
խանգարում են`
դժվարացնելով
նուկլեոֆիլի հարձակումը:
SN2 մեխանիզմով տեղակալումը
հեշտ է ընթանում
ռեակցիոն կենտրոնի
նկատմամբ ![]() դիրքում
էլեկտրոնակցեպտոր
խմբերի առկայության
դեպքում, որոնք
նպաստում են այնպիսի
անցողիկ վիճակի
առաջացման, որում
C-ի վրա մասնակի
դրական լիցքն ավելի
փոքր է, քան ելային
վիճակում: Ալկիլ
տեղակալիչների
ներկայությամբ
SN2 ռեակցիայի արագությունը
(ալկիլհալոգենիդի
հիդրոլիզ) մեծանում
է հետևյալ շարքում.
դիրքում
էլեկտրոնակցեպտոր
խմբերի առկայության
դեպքում, որոնք
նպաստում են այնպիսի
անցողիկ վիճակի
առաջացման, որում
C-ի վրա մասնակի
դրական լիցքն ավելի
փոքր է, քան ելային
վիճակում: Ալկիլ
տեղակալիչների
ներկայությամբ
SN2 ռեակցիայի արագությունը
(ալկիլհալոգենիդի
հիդրոլիզ) մեծանում
է հետևյալ շարքում.
![]()
Նշանակում է, տեղակալիչները փոխելով, կարելի է փոխել ռեակցիայի մեխանիզմը:
15.6.4. Տեղակալվող խմբի բնույթը
Միևնույն պայմաններում և΄ SN1, և΄ SN2 ռեակցիաների արագությունը կմեծանա C - X կապի խզման էներգիայի փոքրացումով: Որքան ավելի հեշտ է կատարվում C - X կապի իոնացումը, այնքան արագանում է SN1 ռեակցիան:
Հալոգենածանցյալների համար SN2 ռեակցիայի արագությունն աճում է կապի էներգիայի փոքրացմամբ.
![]()
Որքան փոքր է խմբի էլեկտրաբացասականությունը, այնքան հեշտ է տեղակալվում SN2 ռեակցիայում:
Հետևյալ շարքում փոքրանում է տեղակալման արագությունը.
![]()
Այս հանգամանքը հնարավորություն է տալիս I- իոնը կիրառել որպես կատալիզատոր SN ռեակցիաներում: Յոդ իոնի կատալիզող քանակների ներկայությամբ արագանում են ալկիլքլորիդների հիդրոլիզի և ամոնոլիզի ռեակցիաները.
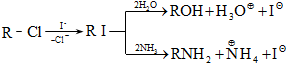
Որոշ
տեղակալիչներ
հրաշալի հեռացող
խմբեր են, առաջացնում
են կայուն իոններ
կամ մոլեկուլներ:
Դժվար հեռացող
խմբերն առաջացնում
են անկայուն իոններ
կամ մոլեկուլներ:
Որպես կանոն` ուժեղ
հիմքերը վատ հեռացող
խմբեր են: Օրինակ`![]()
Բրոմիդ իոնը չի փոխազդում մեթանոլի հետ, քանի որ OH-ը դժվար է հեռանում: Հիդրօքսիդ իոնն ավելի ուժեղ հիմք է, քան ջուրը, նշանակում է ջուրն ավելի հեշտ է հեռանում: Մեթանոլի ռեակցիան բրոմիդ իոնի հետ տեղի է ունենում թթվային միջավայրում, քանի որ հիդրօքսիլ խումբը պրոտոնանում է, և բրոմիդ իոնը դուրս է մղում ոչ թե OH խմբին, այլ H2O-ին:
Կա հակադարձ համեմատականություն մասնիկի հիմնայնության և տեղակալվելու ունակության միջև:
15.6.5. Նուկլեոֆիլ ռեագենտի ազդեցությունը
Նուկլեոֆիլի կոնցենտրացիայի փոփոխությունը SN1 ռեակցիայի արագության վրա չի ազդում, քանի որ այն չի մասնակցում արագությունը բնորոշող փուլում:
SN ռեակցիաներում մեծ նշանակություն ունեն հիմնայնություն և նուկլեոֆիլություն հասկացությունները: Հիմնայնությունը հիմքի (նուկլեոֆիլի) պրոտոն (H+) միացնելու հատկությունն է` նուկլեոֆիլի խնամակցությունը դեպի պրոտոնը: Նուկլեոֆիլությունը հիմքի (նուկլեոֆիլի) ածխածնի կամ որևէ այլ ատոմի հետ միանալու ունակությունն է` նուկլեոֆիլի խնամակցությունը ածխածնի նկատմամբ: Էլեկտրոնային զույգ տրամադրող յուրաքանչյուր դոնոր նուկլեոֆիլ է, երբ գրոհում է որևէ դրական կենտրոնի վրա, և հիմք է, երբ գրոհում է ջրածնի ատոմի վրա: Բոլոր հիմքերը նուկլեոֆիլ են, բայց SN2 ռեակցիայում օժտված չեն միանման արդյունավետությամբ: Նուկլեոֆիլ և հիմք տերմինները կարելի է կիրառել նույն մասնիկի նկատմամբ, ըստ իրականացվող ռեակցիայի.

![]() Նուկլեոֆիլի
ուժգնությունն
աճում է էլեկտրաբացասականության
մեծացմամբ: Նշանակում
է, անիոններն ավելի
ուժեղ նուկլեոֆիլներ
են, քան դրանց զուգորդված
թթուները [զուգորդված
թթու (HA)` A- անիոնի
միացման արգասիքն
է պրոտոնի (H+) հետ]:
Այսպես, OH-ն ավելի
ուժեղ նուկլեոֆիլ
է, քան
Նուկլեոֆիլի
ուժգնությունն
աճում է էլեկտրաբացասականության
մեծացմամբ: Նշանակում
է, անիոններն ավելի
ուժեղ նուկլեոֆիլներ
են, քան դրանց զուգորդված
թթուները [զուգորդված
թթու (HA)` A- անիոնի
միացման արգասիքն
է պրոտոնի (H+) հետ]:
Այսպես, OH-ն ավելի
ուժեղ նուկլեոֆիլ
է, քան ![]()
![]()
Պրոտոնային լուծիչներում (օրինակ, էթանոլում) անիոնն օժտված է մեծ նուկլեոֆիլությամբ, եթե դրա չափերն ավելի մեծ են: Նշանակում է, պարբերական համակարգում վերևից ներքև ատոմների նուկլեոֆիլությունը մեծանում է:
Հալոգենների նուկլեոֆիլության շարք.
![]()
![]()
![]()
![]() Նույն
դատողությամբ
RSH-ն ավելի ակտիվ
նուկլեոֆիլ է,
քան ROH-ը, RS-ն ավելի
ակտիվ, քան RO-ն,
PH2-ն ավելի ակտիվ,
քան NH2-ը: Ատոմի
չափերի ազդեցությունը
նուկլեոֆիլության
վրա պայմանավորված
է նաև ատոմի բևեռանալու
ունակությամբ
և սոլվատացման
փոքր էներգիայով:
Մեծ չափերով ատոմների
արտաքին էլեկտրոնները
գտնվում են ատոմի
դրական լիցքավորված
միջուկից հեռու
և հեշտ են ձևափոխվում
(դեֆորմացվում):
Նույն
դատողությամբ
RSH-ն ավելի ակտիվ
նուկլեոֆիլ է,
քան ROH-ը, RS-ն ավելի
ակտիվ, քան RO-ն,
PH2-ն ավելի ակտիվ,
քան NH2-ը: Ատոմի
չափերի ազդեցությունը
նուկլեոֆիլության
վրա պայմանավորված
է նաև ատոմի բևեռանալու
ունակությամբ
և սոլվատացման
փոքր էներգիայով:
Մեծ չափերով ատոմների
արտաքին էլեկտրոնները
գտնվում են ատոմի
դրական լիցքավորված
միջուկից հեռու
և հեշտ են ձևափոխվում
(դեֆորմացվում):
Մեծ անիոններում բացասական լիցքը բաշխված է համեմատաբար մեծ ծավալում, հետևաբար ջրածնական կապերի առաջացումն այնքան էլ կարևոր չէ անիոնի կայունացման համար: Իսկ փոքր չափերով անիոնների և լուծիչի ուժեղ փոխազդեցության արդյունքում նվազում է նուկլեոֆիլությունը:
Պրոտոնային լուծիչներում որոշ նուկլեոֆիլների ռեակցիոնունակության կարգը հետևյալն է.
![]()
Բերված շարքից երևում է, որ հավասար պայմանների դեպքում, որքան մեծ է ռեագենտի նուկլեոֆիլությունը, այնքան մեծ է SN2 ռեակցիայի հավանականությունը և հակառակը, թույլ նուկլեոֆիլի առկայությամբ ռեակցիան կատարվում է SN1 մեխանիզմով:
15.6.6. Լուծիչի ազդեցությունը
Լուծիչը
մեծ դեր ունի SN ռեակցիաներում:
Լուծիչները լինում
են պրոտոնային
(ջուր, սպիրտներ,
թթուներ, ամոնիակ,
ամիններ) և ցուցաբերում
են ինչպես նուկլեոֆիլ,
այնպես էլ` էլեկտրոֆիլ
հատկություններ,
այսինքն սոլվատացնում
են կատիոններ
(կամ ցածր էլեկտրոնային
խտությամբ մասնիկներ)
և անիոններ (կամ
բարձր էլեկտրոնային
խտությամբ մասնիկներ):
Ապրոտոն լուծիչները
լինում են չեզոք`
ոչ բևեռային (ածխաջրածիններ,
սիմետրիկ պոլիհալոգենածանցյալներ`
CCl4, CHCl2CHCl2,
), բևեռային
(եթերներ, դիօքսան,
ացետոն, ացետոնիտրիլ,
նիտրոմեթան) և
երկբևեռ` բիպոլյար
(դիմեթիլֆորմամիդ,
դիմեթիլ-սուլֆօքսիդ,
հեքսամեթիլֆոսֆորտրիամիդ):
Ոչ բևեռային լուծիչները
սոլվատացնում
են կատիոնները,
իսկ բևեռային լուծիչները`
![]() կատիոնները,
կատիոնները,
![]() անիոնները:
անիոնները:
SN1 ռեակցիայի ընթացքում բևեռացումը մեծանում է, միաժամանակ մեծանում է անցողիկ վիճակի սոլվատացման հնարավորությունը` ելայինի համեմատ:
![]()
Նշանակում է կատիոնների նկատմամբ սոլվատացման ընդունակ լուծիչները կարագացնեն ռեակցիան: Իսկապես, ապրոտոն երկբևեռ լուծիչների կիրառման ժամանակ ռեակցիայի արագությունը մեծանում է լուծիչի բևեռացման մեծացմամբ: Նշանակում է լուծիչի բևեռայնությունը նպաստում է SN1 ռեակցիային:
SN2 ռեակցիաներում հնարավոր են հետևյալ անցողիկ վիճակները.
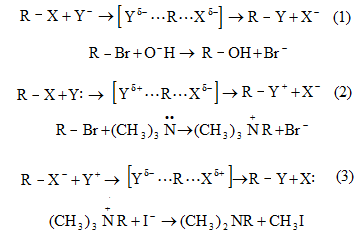
(1) և (3) անցողիկ վիճակներում տեղի է ունենում համակարգի բևեռացման փոքրացում տարածության մեջ լիցքի բաշխման (1) կամ մասնակի չեզոքացման (3) հետևանքով: Համակարգի բևեռացման փոքրացումը նվազեցնում է սոլվատացումը, հետևաբար նաև` արագությունը: Լուծիչներն այս դեպքում չեն նպաստում անցողիկ վիճակին: (2) ռեակցիայում անցողիկ վիճակն ավելի բևեռացված է, հետևաբար` սոլվատացված: Նշանակում է լուծիչի բևեռացումը կնպաստի ռեակցիայի արագության մեծացմանը:
Պրոտոնային լուծիչներում նուկլեոֆիլությունը նվազում է հետևյալ շարքում.
![]()
Իսկ ապրոտոն երկբևեռ լուծիչում նուկլեոֆիլության կարգը փոխվում է, քանի որ այս դեպքում անիոնները սոլվատացված չեն.
![]()
Այժմ SN2 ռեակցիաների համար կիրառվում են մեծ դիէլեկտրիկ թափանցելիությամբ օժտված ապրոտոն երկբևեռ լուծիչներ, որոնք ջըրածնական կապեր չեն առաջացնում և ունեն գերիշխող նշանակություն. դիմեթիլսուլֆօքսիդ (ԴՄՍՕ), սուլֆալան, հեքսամեթիլֆոսֆորտրիամիդ (ՀՄՖՏԱ), դիմեթիլֆորմամիդ (ԴՄՖԱ).
Երկբևեռ ապրոտոն լուծիչների առավելությունը երևում է հետևյալ օրինակով.
1,3-դիքլորպրոպանից 1,3-դիցիանպրոպանի ստացման ռեակցիայի արագությունը ԴՄՍՕ-ում 1000 անգամ ավելի մեծ է, քան ջրասպիրտային միջավայրում.
![]()
15.7. Պոկման ռեակցիաներ
Պոկման
ռեակցիայի ժամանակ
մոլեկուլից միաժամանակ
հեռանում են երկու
խումբ: Այն ատոմը,
որը պարունակում
է բնորոշ հեռացող
խումբ (օրինակ,
Cl) կոչվում է ![]() իսկ այն
ածխածինը, որն
ունի ոչ բնորոշ
հեռացող խումբ
(օրինակ, H), կոչվում
է հաջորդաբար
իսկ այն
ածխածինը, որն
ունի ոչ բնորոշ
հեռացող խումբ
(օրինակ, H), կոչվում
է հաջորդաբար ![]() , ըստ որի
պոկումը կարող
է կոչվել
, ըստ որի
պոկումը կարող
է կոչվել ![]() և այլն,
իսկ ռեակցիաները`
և այլն,
իսկ ռեակցիաները`
![]() պոկման
ռեակցիաներ.
պոկման
ռեակցիաներ.
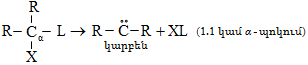
Եթե հեռացող
խմբերը կապված
են կից ատոմների
հետ, ապա պոկման
ռեակցիայի արդյունքում
առաջանում է ![]() կապ:
կապ:
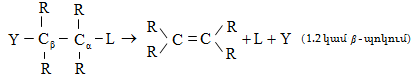
Միմյանցից հեռու գտնվող պոկվող խմբերը բերում են ցիկլոմիացության առաջացման.
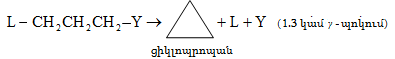
Կարևոր
դեր ունեն ![]() պոկման
ռեակցիաները: Կախված
ռեակցիայի պայմաններից
և ռեակցող միացությունների
կառուցվածքից`
պոկման
ռեակցիաները: Կախված
ռեակցիայի պայմաններից
և ռեակցող միացությունների
կառուցվածքից`
![]() պոկման
ռեակցիաները կարող
են ընթանալ մոնոմոլեկուլային
(E1) կամ բիմոլեկուլային
(E2) գործընթացով:
պոկման
ռեակցիաները կարող
են ընթանալ մոնոմոլեկուլային
(E1) կամ բիմոլեկուլային
(E2) գործընթացով:
15.7.1. Մոնոմոլեկուլային պոկում (E1)
E1 ռեակցիան իրականանում է երկու փուլով. առաջին` դանդաղ, ռեակցիայի արագությունը բնորոշող փուլը կարբկատիոնի առաջացումն է, որը հաջորդ` արագ փուլում կայունանում է պրոտոնի պոկումով: E1 ռեակցիան բնորոշ է երրորդային ալկիլհալոգենիդներին.
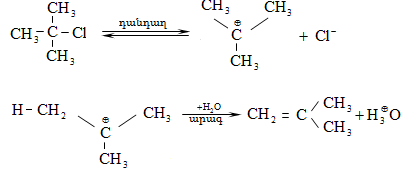
Ռեակցիան համապատասխանում է առաջին կարգի կինետիկական հավասարման: Ռեակցիայի արագությունն ուղիղ համեմատական է ալկիլհալոգենիդի կոնցենտրացիային:
![]()
Ինչպես երևում է, E1 և SN1 ռեակցիաներն ունեն ռեակցիայի արագությունը բնորոշող միևնույն փուլը` կարբկատիոնի առաջացումը, նշանակում է մրցակցող ռեակցիաներ են.
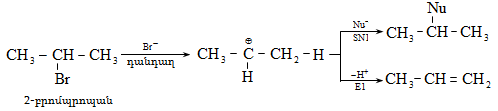
Եթե
մոլեկուլում առկա
են պոկման համար
մատչելի մի քանի
![]() ջրածիններ,
ապա պոկվում է
այն ջրածինը, որի
պոկման արդյունքում
առաջանում է առավել
կայուն (ճյուղավորված)
ալկեն, այսինքն
E1 ռեակցիան կատարվում
է ըստ Զայցևի կանոնի
(ջրածինը պոկվում
է պակաս հիդրոգենացված
ածխածնի ատոմից):
ջրածիններ,
ապա պոկվում է
այն ջրածինը, որի
պոկման արդյունքում
առաջանում է առավել
կայուն (ճյուղավորված)
ալկեն, այսինքն
E1 ռեակցիան կատարվում
է ըստ Զայցևի կանոնի
(ջրածինը պոկվում
է պակաս հիդրոգենացված
ածխածնի ատոմից):
![]()
E1 ռեակցիան ուղեկցվում է վերախմբավորումներով և բացի սպասվելիք ալկեններից վերախմբավորման արդյունքում ստացվում է նաև իզոմեր: Օրինակ, 3-մեթիլ-2-բութանոլի դեհիդրատացման արդյունքում, բացի 3-մեթիլ-1-բութենից և 2-մեթիլ-2-բութենից (հիմնական ուղղություն), ստացվում է նաև 2-մեթիլ-1-բութեն:
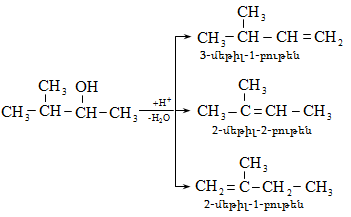
2-մեթիլ-1-բութենի առաջացումը բացատրվում է միջանկյալ առաջացող կարբկատիոնում 1,2-հիդրիդային տեղաշարժի հետևանքով գոյացած կատիոնի դեպրոտոնացումով.
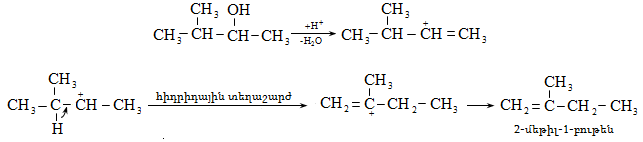
15.7.2. Բիմոլեկուլային պոկում (E2)
E2 ռեակցիայում
նուկլեոֆիլն էլեկտրոնային
զույգով գրոհում
է հեռացող խմբի
նկատմամբ ![]() դիրքի ջրածնի
վրա: Նուկլեոֆիլի
ազդեցությամբ
դիրքի ջրածնի
վրա: Նուկլեոֆիլի
ազդեցությամբ
![]() կապը խարխլվում
է, միաժամանակ
կատարվում C - Br կապի
խզում և
կապը խարխլվում
է, միաժամանակ
կատարվում C - Br կապի
խզում և ![]() կապի գոյացում:
Ակտիվացված կոմպլեքսում
Nu-H,
կապի գոյացում:
Ակտիվացված կոմպլեքսում
Nu-H, ![]() (
(![]() կապ) կապերն
առաջանում են մասնակի,
իսկ
կապ) կապերն
առաջանում են մասնակի,
իսկ ![]() կապերը
մասնակի խզվում
են.
կապերը
մասնակի խզվում
են.
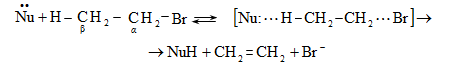
Ռեակցիան համաձայնեցված գործընթաց է` կապերի խզումը և առաջացումը կատարվում են միաժամանակ:
Ռեակցիայի արագությունն արտահայտվում է հետևյալ հավասարմամբ.
![]()
15.7.3. E1cb ռեակցիաներ
![]() պոկման
այս մեխանիզմը
բաղկացած է հիմքի
ազդեցությամբ
պրոտոնի պոկման
արդյունքում գոյացող
կայուն կարբանիոնի
առաջացման արագ
փուլից և կարբանիոնի
փոխարկումից ալկենի
(դանդաղ փուլ): Քանի
որ գործընթացն
իրականանում է
ելանյութին համապատասխան
զուգորդված հիմքի
առաջացման վրայով,
այն նշանակվում
է E1cb (cb - conjugation base - զուգորդված
հիմք): E1cb-ն մրցակից
է E2 ռեակցիային:
Կարբանիոնի անկայունության
հետևանքով E1cb հազվադեպ
հանդիպող ռեակցիաներից
է: E1cb ռեակցիան մոնոմոլեկուլային
է, քանի որ ռեակցիայի
արագությունը
բնորոշող փուլում
մասնակցում է միայն
մեկ մասնիկ.
պոկման
այս մեխանիզմը
բաղկացած է հիմքի
ազդեցությամբ
պրոտոնի պոկման
արդյունքում գոյացող
կայուն կարբանիոնի
առաջացման արագ
փուլից և կարբանիոնի
փոխարկումից ալկենի
(դանդաղ փուլ): Քանի
որ գործընթացն
իրականանում է
ելանյութին համապատասխան
զուգորդված հիմքի
առաջացման վրայով,
այն նշանակվում
է E1cb (cb - conjugation base - զուգորդված
հիմք): E1cb-ն մրցակից
է E2 ռեակցիային:
Կարբանիոնի անկայունության
հետևանքով E1cb հազվադեպ
հանդիպող ռեակցիաներից
է: E1cb ռեակցիան մոնոմոլեկուլային
է, քանի որ ռեակցիայի
արագությունը
բնորոշող փուլում
մասնակցում է միայն
մեկ մասնիկ.
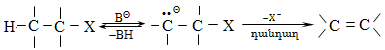
E2 և E1cb ռեակցիաները կարելի է տարբերել դեյտերացված լուծիչի օգնությամբ: Եթե E2 ռեակցիան դեյտերացված լուծիչում մինչև վերջ չտարվի, ապա առանձնացված չփոխազդած ելանյութը D չի պարունակի, քանի որ ըստ E2 մեխանիզմի ուղիներ չկան D-ի մուտքի համար.
![]()
Այսպիսի փոխազդեցություն չի կատարվում:
Եթե ռեակցիան տեղի է ունենում միջանկյալ կարբանիոնի առաջացումով (E1cb), ապա D-ն մտնում է ելանյութի մեջ.
![]()
Քլորոֆորմից
դիքլորկարբենի
առաջացումը (![]() պոկում)
ընթանում է E1cb մեխանիզմով.
պոկում)
ընթանում է E1cb մեխանիզմով.
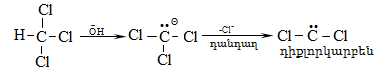
15.8. Տեղակալման և պոկման ռեակցիաների որոշ օրինաչափություններ
Ընդհանրացնելով տեղակալման և պոկման ռեակցիաների օրինաչափությունները` կարելի է կանխատեսել տարբեր ռեակցող համակարգերի վարքը.
15.8.1. ՈՒժեղ հիմքերը (օրինակ` NH2) նպաստում են ավելի մեծ չափով պոկման, քան տեղակալման ռեակցիային, ընդ որում գերակշռում է E2 (կամ E1cb) մեխանիզմով գործընթացը:
15.8.2. Չնայած SN և E ռեակցիաներում հեռացող խմբերի հարաբերական ակտիվությունը գործնականում չի տարբերվում` որոշ խմբերի պոկումը հիմնականում կատարվում է E1 և E2 մեխանիզմներով: Այդպիսի խմբեր են OH2 և N2 : Պոկման ռեակցիաներում (E1 և E2) որպես հեշտ հեռացող անիոնային խումբ կիրառում են RSO3:
Ֆտորիդ իոնը հրաշալի հեռացող խումբ է E1cb ռեակցիաներում:
15.8.3. Առավել բևեռային լուծիչներում E2-ի համեմատ գերակշռում են SN2 ռեակցիաները: Այսպես, E2 ռեակցիաներում կիրառվում է KOH-ի սպիրտային լուծույթ, իսկ SN2 ռեակցիաներում` KOH-ի ջրային լուծույթ:
15.8.4. Կարբկատիոնները գերազանցապես առաջացնում են ավելի մեծ ելքով տեղակալման, քան պոկման արգասիքներ (SN1>E1): Այս հարաբերությունը չի կարելի փոխել` լուծիչը փոխելով:
15.8.5. Տեղակալումը
![]() -ի մոտ ավելի
է նպաստում E2-ին,
քան SN2-ին և հեշտացնում
է E1-ը:
-ի մոտ ավելի
է նպաստում E2-ին,
քան SN2-ին և հեշտացնում
է E1-ը: ![]() ի մոտ տեղակալումը
կնպաստի E2-ին: Էլեկտրոնակցեպտոր
խմբերը (Br, CN, ...)
ի մոտ տեղակալումը
կնպաստի E2-ին: Էլեկտրոնակցեպտոր
խմբերը (Br, CN, ...) ![]() դիրքում
բարձրացնում են
ջրածնի թթվայնությունը
և նպաստում E2 (E1cb) ռեակցիաներին:
դիրքում
բարձրացնում են
ջրածնի թթվայնությունը
և նպաստում E2 (E1cb) ռեակցիաներին:
15.8.6. Ջերմաստիճանի բարձրացումը մեծացնում է պոկման ռեակցիայի հնարավորությունը:
15.8.7. Ալկենների ստացման համար հիմնականում կիրառում են E2 ռեակցիաներ, քանի որ E1 պոկումն ուղեկցվում է իզոմերացումով:
16. ՍԱՀՄԱՆԱՅԻՆ ԱԾԽԱՋՐԱԾԻՆՆԵՐԻ ԴԻ- ԵՎ ՊՈԼԻՀԱԼՈԳԵՆԱԾԱՆՑՅԱԼՆԵՐ
Դի- և պոլիհալոգենածանցյալները կարող են ունենալ միևնույն կամ տարբեր հալոգենների ատոմներ:
16.1. Իզոմերիա, անվանակարգում
Միևնույն ածխածնի մոտ հալոգենների ատոմներով ալկիլհալոգենիդները կոչվում են հեմինալ, կից ածխածնի ատոմների մոտ հալոգեններով ալկիլհալոգենիդները` վիցինալ.

16.2. Ստացման եղանակներ
Պոլիհալոգենածանցյալները, սովորաբար, ստանում են ածխաջրածիններից կամ թթվածին պարունակող միացություններից:
16.2.1. Դի- և պոլիքլորիդներ կարելի է ստանալ սահմանային ածխաջրածինների քլորացման արգասիքներից ( տես «Ալկաններ» ):
16.2.2. Հեմինալ դիհալոգենածանցյալներ ստացվում են ալդեհիդների և կետոնների փոխազդեցությամբ ֆոսֆորի հալոգենիդների հետ.
![]()
16.2.3. Ալկեններին հալոգենների միացմամբ ստացվում են վիցինալ դիհալոգենածանցյալներ (տես «Ալկեններ»).
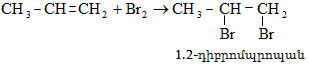
16.2.4. Ածխածնի տարբեր ատոմների մոտ հալոգենով միացություններ ստանում են գլիկոլների կամ այլ բազմատոմ սպիրտների փոխազդեցությամբ հալոգենաջրածինների, ֆոսֆորի հալոգենիդների, թիոնիլքլորիդի հետ:
![]()
16.3. Ֆիզիկական և քիմիական հատկություններ
Դի- և պոլիհալոգենածանցյալները ջրում անլուծելի ծանր հեղուկներ կամ բյուրեղային նյութեր են: Հալոգենալկանների նման մտնում են նուկլեոֆիլ տեղակալման ռեակցիաների մեջ: Հիդրոլիզվում են գլիկոլների, ալդեհիդների, կետոնների, թթուների.
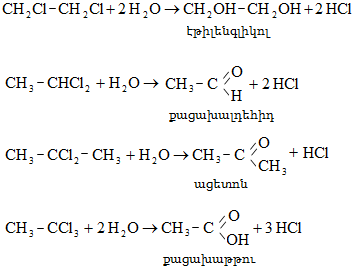
Հեմինալ դիհալոգենածանցյալների հիդրոլիզը երկփուլ է (SN2, E2).
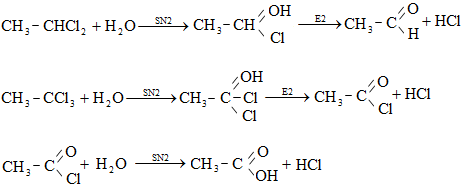
16.4. Առանձին ներկայացուցիչներ
Տեխնիկայում կիրառություն ունեն մեթանի և էթանի քլորածանցյալները, նաև` ֆտորքլորիդները:
16.4.1. Մեթիլենքլորիդ
CH2Cl2, հեղուկ է.
![]() Կիրառվում
է որպես չբռնկվող
և դյուրաեռ լուծիչ:
Կիրառվում
է որպես չբռնկվող
և դյուրաեռ լուծիչ:
16.4.2. Քլորոֆորմ
CHCl3, ![]() Լավ լուծիչ
է (նախկինում կիրառվել
է բժշկության մեջ
ընդհանուր անզգայացման
համար): Քլորոֆորմն
արտադրության
մեջ ստացվում է`
Լավ լուծիչ
է (նախկինում կիրառվել
է բժշկության մեջ
ընդհանուր անզգայացման
համար): Քլորոֆորմն
արտադրության
մեջ ստացվում է`
ա) սպիրտից քլորի և ալկալու կամ քլորակրի ազդեցությամբ.
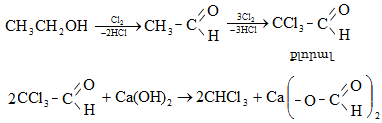
բ) ացետոնից.
![]()
16.4.3. Քլորոֆորմի վրա ալկալիներով ազդելիս, որպես միջանկյալ միացություն, առաջանում է դիքլորկարբեն, որը ժամանակակից օրգանական քիմիայում կիրառվում է մոլեկուլում մեթիլենային խումբ ներմուծելու համար:
![]()
ա) դիազոմեթանի ստացում.
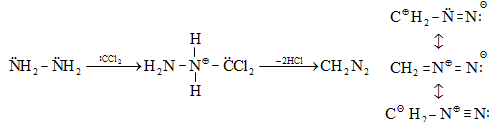
բ) քլորոֆորմի հիդրոլիզ.
16.4.4. Տետրաքլորածխածինը (CCl4) կիրառվում է որպես չայրվող լուծիչ, ինչպես նաև կրակմարիչներում: Ելանյութ է ֆրեոն-12-ի ստացման համար:
16.4.5. 1,2-դիքլորէթան` CH2ClCH2Cl,
![]() Էժան, բայց
թունավոր
լուծիչ
է, ելանյութ
է
վինիլքլորիդի
սինթեզի
համար:
Էժան, բայց
թունավոր
լուծիչ
է, ելանյութ
է
վինիլքլորիդի
սինթեզի
համար:
16.4.6. Հեքսաքլորէթան` CCl3CCl3,
բյուրեղային
նյութ
է, ![]() կիրառվում
է
որպես
թունաքիմիկատ
անասնաբուժության
մեջ:
կիրառվում
է
որպես
թունաքիմիկատ
անասնաբուժության
մեջ:
16.4.7. Լայն կիրառություն ունեն սառեցնող միջոցները` ֆրեոնները (պոլիքլորֆտորածանցյալներ): Ֆրեոնները շատ կայուն միացություններ են, չեն հիդրոլիզվում, այդ պատճառով մետաղը կոռոզիայի չեն ենթարկում, կիրառվում են նաև որպես լուծիչ ինսեկտոֆունգիցիդների, աերոզոլների և ֆտորածանցյալների ստացման ժամանակ: Առավել տարածված ֆրեոն-12-ն ստացվում է տետրաքլորածխածնից և ֆտորաջրածնից SbF3 կատալիզատորի ներկայությամբ.
![]()
16.4.8. Ֆտորոտանը` CF3CHClBr, անգույն, քլորոֆորմի հոտով, ծանր հեղուկ է: Արդյունավետ միջոց է ընդհանուր անզգայացման համար, ունի մի շարք առավելություններ քլորոֆորմի նկատմամբ, պակաս թունավոր է, համարյա գրգռման երևույթներ չի առաջացնում, և թմրեցումն արագ է անցնում:
17. ՉՀԱԳԵՑԱԾ ԱԾԽԱՋՐԱԾԻՆՆԵՐԻ ՀԱԼՈԳԵՆԱԾԱՆՑՅԱԼՆԵՐ
Չհագեցած հալոգենածանցյալները բաժանվում են երեք խմբի`

17.1. Իզոմերիա, անվանակարգում
Այս ածխաջրածինների անվանակարգումը և իզոմերիան սկզբունքորեն չեն տարբերվում սահմանային հալոգենածանցյալներից`

17.2. Ֆիզիկական հատկություններ
Հոմոլոգիական շարքում ֆիզիկական հատկություններն ունեն օրգանական միացություններին բնորոշ օրինաչափություններ:
Առաջին խմբի հալոգենածանցյալներին բնորոշ է կրկնակի կապի և հալոգենի փոքր ռեակցիոնունակությունը` կրկնակի կապի և հալոգենի ազատ էլեկտրոնային զույգի զուգորդման հետևանքով: Այդ փոխազդեցության արդյունքում CCl, C=C և CC կապերի երկարությունը փոխվում է: Նման զուգորդման արդյունքում կարճանում է CHal կապը: CCl կապի երկարությունը քլորէթանում և սիմէթիլենքլորիդում 0,176 նմ է, իսկ էթենիլքլորիդում` 0,169 նմ: Կապի դիպոլային մոմենտը փոքրանում է, քանի որ CHal կապի -I էֆեկտի հետ միաժամանակ գործում է հալոգենի էլեկտրոնային զույգի և կրկնակի կապի զուգորդումը (+M էֆեկտ): Դիպոլային մոմենտն էթիլքլորիդում ավելի մեծ է, քան էթենիլքլորիդում (2.05 D և 1.44 D համապատասխանաբար):
17.3. Կիրառման բնագավառներ, թունավորություն
Գործնական
լայն կիրառություն
ունի վինիլքլորիդը,
որը պոլիվինիլքլորիդային
կաուչուկների
հիմնական հումքն
է, ՍԹԿ-ն օդում 0,1 մգ/մ3
է: Համաշխարհային
արտադրությունը
2000 թ. կազմել է ![]() տոննա:
Պոլիվինիլքլորիդը
լայն կիրառություն
ունի մեկուսիչ
նյութերի, կինո-,
ֆոտոժապավենների,
անջրանցիկ նյութերի
և այլ ապրանքների
արտադրության
մեջ: Վինիլֆտորիդի
ՍԹԿ` 3 գ/մ3 է:
տոննա:
Պոլիվինիլքլորիդը
լայն կիրառություն
ունի մեկուսիչ
նյութերի, կինո-,
ֆոտոժապավենների,
անջրանցիկ նյութերի
և այլ ապրանքների
արտադրության
մեջ: Վինիլֆտորիդի
ՍԹԿ` 3 գ/մ3 է:
Տրիքլորէթիլենը
կիրառվում է որպես
յուղազրկող միջոց,
տեքստիլ նյութերի
քիմիական մաքրման
գործընթացում,
ՍԹԿ-ն օդում կազմում
է 10 մգ/մ3: Համաշխարհային
արտադրությունը
1999 թ. եղել է ![]() հազար
տոննա: Գործնական
հետաքրքրություն
է ներկայացնում
տետրաֆտորէթիլենը
[անգույն գազ,
հազար
տոննա: Գործնական
հետաքրքրություն
է ներկայացնում
տետրաֆտորէթիլենը
[անգույն գազ, ![]() խտությունը
խտությունը![]()
Գործնական
խիստ կարևորություն
ունեն ալիլային
շարքի հալոգենիդները,
հատկապես, ալիլբրոմիդը
և ալիլքլորիդը
(անգույն հեղուկ
է,![]()
17.3.ա .Ստացման եղանակներ
Վինիլքլորիդի ստացման եղանակներն են.
17.3.1. Ացետիլեն և էթիլեն պարունակող հրագազի հիդրոքլորացում. դիքլորէթանի և վինիլքլորիդի ստացման համատեղ եղանակ: Վինիլքլորիդի ելքը համարյա քանակական է:
![]()
17.3.2. Վինիլքլորիդի ստացման առավել էժան արտադրական եղանակ է էթիլենի քլորացումը CaCl2 կատալիզատորի ներկայությամբ: Ստացված դիքլորէթանը ենթարկվում է դեհիդրոքլորացման:
17.3.3. Ացետիլենի հիդրոքլորացում 10...15% սուլեմայով ներծծված ակտիվացված ածխի վրա 150...220oC-ում: Սա սինթեզի ավելի հին եղանակ է, որն այժմ չի կիրառվում:
![]()
17.3.4. Լաբորատոր նշանակություն ունի դիքլորէթանի դեհիդրոքլորացումն ավտոկլավում 400...500oC-ում կծու նատրիումի կամ կծու կալիումի սպիրտային լուծույթում.
![]()
17.4. Քիմիական հատկություններ
Հալոգենի ինդուկցիոն էֆեկտը փոքրացնում է կրկնակի կապի էլեկտրոնային ամպի խտությունը և դժվարացնում էլեկտրոֆիլ միացումը (I խումբ): Ռեակցիան կատարվում է համաձայն Մարկովնիկովի կանոնի.
![]()
Էլեկտրոֆիլ գրոհի ժամանակ հնարավոր է ստորև բերված զուգորդված միջանկյալ վիճակ.
![]()
Երկու հնարավոր միջանկյալ կարբկատիոններից ավելի կայուն է I կատիոնը, քանի որ դրական լիցքը մասնակի չեզոքանում է հալոգենի ատոմի հետ զուգորդմամբ.
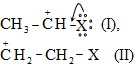
Ալիլային (II խումբ) հալոգենածանցյալների հալոգենի ատոմը շարժունակ է` շնորհիվ միջանկյալ կարբկատիոնի մեծ կայունության.
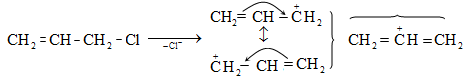
Ալիլ կարբկատիոնում երկու հնարավոր սահմանային կառուցվածքները համազոր են, որը բացատրվում է էլեկտրոնային խտության ապատեղայնացմամբ, հետևաբար, և իոնի կայունությամբ: Իոնի քվանտաքիմիական մոդելը կարելի է ներկայացնել հետևյալ տեսքով.
Ալիլհալոգենիդներում հալոգենի ատոմի նուկլեոֆիլ տեղակալման ռեակցիան ուղեկցվում է ալիլային վերախմբավորումով կամ ալիլային տեղաշարժով: SN1 ռեակցիայի պայմաններում սովորաբար առաջանում են տեղակալման և վերախմբավորման արգասիքներ: Ալիլային վերախմբավորումն ապացուցվել է նշված ատոմների եղանակով.
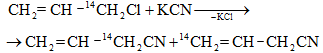
Երկու նյութերի առաջացումը պայմանավորված է նրանով, որ ալիլ կարբկատիոնը ռեզոնանսային հիբրիդ է.
![]()
Ալիլային
վերախմբավորում
է կատարվում նաև
SN2 ռեակցիայի պայմաններում,
երբ ռեակցիայի
արագությունը
բնորոշող փուլում
ռեագենտը գրոհում
է մոլեկուլին:
Այս դեպքում նուկլեոֆիլը
գրոհում է ![]() լիցք ունեցող
ծայրային ածխածնի
ատոմին, որի արդյունքում
լիցք ունեցող
ծայրային ածխածնի
ատոմին, որի արդյունքում
![]() կապը բևեռանում
է, էլեկտրոնները
տեղաշարժվում
են դեպի հալոգենին
կից ածխածնի ատոմը
և դուրս մղում
հալոգենանիոնը.
կապը բևեռանում
է, էլեկտրոնները
տեղաշարժվում
են դեպի հալոգենին
կից ածխածնի ատոմը
և դուրս մղում
հալոգենանիոնը.
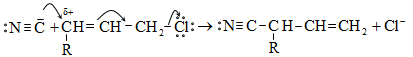
Համակարգն
աշխատում է որպես
C = C և C-Cl (![]() զուգորդում)
զուգորդված կապերի
միասնական ամբողջություն:
Այսպիսի գրոհը
ձևականորեն կարելի
է նկարագրել որպես
1,4-միացում, ինչպես
զուգորդում)
զուգորդված կապերի
միասնական ամբողջություն:
Այսպիսի գրոհը
ձևականորեն կարելի
է նկարագրել որպես
1,4-միացում, ինչպես![]() զուգորդված
համակարգերում.
զուգորդված
համակարգերում.
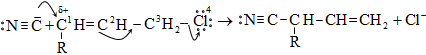
Ինչպես
զուգորդված համակարգում,
այստեղ նույնպես
խզվում են 1,2- և 3,4- կապերը,
իսկ 2,3-դիրքում առաջանում
է ![]() կապ:
կապ:
Չնայած CHal կապի բևեռայնությանը` էլեկտրոֆիլ ռեագենտներն ալիլհալոգենիդներին միանում են համաձայն Մարկովնիկովի կանոնի.
![]()
Հալոգենի ատոմների թվի մեծացման դեպքում, հատկապես ֆտորի առկայությամբ, միացումը գնում է հակառակ Մարկովնիկովի կանոնի, քանի որ կրկնակի կապի էլեկտրոնային ամպի խտությունը փոքրանում է.

Երրորդ խմբի հալոգենածանցյալներն իրենց հատկություններով էապես չեն տարբերվում սահմանային հալոգենածանցյալներից և ալկեններից:
17.5. Առանձին ներկայացուցիչներ
Առավել մեծ տեխնիկական նշանակություն ունեն վինիլքլորիդը, ալիլքլորիդը, տետրաֆտորէթիլենը, քլորոպրենը:
17.5.1. Վինիլքլորիդը մտնում է ալկեններին հատուկ ռեակցիաների մեջ: Համեմատած սովորական ալկենների հետ` հալոգենաջրածինների միացումը տեղի է ունենում ավելի բարձր ջերմաստիճանում (50...60°C) և ճնշման տակ ալյումինի և երկաթի քլորիդների ներկայությամբ: Կիրառական նշանակություն ունի վինիլքլորիդի պոլիմերացումը, ինչպես նաև համապոլիմերացումը: Վինիլքլորիդը պոլիմերանում է ֆոտոքիմիական, ջերմային կամ կատալիզային եղանակներով:
17.5.2. Ալիլքլորիդ ստացվում է պրոպիլենի բարձրջերմաստիճանային քլորացմամբ (Լվովի ռեակցիա).
![]()
Ալիլքլորիդը ելանյութ է ալիլ սպիրտի և գլիցերինի ստացման համար:
17.5.3.
Քլորոպրեն ![]() ստացվում
է մի շարք եղանակներով:
Նախկինում լայն
գործնական նշանակություն
ուներ վինիլացետիլենի
փոխազդեցությունը
քլորաջրածնի հետ
Cu2Cl2-ի ներկայությամբ:
Այս եղանակը կիրառվում
էր նաև «Նաիրիտ»
ԳԱՄ-ում:
ստացվում
է մի շարք եղանակներով:
Նախկինում լայն
գործնական նշանակություն
ուներ վինիլացետիլենի
փոխազդեցությունը
քլորաջրածնի հետ
Cu2Cl2-ի ներկայությամբ:
Այս եղանակը կիրառվում
էր նաև «Նաիրիտ»
ԳԱՄ-ում:
![]()
Այժմ կիրառվում է դիքլորբութենների կամ դիքլորբութանների դեհիդրոհալոգենացումը հիմնային միջավայրում: Քլորոպրենը կիրառվում է չափազանց արժեքավոր արհեստական կաուչուկի ստացման համար: Պոլիքլորոպրենն անփոխարինելի սկզբնանյութ է մեքենաշինության (անվադողերի), ռազմական և այլ նմանատիպ արտադրություններում: Քլորոպրենի պոլիմերացումը և պոլիմերի վուլկանացումը կատարվում է օդի թթվածնի ներկայությամբ.
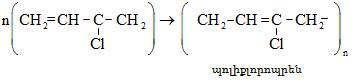
17.5.4. Տետրաֆտորէթիլեն ստացվում է քլորդիֆտորմեթանի (ֆրեոն-22) պիրոլիզով.
![]()
Պերօքսիդային կատալիզատորների ներկայությամբ տետրաֆտորէթիլենը պոլիմերանում է 500000...2000000 զանգվածով պոլիմերի (տեֆլոն), որը քիմիապես իներտ է, կայուն է բոլոր ռեագենտների նկատմամբ` բացառությամբ հալված ալկալիական մետաղների:
![]()
Տեֆլոնը քիմիապես չափազանց կայուն է (օրգանական պլատին): Անտարբեր է ուժեղ թթուների, հիմքերի, օքսիդիչների, ինչպես նաև արքայաջրի նկատմամբ: Կարող է օգտագործվել -70°... 330°C ջերմաստիճանային տիրույթում: Կիրառվում է քիմիական մեքենաշինության, սարքաշինության մեջ, կենցաղում:
Շնորհիվ ֆտորի ուժեղ էլեկտրաբացասականության` էթիլենային ֆտորածանցյալները, ֆտորի մյուս օրգանական միացությունները, տարբերվում են մյուս նմանակներից իրենց քիմիական հատկություններով: Էթիլենային ֆտորածանցյալները միացման ռեակցիաներում չեն ենթարկվում հոմոլոգիական շարքին բնորոշ օրինաչափություններին (Ի. Լ. Կնունյանց, Մակ-Բի):
18. ԱՐՈՄԱՏԻԿ ՀԱԼՈԳԵՆԱԾԱՆՑՅԱԼՆԵՐ
18.1. Անվանակարգում իզոմերիա
Արոմատիկ հալոգենածանցյալներն ըստ իրենց կառուցվածքի, հատկությունների և ստացման եղանակների, բաժանվում են երկու խմբի՝
ա) միացություններ` հալոգենի ատոմով բենզոլի օղակում, որոնք պակաս ռեակցիոնունակ են, քան դրանց ալիֆատիկ նմանակները.
բ) միացություններ` հալոգենի ատոմով կողմնային շղթայում, որոնք կառուցվածքով և հատկություններով նման են տեղակալված ալ-կիլհալոգենիդներին.
18.2. Ֆիզիկական հատկություններ
Բենզոլի և դրա ածանցյալների հալոգենիդները հեղուկ կամ բյուրեղային նյութեր են, որոնց խտությունը մեծ է մեկից: Հալոգենբենզոլների եռման ջերմաստիճաններն աճում են ֆտորբենզոլից յոդբենզոլ:
![]()
Բենզոլային
օղակում հալոգենի
ատոմով միացություններն
ունեն արոմատիկ
հոտ, կողմնային
շղթայի![]() դիրքում
հալոգենի ատոմ
ունեցող միացությունները
գրգռիչ հոտ ունեն,
արցունքաբեր են
(լաքրիմատոր), ջրում
չեն լուծվում,
լուծվում են օրգանական
լուծիչներում:
դիրքում
հալոգենի ատոմ
ունեցող միացությունները
գրգռիչ հոտ ունեն,
արցունքաբեր են
(լաքրիմատոր), ջրում
չեն լուծվում,
լուծվում են օրգանական
լուծիչներում:
18.3. Կիրառման բնագավառներ, թունավորություն
Քիմիական արդյունաբերության մեջ առանձնապես մեծ քանակներով կիրառվում է քլորբենզոլը, որը միջանկյալ արգասիք է ֆենոլի, անիլինի, ԴԴՏ-ի ստացման գործընթացներում: Քլորբենզոլը (ՍԹԿ` 50 մգ/մ3) կիրառվում է 1,3- դիքլորբենզոլի (ՍԹԿ` 20 մգ/մ3) և 2-քլորանտրախինոնի, դեղամիջոցների ստացման համար, ինչպես նաև որպես լուծիչ:
Պ-դիքլորբենզոլը պայքարի միջոց է ցեցի և միջատների դեմ: Բենզիլքլորիդը (ՍԹԿ` 0,5 մգ/մ3) թունավոր, արցունքաբեր միացություն է (լաքրիմատոր): Կիրառվում էբենզիլսպիրտի ստացման գործընթացում, որը կարևոր նշանակություն ունի օծանելիքի արտադրությունում:
18.4. Ստացման եղանակներ
Հալոգենների անմիջական փոխազդեցություն արոմատիկ ածխաջրածինների հետ: Հալոգենները փոխազդում են արոմատիկ ածխաջրածինների հետ երեք եղանակով.
ա) անմիջական միացում, բ) բենզոլային օղակի ջրածնի ատոմի տեղակալում, գ) բենզոլային օղակի կողմնային շղթայում ջրածնի ատոմի տեղակալում:
18.4.1. Լույսի ազդեցությամբ բենզոլը միացնում է քլոր և բրոմ, առաջացնելով հեքսահալոգենիդներ, որոնք տաքացման պայմաններում վերածվում են տրիհալոգենբենզոլի: Բենզոլի հալոգենացումը կատարվում է արագ, ինչպես հալոգենի անմիջական ազդեցությամբ, այնպես էլ կատալիզատորների (հալոգենի փոխանցիչի) ներկայությամբ:

18.4.2. Ցածր ջերմաստիճանում կատալիզատորների ներկայությամբ հալոգենը տեղակալում է արոմատիկ օղակի ջրածնի ատոմը: Կատալիզատորի դերն այն է, որ հալոգենի անիոնի հետ առաջացնում է կոմպլեքսային անիոն՝ հանդիսանալով հալոգենի դրական իոնի փոխանցիչ, իրականացնելով բենզոլային օղակում էլեկտրոֆիլ տեղակալում:
Ռեակցիայի հավանական մեխանիզմը, օրինակ, FeCl3-ի ներկայությամբ նկարագրվում է հետևյալ կերպ.

Հնարավոր
է նաև ![]() կոմպլեքսի
գոյացում` առանց
հալոգենի նախնական
իոնացման (տես
«SE ռեակցիաներ»):
կոմպլեքսի
գոյացում` առանց
հալոգենի նախնական
իոնացման (տես
«SE ռեակցիաներ»):
Բենզոլային օղակ յոդի ատոմ ներմուծելու համար անհրաժեշտ է օքսիդիչների ներկայություն: Բենզոլը կարելի է յոդացնել յոդով և արծաթի տրիֆտորացետատով կամ յոդով և նիտրացնող խառնուրդով: Բենզոլի օղակում առաջին կարգի ուժեղ տեղակալիչի առկայությամբ (-NH2, -OH և այլն) հեշտությամբ կատարվում է յոդացում:
Հալոգեններն առաջին կարգի տեղակալիչներ են, հաջորդ հալոգենը հիմնականում ուղարկում են պարադիրք: SE ռեակցիան դժվարացված է -I էֆեկտի հետևանքով: Հալոգենբենզոլի ռեակցիայի արագությունը փոքր է չտեղակալված բենզոլի տեղակալման ռեակցիայի արագությունից:
Պ-ֆտորքլորբենզոլի քլորացման ժամանակ երրորդ հալոգենի ատոմը մտնում է քլորի նկատմամբ օրթո դիրք, նշանակում է տեղակալման կարգի վրա որոշիչ ազդեցություն Է գործում հալոգենի ինդուկտիվ էֆեկտը (-IF>-ICl): Ֆտորի նկատմամբ օրթո դիրքն ունի ավելի մեծ դրական լիցք:

18.4.3. Բենզոլային օղակի ամինոխմբի տեղակալում` միջանկյալ դիազոմիացությունների առաջացումով: Այս եղանակով ստացվում են բոլոր հալոգենածանցյալները:
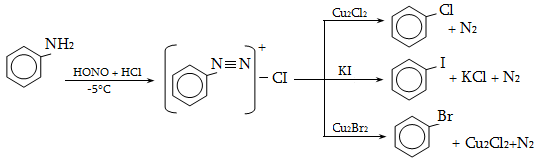
Ֆտորով բենզոլի անմիջական ֆտորացումը հնարավոր չէ. մոլեկուլը քայքայվում է, գոյանում են CF4 և HF: Հարմար է ամինոխմբի տեղակալումը ֆտորով չոր դիազոնիումբորֆտորիդի կոմպլեքսի քայքայումով (Բալց-Շիման):
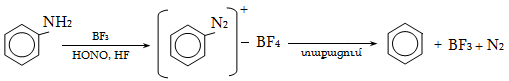
18.4.4. Ցանկացած հալոգեն կարելի է ներմուծել բենզոլային օղակ ֆենիլթալիումի դիտրիֆտորացետատի միջոցով: Բենզոլը փոխազդում է թալիումի տրիֆտորացետատի հետ տրիֆտորքացախաթթվում.
![]()
18.4.5. Հալոգենացումը կողմնային շղթայում իրականացվում է այնպես, ինչպես ալիֆատիկ ածխաջրածիններում` լույսի ազդեցությամբ կամ տաքացումով: Ռեակցիայի մեխանիզմը ռադիկալային է (SR):
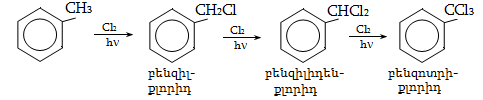
Կողմնային շղթայում յոդացում չի կատարվում: Ֆտոր և յոդ- ածանցյալներն ստանում են համապատասխան քլորիդների փոխանակման ռեակցիայով AgF, SbF3, Na I հետ:
Կողմնային շղթայում հալոգեն պարունակող արոմատիկ ածխաջրածիններ կարելի է ստանալ ալիֆատիկ շարքի հալոգենածանցյալների սինթեզի բոլոր հնարավոր եղանակներով. օրինակ, հիդրօքսիլ խմբի կամ հալոգենի ատոմի տեղակալում հալոգենով, կրկնակի կապի հիդրոհալոգենացում և այլն:
18.4.6. Յուրահատուկ եղանակ է քլորմեթիլացման ռեակցիան. արոմատիկ ածխաջրածնի փոխազդեցություն ֆորմալդեհիդի (ֆորմալինի կամ պարաֆորմի տեսքով) և քլորաջրածնի հետ` ZnCl2-ի ներկայությամբ.
![]()
Ռեակցիայի մեխանիզմը կարելի է ներկայացնել այսպես.
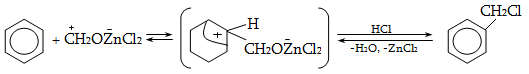
18.4.ա. Քիմիական հատկություններ
Արիլհալոգենիդներն, ի տարբերություն ալկիլհալոգենիդների, դժվար են տալիս նուկլեոֆիլ տեղակալման ռեակցիաներ. չեն փոխազդում կծու նատրիումի, արծաթի աղերի, ամոնիակի, ցիանիդների, ալկոհոլատների հետ այն պայմաններում, որոնք հատուկ են ալկիլհալոգենիդներին: Քլոր- և բրոմբենզոլներն ալկալիների հետ փոխազդում են 300°C-ում, կատալիզատորների ներկայությամբ՝ ավելի ցածր ջերմաստիճանում, ամոնիակի հետ՝ պղնձի աղերի կամ պղնձի փոշու ներկայությամբ՝ 180...200°C-ում: Հալոգենի ատոմի այսպիսի «անշարժությունը» բացատրվում է երկու տարբեր գործոններով.
1. Էլեկտրոնների բաշխումով ռեզոնանսի հետևանքով,
2.
![]() կապերի
էներգիաների տարբերությամբ`
պայմանավորված
ածխածնի ատոմի
հիբրիդացումով:
կապերի
էներգիաների տարբերությամբ`
պայմանավորված
ածխածնի ատոմի
հիբրիդացումով:
1. Քլորբենզոլը կարելի է դիտարկել հետևյալ ռեզոնանսային կառուցվածքների տեսքով.
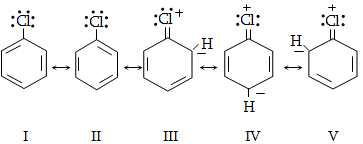
III, IV, V ռեզոնանսային կառուցվածքների առկայությունը կայունացնում է այդ մոլեկուլները և C - Cl կապին հաղորդում կրկնակի կապի բնույթ: Այսպիսով, ածխածինը և քլորը կապված են միմյանց հետ առավել քան մեկ էլեկտրոնային զույգով, և C - Cl կապն այստեղ ավելի ամուր է, քան ալկիլհալոգենիդներում: Հալոգենիդների ցածր ռեակցիոնունակությունը SN ռեակցիաներում բացատրվում է դրանց մասնակի ռեզոնանսային կայունացմամբ, որը մեծացնում է ռեակցիայի ակտիվացման էներգիան Eակտ. և դանդաղեցնում ռեակցիայի ընթացքը:
2. Արիլհալոգենիդներում ածխածինը sp2 hիբրիդային վիճակում է, նշանակում է C-Hal կապն այդ միացություններում կարճ է և ամուր (+M էֆեկտ), բնականաբար, մոլեկուլներն ավելի կայուն են: Այս ամենից բխում է դիպոլային մոմենտների փոքրացումը` համեմատած ալկիլհալոգենիդների դիպոլային մոմենտների հետ:
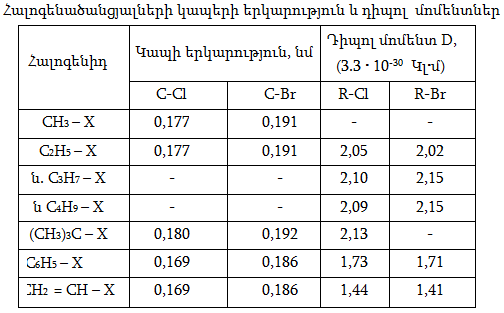
18.5. Նուկլեոֆիլ տեղակալման ռեակցիայի մեխանիզմ
Արիլհալոգենիդների SN ռեակցիաներն էապես տարբերվում են ալկիլհալոգենիդների SN ռեակցիաներից: Կան անհերքելի ապացույցներ, որ Ar-Hal-ի SN ռեակցիան ունի աստիճանական ընթացք. ուժեղ նուկլեոֆիլ ռեագենտի ազդեցությամբ նախ պոկվում է հալոգենաջրածին (E2), առաջանում է չափազանց ռեակցիոնունակ միջանկյալ արգասիք՝ դեհիդրոբենզոլ, որն արագ ռեակցում է նուկլեոֆիլի հետ` առաջացնելով միացման արգասիք (AdN): Ռեակցիան ներառում է երկու փուլ` պոկում և միացում:
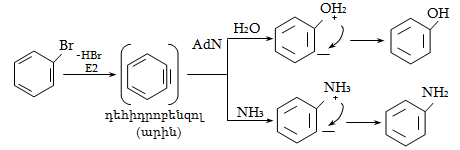
Դեհիդրոբենզոլում առաջացած երրորդ կապի օրբիտալները վերածածկված չեն բենզոլային օղակի p օրբիտալների հետ և չեն մասնակցում զուգորդման: Դրանք գտնվում են օղակի հարթության մեջ: Վերածածկումը կողմնային է և շատ թույլ, կապը՝ ռեակցիոնունակ.
Անհերքելի փաստերով ապացուցված է ռեակցիայի միջավայրում դեհիդրոբենզոլի առկայությունը որպես միջանկյալ վիճակ. նուկլեոֆիլը ոչ միշտ է գրավում այն դիրքը, որը թողնում է հալոգենը` պ-քլորտոլուոլի հիդրոլիզի ժամանակ առաջանում են մ- և պ-կրեզոլների համարժեք քանակներ.
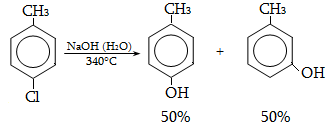
Օ-քլորանիզոլի ամինացման ռեակցիայի արդյունքում բացառապես ստացվոմ է մ-ամինոանիզոլ, քանի որ մեթօքսի խումբը տարածական դժվարություն է ստեղծում օրթո դիրքի վրա գրոհելու համար.
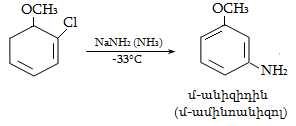
Նշված 14C ատոմով քլորբենզոլի ամինացման ժամանակ ստացվում են հավասար քանակներով անիլիններ (ամինոխումբը 14C-ի մոտ և դրա նկատմամբ օրթոդիրքում).
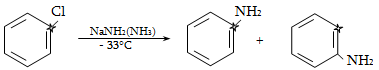
Այսպիսի «վերախմբավորումները» բացատրվում են նուկլեոֆիլ ռեագենտների միացմամբ դեհիդրոբենզոլի եռակի կապի երկու ածխածնի ատոմներին.
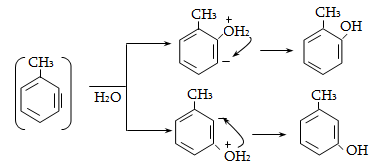
Այն միացությունները, որոնք հալոգենի ատոմի նկատմամբ երկու oրթո դիրքերում ունեն տեղակալիչներ, SN ռեակցիա չեն տալիս (oրթո դիրքի ջրածնի ատոմը բացակայում է, դեհիդրոբենզոլ չի առաջանում): 2-բրոմ-3-մեթիլանիզոլը չի փոխազդում նուկլեոֆիլ ռեագենտի հետ.

![]() Բրոմբենզոլ
և օ-դեյտերիումբրոմբենզոլ
խառնուրդի (50:50) և
սահմանափակ քանակով
ամիդ (NH2) իոնի փոխազդեցության
ռեակցիայից անջատված
չփոխազդած բրոմիդը
պարունակում է
ավելի շատ դեյտերիումբրոմբենզոլ,
քան բրոմբենզոլ:
Դեյտերացված միացությունը
պակաս ռեակցիոնունակ
է և քիչ է ծախսվում:
Այս իզոտոպային
էֆեկտը մասնակցում
է արագությունը
բնորոշող փուլին`
D-ի պոկումն ընդհանուր
առմամբ դանդաղեցնում
է ռեակցիան, նշանակում
է ռեակցիայի ընդհանուր
արագությունը
բնորոշվում է պոկման
փուլի արագությամբ.
Բրոմբենզոլ
և օ-դեյտերիումբրոմբենզոլ
խառնուրդի (50:50) և
սահմանափակ քանակով
ամիդ (NH2) իոնի փոխազդեցության
ռեակցիայից անջատված
չփոխազդած բրոմիդը
պարունակում է
ավելի շատ դեյտերիումբրոմբենզոլ,
քան բրոմբենզոլ:
Դեյտերացված միացությունը
պակաս ռեակցիոնունակ
է և քիչ է ծախսվում:
Այս իզոտոպային
էֆեկտը մասնակցում
է արագությունը
բնորոշող փուլին`
D-ի պոկումն ընդհանուր
առմամբ դանդաղեցնում
է ռեակցիան, նշանակում
է ռեակցիայի ընդհանուր
արագությունը
բնորոշվում է պոկման
փուլի արագությամբ.
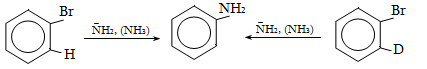
18.6. Բիմոլեկուլային նուկլեոֆիլ տեղակալում արոմատիկ օղակում (SN2)
Արոմատիկ օղակի օրթո և պարա դիրքերում էլեկտրոնակցեպտոր խմբերի առկայությունը նկատելի ակտիվացնում է հալոգենը նուկլեոֆիլ տեղակալման ռեակցիաներում: Այսպես, քլորբենզոլը նատրիումի հիդրօքսիդի ջրային լուծույթով փոխարկվում է ֆենոլի 300°C-ում, իսկ պ-նիտրոքլորբենզոլը՝ 160°C-ում: Օրթո և պարա դիրքերում նիտրոխմբի առկայությունն առավել շարժունակ է դարձնում քլորի ատոմը. 2,4-դինիտրոքլորբենզոլից ֆենոլ ստացվում է նատրիումի կարբոնատի տաք ջրային լուծույթով, իսկ 2,4,6-տրինիտրոքլորբենզոլից՝ ուղղակի ջրով տաքացումով.
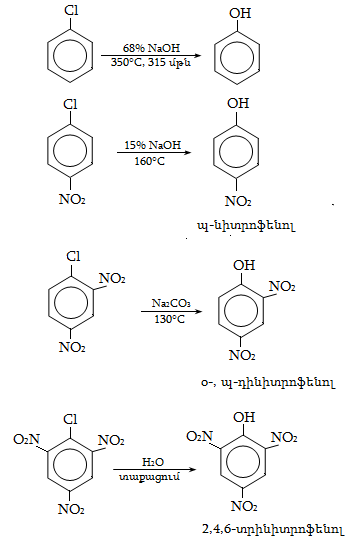
Նույնը
նկատվում է մյուս
նուկլեոֆիլների
դեպքում: Հալոգենի
ատոմի տեղակալմանը
նպաստում են![]() խմբերը,
որոնք էլեկտրոնակցեպտոր
են և հեշտացնում
են նուկլեոֆիլ
ռեագենտի հարձակումը
արոմատիկ օղակի
վրա:
խմբերը,
որոնք էլեկտրոնակցեպտոր
են և հեշտացնում
են նուկլեոֆիլ
ռեագենտի հարձակումը
արոմատիկ օղակի
վրա:
Էլեկտրոնակցեպտոր խմբերի առկայության դեպքում հալոգենի ատոմի նուկլեոֆիլ տեղակալումը կատարվում է բիմոլեկուլային մեխանիզմով, որը ներառում է երկու հիմնական փուլ.
ա) նուկլեոֆիլ ռեագենտի հարձակում օղակի վրա` միջանկյալ կարբանիոնի առաջացում,
բ) հալոգենի անիոնի պոկում միջանկյալ կարբանիոնից` ռեակցիայի արգասիքի առաջացումով.
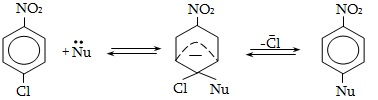
Միջանկյալ կայուն կարբանիոնը (պենտադիենատ իոն) կարելի է նկարագրել հետևյալ ռեզոնանսային կառուցվածքներով.
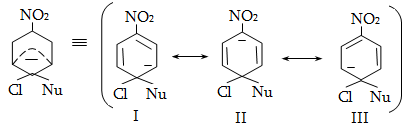
Մետա դիրքում գտնվող էլեկտրոնակցեպտոր խմբերը ոչ մի ազդեցություն չեն գործում հալոգենի ատոմի շարժունակության վրա, քանի որ այս դեպքում առաջացած միջանկյալ կարբանիոնն անկայուն է: Օրթո և պարա դիրքերում գտնվող խմբերի առկայության դեպքում առաջացած II ռեզոնանսային վիճակը չափազանց կայուն է. բացասական լիցքը գտնվում է նիտրոխմբի հետ միացած ածխածնի ատոմի վրա:
Ինչպես էլեկտրոֆիլ, այնպես էլ նուկլեոֆիլ տեղակալման դեպքում մեծ նշանակություն ունի տեղակալիչի բնույթը: Էլեկտրոնակցեպտոր խմբերն ակտիվացնում են արոմատիկ օղակը նուկլեոֆիլ ռեագենտի հարձակման համար և նպաստում SN2 ռեակցիային:
Եթե հալոգենը գտնվում է կողմնային շղթայում, ապա նուկլեոֆիլ տեղակալման ռեակցիան կատարվում է սովորական SN1 կամ SN2 մեխանիզմներով: Բենզիլքլորիդը հիդրոլիզվում է նատրիումի կարբոնատի ջրային լուծույթով, իսկ բենզիլբրոմիդը երրորդային ամինների հետ փոխազդում է 300 անգամ ավելի արագ, քան պրոպիլբրոմիդը: Հալոգենի շարժունակությունն այս միացություններում բացատրվում է միջանկյալ առաջացող կարբկատիոնի կայունությամբ (զուգորդում բենզոլային օղակի հետ).
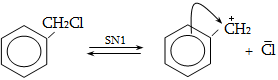
Էլեկտրոնադոնոր խմբերն արագացնում, իսկ էլեկտրոնակցեպտորները դանդաղեցնում են բենզիլհալոգենիդների նուկլեոֆիլ տեղակալման ռեակցիան:
18.6. Արիլհալոգենիդների ռեակցիաներ
18.6.1. Մետաղների հետ առաջացնում են մետաղօրգանական միացություններ, գրեթե նույն հեշտությամբ, ինչ ալկիլհալոգենիդները.
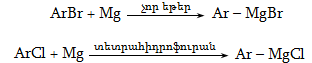
18.6.2. Արոմատիկ օղակում էլեկտրոֆիլ տեղակալում. Արիլհալոգենիդներն ավելի դժվար են տալիս SE ռեակցիաներ, քան բենզոլը, որը բացատրվում է հալոգենի ատոմի I էֆեկտով (բենզոլային օղակի էլեկտրոնային ամպի խտությունը փոքրանում է): Հաջորդ էլեկտրոֆիլը կողմնորոշվում է օրթո կամ պարա դիրք. (տես «SE ռեակցիաներ»)
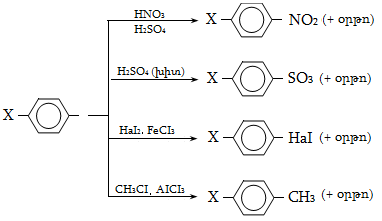
Խնդիրներ
1. Գրել C6H13Cl բաղադրությամբ միացությունների կառուցվածքային բանաձևերը: Նշել առաջնային, երկրորդային, երրորդային հալոգենալկանները և անվանել:
2. Բերված զույգերից ո՞րն է օժտված ավելի մեծ դիպոլային մոմենտով: Դիտարկել մոլեկուլում ատոմների փոխադարձ ազդեցությունը.
3. Իրականացնել հետևյալ փոխարկումները.
4. Նշված ռեակցիաներում ուղղել ստացվող արգասիքների սխալ գրված մոլեկուլները.
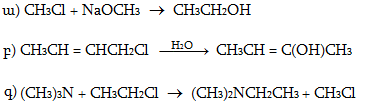
5. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը: Կարդալ IUPAC անվանակարգումով.

6. Լրացնել ռեակցիաները.
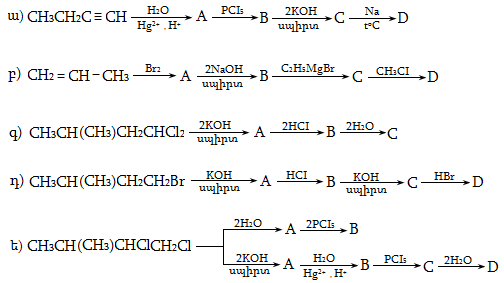
7. Հետևյալ տեղակալման ռեակցիաներում որոշել ա) նուկլեոֆիլը, բ) էլեկտրոֆիլը, գ) հեռացող խումբը.
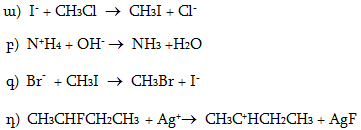
8. Լրացնել հետևալ փոխարկումները.
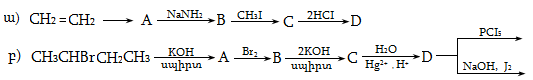
9. Նշված հալոգենալկանները դասավորել ըստ ռեակցիոնունակության աճի` SN2 ռեակցիաներում.
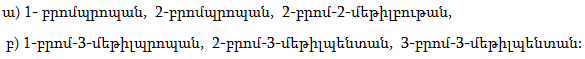
10. Ո՞ր մեխանիզմով կընթանա 1-քլոր-2-բութենի հիդրոլիզը:
11. Պարզել C6H13Br բաղադրությամբ միացության կառուցվածքը, եթե դրա հիդրոլիզով ստացվում է երրորդային սպիրտ, դեհիդրոբրոմացումով` ալկեն, իսկ վերջինիս օզոնոլիզով` ացետոն և պրոպիոնալդեհիդ:
12. Իրականացնել հետևյալ փոխարկումները.

13. Անվանել հետևյալ միացությունները.
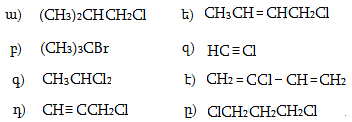
14. Հետևյալ հալոգենալկանները դասավորել ըստ դեհիդրոհալոգենացման հեշտության (KOH-ի սպիրտային լուծույթ) և հիմնավորել.
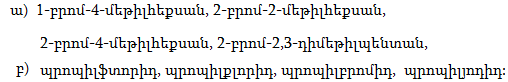
15. Ի՞նչ միացություններ են ստացվում հետևյալ հալոգենալկանների փոխազդեցության արդյունքում նատրիումի էթիլատի հետ էթանոլում: Հիմնավորել SN1 և SN2 մեխանիզմների ընթացքը: Ո՞ր դեպքում կգերակշռի պոկման ռեակցիան.
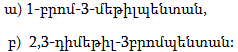
16. Իրականացնել հետևյալ փոխարկումները.
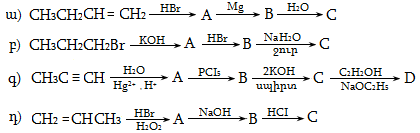
17. Ալիլբրոմիդից սինթեզել հետևյալ միացությունները.
18. Ստանալ իզոբութիլքլորիդ հալոգենալկանների ստացման եղանակներով և իրականացնել դրա փոխարկումները կալիումի ցիանիդի, ամոնիակի, նատրիումի էթիլատի հետ:
19. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը և կարդալ IUPAC անվանակարգումով.

20. Գրել էթիլբենզոլի բոլոր բրոմածանցյալների կառուցվածքային բանաձևերը: Այդ միացություններից ո՞րը կստացվի էթիլբենզոլի անմիջական բրոմացումով: Նշել ռեակցիաների պայմանները:
21. Համեմատել քլորբենզոլի և վինիլքլորիդի կառուցվածքները: Քննարկել դրանց վարքը նուկլեոֆիլ տեղակալման ռեակցիաներում:
22. Ինչու՞ բերված ռեակցիաներում քլորի նուկլեոֆիլ տեղակալումն ուղեկցվում է մասնակի կամ լրիվ վերախմբավորումով.
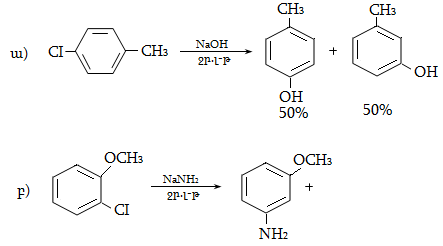
23. Լրացնել հետևյալ փոխարկումները.
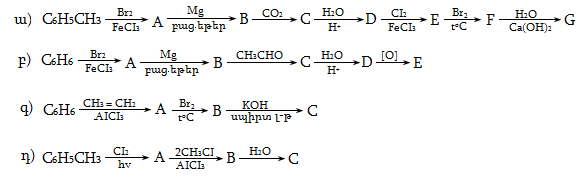
24. Հետևյալ միացություններից ստանալ իզոպրոպիլբրոմիդ.
25. Իրականացնել փոխարկումները և հաստատել ստացվող արգասիքի կառուցվածքը.
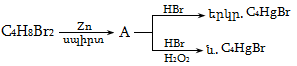
26. Բենզոլից քլորմեթիլացումով և տոլուոլից քլորացումով ստանալ բենզիլքլորիդ և բերել վերջինիս փոխազդեցության ռեակցիաները.
27. C7H6Cl2 բաղադրությամբ միացությունը սառեցման պայմաններում հիմքի ջրային լուծույթով հիդրոլիզվում է C7H7OCl-ի, որի օքսիդացումով առաջանում է պ-քլորբենզոյական թթու: Գրել միացության կառուցվածքային բանաձևը:
28. Բենզոլից ստանալ`
ա) պ-պրոպիլբենզոյական թթու, բ)ֆենիլքացախաթթու:
Տոլուոլից ստանալ`
ա) պ-էթօքսի-մ-նիտրոտոլուոլ, բ) բենզիլսպիրտ:
Պ-նիտրոքլորբենզոլից ստանալ`
ա) պ-էթօքսիֆենիլամոնիումի քլորիդ, բ) պ-դիքլորբենզոլ:
29. Գրել C7H5Cl3 բաղադրությամբ միացության այն կառուցվածքային բանաձևը, որը հիմքի ջրային լուծույթով հիդրոլիզվում է C7H5OCl-ի: Վերջինս փոխազդում է հիդրօքսիլամինի և ֆենիլհիդրազինի հետ:
30. Լրացնել հետևյալ փոխարկումները.
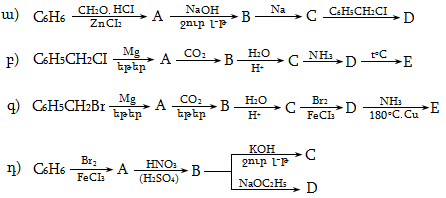
31. Գրել տոլուոլի կողմնային շղթայի քլորացման արդյունքում առաջացող յուրաքանչյուր միացության հիմնային հիդրոլիզի ռեակցիան և անվանել ստացվող արգասիքները:
32. Ածխածին, ջրածին և քլոր պարունակող նյութի այրումից ստացվել է 44 գ ածխածնի օքսիդ (IV) և 0,18 գ ջուր: Տվյալ նմուշի նույն զանգվածի փոխարկումների արդյունքում ստացվել է 2,86 գ արծաթի քլորիդ: Որոշել ելանյութի բանաձևը:
33. Լրացնել փոխարկումները և պարզել դիքլորածանցյալի կառուցվածքը.
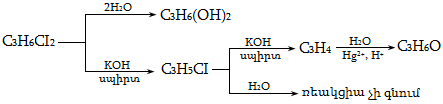
19. ՍՊԻՐՏՆԵՐ (ԱԼԿՈՀՈԼՆԵՐ)
Մեկ կամ մի քանի հիդրօքսիլ խումբ պարունակող ածխաջրածինները կոչվում են սպիրտներ: Հիդրօքսիլ խմբերի թվով պայմանավորված` լինում են միատոմ, երկատոմ, եռատոմ և այլ սպիրտներ, իսկ ռադիկալի կառուցվածքով պայմանավորված` հագեցած և չհագեցած:
19.1. Միատոմ հագեցած սպիրտներ, անվանակարգում, իզոմերիա
Միատոմ սպիրտների ընդհանուր բանաձևն է` CnH2n+1OH:
Ըստ հիդրօքսիլ խմբին կից ածխաջրածնային ռադիկալի բնույթի լինում են` առաջնային, երկրորդային, երրորդային սպիրտներ:
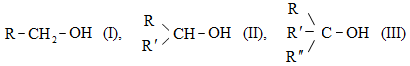
Սպիրտների իզոմերիան պայմանավորված է ռադիկալի կառուցվածքով և ածխածնային շղթայում հիդրօքսիլ խմբի դիրքով: Կիրառվում է սպիրտների անվանակարգման երեք եղանակ. սպիրտային, կարբինոլային և Ժնևյան (IUPAC):
Համաձայն սպիրտային անվանակարգման` ալկիլ (R) խմբի անվանն ավելացվում է սպիրտ բառը (էթիլսպիրտ, ամիլսպիրտ և այլն): Ըստ կարբինոլային անվանակարգման, սպիրտները կարդացվում են որպես մեթանոլի (կարբինոլի) ածանցյալ: Ըստ Ժնևյան անվանակարգման` ընտրվում է հիդրօքսիլ խումբ պարունակող ամենաերկար ածխածնային շղթան, թվով նշվում է հիդրօքսիլ խմբի դիրքը, կարդացվում համապատասխան ալկանը` ոլ վերջավորությամբ:

Օրինակ, C4H9OH ընդհանուր բանաձևին համապատասխանում են հետևյալ կառուցվածքով սպիրտները.

Որոշ ցածրամոլեկուլային սպիրտներ ունեն հին անվանումներ.
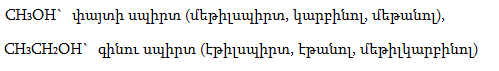
19.2. Ֆիզիկական հատկություններ
Մինչև 10 ածխածնի ատոմ պարունակող սպիրտները սենյակային ջերմաստիճանում հեղուկներ են, C11-ից` պինդ նյութեր: Ցածրամոլեկուլային սպիրտները բնորոշ հոտով, այրող համով հեղուկներ են, որոնց լուծելիությունը ջրում փոքրանում է մոլեկուլային զանգվածի մեծացմամբ, իսկ հոտը դառնում սուր և տհաճ: Պինդ սպիրտները ջրում գրեթե չեն լուծվում և հոտ չունեն:
Միատոմ սպիրտների եռման ջերմաստիճանը, համեմատած համապատասխան ածխաջրածինների և հալոգենածանցյալների հետ, բարձր է. C2H6` եռման ջերմաստիճանն է 88,3°C, C2H5Br` +38,0°C, C2H5OH` +78,3°C: Այս երևույթը բացատրվում է սպիրտների մոլեկուլների ասոցմամբ, որն արդյունք է միջմոլեկուլային ջրածնական կապերի առաջացման.
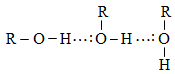
Ցածրամոլեկուլային սպիրտների լուծելիությունը ջրում բացատրվում է ջրածնական կապերի առկայությամբ սպիրտների և ջրի մոլեկուլների միջև: Բարձրամոլեկուլային սպիրտների լուծելիությունը խիստ նվազում է ալկիլ ռադիկալների հիդրոֆոբ հատկության պատճառով: ՈՒղիղ շղթայով սպիրտներն ունեն ավելի բարձր եռման ջերմաստիճան, քան դրանց իզոմերները: Սպիրտների խտությունը փոքր է մեկից:
ԻԿ
սպեկտրում չխմբավորված
հիդրօքսիլ խմբերի
վալենտային տատանումների
տիրույթը ![]() մկմ է
(3600 սմ-1), իսկ խմբավորված
հիդրօքսիլ խմբերինը`
մկմ է
(3600 սմ-1), իսկ խմբավորված
հիդրօքսիլ խմբերինը`![]() մկմ
(3200 սմ-1):
մկմ
(3200 սմ-1):
19.3./19.4. Կիրառման բնագավառներ, թունավորություն
Միատոմ սպիրտները տարածված են բնության մեջ. հանդիպում են գրեթե բոլոր եթերայուղերում: Մեթանոլը և էթանոլը բույսերում հանդիպում են նույնիսկ ազատ վիճակում:
Սպիրտները կիրառվում են օրգանական սինթեզում` որպես սկզբնանյութեր և լուծիչներ: Խառնվում են ջրի և օրգանական լուծիչների հետ: Դրանց կարևորությունը վկայում են համաշխարհային արտադրության մեծ չափերը: Մեթանոլի արտադրությունը 1999 թ. կազմել է 16 մլն տոննա: 2002 թ. էթանոլի արտադրությունը կազմել է 15 մլն տոննա, պրոպանոլինը` 15000 տոննա, 2-բութանոլինը` 850000 տոննա:
Մեթանոլը կիրառվում է ֆորմալդեհիդի, քացախաթթվի արտադրություններում, նաև որպես ալկիլող միջոց (դիմեթիլտերեֆտալատ, մեթիլմեթակրիլատ, մեթիլանիլին): Լավագույն լուծիչ է քսուքների, ներկերի արտադրություններում: Էթանոլը կիրառվում քացախալդեհիդի, քլորոֆորմի, դիէթիլեթերի, էթիլացետատի, 1,3-բութադիենի արտադրություններում: Պրոպանոլը, ն.բութանոլը, իզոբութիլսպիրտը կիրառվում են միջատասպան միջոցների, հերբիցիդների, ներկանյութերի, քսուքների արտադրությունում:
Սպիրտների
մեծ մասն օժտված
է ֆիզիոլոգիական
ազդեցությամբ:
Առավել թունավոր
է մեթանոլը` ՍԹԿ-ն
5 մգ/մ3, ![]() մարդկային
օրգանիզմ թափանցելու
դեպքում այն մահաբեր
է, իսկ 5
10 գրամն առաջացնում
է խիստ թունավորում`
ընդհուպ մինչև
կուրացում: Մեթանոլը
գերազանցապես
ազդում է նյարդային
և սրտանոթային
համակարգերի վրա:
մարդկային
օրգանիզմ թափանցելու
դեպքում այն մահաբեր
է, իսկ 5
10 գրամն առաջացնում
է խիստ թունավորում`
ընդհուպ մինչև
կուրացում: Մեթանոլը
գերազանցապես
ազդում է նյարդային
և սրտանոթային
համակարգերի վրա:
Թունավոր է նաև էթիլսպիրտը` ՍԹԿ-ն 5 մգ/մ3 մթնոլորտում և 1000 մգ/մ3 աշխատանքային գոտում: Էթանոլի երկարատև օգտագործումը դանդաղեցնում է ուղեղի կենտրոնների աշխատանքը, թունավորում է օրգանիզմը: Բութիլ, իզոբութիլ, ամիլ, իզոամիլ սպիրտները (ՍԹԿ` 10 մգ/մ3) թմրանյութեր են, ունեն գրգռող ազդեցություն, ազդում են աչքի, շնչառական ուղիների լորձաթաղանթների վրա, առաջացնում են գլխապտույտ, սրտխառնոց, գլխացավ, խլություն, զառանցանք:
19.5. Ստացման եղանակներ
19.5.1. Ալկենների հիդրատացում: Ռեակցիան իրականացվում է թթվային միջավայրում, ընթանում է AdE մեխանիզմով համաձայն Մարկովնիկովի կանոնի (տես «Ալկեններ»).
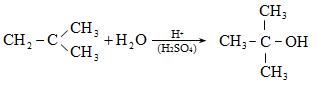
19.5.2. Հալոգենալկանների հիդրոլիզ (տես «Հալոգենածանցյալներ»).
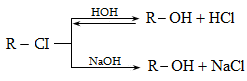
19.5.3. Ալդեհիդների, կետոնների և բարդ եթերների վերականգնում կատալիզատորների ներկայությամբ (պլատին, պալադիում, Ռենեի նիկել)` ալդեհիդները հիդրվում են առաջնային, կետոնները` երկրորդային սպիրտների.
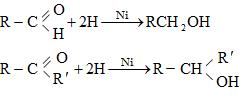
Կարբոնաթթուների բարդ եթերների վերականգնումն իրականացվում է խառը կատալիզատորներով (ջրածնով անջատման պահին), ստացվում է առաջնային սպիրտների խառնուրդ.
![]()
Կիրառական քիմիայում, որպես կատալիզատոր, օգտագործվում է լիթիումալյումինհիդրիդ.

19.5.4. Մետաղօրգանական միացությունների փոխազդեցություն ալդեհիդների, կետոնների և բարդ եթերների հետ:
Ռեակցիան իրականացվում է Գրինյարի ռեակտիվով (մագնեզիում-օրգանական միացություն), որը AdN մեխանիզմով միանում է կարբոնիլային խմբին` առաջացնելով մագնեզիումի ալկոհոլատ: Վերջինս հիդրոլիզվում է համապատասխան սպիրտի. AdN H2O
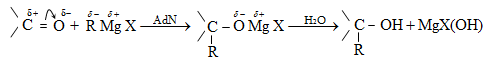
Ֆորմալդեհիդից ստացվում է առաջնային, մյուս ալդեհիդներից` երկրորդային, կետոններից` երրորդային սպիրտ`
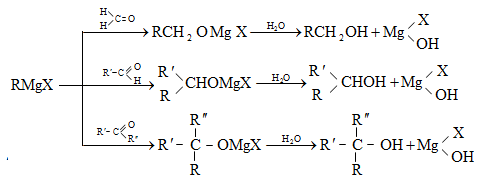
Կարբոնաթթուների բարդ եթերների փոխազդեցության ժամանակ առաջանում են երրորդային, իսկ մրջնաթթվի եթերների դեպքում` երկրորդային սպիրտներ: Առաջին փուլում նուկլեոֆիլը միանում է կարբոնիլային խմբին, ապա թթվածնի էլեկտրոնային զույգը գրոհում է կարբոնիլային խմբի ածխածնին` դուրս մղելով ալկօքսի խումբը:
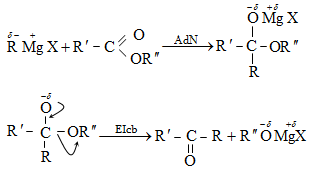
Միացման-պոկման արդյունքում տեղի է ունենում նուկլեոֆիլ տեղակալում: Առաջացած կետոնը ռեակցում է Գրինյարի ռեակտիվի հետ.
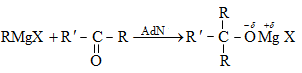
Գումարային փոխազդեցությունը կարտահայտվի հետևյալ ռեակցիայով.

19.5.5. Գրինյարի ռեակտիվի և էթիլենօքսիդի փոխազդեցությամբ ստացվում է առաջնային սպիրտ
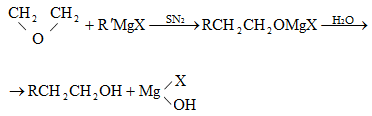
19.5.6. Ալկենների հիդրոբորացում հետագա օքսիդացումով.
Ալկենի և դիբորանի (BH3)2 միացման արդյունքում առաջացող ալկիլբորանի օքսիդացումը ջրածնի պերօքսիդով հանգեցնում է սպիրտի գոյացման: Դիբորանը չափազանց թունավոր գազ է, ստացվում է բորֆտորիդի փոխազդեցությամբ նատրիումի բորհիդրիդի հետ տետրահիդրոֆուրանում
![]()
Դիբորանի ցիս-միացումը ալկենին տեղի է ունենում հակառակ Մարկովնիկովի կանոնի.
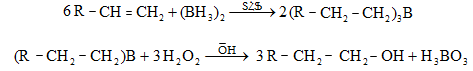
19.5.7. Լայն կիրառություն ունեցող սպիրտների ստացման արտադրական եղանակներ`
19.5.7.1. CH3OH` մեթանոլ, կարբինոլ, փայտի սպիրտ (ծագումնաբանական անվանում), tեռմ.=64,7°C: Մինչև 1925 թ. այն ստացվում էր փայտի չոր թորումով (առանց օդի մուտքի բարձրջերմաստիճանային տաքացում): Այժմ արդյունաբերական եղանակով մեթանոլ ստանում են սինթեզ գազից (տես «Ալկաններ»).
![]()
19.5.7.2. C2H5OH` էթանոլ, գինու սպիրտ, tեռմ.=78,3°C:
Էթիլսպիրտի ստացման հնագույն եղանակ է շաքարանյութերի, հիմնականում մրգերի խմորումն էնզիմների ազդեցությամբ.
![]()
Էթանոլի ստացման արդյունաբերական եղանակ է էթիլենի հիդրատացումը.
![]()
Արտադրական էթիլսպիրտն ազեոտրոպ խառնուրդ է (95,57% էթանոլ և 4,43% ջուր), եռման ջերմաստիճանը` 78,2°C: Բացարձակ էթանոլ ստացվում է սովորական էթանոլը մշակելով չհանգած կրով (CaO).
![]()
19.6. Քիմիական հատկություններ
Ռեակցիոնունակ հիդրօքսիլ խմբի առկայությունը պայմանավորում է սպիրտների քիմիական հատկությունները` տեղակալում, պոկում, օքսիդացում:
19.6.1. Տեղակալման ռեակցիաներ
Տեղակալման ռեակցիաները կարող են կատարվել O H և C O կապերի խզման արդյունքում:
19.6.1.1. Թթվահիմնային հատկություններ: Սպիրտները, լինելով բնույթով չեզոք, ցուցաբերում են ամֆոտեր հատկություններ: Քանի որ O H կապը բևեռային է, ջրածինը կարող է պոկվել որպես պրոտոն (թթվային հատկություն): Սպիրտներն ավելի թույլ թթուներ են, քան ջուրը (Ka H2O=10-16, Ka C2H5OH=10-18 ):
Ակտիվ մետաղների հետ (Na, K, Mg, Al) սպիրտներն առաջացնում են ալկոհոլատներ.
![]()
Ալկոհոլատները կիրառվում են ոչ թե ջրային, այլ սպիրտային լուծույթի ձևով, քանի որ ջուրը, լինելով ավելի ուժեղ թթու, քան սպիրտը, քայքայում է ալկոհոլատը.
![]()
Թթվային հատկություններն ի հայտ են գալիս Գրինյարի ռեակտիվի հետ փոխազդեցության ժամանակ.
![]()
Ռեակցիան կիրառվում է սպիրտի քանակական որոշման համար (Չուգաև, Ցերեվիտինով, Տերենտև):
Սպիրտներն ուժեղ թթուների հետ սառը պայմաններում առաջացնում են օքսոնիումային աղեր (դոնոր-ակցեպտորային կապ).
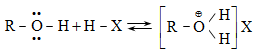
Փոխազդում են նաև Լյուիսի թթուների հետ (BF3, ZnCl2 և այլն).
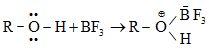
Սպիրտերի թթվահիմնային հատկությունները լուծույթում փոփոխվում են հետևյալ կարգով.

19.6.1.2.
OH խմբի տեղակալման
ռեակցիաներ: ![]() Սպիրտների
քիմիական փոխարկումների
ժամանակ «դժվար»
հեռացող OH խումբը
վերածվում է OH2
«հեշտ» հեռացողի,
այսինքն` հիդրօքսիլ
խումբը ենթարկվում
է պրոտոնացման,
և պոկումը դառնում
է ավելի մատչելի:
Այդ պատճառով նուկլեոֆիլ
տեղակալման ռեակցիաներն
իրականացվում
են թթվային միջավայրում:
Սպիրտների
քիմիական փոխարկումների
ժամանակ «դժվար»
հեռացող OH խումբը
վերածվում է OH2
«հեշտ» հեռացողի,
այսինքն` հիդրօքսիլ
խումբը ենթարկվում
է պրոտոնացման,
և պոկումը դառնում
է ավելի մատչելի:
Այդ պատճառով նուկլեոֆիլ
տեղակալման ռեակցիաներն
իրականացվում
են թթվային միջավայրում:
ա) ալկիլհալոգենիդների ստացում.
![]()
Այս ռեակցիան կարող է ընթանալ SN1 և SN2 մեխանիզմներով: Առաջնային սպիրտների դեպքում առավել հավանական է SN2 մեխանիզմ, իսկ երրորդայինների դեպքում` SN1:
SN2 մեխանիզմ
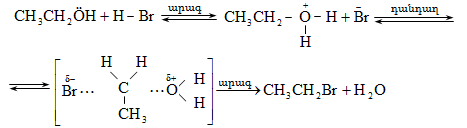
SN1 մեխանիզմ
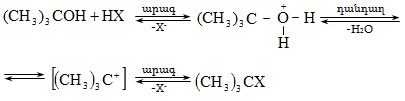
բ) թիոնիլքլորիդի հետ փոխազդեցությունը տեղի է ունենում ավելի արագ և առանց կողմնակի ռեակցիաների.
![]()
Այս ռեակցիան հետաքրքիր է նրանով, որ ընթանում է կոնֆիգուրացիայի պահպանմամբ, ինչը վկայում է ռեակցիայի ներմոլեկուլային ցիկլային մեխանիզմի մասին.
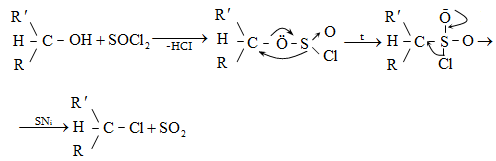
գ) բարդ եթերների ստացում (եթերացում): Սպիրտների փոխազդեցությամբ հանքային թթուների, դրանց անհիդրիդների և հալոգենանհիդրիդների հետ` առաջանում են բարդ եթերներ.
Հանքային թթուների բազմաթիվ բարդ եթերներ ունեն գործնական նշանակություն: Ֆոսֆորական և թիոֆոսֆորական S=P(OH)3 թթուների եթերները կիրառվում են որպես թունաքիմիկատներ:
19.6.1.3. Սպիրտներն օրգանական թթուների հետ առաջացնում են կարբոնաթթուների բարդ եթերներ (տես «Կարբոնաթթուներ»).
![]()
19.6.2. Պոկման ռեակցիաներ
Սպիրտների դեհիդրատացումն իրականացվում է թթվային միջավայրում (Արենիուսի կամ Լյուիսի թթուներ): Գործընթացը կարող է կատարվել ներմոլեկուլային` ալկենի առաջացումով և միջմոլեկուլային` պարզ եթերի գոյացումով: Որպես կատալիզատոր կիրառվում են թթուներ (ծծմբական, ֆոսֆորական, թրթնջկաթթու, բենզոլսուլֆաթթու և այլն), օքսիդներ (ալյումինի, թորիումի), որոշ աղեր (կալիումի հիդրոսուլֆատ, պղնձի սուլֆատ, ցինկի քլորիդ և այլն ):
19.6.2.1. Ներմոլեկուլային դեհիդրատացում: Առաջնային սպիրտների դեհիդրատացումն ընթանում է E2 մեխանիզմով, իսկ երկրորդային և երրորդային սպիրտների դեհիդրատացումը` E1 մեխանիզմով: Համաձայն Զայցևի կանոնի` առաջանում է առավել ճյուղավորված ալկենը (ջրածինը պոկվում է պակաս հիդրոգենացված ածխածնի ատոմից).
E1 մեխանիզմ
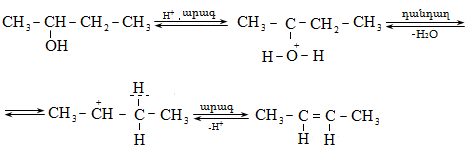
Ջրի պոկման ռեակցիայի արագությունը նվազում է հետևյալ շարքում.
երրորդային > երկրորդային > առաջնային
E2 մեխանիզմ
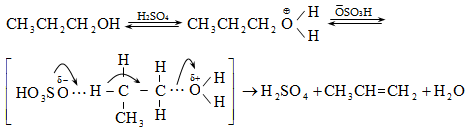
19.6.6.2. Միջմոլեկուլային դեհիդրատացում: Միջմոլեկուլային դե-հիդրատացումն իրականանում է նուկլեոֆիլ տեղակալման մեխանիզմով համեմատաբար ցածր ջերմաստիճաններում: Առաջնային սպիրտներին բնորոշ է SN2, իսկ երրորդային սպիրտներին` SN1 մեխանիզմ: Թթվային կատալիզատորի ներկայությամբ գոյանում է հիդրօքսոնիում, իսկ սպիրտի երկրորդ մոլեկուլը փոխազդում է որպես նուկլեոֆիլ:
SN1 մեխանիզմ
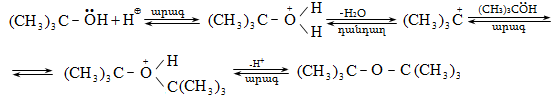
SN2 մեխանիզմ
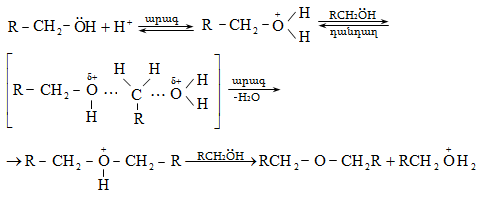
19.6.3. Սպիրտների օքսիդացում
Սպիրտների օքսիդացման ժամանակ առաջանում են զանազան արգասիքներ` կախված հիդրօքսիլ խմբի դիրքից: Որպես օքսիդիչ կիրառվում են օդի թթվածին` պղնձի և այլ փոփոխական վալենտականությամբ մետաղների ներկայությամբ (300 350°C), քրոմային խառնուրդ (կալիումի բիքրոմատ ծծմբական թթվում), քրոմաթթու, կալիումի պերմանգանատ: Ավելի ցածր ջերմաստիճանում (100 180°C) սպիրտները ենթարկվում են դեհիդրման: Առաջնային սպիրտներն օքսիդանում են ալդեհիդների, ապա` թթուների, երկրորդային սպիրտները` կետոնների, երրորդային սպիրտները չեզոք և հիմնային միջավայրում չեն օքսիդանում, իսկ թթվային միջավայրում օքսիդանում են ածխածնային շղթայի խզումով` առաջացնելով թթուների և կետոնների խառնուրդ.

20. ԵՐԿԱՏՈՄ ՍՊԻՐՏՆԵՐ
20.1. Անվանակարգում, իզոմերիա
Երկատոմ սպիրտներն ալկանների երկհիդրօքսիլ ածանցյալներ են, կոչվում են գլիկոլներ կամ ալկանդիոլներ: Այս միացությունների ընդհանուր բանաձևն է` CnH2n(OH)2: Գլիկոլներ առաջին անգամ ստացել է Վյուրցը` ալկանների վիցինալ դիհալոգենածանցյալներից:
Ըստ
հիդրօքսիլ խմբերի
փոխադարձ դասավորության`
գլիկոլները լինում
են ![]() և այլն:
և այլն:

20.2. Ֆիզիկական հատկություններ
Էթիլենգլիկոլը
մածուցիկ, անգույն,
քաղցրահամ, 198°C
եռման ջերմաստիճանով
հեղուկ է, բոլոր
հարաբերություններով
խառնվում է ջրի
և սպիրտի հետ, անլուծելի
է եթերում: Մոլեկուլային
զանգվածի աճի հետ
նվազում է գլիկոլների
լուծելիությունը
![]() ջրում,
ջրում,
![]() սպիրտներում:
սպիրտներում:
20.3. Կիրառման բնագավառներ, թունավորություն
Գլիկոլները գործնականում լայնորեն օգտագործվում են որպես լուծիչներ ու պլաստիֆիկատորներ: Դրանց մեծ զանգվածը վաղուց կիրառվում է սննդամթերքի թրջման, խոնավացման համար, նաև որպես մանրէասպան (բակտերիցիդային) միջոց:
Գործնական մեծ հետաքրքրություն են ներկայացնում էթիլենգլիկոլը և 1,2-պրոպանդիոլը: Էթիլենգլիկոլն օգտագործվում է ներկանյութերի արտադրությունում` որպես գլիցերինի փոխարինող, հիդրավլիկական հեղուկներում, պոլիուրետանի և ակրիլային խեժերի ստացման գործընթացներում, մեխանիզմների և մեքենաների շարժիչներում` որպես ջրի հակասառեցնող միջոց (անտիֆրիզ): Էթիլենգլիկոլի տարեկան արտադրությունը աշխարհում 2002 թ. կազմել է 100 միլիոն տոննա, որի հիմնական քանակությունը կիրառվել է պոլիեթերային թելերի և թաղանթների ստացման համար:
Պրոպանդիոլի համաշխարհային արտադրությունը նույն թվականին կազմել է 500 հազար տոննա, որի մեծ մասն օգտագործվել է դեղագործությունում և կոսմետիկայում չհագեցած պոլիեթերային խեժերի ստացման համար: Կիրառական նշանակություն ունի 1,4-բութիլենգլիկոլը` որպես պլաստիֆիկատոր լվացող նյութերում, քսուքներում, թանաքի մեջ: Նախկինում այս նյութը ելանյութ էր 1,3-բութադիենի ստացման համար:
Գլիկոլների թունավորությունը նվազում է մոլեկուլային զանգվածի աճի հետ: Էթիլենգլիկոլը մարդու օրգանիզմ թափանցելիս վնասում է նյարդային համակարգը և միզուղիները: 1,4 գ/կգ չափաբաժինը մահացու է, ՍԹԿ-ն աշխատանքային գոտում` 5 մգ/մ3: Պրոպիլենգլիկոլները պակաս թունավոր են, իսկ բութիլենգլիկոլները զերծ են թունավորությունից:
20.4. Ստացման եղանակներ
20.4.1. Էթիլենօքսիդի հիդրատացում (արտադրական եղանակ)
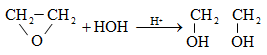
Գործընթացը տեղի է ունենում 130...150oC և 15...20 մթն ճնշման տակ` էթիլենօքսիդ: ջուր հարաբերությունը 1:(8...15):
20.4.2. Էթիլենքլորիդի հիդրոլիզ
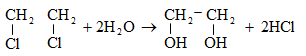
Այս գործընթացն էթլիենգլիկոլի ստացման առաջին արտադրական եղանակն է: Այն իրականացվում է 200 oC, 100 մթն ճնշման տակ:
20.4.3. Էթիլենգլիկոլի ժամանակակից ստացման եղանակ է էթիլենօքսիդի փոխազդեցությունը ածխաթթու գազի հետ բութիրոլակտոնում ալկալիական մետաղների հալոգենիդների, ամինների կամ ամոնիումային աղերի ներկայությամբ 80 120oC, 20 50 մթն ճնշման տակ:
20.4.4. Արտադրությունում 1,2-պրոպանդիոլ ստացվում է պրոպենի օքսիդացնող հիդրօքսիլացմամբ կալիումի պերմանգանատի ազդեցությամբ հիմնային միջավայրում կամ ջրածնի պերօքսիդով մրջնաթթվում (տես «Ալկեններ»):
20.4.5. 1,4-բութանդիոլ ստացվում է ացետիլենի և ֆորմալդեհիդի փոխազդեցությամբ (տես «Ալկիններ»):
20.5. Քիմիական հատկություններ
Գլիկոլները կրկնում են միատոմ սպիրտների քիմիական հատկությունները, ընդ որում, հիդրօքսիլ խմբերը ռեակցում են հաջորդաբար: Երկու հիդրօքսիլ խմբերի առկայությունը, հատկապես հարևան ածխածիններին կից, պայմանավորում է դրանց քիմիական առանձնահատկությունները: Այսպես, փոխազդեցության առաջին փուլը, օրինակ աղաթթվի հետ, ընթանում է հեշտությամբ: Էթիլենգլիկոլից ստացվում է էթիլենքլորհիդրին, որն արդյունաբերական կարևոր միացություն է ներկանյութերի, դեղանյութերի և թունավոր նյութերի արտադրություններում: Լավ լուծիչ է օրգանական տարբեր միացությունների ստացման գործընթացներում: Փոխազդեցությունը ֆոսֆորի պենտաքլորիդի հետ առաջացնում է դիհալոգենածանցյալներ:
20.5.1. Քլորաջրածնի հետ սկզբում առաջանում է էթիլենքլորհիդրին, իսկ ավելի բարձր ջերմաստիճանում` դիքլորէթան.
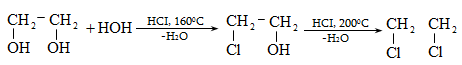
20.5.2. Մետաղների հետ գլիկոլներն առաջացնում են ոչ լրիվ և լրիվ գլիկոլատներ.
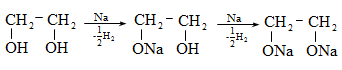
Գլիկոլներն, ի տարբերություն սպիրտների, փոխազդում են նաև այնպիսի մետաղների հետ, որոնք ունեն ազատ p և d օրբիտալներ` առաջացնելով կոմպլեքս աղեր` գլիկոլատներ: Պղնձի հիդրօքսիդի երկնագույն նստվածքը սառը պայմաններում լուծվում է էթիլենգլիկոլում պղնձի մուգ կապույտ գլիկոլատի առաջացումով:
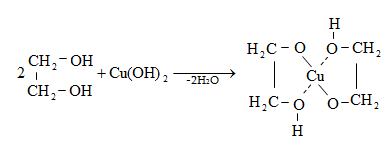
20.5.3. Հանքային և օրգանական թթուների հետ առաջանում են ոչ լրիվ և լրիվ բարդ եթերներ.
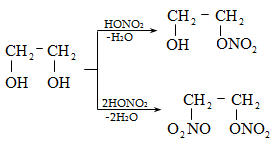
Էթիլենգլիկոլի լրիվ և ոչ լրիվ եթերները սովորաբար ստանում են էթիլենօքսիդի և սպիրտի փոխազդեցությամբ`
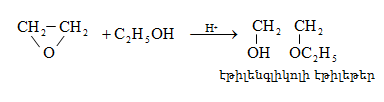
Այս միացությունը` էթիլցելոզոլֆը, կիրառվում է որպես լուծիչ, հատկապես ներկանյութերի արտադրությունում:
20.5.4. Գլիկոլների դեհիդրատացում: Ռեակցիայի պայմաններից կախված` կատարվում է ներմոլեկուլային կամ միջմոլեկուլային ջրի պոկում.
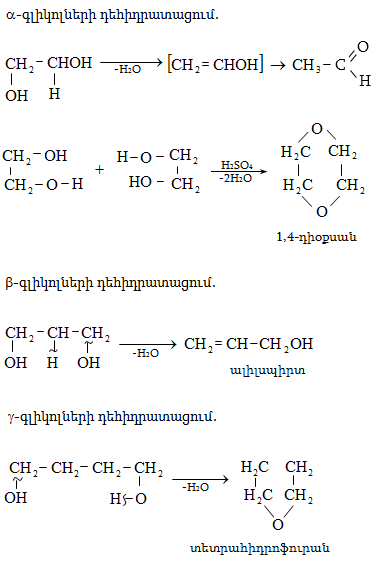
20.5.5. Էթիլենգլիկոլի օքսիդացումն ընթանում է տարբեր ուղղություններով` կախված օքսիդիչի բնույթից և փոխազդեցության պայմաններից:
Օրինակ, ազոտական թթվով օքսիդացումը բերում է խիստ կարևոր միացությունների` գլիօքսալաթթվի, ապա` թրթնջկաթթվի առաջացման.
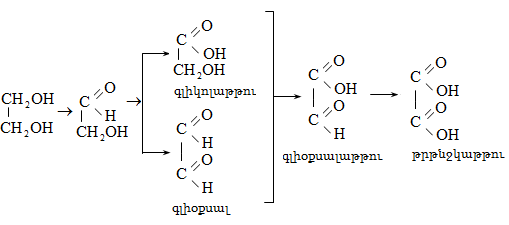
20.5.6. Գործնական նշանակություն ունի պինակոնից (տետրամեթիլէթիլենգլիկոլ կամ 2,3-դիմեթիլբութանդիոլ-2,3) պինակոլինի ստացման ռեակցիան: Առաջարկված մեխանիզմի համաձայն, գործընթացի դանդաղ փուլը կարբկատիոնի առաջացումն է, որին հաջորդում է անիոնոտրոպ իզոմերացում` իզոմերային կատիոնի գոյացումով: Վերջինս կայունանում է հիդրօքսիլ խմբի ջրածնի պրոտոնացումով.
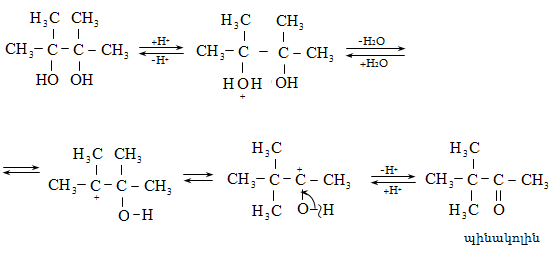
Ալյումինի օքսիդի ներկայությամբ պինակոնի դեհիդրատացումով գերազանցապես գոյանում են դիենային ածխաջրածիններ:
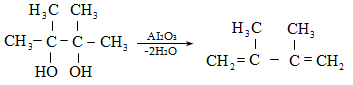
21. ԵՌԱՏՈՄ ՍՊԻՐՏՆԵՐ
Եռատոմ սպիրտների տարածված ներկայացուցիչը գլիցերինն է: Այն կա բնական յուղերում և ճարպերում, ինչպես նաև ֆոսֆատիտներում, մասնավորապես լեցիտինում: Քիչ քանակով հանդիպում է արյան մեջ և միշտ գոյանում է ալկոհոլային խմորման գործընթացում:
Գլիցերինի համաշխարհային արտադրությունը 2001 թ. կազմել է մոտ 500 հազար տոննա: Կիրառվում է որպես կտորեղենի, կաշվեղենի, թղթի փափկեցուցիչ, կոշկեղենի քսուք: Էմուլգատորների, անտիֆրիզի, բաղադրամաս է, օգտագործվում է օծանելիքի և սննդի արտադրություններում:
Գլիցերինը քաղցր համով, անգույն, թանձր հեղուկ է, բոլոր հարաբերություններով խառնվում է ջրի և սպիրտի հետ, եթերում չի լուծվում: Ավելի ուժեղ թթու է (pKa =14), քան էթիլենգլիկոլը (pKa = 15):
21.1. Ստացման եղանակներ
21.1.1. Նախկինում գլիցերինն ստացվում էր ճարպերի քայքայումից ծծմբական թթվով կամ ալկալիներով.
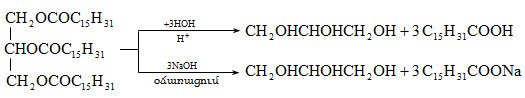
Հիմնային հիդրոլիզի ժամանակ ստացվում են օճառներ` բարձրամոլեկուլային ճարպային թթուների նատրիումական աղեր (օճառացում):
Գլիցերինի պահանջարկի խիստ մեծացումը խթանեց պրոպիլենից ստացման արտադրական եղանակների մշակում:
21.1.2. Պրոպիլենի նախնական քլորացում և հետագա հիդրոլիզ.
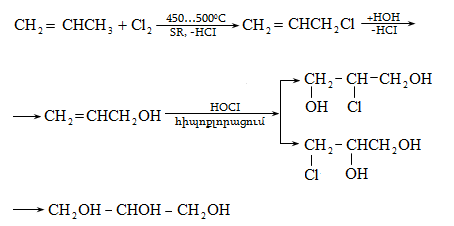
21.1.3. Պրոպիլենի օքսիդացում և ստացված ալիլ սպիրտի փոխազդեցություն ջրածնի պերօքսիդի հետ.
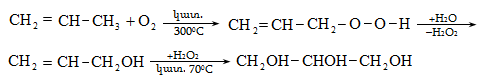
21.2. Քիմիական հատկություններ
Գլիցերինի քիմիական հատկությունները բնորոշվում են մոլեկուլում տարբեր դիրք գրավող հիդրօքսիլ խմբերի (առաջնային և երկրորդային) առկայությամբ:
21.2.1. Ալկալիական մետաղների և դրանց հիդրօքսիդների, ինչպես նաև երկաթի, պղնձի, կալցիումի և այլ մետաղների հիդրօքսիդների ազդեցությամբ առաջանում են գլիցերատներ.
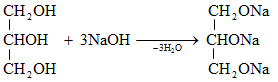
21.2.2. Հալոգենաջրածինների ազդեցությամբ առաջանում են մոնո- և դիհալոգենհիդրիններ.
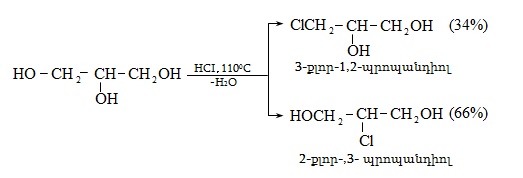
21.2.3. Թթուների հետ առաջանում են ոչ լրիվ և լրիվ եթերներ.
Գլիցերինը ցածր ջերմաստիճաններում փոխազդում է խիտ ազոտական թթվի հետ ծծմբական թթվի ներկայությամբ` առաջացնելով գլիցերինտրինիտրատ` նիտրոգլիցերին: Այն անգույն կամ դեղնավուն հեղուկ է, որը տաքացնելիս կամ հարվածից պայթում է:
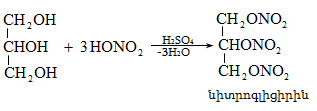
Նիտրոգլիցերինի պայթման քիմիական նկարագիրն է`
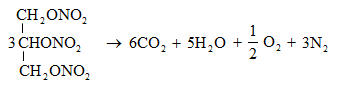
![]()
![]()
Նոբելը 1867 թ. հայտնաբերեց, որ նիտրոգլիցերինով ներծծված կիզելգուրը դառնում է կայուն և պայթում է միայն անդրճայթյունից հետո: Դինամիտը 75% նիտրոգլիցերինի, 24,5% կիզելգուրի և 0,5% նատրիումի կարբոնատի խառնուրդ է, այն անվտանգ է տեղափոխման համար: Կիզելգուրի փոխարեն կարելի է օգտագործել նատրիումի նիտրատ կամ կարբոնատ և թեփ:
Կարբոնաթթուների հետ գլիցերինն առաջացնում է բարդ եթերներ.
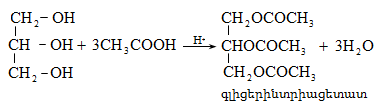
21.2.4. Գլիցերինի օքսիդացումով ստացվում են բազմաթիվ միացություններ.
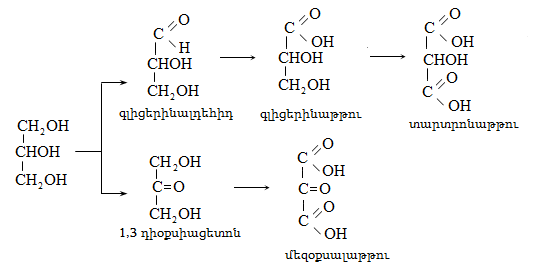
21.2.5. Գլիցերինը գունավոր և ծանր մետաղների հետ հիմնային միջավայրում առաջացնում է խելատային միացություններ` գլիցերատներ, որոնք ունեն վառ արտահայտված գունավորում և կիրառվում են անալիտիկ քիմիայում:
22. ՉՀԱԳԵՑԱԾ ՍՊԻՐՏՆԵՐ
Չհագեցած սպիրտների կարևոր ներկայացուցիչներ են.

Վինիլսպիրտն անկայուն
է, իզոմերվում
է կարբոնիլային
միացության, քանի
որ մոլեկուլում
առկա է![]() զուգորդում.
զուգորդում.
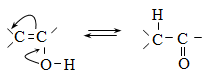
Կետոենոլային տաուտոմերիայի հավասարակշռությունը տեղաշարժված է ալդեհիդի կամ կետոնի առաջացման ուղղությամբ (Էլտեկովի կանոն):
Վինիլսպիրտի համապատասխան պոլիմերը` պոլիվինիլսպիրտը (ՊՎՍ), ստացվում է պոլիվինիլացետատի օճառացումով և կիրառվում է արհեստական մանրաթելի (վինոլ), դեղամիջոցների ստացման համար.
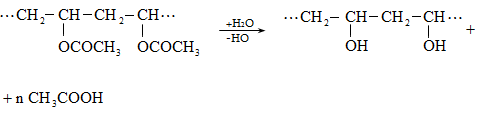
Ալիլ սպիրտն անգույն, սուր հո տով, 97,5°C եռման ջերմաստիճանով հեղուկ է, բոլոր հարաբերություններով խառնվում է ջրի հետ: Կիրառվում է գլիցերինի, ակրոլեինի, ալիլեթերների արտադրություններում: Թունավոր է (ՍԹԿ` 2 մգ/մ3), բորբոքում է մաշկը, շնչուղիների, աչքերի լորձաթաղանթները:
Ալիլ սպիրտի ստացման արտադրական եղանակ է ալիլքլորիդի հիմնային հիդրոլիզը.
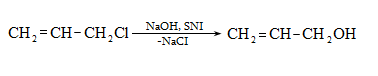
աբորատոր ստացման եղանակ է գլիցերինի և թրթնջկաթթվի կամ մրջնաթթվի համատեղ տաքացումը`
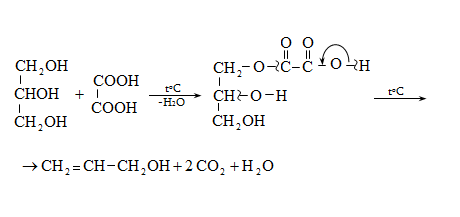
Պրոպարգիլսպիրտն անգույն, տհաճ հոտով, 114,7°C եռման ջերմաստիճանով հեղուկ է, լուծվում է ջրում և օրգանական լուծիչներում: Լավ լուծիչ է պոլիամիդների, ացետիլցելյուլոզի համար, օժտված է թմրեցնող հատկությամբ, գրգռում է մաշկը (ՍԹԿ` 1 մգ/մ3):
Ստացվում է ացետիլենի և ֆորմալդեհիդի կոնդենսացումով` բիսմուտի միացություններով կայունացված պղնձի ացետիլենիդի ներկայությամբ (Ռեպպե).
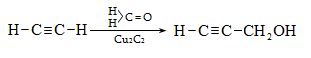
Պրոպարգիլսպիրտին բնորոշ են մոնոտեղակալված ացետիլենի և առաջնային սպիրտի հատկությունները`
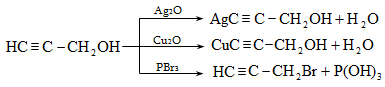
23. ԱՐՈՄԱՏԻԿ ՕՔՍԻՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
Օքսիմիացությունները բաժանվում են ֆենոլների և արոմատիկ սպիրտների:
Ֆենոլներում հիդրօքսիլ խումբը կապված է արոմատիկ օղակի հետ, իսկ սպիրտներում գտնվում է կողմնային շղթայում: Ֆենոլները կարևոր դեր ունեն քիմիական արտադրություններում, լայնորեն կիրառվում են պլաստիկ զանգվածների արտադրությունում: Ֆենոլները լինում են միատոմ, երկատոմ և այլն, կոչվում են որպես ածխաջրածնի օքսիածանցյալներ.

23.1. Ֆիզիկական հատկություններ
Ֆենոլները ջրում վատ լուծվող, բնորոշ հոտով բյուրեղային նյութեր են, ցնդում են ջրային գոլորշիների հետ, թունավոր են, կիրառվում են որպես հականեխիչ: Առաջացնում են մաշկի այրվածք: Ջրի հետ գոյացնում են իրենց հալման ջերմաստիճանից ցածր հալման ջերմաստիճան ունեցող բյուրեղահիդրատներ:
23.2. Կիրառման բնագավառներ, թունավորություն
Ֆենոլը մեծ քանակներով կիրառվում է պլաստիկ զանգվածների (ֆենոլֆորմալդեհիդային խեժեր), դեղամիջոցների (սալիցիլաթթու և ածանցյալներ), ներկանյութերի, պայթուցիկ նյութերի (պիկրինաթթու) արտադրություններում: Ֆենոլի մեթիլեթերը կիրառվում է հոտավետ նյութերի, ներկանյութերի արտադրությունում: Կրեզոլները կիրառվում են պլաստիկ զանգվածների, ներկանյութերի արտադրության մեջ և որպես ախտահանող միջոցներ: Կրեզոլների և օճառների խառնուրդը (լիզոլ, կրեոլին) կիրառվում է անասնաբուժության մեջ: Ֆենոլը (կարբոլաթթու) թունավոր է, մաշկի վրա այրվածքներ է առաջացնում, մանրէասպան է, ընդհանուր օգտագործման ջրերում ֆենոլի ՍԹԿ-ն 0.001 մգ/լ է, իսկ մթնոլորտում` 0,3...1 մգ/մ3: Ֆենոլի թունավորության աստիճանը փոքրանում, իսկ մանրէասպան հատկությունը մեծանում է ալկիլ խմբերի մեծացման հետ: Ֆենոլն առաջին միացությունն է, որ օգտագործվել է որպես հականեխիչ: 2-իզոպրոպիլ-5-մեթիլֆենոլը կիրառվում է որպես լավագույն հականեխիչ, անեգալը` (պպրոպենիլանիզոլ) օծանելիքի արտադրությունում:
23.3. Ֆենոլների ստացում
23.3.1. Ֆենոլի ստացման արտադրական հիմնական եղանակը սուլֆաթթուների աղերի միահալումն է ալկալիների հետ, որն իրականացվում է բաց և ավտոկլավային եղանակներով.
![]()
Ավելի
լավ ելքեր է տալիս
կծու կալիումը:
Ռեակցիան ուղեկցվում
է կողմնակի նյութերի
առաջացումով. ռեզորցին,
ֆլորոգլյուցին,
![]() դիօքսիդիֆենիլ:
դիօքսիդիֆենիլ:
23.3.2. Արտադրությունում ստացվում է նաև հալոգենածանցյալների հիդրոլիզով ավտոկլավում, պղնձի աղերի ներկայությամբ, NaOH-ի 8%-ոց լուծույթում 300°C-ում, (առաջին անգամ կիրառել է Daw-chemical ընկերությունը` «Դաու» - գործընթաց).
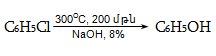
Ռեակցիան ուղեկցվում է կողմնակի դիֆենիլեթերի (C6H5 - O - C6H5), օ- և պ-օքսիդիֆենիլների առաջացումով: Դիֆենիլեթերի առաջացումը կանխելու նպատակով, այն ռեակցիոն միջավայր է տրվում ելանյութերի հետ միասին` ներքոհիշյալ ռեակցիայի հավասարակշռությունը տեղաշարժելու համար.
![]()
23.3.3. Արտադրական եղանակ է կումոլի օքսիդացումն օդի թթվածնով և առաջացած հիդրոպերօքսիդի քայքայումը թթվային միջավայրում: Արդյունքում միաժամանակ ստացվում են ֆենոլ և ացետոն.
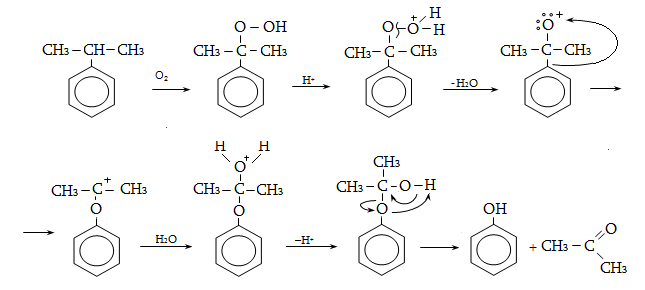
23.3.4. Ֆենոլ կարելի է ստանալ կարբոնաթթուների օքսիդացում-դեկարբօքսիլացումով` 200...300°C-ում, պղնձի աղերի ներկայությամբ: Ռեակտոր է տրվում ջրային գոլորշի և օդ.
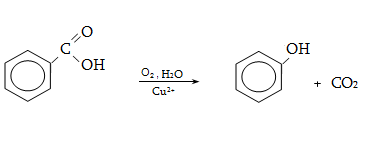
Որպես միջանկյալ միացություն ստացվում է սալիցիլաթթու: Նշված ատոմների եղանակով պարզվել է, որ հիդրօքսիլ խումբը գտնվում է կարբօքսիլ խմբի նկատմամբ օրթո դիրքում: Նշանակում է, նախ կատարվում է օքսիդացում, ապա` դեկարբօքսիլացում.
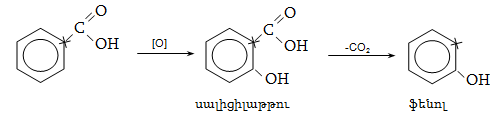
23.3.5. Դիազոաղերի հիդրոլիզով թույլ թթվային միջավայրում ստացվում են ֆենոլներ.
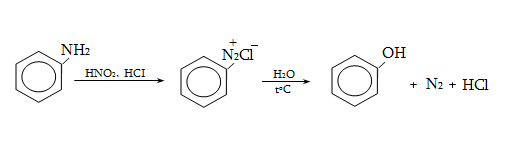
23.3.6. Արիլհալոգենիդները փոխարկվում են ֆենոլների` միջանկյալ մագնեզիումօրգանական միացությունների առաջացումով.
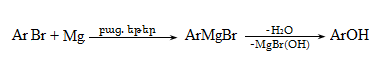
23.3.7. Գրինյարի ռեակտիվի վրա ազդելով բորաթթվի մեթիլ եթերով` ստացվում է արիլբորաթթու, որը նոսր ջրածնի պերօքսիդով օքսիդանում է ֆենոլի.
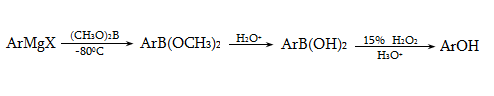
23.3.8. Ֆենոլի հոմոլոգներ կարելի է ստանալ ինչպես բենզոլի սուլֆա, հալոգեն, ամինոածանցյալներից, այնպես էլ` ֆենոլի ալկիլումով: Շնորհիվ հիդրօքսիլ խմբի ակտիվացնող հատկության (առաջին կարգի կողմնորոշիչ), ֆենոլի ալկիլումը, բենզոլի ալկիլման համեմատ, ընթանում է ավելի հեշտ: Որպես ալկիլող միջոց օգտագործվում է սպիրտ` ցինկի քլորիդի ներկայությամբ.
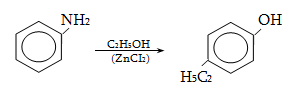
Ֆենոլ կա քարածխային խեժում: Այն գոյանում է նաև նյութափոխանակման գործընթացում և գտնվում է կաթնասունների մեզում: Կենդանի օրգանիզմում բենզոլը վերածվում է ֆենոլի:
23.4. Քիմիական հատկություններ
Ֆենոլների ռեակցիաները կարելի է բաժանել երեք խմբի` 1) O-H, 2)C-O կապերի մասնակցությամբ, 3)արոմատիկ օղակի ռեակցիաներ:
23.4.1. Ֆենոլն ավելի ուժեղ թթու է, քան սպիրտներն ու ջուրը, և ավելի թույլ, քան ածխաթթուն ու կարբոնաթթուները` pKa = 10-10: Ֆենոլի բարձր թթվայնությունը պայմանավորված է թթվածնի էլեկտրոնային զույգի և բենզոլի օղակի զուգորդմամբ:
Ի տարբերություն ալիֆատիկ սպիրտների, ֆենոլները OH խմբին կից ածխածնի մոտ դժվար են ենթարկվում նուկլեոֆիլ տեղակալման:
Ֆենոլները փոխազդում են ալկալու լուծույթի հետ` առաջացնելով ֆենոլյատներ.
![]()
Ֆենոլները ֆենոլյատների լուծույթներից անջատվում են ածխաթթվով, որը համեմատաբար ավելի ուժեղ թթու է, քան ֆենոլը.
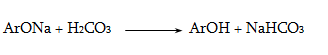
Արոմատիկ օղակում օրթո և պարա դիրքերում էլեկտրոնակցեպտոր խմբերի ներկայությունը մեծացնում է ֆենոլի թթվայնությունը: Պիկրինաթթուն (տրինիտրոֆենոլ) ունի հանքային թթուների ուժգնություն: Ֆենոլների ուժեղ թթվայնությունը, համեմատած սպիրտների հետ, բացատրվում է ֆենոլյատ (ֆենօքսիդ) իոնի առաջացման շահավետությամբ: Ֆենօքսիդ իոնը կայունացված է ռեզոնանսով (ունի մասնակի բացասական լիցքեր բենզոլային օղակի երեք ածխածնի ատոմների վրա).
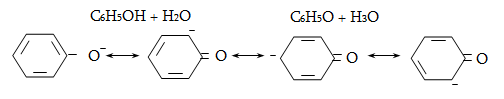
23.4.2. Ֆենոլների պարզ եթերներ ստացվում են Վիլյամսոնի սինթեզով` ֆենոլյատների և ալկիլհալոգենիդների փոխազդեցությամբ: Չնայած օղակում առկա են բացասական լիցքեր, օղակը չի ալկիլանում, քանի որ O-ալկիլումը կատարվում է ավելի արագ, քան C-ալկիլումը, և արդյունքում ստացվում են կայուն եթերներ: Ռեակցիան արագանում է պղնձի փոշու ներկայությամբ: Ալկիլումն իրականացվում է նաև ալկիլսուլֆատներով, սուլֆաթթուների եթերներով և դիազոալկաններով.
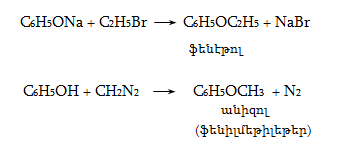
O-ալկիլման գերադասելիությունը C-ալկիլման նկատմամբ ներկայացվում է հետևյալ սխեմայով.
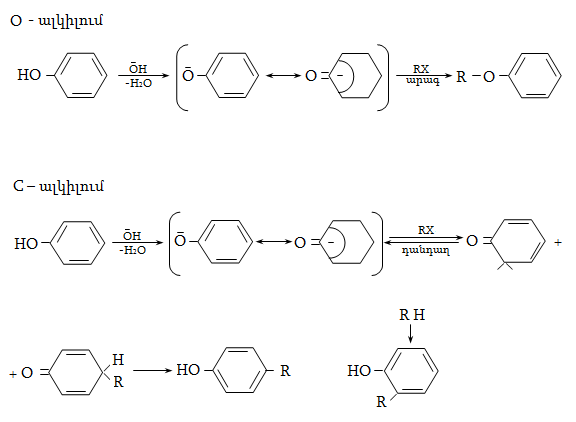
Ի տարբերություն ալկիլֆենիլեթերների, ալիլֆենիլեթերները բարձր ջերմաստիճանում անկայուն են, վերախմբավորվում են օղակում օ-տեղակալված ֆենոլի (Կլայզենի վերախմբավորում)`
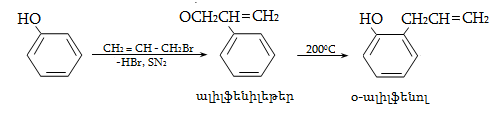
Վերախմբավորումն ընթանում է միջանկյալ ցիկլային վիճակի վրայով, որը բերում է O- և C- ալկիլֆենոլների հավասարակշռության: Ռեակցիայի վերջնական արգասիքը C-ալկիլված ֆենոլն է: Սա բացատրվում է C-ալկիլման թերմոդինամիկական շահավետությամբ.
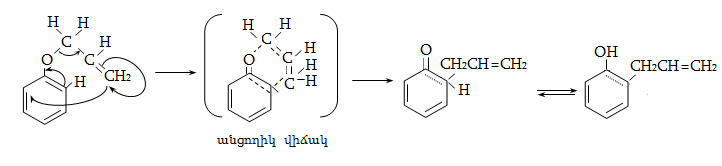
Ալկիլֆենիլեթերները թթվային միջավայրում տաքացնելիս ենթարկվում են վերախմբավորման.

23.4.3. Ֆենոլը կոնդենսանում է էթիլենօքսիդի հետ` առաջացնելով մակերևութային ակտիվ պոլիէթիլենգլիկոլի ֆենիլեթեր.
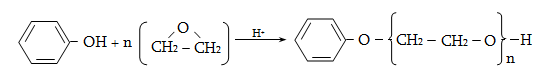
23.4.4. Կարբոնաթթուների հետ անմիջական փոխազդեցությամբ ֆենոլները բարդ եթեր չեն առաջացնում: Այս շարքի բարդ եթերներն ստացվում են ֆենոլների կամ ֆենոլյատների փոխազդեցությամբ թթուների հալոգենանհիդրիդների և անհիդրիդների հետ պիրիդինի միջավայրում:
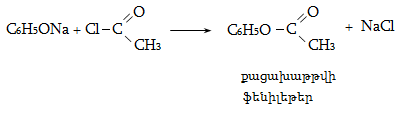
Ֆենոլների ացիլեթերներն ալյումինի քլորիդի ազդեցությամբ փոխարկվում են արոմատիկ օքսիկետոնների (Ֆրիսի ռեակցիա).
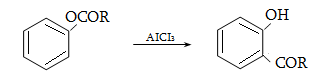
Հիդրօքսիլ
խմբում տեղակալիչ
ունեցող ֆենոլների
նմանատիպ վերախմբավորումները
(Ֆրիս, Կլայզեն)
բացատրվում են
օ- և պ-դիրքերում
![]() կոմպլեքս
առաջացնելու` դրանց
հակումով: Հայտնի
է, որ դեյտերիումը
հեշտությամբ անցնում
է բենզոլային օղակի
օ- և պ-դիրքեր.
կոմպլեքս
առաջացնելու` դրանց
հակումով: Հայտնի
է, որ դեյտերիումը
հեշտությամբ անցնում
է բենզոլային օղակի
օ- և պ-դիրքեր.
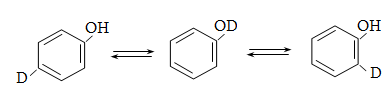
23.4.5. Հիդրօքսիլ խումբը դժվար է տեղակալվում հալոգենով: Ֆոսֆորի տրիքլորիդի հետ փոխազդեցության արդյունքում առաջանում են ֆոսֆորային թթվի եթերներ.
![]()
Հիդրօքսիլ
խմբի տեղակալումը
հալոգենով կատարվում
է միայն, երբ օ- և
պ-դիրքերում առկա
են ուժեղ էլեկտրոնակցեպտոր
խմբեր: Բացասական
լիցքի բաշխման
հետևանքով միջանկյալ
![]() կոմպլեքսը
կայուն է.
կոմպլեքսը
կայուն է.
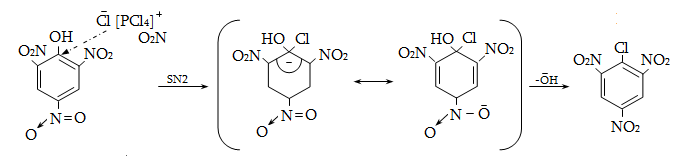
23.4.6. Ցինկի փոշու հետ թորման ժամանակ հիդրօքսիլ խումբը տեղակալվում է ջրածնով.
![]()
Այս եղանակը կիրառվում է բարդ ֆենոլների կառուցվածքը պարզաբանելու համար:
23.4.7. Էլեկտրոֆիլ տեղակալման ռեակցիաներում ֆենոլները` շնորհիվ հիդրօքսիլ խմբի, արագ են փոխազդում էլեկտրոֆիլ ռեագենտների հետ: Ֆենոլները և դրանց պարզ եթերներն այնքան ռեակցիոնունակ են SE ռեակցիաներում, որ դրանց հալոգենացման համար կատալիզատորի անհրաժեշտություն չի զգացվում: Ընտրելով ռեակցիայի պայմանները` կարելի է բենզոլի օղակ ներմուծել մեկ, երկու կամ երեք հալոգենի ատոմ.
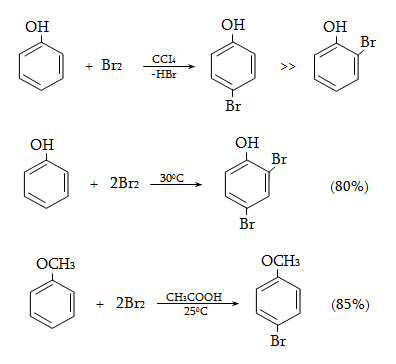
Ֆենոլը բրոմաջրով միանգամից առաջացնում է 2,4,6-տրիբրոմֆենոլ
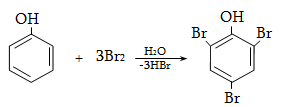
Բրոմաջրի ավելցուկի դեպքում բրոմացումը շարունակվում է, առաջանում է 2,4,4,6-տետրաբրոմցիկլոհեքսադիենոն:
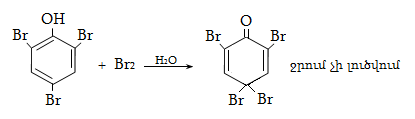
23.4.8. Նոսր ազոտական թթվով մշակելիս սովորական պայմաններում ֆենոլը փոխարկվում է օ- և պ-նիտրոֆենոլների.
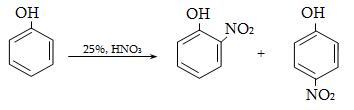
Իզոմերները շատ հեշտությամբ բաժանվում են. օ-իզոմերը առաջացնում է ներմոլեկուլային ջրածնական կապեր, թորվում է ջրային գոլորշիներով (ցնդող է), իսկ պ-իզոմերը ջրի հետ և ինքն իր հետ առաջացնում է միջմոլեկուլային ջրածնական կապեր և դժվարաեռ է.
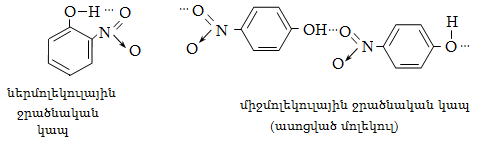
Նիտրոֆենոլների հետագա նիտրացումը խիտ ազոտական թթվով բերում է տրինիտրոֆենոլի (պիկրինաթթու): Օքսիդացումից խուսափելու համար ռեակցիան տարվում է մեղմ պայմաններում.
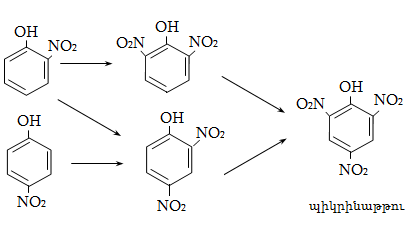
23.4.9. Ֆենոլը սուլֆուրանում է խիտ ծծմբական թթվով սենյակային ջերմաստիճանում` առաջացնելով մոտավորապես հավասար քանակներով օ- և պ-իզոմերներ.
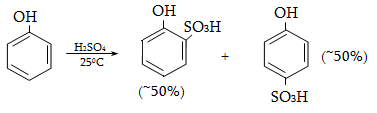
Բարձր ջերմաստիճանում (100°C) գերակշռում է պ-իզոմերը.
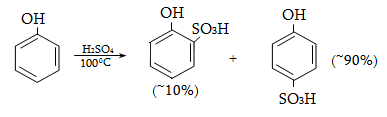
23.4.10. ֆենոլների ացիլումն ըստ Ֆրիդել-Կրաֆտսի հնարավոր չէ, քանի որ դրանք փոխազդում են ալյումինի քլորիդի հետ.
Բարդությունից խուսափելու համար ացիլվում են մեթօքսիֆենոլները հետևյալ սխեմայով.

Մեթօքսի խումբը փոխարկվում է օքսի խմբի` յոդաջրածնական թթվով ազդելիս.
![]()
Ֆրիդել-Կրաֆտսի ացիլման ռեակցիայով կարելի է ստանալ կարևորագույն միացություն՝ ֆենոլֆտալեին, որը կիրառվում է բժշկության մեջ, և որպես թթվահիմնային ինդիկատոր.
Ֆենոլֆտալեինն անգույն միացություն է, սակայն միջավայրի pH-ից կախված` գունավորվում է: Հիմնային լուծույթներում (pH>9) առաջանում է վառ կարմիր գույնի դիանիոն, իսկ pH < 8,5-ում դիանիոնը պրոտոնանում է` փոխարկվելով անգույն ձևի.
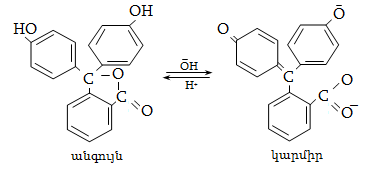
23.4.11. Ֆենոլները, մանավանդ ֆենօքսիդ իոնը, դիազոաղերի հետ տալիս են ազոհամակցում.
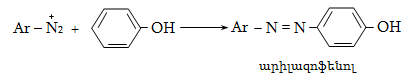
23.4.12. Ֆենօքսիդ իոնը փոխազդում է թույլ էլեկտրոֆիլ ածխածնի դիօքսիդի հետ` առաջացնելով կարբոնաթթվի աղ (Կոլբե-Շմիդտի ռեակցիա).
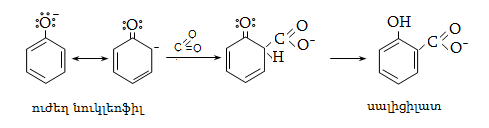
23.4.13. Ֆենոլի բենզոլային օղակ (հիմնականում օրթո դիրք) ալդեհիդային խումբ է ներմուծվում Ռեյմեր-Թիմանի ռեակցիայով.
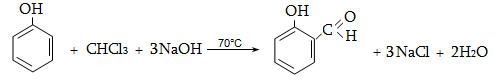
Քլորոֆորմի
և ալկալու փոխազդեցությամբ
![]() պոկման
արդյունքում առաջանում
է էլեկտրոֆիլ դիքլորկարբեն,
որը փոխազդում
է ֆենոլյատի
հետ: Առաջացած
դիհալոգենիդի
հիդրոլիզով ստացվում
է ալդեհիդ.
պոկման
արդյունքում առաջանում
է էլեկտրոֆիլ դիքլորկարբեն,
որը փոխազդում
է ֆենոլյատի
հետ: Առաջացած
դիհալոգենիդի
հիդրոլիզով ստացվում
է ալդեհիդ.
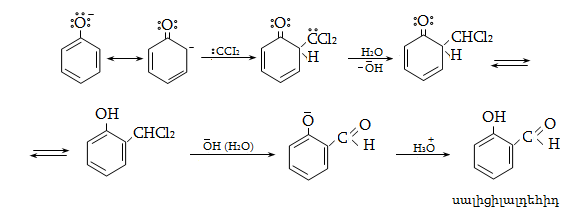
23.4.14. Հիդրօքսիլ խմբի մուտքը բենզոլային օղակ վերջինիս խոցելի է դարձնում օքսիդիչների նկատմամբ, որոնց բնույթից և ռեակցիայի միջավայրից կախված` ստացվում են տարբեր նյութեր: Ջրածնի պերօքսիդով երկաթի կատալիզատորի ներկայությամբ ստացվում է պիրոկատեխին.
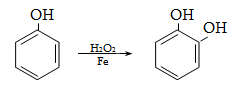
Քրոմային խառնուրդով (H2SO4, K2Cr2O7) ստացվում են պ-բենզոխինոն և հետագա օքսիդացման արգասիքներ.
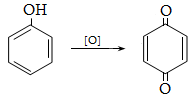
Ֆենոլն օդում մնալուց գունավորվում է, որը բացատրվում է խինոնի գոյացումով:
23.4.15. Ֆենոլները ջրածնով կատալիզատորների ներկայությամբ վերականգնվում են` առաջացնելով ցիկլոհեքսանի շարքի սպիրտներ.
23.4.16. Ֆենոլները հեշտությամբ կոնդենսանում են ալիֆատիկ ալդեհիդների հետ օրթո կամ պարա դիրքերում, թթվային կամ հիմնային կատալիզատորների ներկայությամբ: Այս ռեակցիան կարևորագույն բակելիտային պլաստիկ նյութերի և լաքերի ստացման հիմքն է.
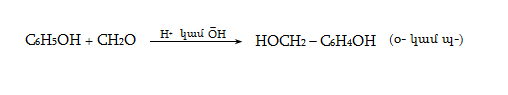
Սովորական ջերմաստիճանում ստացվում է գծային պոլիմեր.
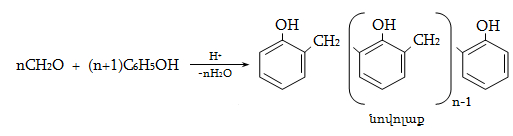
Բարձր
ջերմաստիճանում
ստացվում է ճյուղավորված
պոլիմեր:
Արոմատիկ ալդեհիդների
հետ կոնդենսացման
ռեակցիայով ստացվում
են տրիֆենիլմեթանի
շարքի կարևոր ներկանյութեր.
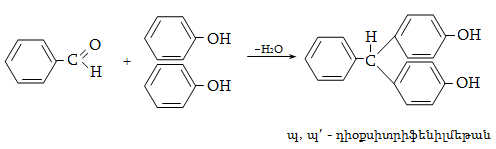
Կենսաբանական կարևորություն ներկայացնող մի շարք ֆենոլներ պարունակում են մեկից ավելի հիդրօքսիլ խումբ
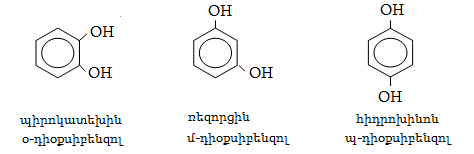
Եռատոմ ֆենոլներ.
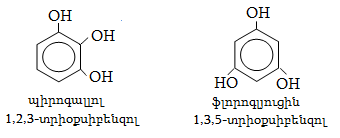
Բազմատոմ ֆենոլները հիմնականում գտնվում են բույսերում, հազվադեպ` կենդանի օրգանիզմներում:
Պիրոկատեխին ստացվում է պրոտոկատեխաթթվի (3,4-դիօքսի-բենզոյական թթու) դեկարբօքսիլացումով, ինչպես նաև օ-դիքլորբենզոլի հիդրոլիզով գերտաք գոլորշով սիլիկագել-պղնձի աղ կատալիզատորի վրա.
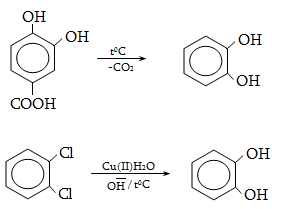
Պիրոկատեխինն ուժեղ վերականգնիչ է. g+ կատալիզատորի ներկայությամբ հեշտությամբ օքսիդանում է .

Պիրոկատեխինի ալկիլ խումբ ունեցող ածանցյալները (R-ը C15-ից բարձր հագեցած կամ չհագեցած խմբեր) կոչվում են «ուրուշիոլներ», որոնք ակտիվ ալերգեններ են, մաշկի վրա ազդում են ինչպես թունավոր բաղեղը կամ կաղնին:
Պիրոկատեխինի մոնոմեթիլեթերը (գվայակոլ) գտնվում է հաճարենու խեժում, ունի դեղագործական նշանակություն և ստացվում է օ-անիզիդինից:
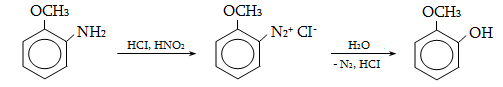
Գվայակոլի և մեթիլֆորմանիլիդի փոխազդեցությամբ ֆոսֆորի քլորօքսիդի ներկայությամբ (Վիլսմայեր) ստացվում է վանիլին հոտավետ նյութը, որն օգտագործվում է սննդարդյունաբերության մեջ:
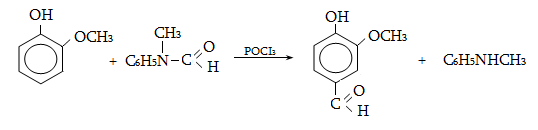
Մեխակի հոտով էվգենոլը (4-ալիլ-2-մեթօքսիֆենոլ) կառուցվածքով նման է վանիլինին: Այդ նմանությունն ապացուցվել է հետևյալ ռեակցիաների հաջորդականությամբ.
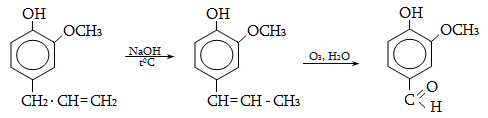
Պիրոկատեխինի որոշ ածանցյալներ կիրառվում են օծանելիքի արտադրության մեջ: Պիրոկատեխինի դիմեթիլեթերը (վերատրոլ) նույնպես հոտավետ է, ստացվում է հետևյալ ռեակցիայով.
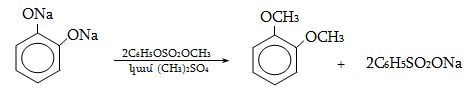
Վերատրոլ առաջանում է բնական միացությունների` ալկալոիդների քայքայման գործընթացում, իսկ արհեստական ստացման եղանակը վերատրաթթվի դեկարբօքսիլացումն է.
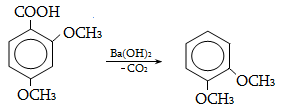
Ռեզորցին ստացվում է նատրիումի բենզոլդիսուլֆոնատի և ալկալու միահալումով.
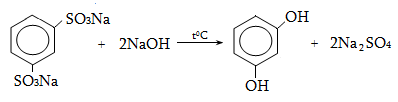
Օ- և պ-բենզոլդիսուլֆաթթուները, ինչպես նաև օ- և պ-քլորբենզոլսուլֆաթթուներն ալկալու հետ միահալումով փոխարկվում են միևնույն դիօքսիբենզոլի` ռեզորցինի: Հնարավոր է, որ սկզբում հիմքի ազդեցությամբ կատարվում է NaHSO3-ի պոկում` դեհիդրոբենզոլի առաջացում, ապա` ալկալու միացում.
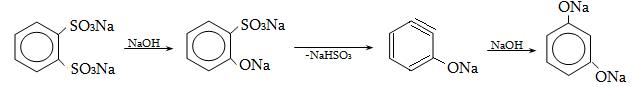
Ռեզորցինն իր իզոմերներից ավելի կայուն է, դժվար է օքսիդանում, ավելի ուժեղ թթու է, քան ֆենոլը: Ջրածնով անջատման պահին (Na/Hg,H2O) վերականգնվում է` առաջացնելով դիհիդրոռեզորցին (1,3-ցիկլոհեքսան-դիոն).
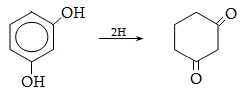
Ռեզորցինն ավելի հեշտ է ընդունում էլեկտրոֆիլ ռեագենտի գրոհը, քան ֆենոլը, որը բացատրվում է OH խմբերի համաձայնեցված կողմնորոշումով: Հալոգենացումը, սուլֆուրացումը, նիտրոզացումը, ազոհամակցումը ռեզորցինի օղակում կատարվում է ավելի մեղմ պայմաններում: Նիտրացման արդյունքում առաջանում է տրինիտրոռեզորցին (ստիֆնինաթթու):
Նատրիումի հիդրոկարբոնատի ջրային լուծույթում տաքացնելիս ռեզորցինը կարբօքսիլանում է` առաջացնելով ռեզորցիլաթթու.
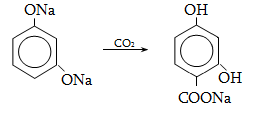
Ռեզորցիլալդեհիդ առաջանում է Ռեյմեր-Թիմանի ռեակցիայով, ինչպես նաև կապտաթթվի և քլորաջրածնի ազդեցությամբ ռեզորցինի վրա (Գատերման-Կոխի ռեակցիայի տարբերակ)
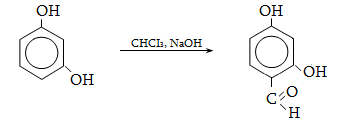
Այս ռեակցիայի մանրամասն նկարագրությունը տես «Արոմատիկ ալդեհիդներ» բաժնում: Գատերման-Կոխի ռեակցիայում ածխածնի օքսիդի փոխարեն օգտագործվում է կապտաթթու, իսկ ալյումինի քլորիդի փոխարեն` ցինկի քլորիդ:
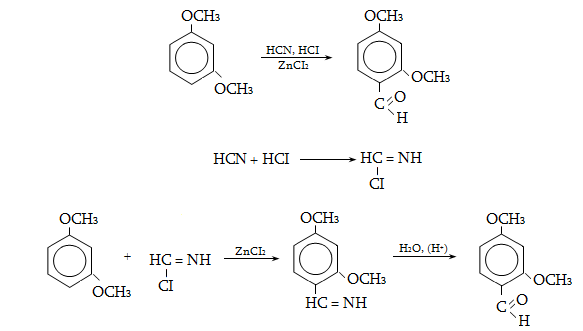
Հիդրոխինոն կարելի է ստանալ պ-բենզոխինոնի վերականգնումով կամ անիլինի օքսիդացումով քրոմաթթվով թթվային միջավայրում.
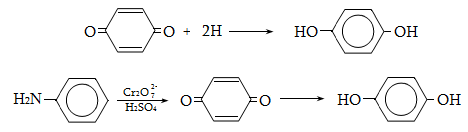
Ինչպես պիրոկատեխինը, հիդրոխինոնը ևս ուժեղ վերականգնիչ է:
Կիրառվում են լուսանկարչության մեջ որպես երևակիչ` վերականգնում են արծաթի բրոմիդը: Հիդրոխինոնը հակաօքսիդիչ է և պոլիմերացման կանխարգելիչ:
Պիրոգալլոլ ստացվում է գալլաթթվի դեկարբօքսիլացումով.
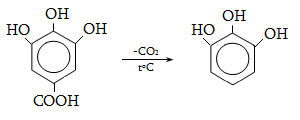
Ծառերի վրա միջատների ազդեցությամբ առաջացող ուռուցքները` գալլերը, պարունակում են գրեթե 50% տանին: Տանինները գունավոր են և ունեն սոսնձող հատկություն: Դրանցով է պայմանավորված թեյի, ընկույզի գույնը: Կիրառվում են կաշվի դաբաղման համար: Տանինի հիդրոլիզով ստացվում է գալլաթթու (3,4,5-տրիօքսիբենզոյական թթու): Պիրոգալլոլը հիմնային միջավայրում հեշտ է օքսիդանում, նույնիսկ օդի թթվածնով: Այսպիսի լուծույթներն օգտագործվում են թթվածնի կլանման համար:
Ֆլորոգլյուցին ստացվում է սիմետրիկ տրիամինոբենզոլի հիդրոլիզով.
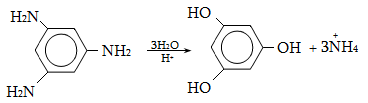
Կարելի է ստանալ նաև Ռեյմեր-Թիմանի ռեակցիայով:
25. ԽԻՆՈՆՆԵՐ
Խինոնները լայն արտադրական կիրառություն ունեն ներկանյութերի և լուսանկարչության բնագավառում, ինչպես նաև կենսաբանության մեջ:

Օ-խինոններն ունեն բարձր ռեակցիոնունակություն և դժվար են ստացվում:
25.1. Ստացման եղանակներ
25.1.1. Խինոնների ստացման հարմար եղանակ է համապատասխան ֆենոլների կամ ամինների օքսիդացումը.
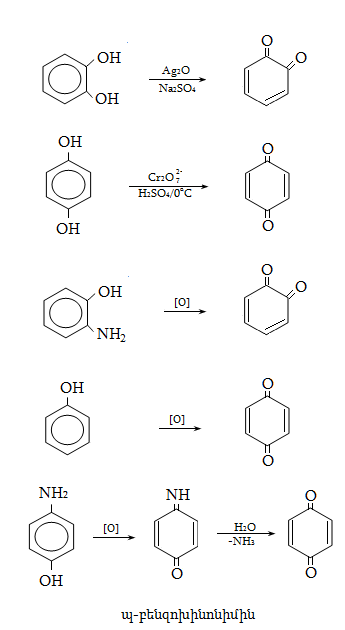
Անիլինից պ-բենզոխինոնի ստացման ռեակցիան ներառում է հետևյալ միջանկյալ փուլերը. առաջացած ֆենիլհիդրօքսիլամինի վերախմբավորում պ-ամինոֆենոլի և վերջինիս օքսիդացում մոնոխինոնիմինի, որը հիդրոլիզվում է` առաջացնելով խինոն.
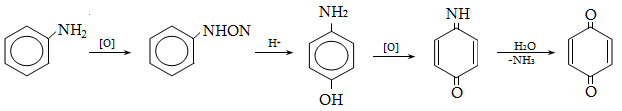
25.1.2. 1,2-դիկետոնների կոնդենսացում հիմնային միջավայրում: Ստացվում են 2,5-դիալկիլբենզոխինոնններ.
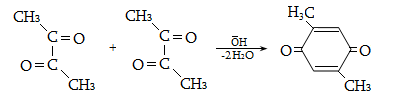
25.1.3. Երկաթի պենտակարբոնիլի և դիմեթիլացետիլենի փոխազդեցությամբ ստացվում է դուրոխինոնի կոմպլեքս, որը թթվով քայքայվում է դուրոխինոնի.
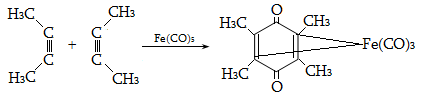
25.1.4 Բենզոլի ածանցյալների վրա (մասնավորապես անիլինի) արքայաջրով ազդելով` ստացվում է տետրաքլոր-պ-բենզոխինոն (քլորանիլ).
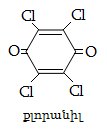
25.2. Քիմիական հատկություններ
Խինոնները սուր հոտով, հեշտ ցնդող (սուբլիմացվող) գունավոր (պ-խինոնը` դեղին, օ-խինոնը` կարմիր) նյութեր են: Ռեակցիոնունակ են և նման են չհագեցած կետոնների:
Խինոնների վերականգնումը տեղի է ունենում բենզոիդային կառուցվածքով կայուն ռադիկալանիոնի գոյացումով, որը կոչվում է սեմիխինոն: Սեմիխինոնում էլեկտրոնները երկու թթվածնի ատոմների վրա բաշխվում են այնպես, որ յուրաքանչյուր թթվածին կրում է բացասական լիցք:
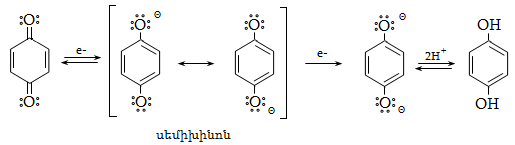
Գործընթացը բարդանում է խինոնի և հիդրոխինոնի միջև 1:1 հարաբերությամբ առաջացող խինհիդրոնի (սև-կանաչավուն) պատճառով.
ՈՒժեղ էլեկտրոնակցեպտոր խմբեր ունեցող խինոնները կիրառվում են որպես լավ օքսիդիչներ, ինչպես 2,3-դիքլոր-5,6-դիցիան-1,4-բենզոխինոնը (ԴԴԽ), որը մեծ կիրառություն ունի ոչ արոմատիկ միացություններից արոմատիկ միացություններ ստանալու համար.
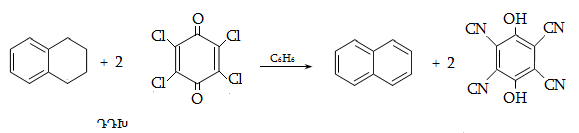
Որպես
![]() չհագեցած
կետոններ, խինոնները
կարող են մտնել
1,2- և 1,4-միացման ռեակցիաների
մեջ: Անօրգանական
և օրգանական թթուների,
սպիրտների, առաջնային
և երկրորդային
ամինների հետ պ-բենզոխինոնը
փոխազդում է 1,4-դիրքերում:
Խինոիդային համակարգը
վերածվում է բենզոիդայինի.
առաջանում է տեղակալված
հիդրոխինոն: Օրինակ,
քլորաջրածնի և
բենզոխինոնի փոխազդեցությամբ
ստացվում է քլորհիդրոխինոն.
չհագեցած
կետոններ, խինոնները
կարող են մտնել
1,2- և 1,4-միացման ռեակցիաների
մեջ: Անօրգանական
և օրգանական թթուների,
սպիրտների, առաջնային
և երկրորդային
ամինների հետ պ-բենզոխինոնը
փոխազդում է 1,4-դիրքերում:
Խինոիդային համակարգը
վերածվում է բենզոիդայինի.
առաջանում է տեղակալված
հիդրոխինոն: Օրինակ,
քլորաջրածնի և
բենզոխինոնի փոխազդեցությամբ
ստացվում է քլորհիդրոխինոն.
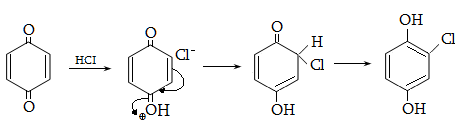
Այս եղանակը կիրառվում է ԴԴԽ-ի ստացման համար.

1,4-միացում է կատարվում նաև քացախաթթվի անհիդրիդի հետ փոխազդեցության արդյունքում.
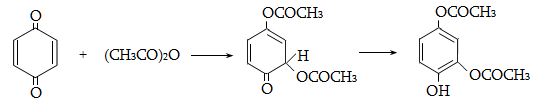
Ստացված միացության հիդրոլիզով առաջանում է 1,2,4-տրիօքսիբենզոլ.
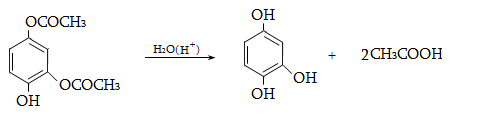
Խինոնի լուծույթն ալդեհիդում լուսավորելիս, հավանաբար, տեղի է ունենում ալդեհիդի հոմոլիտիկ 1,4-միացում.

Միացման ռեակցիաների խթանիչ ուժն այն է, որ խինոիդային խմբավորումը փոխարկվում է առավել կայուն բենզոիդային կառուցվածքի (անջատվում է էներգիա):
Խինոնները փոխազդում են դիենների հետ` առաջացնելով պոլիցիկլային համակարգեր.
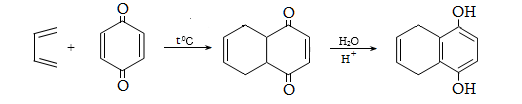
Դիենային սինթեզով կարելի է ստանալ նավթալին.

Խինոնները, որպես կետոն, փոխազդում են 2,4-դինիտրո-ֆենիլհիդրազինի հետ, բայց սպասվելիք հիդրազոնի փոխարեն վերախմբավորման արդյունքում ստացվում է ազոմիացություն:

Պ-բենզոխինոնը հիդրօքսիլամինի հետ առաջացնում է մոնօքսիմ և դիօքսիմ: Մոնօքսիմը տաուտոմեր է նիտրոզոֆենոլին.
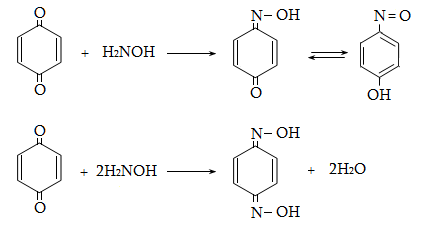
Պ-բենզոխինոնը ճառագայթումով դիմերանում է:
Պերծծմբական թթվով Ag+-ի ներկայությամբ պ-խինոնն օքսիդանում է` առաջացնելով մալեինաթթու: Այս ռեակցիան հաստատում է բենզոխինոնի կառուցվածքը:
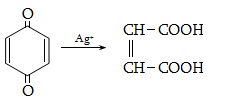
Խնդիրներ
1. Գրել C7H15OH մոլեկուլային բանաձևին համապատասխանող երրորդային սպիրտների կառուցվածքային բանաձևերը և անվանել:
2. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը. 2-մեթիլ-1-բութանոլ, 2,3-դիմեթիլ-2-բութանոլ, 3-բութեն-2-բութանոլ, 2-պրո-պին-1-բութանոլ, 2-մեթիլ-3-բութին-2-բութանոլ, 2-մեթիլ-2,3-բութանդիոլ, 2,3-դիմեթիլ-2,3-պենտանդիոլ:
3. Ծծմբական թթվի ներկայությամբ ո՞ր ածխաջրածինն ավելի հեշտ կենթարկվի հիդրատացման` էթիլեն, պրոպիլեն, բութիլեն, իզոբութիլեն շարքում:
4. Գրինյարի ռեակտիվի օգնությամբ ստանալ հետևյալ սպիրտները. մեթիլպրոպիլկարբինոլ, դիբութիլկարբինոլ, մեթիլէթիլիզոպրոպիլկարբինոլ, երրբութիլկարբինոլ:
5. Լրացնել հետևյալ փոխարկումները.
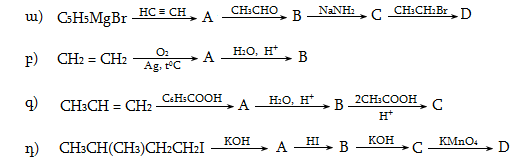
6. Էթիլսպիրտից ստանալ դիէթիլեթեր, էթիլքլորիդ, դիվինիլ, քլորալ:
7. Պարզել C7H16O բաղադրությամբ միացության կառուցվածքը, եթե այն սովորական պայմաններում չի փոխազդում մետաղական նատրիումի հետ, յոդաջրածնի հետ տաքացմամբ առաջանում են C2H5I և C5H11I: Վերջինս խոնավ արծաթի օքսիդով մշակելիս փոխարկվում է իզոպենտիլ-եթերի:
8. Ացետիլենից ստանալ բութիլվինիլեթեր, էթիլենօքսիդ, բութինդիոլ, բութադիեն:
9. Ստանալ 1-պենտանոլ, որպես ելանյութ կիրառելով հետևյալ միացությունները.
10. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.

11. Գրել և անվանել C7H8O բաղադրությամբ իզոմեր ֆենոլների կառուցվածքային բանաձևերը:
12. Լրացնել հետևյալ ռեակցիաները.
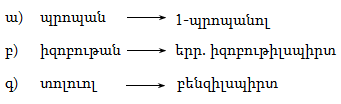
13. Լրացնել հետևյալ փոխարկումները.
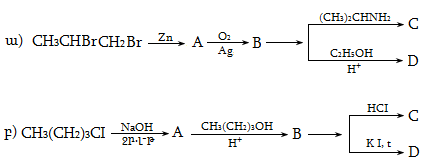
14. Պարզաբանել ռեակցիաների մեխանիզմը.
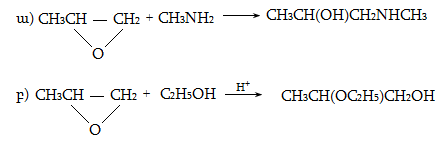
15. Գրինյարի ռեակտիվի օգնությամբ իրականացնել հետևյալ ռեակցիաները, անվանել ստացված միացությունները.
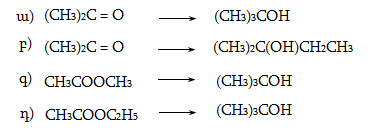
16. Պրոպենից ստանալ գլիցերին, ապա` նիտրոգլիցերին: Նկարագրել պայմանները և մեխանիզմը:
17. Լրացնել հետևյալ փոխարկումները.
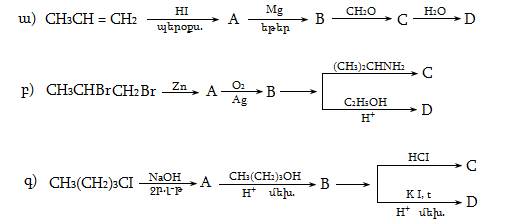
18. Սպիրտները փոխազդում են կարբոնիլային միացության հետ` առաջացնելով մեկ (կիսաացետալ) կամ երկու (ացետալ) ալկօքսի խմբերով միացություններ: Առաջին ռեակցիան կատալիզվում է թթվով և հիմքով, իսկ երկրորդը` միայն թթվով: Գրել ռեակցիաները և բացատրել:
19. Ստանալ 2-ֆենիլէթանոլ հետևյալ ելանյութերից.
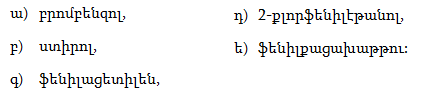
20. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.

21. Բացատրել,
թե ինչու ֆենոլի
դիսոցման հաստատունը
![]() մի քանի
կարգով մեծ է, քան
բենզիլսպիրտի
դիսոցման հաստատունը
մի քանի
կարգով մեծ է, քան
բենզիլսպիրտի
դիսոցման հաստատունը
![]() Քննարկել
ֆենոլում հիդրօքսիլ
խմբի և բենզոլային
օղակի փոխազդեցությունը:
Քննարկել
ֆենոլում հիդրօքսիլ
խմբի և բենզոլային
օղակի փոխազդեցությունը:
22. Գրել ֆենոլի ստացման արտադրական եղանակները, նշել ռեակցիաների պայմանները:

23. Հետևյալ միացություններից ստանալ 1-ֆենիլէթանոլ` օգտագործելով անհրաժեշտ ռեագենտները.
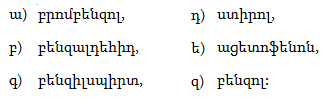
24. Գրել հաջորդական ռեակցիաները, որոնց օգնությամբ 2-պրոպանոլից կստացվեն հետևյալ միացությունները.
25. Իրականացնել հետևյալ փոխարկումները.
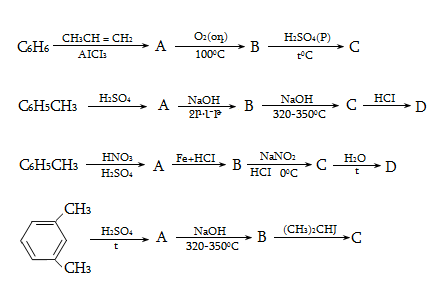
26. Գերազանցապես ո՞ր ալկենը կստացվի հետևյալ սպիրտների դեհիդրատացումով թթվային միջավայրում.
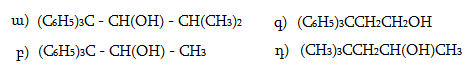
27. Գրել ռեակցիաները և անվանել ստացվող արգասիքները.
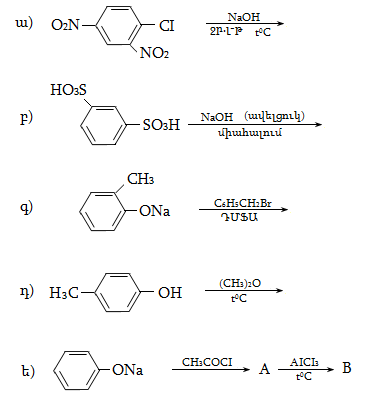
28. Պարզել C8H10O միացության կառուցվածքը, եթե այն FeCl3-ի հետ գունավորվում է, հիմնային միջավայրում դիմեթիլսուլֆատովմեթիլանում է: Ստացված նյութի օքսիդացման արդյունքում գոյանում է պ-մետօքսի-բենզոյական թթու:
29. Լրացնել հետևյալ ռեակցիաները և նշել պայմանները.

30. 1-բութանոլից ստանալ հետևյալ միացությունները` կիրառելով անհրաժեշտ ռեագենտներ.

31. Ի՞նչ միացություններ կստացվեն հետևյալ նյութերը խիտ բրոմաջրածնական թթվի ավելցուկում եռացնելիս.
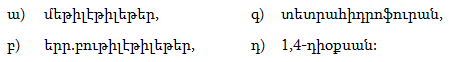
32. Իրականացնել հետևյալ փոխարկումները.

33. Բրոմբենզոլից և 1-բութենից ստանալ 1-ֆենիլ-2-բութանոլ:
34. Հետևյալ միացությունների և էթիլմագնեզիումյոդիդի փոխազդեցության արդյունքում ստացվող միացությունները ենթարկել հիդրոլիզի և անվանել ստացվող սպիրտները:
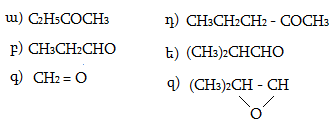
35. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.

36. Անվանել հետևյալ միացությունները IUPAC անվանակարգումով.
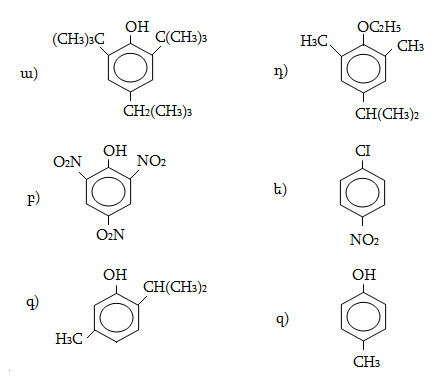
37. Լրացնել հետևյալ փոխարկումները.
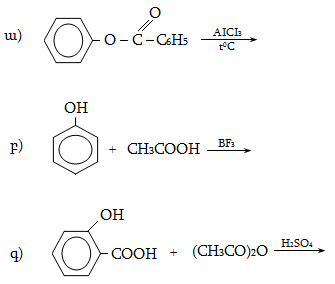
38. Հետևյալ միացությունները դասավորել ըստ թթվայնության աճի.
39. Առաջարկել հետևյալ միացությունների ստացման եղանակներ.

26. ՊԱՐԶ ԵԹԵՐՆԵՐ
Պարզ
եթերները
![]() ընդհանուր
բանաձևով միացություններ
են, բաժանվում
են երեք խմբի, որոնք
իրարից տարբերվում
են կառուցվածքով
և քիմիական հատկություններով.
ընդհանուր
բանաձևով միացություններ
են, բաժանվում
են երեք խմբի, որոնք
իրարից տարբերվում
են կառուցվածքով
և քիմիական հատկություններով.
ա) դիալկիլեթերներ, որոնցում թթվածնի ատոմը կապված է երկու ածխաջրածնային մնացորդի հետ: Երկու միանման տեղակալիչներով եթերները կոչվում են սիմետրիկ, իսկ տարբեր տեղակալիչներով եթերները` խառը,
բ) ալկենների օքսիդներ կամ օքսիրաններ (էպօքսիդներ), որոնցում թթվածնի ատոմը կապում է միևնույն ածխաջրածնային մնացորդի երկու հարևան ածխածինները,
գ) ցիկլային եթերներ, որոնցում ածխաջրածնային շղթայի ծայրային ածխածինները միացված են թթվածնային կամրջակով: Այս շարքին են դասվում նաև մակրոցիկլային պոլիեթերները, օրինակ` կրաուն եթերները:

26.1. Անվանակարգում, իզոմերիա
Եթերները սովորաբար անվանվում են` նշելով ալկիլ խմբերը: IUPAC անվանակարգումով կարդացվում են որպես ալկօքսիալկաններ: Որպես ալկան ընդունվում է առավել երկար ածխածնային շղթայով տեղակալիչը:

26.2 Ֆիզիկական հատկություններ
Դիմեթիլ և մեթիլէթիլեթերները սովորական պայմաններում գազեր են, մնացածները` շարժուն հեղուկներ: Պարզ եթերները ջրածնական կապեր չեն առաջացնում և խմբավորված չեն, այդ պատճառով շատ ավելի դյուրաեռ են, քան սպիրտները: Պարզ եթերները, բացառությամբ ցիկլային և կրաուն եթերների, վատ են լուծվում ջրում:
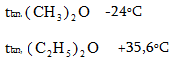
26.3. Կիրառման բնագավառներ, թունավորություն
Եթերներն անտարբեր են քիմիական ռեագենտների նկատմամբ: Այդ պատճառով քիմիական ռեակցիաներում կիրառվում են որպես լուծիչ: Եթերները հիանալի լուծիչներ են յուղերի, խեժերի և շատ օրգանական միացությունների համար: Դրանց վրա սենյակային ջերմաստիճանում չեն ազդում նոսր հանքային թթուները, ալկալիները, ֆոսֆորի պենտաքլորիդը, մետաղական նատրիումը, որը կիրառվում է որպես եթերների չորացուցիչ: Եթերների միջավայրում իրականացվում է մետաղօրգանական միացությունների ստացում: Եթերները կիրառվում են մեծ թվով օրգանական միացություններ այլ լուծիչներից, մասնավորապես ջրից, լուծահանելու (էքստրակտելու) համար: Շնորհիվ բարձր ջերմապարունակության` բարձրաեռ պարզ եթերները քիմիական տեխնոլոգիաներում օգտագործվում են որպես ջերմակիրներ: Որոշ պարզ եթերներ, շնորհիվ իրենց բնորոշ հաճելի հոտի, կիրառվում են օծանելիքի արտադրությունում: Դիէթիլեթերը կիրառում էին բժշկության մեջ որպես թմրեցնող միջոց: Հիմք ընդունելով դիէթիլեթերի ստացման ծծմբաթթվական եղանակը` այն կոչվում է նաև ծծմբական եթեր: Լայն կիրառություն ունեն նաև դիմեթիլ, դիիզոպրոպիլ, դիիզոամիլեթերները:
Դիէթիլեթերը թմրանյութ է, գրգռում է երիկամները, շնչառական ուղիները, առաջացնում է թոքերի բորբոքում, ծանր նյարդային հիվանդություններ (ՍԹԿ` 300 մգ/մ3): Ավելի մեծ քանակներով աշխատելու դեպքում առաջանում է կախվածություն մարդու օրգանիզմի համար:
26.4. Ստացման եղանակներ
26.4.1. Եթերների ստացման հիմնական եղանակները սպիրտների կամ դրանց ալկոհոլատների ալկիլման գործընթացներն են: Կիրառական նշանակություն ունի Վիլյամսոնի սինթեզը (փոխազդեցություն ալ-կոհոլատների և հալոգենալկանների միջև), որն իր բնույթով SN2 ռեակցիա է.
![]()
26.4.2. Սպիրտների միջմոլեկուլային դեհիդրատացումով թթվային կատալիզատորների (խիտ ծծմբական թթու, ֆոսֆորական թթու, ալյումինի օքսիդ) ներկայությամբ առաջանում են պարզ եթերներ: Կախված սպիրտի կառուցվածքից և ռեակցիայի իրականացման պայմաններից` դեհիդրատացումը կարող է կատարվել SN1 կամ SN2 մեխանիզմներով (տես «Սպիրտներ»).
![]()
26.4.3. Նուրբ օրգանական սինթեզում և լաբորատոր աշխատանքներում եթերներ ստացվում են սպիրտների և ալկենների փոխազդեցությամբ սնդիկի ացետատի և նատրիումի բորհիդրիդի ներկայությամբ (ալկօքսիմերկուրացում - դեմերկուրացում).
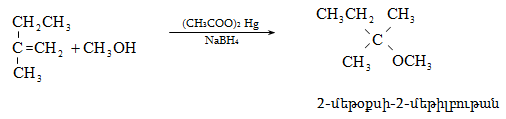
26.5. Քիմիական հատկություններ
Պարզ եթերներում առկա են ռեակցիոն կենտրոններ` պայմանավորված ածխածին-ջրածին և ածխածին-թթվածին կապերով, նաև թթվածնի ատոմի էլեկտրոնային զույգով:
26.5.1. Եթերները խիստ զգայուն են ուժեղ օքիդիչների, օդի թթվածնի նկատմամբ. առաջանում են հիդրոպերօքսիդներ, որոնք պայթյունավտանգ են.
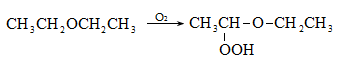
Այդ պատճառով նախքան թորելը, եթերները պետք է մաքրել պերօքսիդներից` մշակելով ջրով, ալկալու կամ երկաթի սուլֆատի լուծույթներով:
26.5.2. Պարզ եթերները հեշտությամբ փոխազդում են անօրգանական թթուների հետ` առաջացնելով օքսոնիումային աղեր.
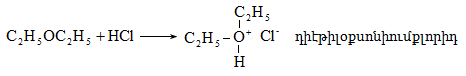
Նմանօրինակ փոխազդեցություն իրականանում է Լյուիսի թթուների հետ: Առաջանում են կոմպլեքսներ`եթերատներ.
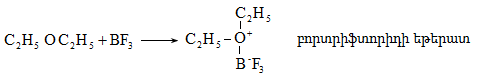
Պարզ արոմատիկ եթերները դժվար են ենթարկվում վերը նկարագրած գործընթացին, քանի որ արոմատիկ օղակի էլեկտրոնային ամպը մտնում է զուգորդման մեջ թթվածնի էլեկտրոնային զույգի հետ, հետևաբար, թուլանում է կոմպլեքսագոյացման հատկությունը:
26.5.3. Ռեակցիաներ ածխածինթթվածին կապի ճեղքմամբ
Թթուների և հիմքերի ազդեցությամբ կատարվում է եթերների ճեղքում, որին նախորդում է օքսոնիում իոնի առաջացումը.
26.5.3.1. Խիտ HBr կամ H I.
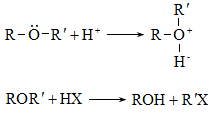
Կախված ալկիլ խմբի բնույթից` պրոտոնացված եթերի փոխազդեցությունը հալոգեն իոնի հետ կարող է կատարվել SN1 (R-ը II կամ III ալկիլ է) կամ SN2 մեխանիզմով (R-ը I ալկիլ է).
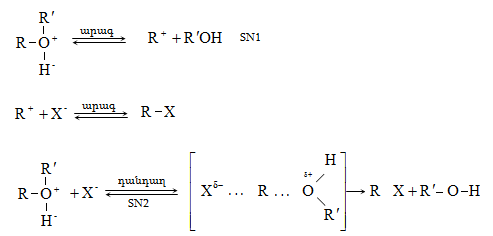
26.5.3.2. Թթվի անհիդրիդի կամ հալոգենանհիդրիդի ազդեցությամբ (Լյուիսի թթվի ներկայություն) պարզ եթերը ճեղքվում է` առաջացնելով բարդ եթեր և հալոգենալկան.
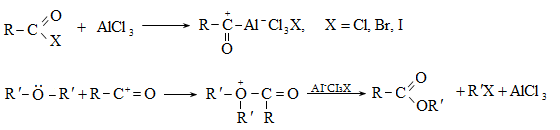
26.5.3.3. Պինդ հիմքերը չեն քայքայում եթերը նույնիսկ տաքացնելիս, իսկ մետաղական նատրիումը տաքացման պայմաններում ճեղքում է պարզ եթերները.
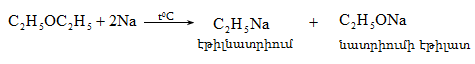
27. ՄԱԿՐՈՑԻԿԼԱՅԻՆ ՊԱՐԶ ԵԹԵՐՆԵՐ (ԿՐԱՈՒՆ ԵԹԵՐՆԵՐ)
Վալինոմիցին հակամանրէի հայտնագործումը (Գ. Բրոկման 1955թ.) և դրա կառուցվածքի վերծանումը խթանեցին մակրոցիկլային ակտիվ թաղանթներով կոմպլեքսների կամ իոնոֆորների հետազոտությունները: Այս միացությունները լուծույթներում կատիոնների հետ առաջացնում են կոմպլեքսներ և կապված կատիոնը փոխանցում կենսաբանական թաղանթի (մեմբրան) միջով: Որպես նմանատիպ թաղանթաակտիվ կոմպլեքսներ կարող են ծառայել ավելի պարզ մակրոցիկլեր, որոնք ցիկլում ունեն ազատ էլեկտրոնային զույգով ատոմներ (O, N, S, P,...): Կրաուն եթերները դիտարկվում են որպես բազմանդամ ցիկլային եթերներ: Այսպես, չորս թթվածնի ատոմ ունեցող տասներկուանդամ ցիկլը կարդացվում է 12-կրաուն-4:
Մակրոցիկլային և բիցիկլային պարզ եթերները, որոնք կամրջակի գլխիկներում ունեն ազոտի ատոմներ, կոչվում են կրիպտանդներ:
Նշված միացությունների առանձնահատկությունն այն է, որ դրանք առաջացնում են կոմպլեքսներ` ներքաշելով կամ կապելով փոքր մոլեկուլներ (CO, CO2, O2), ինչպես նաև կատիոններ (K+, Na+, Fe2+, Fe3+, Mg2+, Ca2+,...): Ընտրողականությունն այս կամ այն կատիոնի նկատմամբ և առաջացող կոմպլեքսի կայունությունը պայմանավորված են բազմաթիվ գործոններով` մակրոցիկլի խոռոչի և կատիոնի հարաբերական չափերով, կատիոնների լիցքերով և տեսակով, կապվելու տեղի բնույթով, դոնորային ատոմների տեսակով, տեղակալիչների և լուծիչի բնույթով:
Օրինակ, 18-կրաուն-6 մակրոցիկլն ամուր կոմպլեքս է առաջացնում K+ և Ba2+ իոնների հետ, որոնց շառավիղների չափերը համապատասխանում են մակրոցիկլի ներմոլեկուլային խոռոչին:
Մակրոցիկլերի կոմպլեքսագոյացումը կատիոնների հետ և փոքր չեզոք մոլեկուլների ներքաշումը ցիկլ բերում է գերմոլեկուլների առաջացման:
Կրաուն եթերների ստացման եղանակներից է Չ. Պեդերսենի մշակած հետևյալ ռեակցիան.
Կրաուն եթերների կիրառման բնագավառները բազմազան են.
1. Ալկալիական և հողալկալիական մետաղների բաժանում:
2. Սորբման և քրոմատոգրաֆիական անալիզի եղանակներ:
3. Կիրառություն իոնաընտրողական էլեկտրոդներում:
4. Դժվարալուծ աղերի լուծելիության մեծացում ոչ բևեռային օրգանական լուծիչներում և ռեագենտների ռեակցիոնունակության մեծացում:
5. Կենսաքիմիական գործընթացների կարգավորում:
6. Արդյունավետ դեղամիջոցների ստացում (օրգանիզմից ռադիոակտիվ իզոտոպների հեռացում):
7. Հոսքաջրերի վնասազերծում և մաքրում:
Կրաուն եթերները կիրառվում են նաև օրգանական սինթեզում: Կալիումի պերմանգանատը դիցիկլոհեքսան-18-կրաուն-6-ի ներկայությամբ լուծվում է բենզոլում` առաջացնելով հետևյալ բաղադրության աղը.
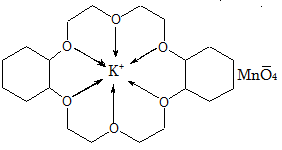
Այս լուծույթը կոչվում է ծիրանագույն բենզոլ, կիրառվում է բենզոլում լուծելի օրգանական միացությունների օքսիդացման համար:
28. ԷՊՕՔՍԻԴԱՅԻՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
Օրգանական
օքսիդները կարելի
է դիտարկել որպես
![]() գլիկոլների
դեհիդրատացման
արգասիքներ.
գլիկոլների
դեհիդրատացման
արգասիքներ.
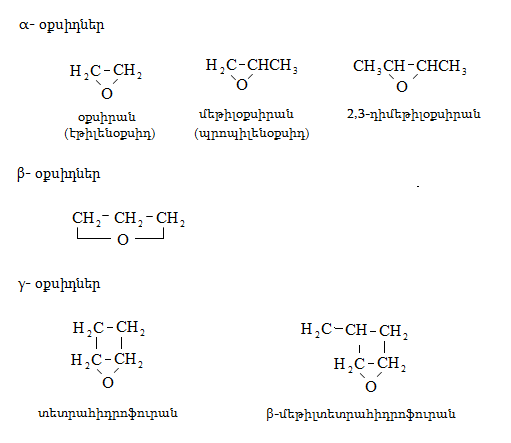
![]()
Էպօքսիդներն
![]() օքսիդներ
են: Կարևորագույն
ներկայացուցիչ
է էթիլենօքսիդը,
որը չափազանց թունավոր,
ջրում լավ լուծվող,
անգույն գազ է
օքսիդներ
են: Կարևորագույն
ներկայացուցիչ
է էթիլենօքսիդը,
որը չափազանց թունավոր,
ջրում լավ լուծվող,
անգույն գազ է
![]() խտությունը`
խտությունը`![]()
28.1. Ստացման եղանակներ
28.1.1. Ալկենների ուղղակի օքսիդացում օդի թթվածնով կատալիզատորի ներկայությամբ կամ պերթթուներով (Պրիլեժաևի ռեակցիա).
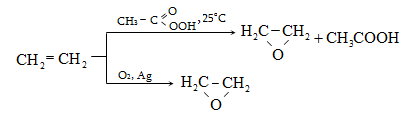
28.1.2. Հալոգենհիդրինների դեհիդրոհալոգենացում.
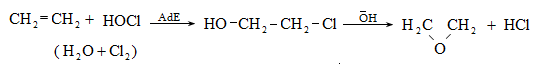
Ռեակցիայի առաջին փուլում առաջանում է ալկոհոլատ իոն, որը լինելով ուժեղ նուկլեոֆիլ` դուրս է մղում քլորին.
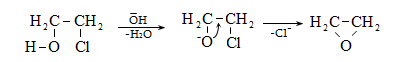
28.2. Քիմիական հատկություններ
Էթիլենօքսիդը չափազանց ռեակցիոնունակ միացություն է, ունի լայն արտադրական կիրառություն:
28.2.1. Ռեակցիաներն իրականանում են ցիկլի հետերոլիտիկ խզումով: Ցիկլի բացումը կատարվում է նուկլեոֆիլի ուղղակի գրոհով ածխածնի ատոմի վրա.
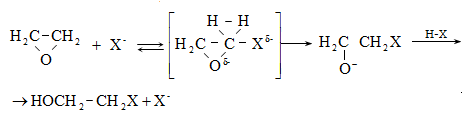
Իրականում
այսպիսի գործընթաց
կարող է տեղի ունենալ
միայն պրոտոնային
նյութերի բացակայության
և ![]() ռեագենտի
բարձր նուկլեոֆիլության
դեպքում: Օրինակ,
ռեակցիան ամինների
հետ առանց կատալիզատորի
(SN2).
ռեագենտի
բարձր նուկլեոֆիլության
դեպքում: Օրինակ,
ռեակցիան ամինների
հետ առանց կատալիզատորի
(SN2).
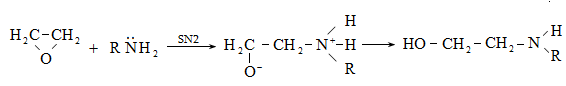
Էթիլենօքսիդը ելանյութ է բազմաթիվ օրգանական միացությունների ստացման համար.
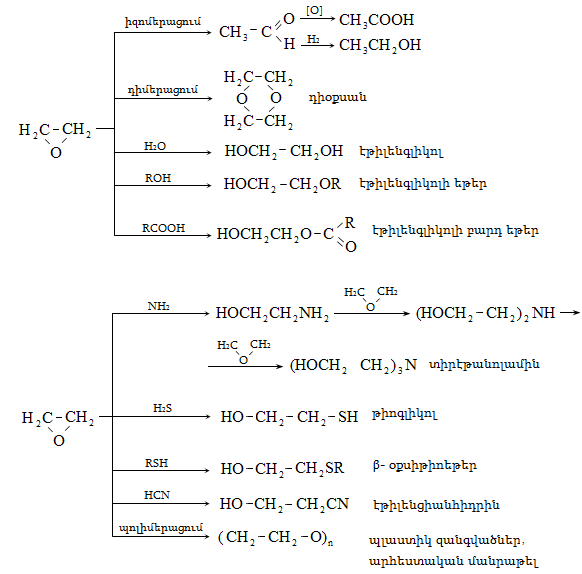
Ի տարբերություն պարզ եթերների` էպօքսիդները մտնում են նուկլեոֆիլ տեղակալման ռեակցիաների մեջ թթվային միջավայրում SN1 և SN2, իսկ չեզոք և հիմնային միջավայրում` SN2 մեխանիզմով: Ստերեոքիմիական ուղղվածությունը բացատրում է մեխանիզմը: Ստերեոյուրահատկության բացակայությունը ցույց է տալիս միջանկյալ կարբկատիոնի առաջացումը (SN1 մեխանիզմ), իսկ ուրվանկարի շրջադարձը` ցիկլային օքսոնիում իոնի մասնակցությունը ռեակցիային (SN2 մեխանիզմ).
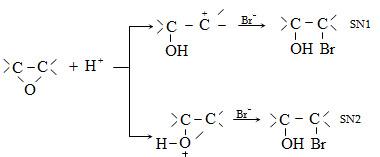
Ռեակցիային
նպաստում է թթվածնի
ատոմի նախնական
էլեկտրոֆիլ սոլվատացումը,
որը բնորոշ է թթվային
հատկություններով
օժտված նյութերին
(H2O, ROH, H2S, HCN, RCOOH), որոնց
զուգորդված հիմքերը
![]() լինելով
ուժեղ նուկլեոֆիլ`
կատարում են նուկլեոֆիլ
կատալիզատորի
դեր.
լինելով
ուժեղ նուկլեոֆիլ`
կատարում են նուկլեոֆիլ
կատալիզատորի
դեր.
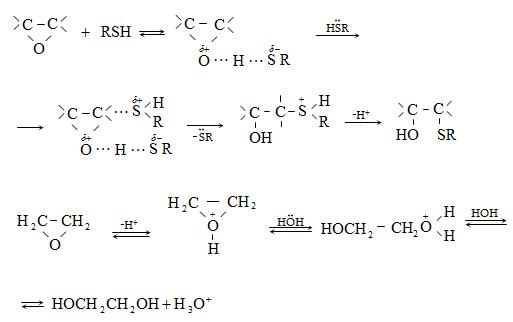
Օղակի բացման մեխանիզմը (SN1 և SN2) կախված է օղակի ածխածիններին կից տեղակալիչների բնույթից.
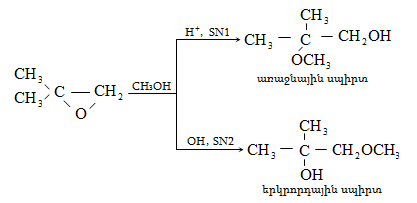
SN1 մեխանիզմ
SN2 մեխանիզմ
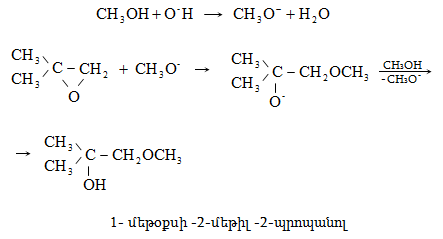
28.2.2. Էպօքսիդների վերականգնում և թթվածնի պոկում
Լիթիումալյումինհիդրիդի
![]() ազդեցությամբ
էպօքսիդները վերականգնվում
են սպիրտների`
առաջացնելով առավել
ճյուղավորված
իզոմերը: Սա բացատրվում
է հիդրիդ իոնի
գրոհով օղակի պակաս
էկրանացված ածխածնի
ատոմի վրա (SN2).
ազդեցությամբ
էպօքսիդները վերականգնվում
են սպիրտների`
առաջացնելով առավել
ճյուղավորված
իզոմերը: Սա բացատրվում
է հիդրիդ իոնի
գրոհով օղակի պակաս
էկրանացված ածխածնի
ատոմի վրա (SN2).
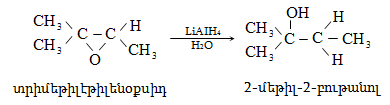
Էպօքսիդները ֆոսֆինների ազդեցությամբ փոխարկվում են ալկենների (SN2), թթվածնի ատոմի պոկումով`
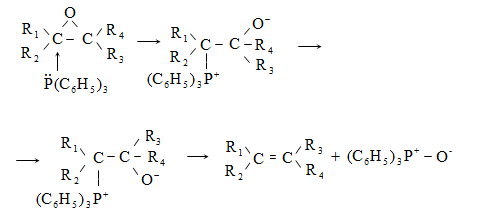
Այս ռեակցիան կիրառվում է E և Z իզոմերների փոխադարձ փոխարկման համար.
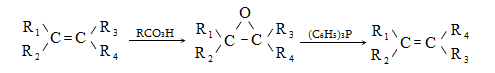
Էպօքսիդները
կիրառվում են որպես
մոնոմերներ, պոլիմերանում
են անիոնային շղթայական
մեխանիզմով: Պոլիմերացումը
կատալիզվում է
հիմքերով (ալկօքսիդ
իոններով ![]() ): Միացման
յուրաքանչյուր
փուլում առաջանում
է ալկօքսիդային
կենտրոն, որը ռեակցում
է հաջորդ մոնոմերի
մոլեկուլի հետ
ի հաշիվ ցիկլի
նուկլեոֆիլ բացման.
): Միացման
յուրաքանչյուր
փուլում առաջանում
է ալկօքսիդային
կենտրոն, որը ռեակցում
է հաջորդ մոնոմերի
մոլեկուլի հետ
ի հաշիվ ցիկլի
նուկլեոֆիլ բացման.
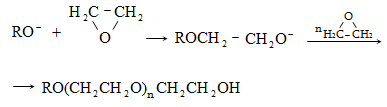
29. ԹԻՈՍՊԻՐՏՆԵՐ (ԹԻՈԼՆԵՐ)
![]() Թիոսպիրտների ընդհանուր
բանաձևն է RSH, որտեղ
SH խումբը կոչվում
է թիո կամ մերկապտան:
Թիոսպիրտների ընդհանուր
բանաձևն է RSH, որտեղ
SH խումբը կոչվում
է թիո կամ մերկապտան:
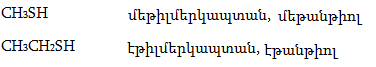
Թիոսպիրտները հեղուկ կամ պինդ նյութեր են, բացառությամբ մեթանթիոլի: Թիոլների եռման ջերմաստիճանները համապատասխան սպիրտների եռման ջերմաստիճաններից ավելի ցածր են, որը բացատրվում է ծծմբի ատոմի ցածր էլեկտրաբացասականությամբ: Թիոլներն ավելի դժվար են լուծվում ջրում, քան սպիրտները, թունավոր են և ունեն սուր, տհաճ հոտ:
ԻԿ սպեկտրում ունեն բնութագրական կլանումներ 2570-սմ-1 մարզում, որը համապատասխանում է SH խմբի վալենտային տատանումներին, ՄՄՌ սպեկտրում SH խմբի քիմիական սահքը տեղի է ունենում 1 2 մկմ մարզում:
29.1. Կիրառման բնագավառներ, թունավորություն
Թիոլները կիրառվում են վառելանյութային գազերին յուրահատուկ հոտ հաղորդելու համար (օդորանտներ), որպես սկզբնանյութ` պեստիցիդների, լատեքսների և կաուչուկների արտադրությունում, դեղագործությունում: Օգտագործվում են որպես հակաօքսիդիչներ, ռադիկալային որսիչներ, որոնք դանդաղեցնում են ռադիկալային ռեակցիաները: Երկար ածխաջրածնային շղթա (C8 C16) պարունակող թիոլները կիրառվում են որպես պոլիմերացման կարգավորիչներ, վառելիքի կայունացուցիչներ, քսայուղեր:
Թիոլների համաշխարհային արտադրությունը կազմում է 260000 տ/տարի, որից մեթանթիոլի արտադրությունը 30000 տ/տարի, իսկ C2 C8 ածխածին պարունակող թիոլներինը` 150000 տ/տարի:
Թիոլներն օրգանիզմում առաջացնում են ներքին օրգանների ախտահարում, անոթային խանգարումներ: Հալոգենսուլֆիդներն ազդում են մաշկի, աչքերի և շնչառական օրգանների վրա:
29.2. Ստացման եղանակներ
29.2.1. Ալկիլհալոգենիդների փոխազդեցություն հիդրոսուլֆիդների հետ (SN2).
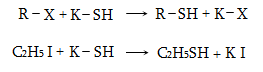
29.2.2. S-ալկիլիզոթիուրոնիումի աղերի օճառացում, որոնք ստացվում են թիոմիզանյութից:
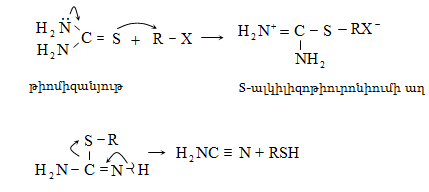
29.2.3. Սպիրտների փոխազդեցություն ծծմբաջրածնի հետ, ալյումինի օքսիդի ներկայությամբ.
![]()
29.2.4. Ծծմբաջրածնի միացում ալկեններին նիկելի սուլֆիդի և ալյումինի օքսիդի ներկայությամբ` 35 70 մթն ճնշման տակ.
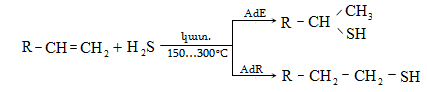
29.3. Քիմիական հատկություններ
Թիոլների քիմիական հատկությունները պայմանավորված են շարժուն ջրածնի և ծծմբի էլեկտրոնային զույգի առկայությամբ: Ի տարբերություն սպիրտների` թիոլները թույլ թթուներ են: Ածխաջրածնային շղթայի երկարացմամբ և ճյուղավորմամբ թթվայնությունը նվազում է, իսկ էլեկտրոնակցեպտոր խմբերի ներկայությամբ` մեծանում.
![]()
29.3.1. Ջրային լուծույթներում թիոլներն ալկալիների հետ առաջացնում են աղեր ` թիոլատներ (մերկապտիդներ).
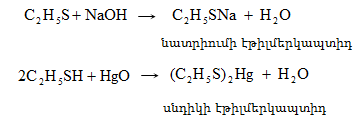
29.3.2. ՈՒժեղ թթուների ներկայությամբ թիոսպիրտները կարբոնաթթուների հետ առաջացնում են բարդ եթերներ.
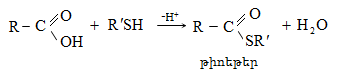
29.3.3.Ռենեի նիկելի ներկայությամբ թիոլները փոխարկվում են ածխաջրածինների: Կատարվում է դեսուլֆուրացում (պոկվում է ծծումբ).
![]()
Այս ռեակցիան կիրառվում է նավթավերամշակման արդյունաբերությունում ծծմբի միացությունների հեռացման համար: Հիդրոզտման ժամանակ թորումն իրականացվում է մոլիբդենի կամ վոլֆրամի սուլֆիդների ներկայությամբ` 300 400°C-ում, 20 40 մթն ճնշման տակ:
29.3.4. Հիմնային միջավայրում յոդի, օ-յոդբենզոյական թթվի, ալիֆատիկ սուլֆօքսիդների ներկայությամբ մերկապտանները ենթարկվում են օքսիդացման.
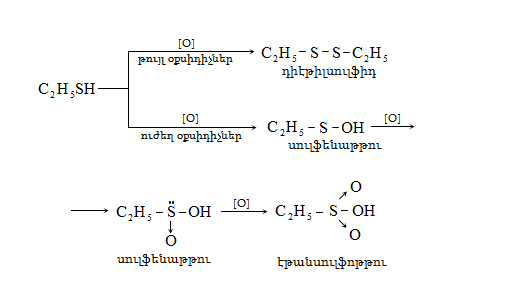
30. ԹԻՈԵԹԵՐՆԵՐ
Թիոեթերները (սուլֆիդներ) կառուցվածքով նման են պարզ եթերներին. RSR, ջրում անլուծելի, տհաճ հոտով միացություններ են:

30.1. Ստացման եղանակներ
30.1.1. Ալկիլմերկապտիդների փոխազդեցություն հալոգենալկանների հետ.
![]()
30.1.2. Հալոգենածանցյալների փոխազդեցություն ալկալիական մետաղների սուլֆիդների հետ.
![]()
30.1.3. Պերօքսիդների ներկայությամբ թիոլների միացում (AdR, AdN մեխանիզմ) ալկեններին.
![]()
AdR մեխանիզմ
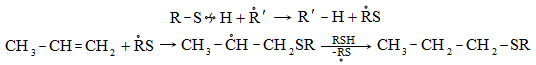
AdN մեխանիզմ
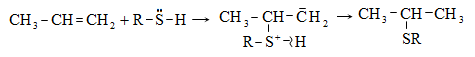
30.2. Քիմիական հատկություններ
30.2.1. Սուլֆիդները եթերների նման թույլ հիմքեր են, խիտ ծծմբական թթվի հետ առաջացնում են դիալկիլսուլֆոնիումի աղեր.
30.2.2. Սուլֆիդների և ալկիլհալոգենիդների փոխազդեցությամբ առաջանում են տրիալկիլսուլֆոնիումի հալոգենիդներ.
30.2.3. Ռեակցիայի պայմաններից և օքսիդիչների բնույթից կախված` սուլֆիդներն օքսիդանում են մինչև սուլֆօքսիդների կամ սուլֆոնների.

30.2.4. Ռազմական
նշանակություն
ունի մաշկաքայքայիչ
ազդեցություն
ունեցող թունավոր
իպրիտը (![]() դիքլորդիէթիլսուլֆիդ),
որը կիրառվել է
առաջին համաշխարհային
պատերազմի ժամանակ
որպես քիմիական
զենք: Այն սխտորի
հոտով անգույն
հեղուկ է
դիքլորդիէթիլսուլֆիդ),
որը կիրառվել է
առաջին համաշխարհային
պատերազմի ժամանակ
որպես քիմիական
զենք: Այն սխտորի
հոտով անգույն
հեղուկ է ![]()
Իպրիտի գազահեռացման համար կիրառվում է քլորակիր, որն այն փոխարկում է սուլֆօքսիդի և այլ նյութերի:
Խնդիրներ
1. Անվանել հետևյալ միացությունները.
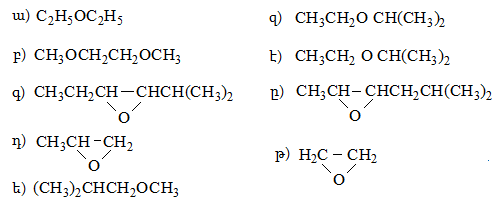
2.
Գրել հինգ ածխածնի
ատոմ պարունակող
![]() օքսիդների
կառուցվածքային
բանաձևերը:
օքսիդների
կառուցվածքային
բանաձևերը:
3. Գրել հետևյալ փոխարկումները` ընտրելով անհրաժեշտ պայմանները.
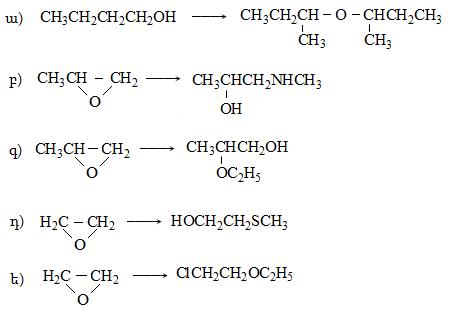
4. Գրել էթիլենօքսիդի փոխազդեցության ռեակցիան ամոնիակի, էթիլամինի, էթիլսպիրտի, ծծմբաջրածնի հետ: Նկարագրել դրա հիդրոլիզի մեխանիզմը (SN1, SN2):
5. Լրացնել հետևյալ փոխարկումները.
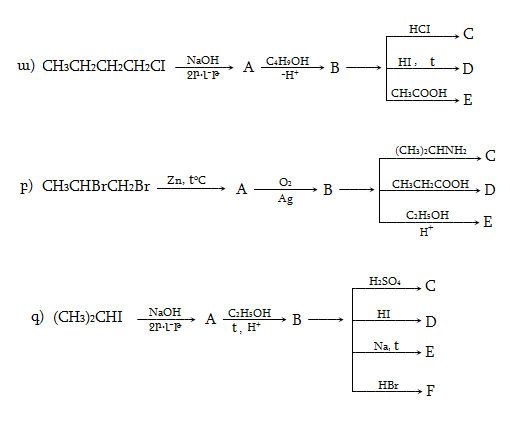
6. Հետևյալ եթերներն ստանալ Վիլյամսոնի ռեակցիայով և անվանել.
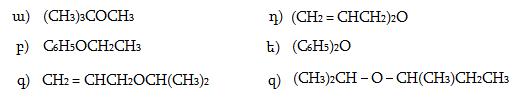
7. Գրել հետևյալ սխեմայի միջանկյալ և վերջնական արգասիքները.
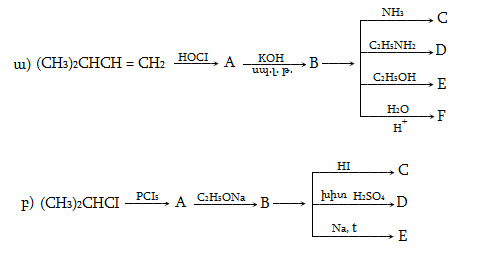
8. Լրացնել հետևյալ սինթեզները` ընտրելով ռեագենտները.
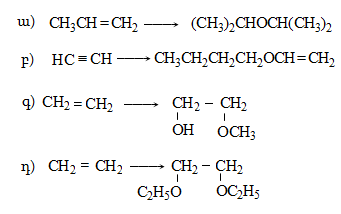
9. Լրացնել հետևյալ ռեակցիաները.
10. Իրականացնել հետևյալ փոխարկումները, անվանել ստացված միացությունները.
11. Լրացնել հետևյալ ռեակցիաները, անվանել ստացվող միացությունները.