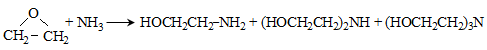ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ
ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐԱՈՒԹՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
(ՊՈԼԻՏԵԽՆԻԿ)
Քիմաիական տեխնեոլոգիաների և
Բնապահպանական Ճարտարագիտության
դեպարտամենտ
Օրգանական քիմիայի և բնապահպանության
Ճարտարագիտական ամբիոն
Ա.Հ. Չերքեզյան, Գ.Հ. Թորոսյան
ՕՐԳԱՆԱԿԱՆ ՔԻՄԻԱ
Մաս 2
Դասագիրք
ԵՐԵՎԱՆ
ՃԱՐՏԱՐԱԳԵՏ
2009

Չերքեզյան Ա.Հ., Թորոսյան Գ.Հ.
Թ 822 Օրգանական քիմիա: Դասագիրք.-Եր.: Ճարտարագետ,2009.-408էջ:
Դասագիրքը նախատեսված է Հայաստանի Հանրապետության բարձրագույն ուսումնական հաստատությունների ուսանողների, մագիստրանտների, ասպիրանտների և օրգանական քիմիա ուսումնասիրողների համար:
Դասագրքում օրգանական միացությունները մանրամասն դիտարկվում են իրենց քիմիական կառուցվածքով, իզոմերիայով, ֆիզիկական հատկություններով, թունավորությամբ, բնապահպանական խնդիրներով, արտադրանքի համաշխարհային ծավալով՝ 1999-2004թթ. Տվյալներով, ստացման եղանակներով և քիմիական հատկություններով:
Կարևորոգույն փոփոխարկումների համար բերված են ռեակցիաների մեխանիզմները: Յուրաքանչյուր դասի համար, համապատասխանաբար, տրված են խնդիրներ:
Գրախոսներ՝
ԵՊՀ Օրգ. քիմ. ամբ. վարիչ,
ք. գ. դ, պրոֆ.՝ Վ.Ս.Հարությունյան,
ԵՊԲՀ Դեղ. և թուն. քիմ. ամբ. վարիչ, մանկ.
գ. դ, պրոֆ.՝ Լ.Ա.Սահակյան,
ԵՊԱՀ Ընդհ. քիմ. ամբ. վարիչ,
ք. գ. դ, պրոֆ.՝ Հ.Հ. Մխիթարյան,
ՀՀ ԱԱԳ Օրգ. և դեղ. քիմ. ԳՏԿ տնօրեն,
ք. գ. դ, պրոֆ.՝ Վ.Օ.Թոփուզյան,
Կենսատեխ. ԳՀԻ փոխտնօրեն,
ք. գ. դ, պրոֆ.՝ Ղ.Պ.Հալաբյան
ԳՄԴ 24.2ց7
ISBN 978-9939-55-186-9

31. ԱԼԻՖԱՏԻԿ ԱԼԴԵՀԻԴՆԵՐ ԵՎ ԿԵՏՈՆՆԵՐ (ՕՔՍՈՄԻԱՑՈՒԹՅՈՒՆՆԵՐ)
31.2. Ֆիզիկական հատկություններ
31.3. Կիրառման բնագավառներ, թունավորություն
31.5.2 Փոխազդեցություն Գրինյարի ռեակտիվի հետ
31.5.3. Նուկլեոֆիլ միացման ռեակցիաներ (AdN)
31.5.4. Նուկլեոֆիլ միացման ռեակցիաներ
31.5.5. Ալդեհիդները սպիրտների հետ առաջացնում են կիսաացետալներ
31.5.6.
Ալդեհիդները
և կետոնները ![]()
![]()
![]() և
և ![]() հետ
առաջացնում
են հեմինալ
դիհալոգենալկաններ.
հետ
առաջացնում
են հեմինալ
դիհալոգենալկաններ.
31.5.8. Պոլիմերացման ռեակցիաներ
31.5.10. Կոնդենսացման ռեակցիաներ
31.6.3. Տրիքլորքացախաթթվական ալդեհիդը
32. ՉՀԱԳԵՑԱԾ ԱԼԴԵՀԻԴՆԵՐ ԵՎ ԿԵՏՈՆՆԵՐ
32.5. Դիալդեհիդներ և դիկետոններ
33.1. Ֆիզիկական հատկություններ
33.2 Կիրառման բնագավառներ, թունավորություն
34.1. Ֆիզիկական հատկություններ
34.2. Կիրառման բնագավառներ, թունավորություն
35. ԿԱՐԲՈՆԱԹԹՈՒՆԵՐ ԵՎ ԱԾԱՆՑՅԱԼՆԵՐ
35.2. Ֆիզիկական հատկություններ
35.3. Կիրառման բնագավառներ, թունավորություն
35.5.1. Թթվային հատկություններ
35.5.2. Ռեակցիաներ կարբոնիլային խմբի ածխածնի մասնակցությամբ
35.5.3. Ածխաջրածնային մնացորդի ռեակցիաներ (հալոգենացում)
35.6. Առանձին ներկայացուցիչներ
35.6.1. Մրջնաթթու (մեթանաթթու)
35.6.2. Քացախաթթու (էթանաթթու)
36. ԵՐԿՀԻՄՆ ՀԱԳԵՑԱԾ ԹԹՈՒՆԵՐ (ԴԻԿԱՐԲՈՆԱԹԹՈՒՆԵՐ)
36.1. Ֆիզիկական հատկություններ, կիրառման բնագավառներ, թունավորություն
36.2.1. Երկառաջնային գլիկոլների օքսիդացում
36.2.2. Առաջնային օքսիթթուների օքսիդացում
36.2.4. Երկհիմն թթուների կարևոր ներկայացուցիչների արտադրական ստացման եղանակներ
37.2. Ֆիզիկական և քիմիական հատկություններ
37.3. Առանձին ներկայացուցիչներ
37.3.1. Ակրիլաթթու (պրոպենաթթու)
38.1. Ֆիզիկական հատկություններ
38.2. Կիրառման բնագավառներ, թունավորություն
39.1. Ֆիզիկական հատկություններ
39.2. Կիրառման բնագավառներ, թունավորություն
41. ԱՑԵՏՈՔԱՑԱԽԱԹԹՎԱԿԱՆ ԷԹԻԼԵԹԵՐ
41.1. Սինթեզներ ացետոքացախաթթվական եթերի հիման վրա
41.2. Ացետոքացախաթթվական եթերի երկբևեռ հատկությունները
42.1. Ֆիզիկական հատկություններ
42.2. Կիրառման բնագավառներ, թունավորություն
43.2. Ֆիզիկական հատկություններ
43.3. Կիրառման բնագավառներ, թունավորություն
44. ԱՐՈՄԱՏԻԿ ՆԻՏՐՈՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
44.1. Ֆիզիկական հատկություններ
44.2. Կիրառման բնագավառներ, թունավորություն
47.1. Ֆիզիկական հատկություններ
47.2. Կիրառման բնագավառներ, թունավորություն
47.3.1. Արոմատիկ առաջնային ամինների ստացում
47.3.2. Արոմատիկ երկրորդային ամինների ստացում
47.3.3. Արոմատիկ երրորդային ամինների ստացում
48. ԱՐՈՄԱՏԻԿ ԴԻԱԶՈՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
48.1. Ֆիզիկական հատկություններ, կիրառման բնագավառներ
48.3.1. Ռեակցիաներ ազոտի անջատումով (դիազոնիումաղի քայքայումը կատարվում է հետերոլիտիկ խզումով):
48.3.2. Ռեակցիաներ` առանց ազոտի անջատման
49. ՄԵՏԱՂՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
49.1. Ֆիզիկական հատկություններ
49.4. Սնդիկօրգանական միացություններ
31. ԱԼԻՖԱՏԻԿ ԱԼԴԵՀԻԴՆԵՐ ԵՎ ԿԵՏՈՆՆԵՐ
(ՕՔՍՈՄԻԱՑՈՒԹՅՈՒՆՆԵՐ)
Ալդեհիդներ
և կետոններ են
կոչվում
ածխաջրածինների
այն
ածանցյալները,
որոնք իրենց
մոլեկուլում
ունեն
կարբոնիլային
խումբ` ![]() Ալդեհիդների
մոլեկուլում
ածխածնի ազատ
կապերից մեկը
ծախսվում է
ջրածնի,
մյուսը` ածխաջրածնային
ռադիկալի հետ
կապ
առաջացնելու
համար: Դրանց
ընդհանուր
բանաձևն է`
Ալդեհիդների
մոլեկուլում
ածխածնի ազատ
կապերից մեկը
ծախսվում է
ջրածնի,
մյուսը` ածխաջրածնային
ռադիկալի հետ
կապ
առաջացնելու
համար: Դրանց
ընդհանուր
բանաձևն է` ![]() Կետոնների
մոլեկուլում
երկու կապերն
էլ ծախսվում
են
ածխաջրածնային
ռադիկալների
հետ կապ
առաջացնելու
համար: Դրանց
ընդհանուր բանաձևն
է`
Կետոնների
մոլեկուլում
երկու կապերն
էլ ծախսվում
են
ածխաջրածնային
ռադիկալների
հետ կապ
առաջացնելու
համար: Դրանց
ընդհանուր բանաձևն
է` ![]()
31.1. Իզոմերիա, անվանակարգում
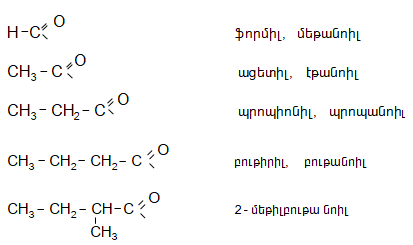
Ալդեհիդների իզոմերիան պայմանավորված է միայն ածխաջրածնային ռադիկալի ճյուղավորվածությամբ: Գոյություն ունի ալդեհիդների անվանակարգման երկու եղանակ`
ա) ըստ համապատասխան թթվի, որն ստացվում է տվյալ ալդեհիդի օքսիդացումով,
բ) ըստ IUPAC անվանակարգման. նույն թվով ածխածնի ատոմ պարունակող հագեցած ածխաջրածնի անվանն ավելացվում է -ալ վերջածանցը, ընդ որում` համարակալումն սկսվում է ալդեհիդային խմբի ածխածնի ատոմից:
Ալդեհիդների առաջին ներկայացուցիչը բնորոշիչ խմբին կից ունի ջրածնի ատոմ:


Կետոնների իզոմերիան պայմանավորված է կարբոնիլային խմբին միացած ռադիկալների կառուցվածքով և ածխածնային շղթայում կարբոնիլային խմբի դիրքով: Կետոնների համար նույնպես գոյություն ունի երկու անվանակարգում`
ա) կարբոնիլային խմբին միացված ռադիկալների անվանն ավելացվում է կետոն բառը,
բ) ըստ համակարգված անվանակարգման` ածխածնային շղթան համարակալվում է կարբոնիլային խմբին մոտ գտնվող ծայրից, նշվում է կարբոնիլային ածխածնի համարը և համապատասխան ածխաջրածնի անվանն ավելացվում է ոն վերջածանցը:

31.2. Ֆիզիկական հատկություններ
Ցածրամոլեկուլային ալդեհիդները և կետոնները ջրում լավ լուծելի, անգույն, դյուրաշարժ, սուր հոտով հեղուկներ են, ընդ որում` ալդեհիդներն ունեն խեղդող, իսկ կետոնները` բավականին հաճելի հոտ: Բացառություն է կազմում ֆորմալդեհիդը, որը գազ է:
Օքսո
խումբը` ![]() վերաբերում
է օսմոֆոր
խմբային
կառույցներին,
որն էլ
պայմանավորում
է
օքսոմիացությունների
հոտավետությունը:
Բարձրամոլեկուլային
ալդեհիդներն
ու կետոնները
հանդիպում են
բնության մեջ,
ունեն հաճելի
հոտ: Նույն
թվով ածխածնի
ատոմ
պարունակող և
նման
կառուցվածք
ունեցող կետոնները
եռում են
ավելի բարձր
ջերմաստիճանում,
քան
ալդեհիդները:
Նորմալ
կառուցվածքով
իզոմերների
եռման կետն
ավելի բարձր
է, քան ճյուղավորվածներինը:
Ալդեհիդները
և կետոնները
եռում են
ավելի ցածր
ջերմաստիճանում,
քան համապատասխան
սպիրտները,
որը վկայում է
դրանց ավելի քիչ
ասոցված
լինելու
մասին:
Ալդեհիդների
և կետոնների
խտությունը
փոքր է մեկից,
ԻԿ սպեկտրում
օքսո խմբի
բնորոշ
կլանումներն
ընկած են
վերաբերում
է օսմոֆոր
խմբային
կառույցներին,
որն էլ
պայմանավորում
է
օքսոմիացությունների
հոտավետությունը:
Բարձրամոլեկուլային
ալդեհիդներն
ու կետոնները
հանդիպում են
բնության մեջ,
ունեն հաճելի
հոտ: Նույն
թվով ածխածնի
ատոմ
պարունակող և
նման
կառուցվածք
ունեցող կետոնները
եռում են
ավելի բարձր
ջերմաստիճանում,
քան
ալդեհիդները:
Նորմալ
կառուցվածքով
իզոմերների
եռման կետն
ավելի բարձր
է, քան ճյուղավորվածներինը:
Ալդեհիդները
և կետոնները
եռում են
ավելի ցածր
ջերմաստիճանում,
քան համապատասխան
սպիրտները,
որը վկայում է
դրանց ավելի քիչ
ասոցված
լինելու
մասին:
Ալդեհիդների
և կետոնների
խտությունը
փոքր է մեկից,
ԻԿ սպեկտրում
օքսո խմբի
բնորոշ
կլանումներն
ընկած են ![]() իսկ
ՈՒՄ
սպեկտրում` 279...294
նմ
տիրույթում:
իսկ
ՈՒՄ
սպեկտրում` 279...294
նմ
տիրույթում:
31.3. Կիրառման բնագավառներ, թունավորություն
Ալդեհիդները և կետոնները գործնական լայն կիրառություն ունեն բազմաթիվ օրգանական միացությունների, խեժերի, հոտավետ նյութերի ստացման արտադրություններում:
Ֆորմալդեհիդը գործնականում լայնորեն օգտագործվում է ֆենոլֆորմալդեհիդային խոժի, մելամինֆորմալդեհիդային խեժի և այլ նմանատիպ խեժերի ստացման գործընթացում, զանազան սպիտակուցային նյութերի, դեղանյութերի, ներկանյութերի արտադրություններում, բժշկության մեջ, ինչպես նաև որպես ախտահանող և թունաքիմիկատային միջոց: Մեծ կիրառություն ունի նաև ացետալդեհիդը` ներկանյութեր, խեժեր, դեղամիջոցներ և այլ նյութեր ստանալու համար:
Ֆորմալդեհիդի, ացետալդեհիդի տարեկան համաշխարհային արտադրական ծավալներն անընդհատ աճում են:
Կիրառական նյութեր են նաև կետոնները. լավ լուծիչներ են և պակաս թունավոր լինելու շնորհիվ օգտագործվում են ինչպես դեղագործության, այնպես էլ սննդարդյունաբերության մեջ: Կարևորագույն ելանյութեր են ժամանակակից ծանր և նուրբ օրգանական սինթեզների համար:
Ֆորմալդեհիդի
ՍԹԿ-ն
մթնոլորտում
կազմում է ![]() աշխատանքային
գոտում`
աշխատանքային
գոտում` ![]() արցունքաբեր
է, ազդում է
շնչառական
ուղիների վրա:
Ֆորմալդեհիդի
40%-ոց ջրային
լուծույթը` ֆորմալինը
արցունքաբեր
է, ազդում է
շնչառական
ուղիների վրա:
Ֆորմալդեհիդի
40%-ոց ջրային
լուծույթը` ֆորմալինը ![]() կիրառվում
է
գյուղատնտեսությունում,
փայտամշակման
տեխնոլոգիաներում,
կենսաբանական
նմուշների
պահածոյացման
ժամանակ,
բժշկության
մեջ և այլն:
Քաղցկեղածին
և մուտագեն նյութ
է, գրգռում է
լորձաթաղանթները,
մաշկը, ճնշում
է
նուկլեինաթթուների
սինթեզը`
խանգարում է C
վիտամինի
փոխանակությունը:
կիրառվում
է
գյուղատնտեսությունում,
փայտամշակման
տեխնոլոգիաներում,
կենսաբանական
նմուշների
պահածոյացման
ժամանակ,
բժշկության
մեջ և այլն:
Քաղցկեղածին
և մուտագեն նյութ
է, գրգռում է
լորձաթաղանթները,
մաշկը, ճնշում
է
նուկլեինաթթուների
սինթեզը`
խանգարում է C
վիտամինի
փոխանակությունը:
Ացետալդեհիդի
ՍԹԿ-ն` ![]() Գոլորշիներն
առաջացնում
են
լորձաթաղանթի
բորբոքում,
գլխացավ,
շնչահեղձություն:
Գոլորշիներն
առաջացնում
են
լորձաթաղանթի
բորբոքում,
գլխացավ,
շնչահեղձություն:
Ացետոնը
![]() ունի
գրգռող,
թմրեցնող
ազդեցություն,
վնասում է
կենտրոնական
նյարդային համակարգը,
ունի
կուտակվելու
հատկություն,
առաջացնում է
տևական
թունավորում:
ունի
գրգռող,
թմրեցնող
ազդեցություն,
վնասում է
կենտրոնական
նյարդային համակարգը,
ունի
կուտակվելու
հատկություն,
առաջացնում է
տևական
թունավորում:
Կարագաթթվական
և
իզոկարագաթթվական
ալդեհիդները ![]() թունավոր
են, հատկապես
գոլորշիները
շնչելիս,
մաշկի հետ
շփման
ժամանակ,
կաթիլներն
աչքի մեջ
ընկնելիս:
թունավոր
են, հատկապես
գոլորշիները
շնչելիս,
մաշկի հետ
շփման
ժամանակ,
կաթիլներն
աչքի մեջ
ընկնելիս:
31.4. Ստացման եղանակներ
Ալդեհիդներ և կետոններ ստացվում են մի շարք ընդհանուր եղանակներով:
31.4.1. Սպիրտների օքսիդացում կամ կատալիզային դեհիդրում: Առաջնային սպիրտներից ստացվում են ալդեհիդներ, իսկ երկրորդային սպիրտներից` կետոններ:
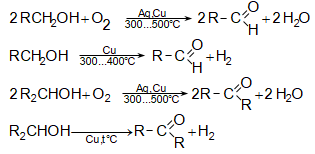
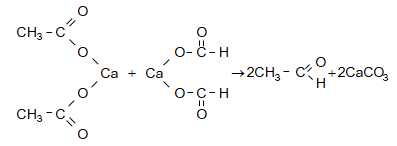
31.4.2. Կարբոնաթթուների Ca-ական կամ Ba-ական աղերի պիրոլիզով, ընդ որում ալդեհիդներ ստանալու համար անհրաժեշտ է անպայման օգտագործել մրջնաթթվի և մեկ այլ թթվի աղերի խառնուրդ:
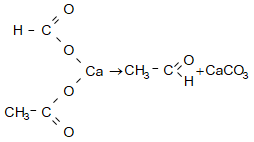
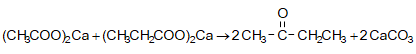
31.4.3.
Կարբոնաթթուների
կամ դրանց
խառնուրդների
պիրոլիզ:
Գործընթացն իրականացվում
է մետաղների
օքսիդների ![]() ներկայությամբ
400…500°C-ում:
Ալդեհիդներ
ստանալու
համար
անհրաժեշտ է
օգտագործել
մրջնաթթու:
ներկայությամբ
400…500°C-ում:
Ալդեհիդներ
ստանալու
համար
անհրաժեշտ է
օգտագործել
մրջնաթթու:
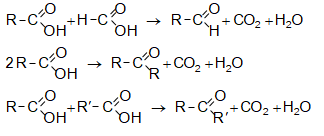
31.4.4. Հեմինալ դիհալոգենածանցյալների հիդրոլիզ: Ալդեհիդներ ստացվում են, երբ հալոգենի ատոմները գտնվում են ծայրային ածխածնի ատոմի մոտ:
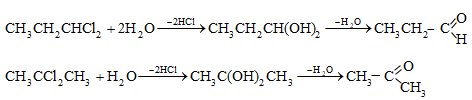
31.4.5. Ացետիլենային ածխաջրածինների հիդրատացում (տես «Ալկիններ»).
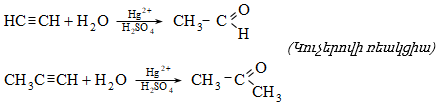
31.4.6. Կարբոնաթթուների քլորանհիդրիդների և մետաղօրգանական միացությունների (լիթիումդիալկիլկուպրատ, դիալկիլկադմիում) փոխազդեցություն.
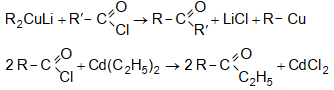
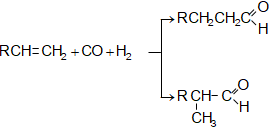
31.4.7.
Արտադրական
գործընթաց է
ալդեհիդների
ստացումը
սինթեզ գազի (CO, H2) և
ալկենների
փոխազդեցությամբ`
օքսոսինթեզ, որն
իրականացվում
է կոբալտի և
նիկելի կատալիզատորի
![]() նստեցված
կիզելգուրի
վրա)
ներկայությամբ,
100…200°C-ում, 100…200 մթն
ճնշման տակ:
Էթիլենի և
պրոպիլենի
դեպքում
ռեակցիան
ընթանում է
գազային ֆազում,
մյուս
ալկենների
դեպքում`
հեղուկ ֆազում.
նստեցված
կիզելգուրի
վրա)
ներկայությամբ,
100…200°C-ում, 100…200 մթն
ճնշման տակ:
Էթիլենի և
պրոպիլենի
դեպքում
ռեակցիան
ընթանում է
գազային ֆազում,
մյուս
ալկենների
դեպքում`
հեղուկ ֆազում.
Օքսոսինթեզի ընթացքը.
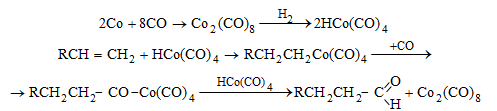
Մոլեկուլում
կարբոնիլային
խմբի
առկայությունը
պայմանավորում
է
ալդեհիդների
և կետոնների բարձր
ռեակցիոնունակությունը:
Կրկնակի կապն
օքսոմիացություններում
իր բնույթով
նման է երկու
ածխածնի
ատոմների
միջև կրկնակի
կապին (մեկ ![]() և մեկ
և մեկ ![]() սակայն
սակայն
![]() մինչդեռ
մինչդեռ
![]() Քանի
որ
կարբոնիլային
խմբի ատոմներից
մեկը`
թթվածինն
ավելի
էլեկտրաբացասական
է, քան
ածխածինը` էլեկտրոնային
ամպի
խտությունը
թթվածնի ատոմի
վրա ավելի մեծ
է.
Քանի
որ
կարբոնիլային
խմբի ատոմներից
մեկը`
թթվածինն
ավելի
էլեկտրաբացասական
է, քան
ածխածինը` էլեկտրոնային
ամպի
խտությունը
թթվածնի ատոմի
վրա ավելի մեծ
է.
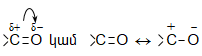
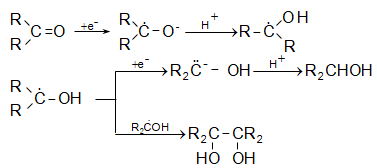
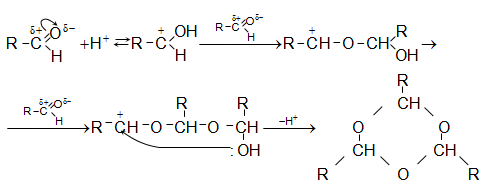
Այսպիսի բևեռացման հետևանքով կարբոնիլային խմբի դիպոլային մոմենտը 2,7D է: Կարբոնիլային խումբը ձեռք է բերում էլեկտրոֆիլ հատկություն և հեշտությամբ ռեակցում է նուկլեոֆիլ ռեագենտների հետ, ընդ որում` նուկլեոֆիլ մասնիկը միանում է ածխածնի ատոմին, իսկ էլեկտրոֆիլը` թթվածնին:
Կարբոնիլային խմբին նուկլեոֆիլ ռեագենտի միացումը աստիճանական է.
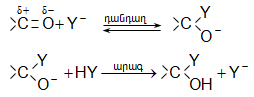
Ինչպես երևում է բերվածից, կարբոնիլային խմբի ռեակցիոնունակությունը պայմանավորված է ածխածնի ատոմի դրական լիցքով: Որքան մեծ են կից խմբերի +I և +M էֆեկտները, այնքան փոքր է այդ լիցքը և հետևաբար` կարբոնիլային միացության ռեակցիոնունակությունը:
Այսպիսի էֆեկտ է նկատվում ալկիլ խմբերի դեպքում.
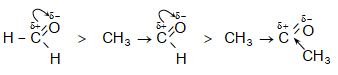
-I և -M էֆեկտ ունեցող խմբերն, ընդհակառակը, մեծացնում են խմբի ռեակցիոնունակությունը
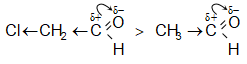
Կարբոնիլային
խմբին
միացման
ռեակցիաների
ժամանակ
կիրառելի է
թթվահիմնային
կատալիզը: Հիմնային
բնույթ
ունեցող
ռեագենտների
դեպքում ![]() ամիններ,
հիդրօքսիլամին,
հիդրազին և
այլն) ռեակցիան
արագանում է
թթվային
կատալիզատորի
ներկայությամբ`
ամիններ,
հիդրօքսիլամին,
հիդրազին և
այլն) ռեակցիան
արագանում է
թթվային
կատալիզատորի
ներկայությամբ`
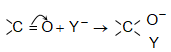
Բացի վերոհիշյալ միացման ռեակցիաներից, ալդեհիդներին և կետոններին հատուկ են կարբոնիլային խմբին կից ածխածնի ատոմների ռեակցիաները` պայմանավորված կարբոնիլային խմբի էլեկտրոնակցեպտոր ներգործությամբ: Դրանք են օքսիդացման, հալոգենացման, կոնդենսացման ռեակցիաները:
ա) ալդեհիդների, կետոնների հիդրոգենացումը կատարվում է կատալիզատորի ներկայությամբ (Ni, Co, Pt, Pd և այլն): Ռեակցիայի արդյունքում ալդեհիդները փոխարկվում են առաջնային, իսկ կետոնները` երկրորդային սպիրտների.
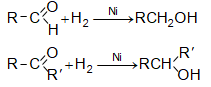
բ)
լաբորատոր և
կիրառական
նպատակների
համար` որպես
հիդրող
օգտագործում
են լիթիումալյումինհիդրիդ
![]() Ռեակցիան
ընթանում է
հիդրիդ իոնի
տեղաշարժով.
Ռեակցիան
ընթանում է
հիդրիդ իոնի
տեղաշարժով.
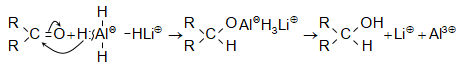
գ) ալդեհիդների և կետոնների վերականգնումով` ջրածնով անջատման պահին (ալկալիական մետաղներով կամ մագնեզիումամալգամով), համապատասխան սպիրտների հետ զուգընթաց ստացվում են նաև գլիկոլներ.
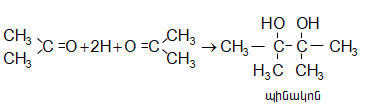
Ստացվող սպիրտի և գլիկոլի հարաբերությունը կախված է կարբոնիլային միացության բնույթից և ռեակցիայի պայմաններից: Կետոնների դեպքում ոչ պրոտոնային լուծիչների միջավայրում գերակշռում են պինակոնները, իսկ ալիֆատիկ հագեցած ալդեհիդների դեպքում գլիկոլներն առաջանում են աննշան քանակներով: Ռեակցիան ընթանում է միջանկյալ ազատ ռադիկալի առաջացմամբ.
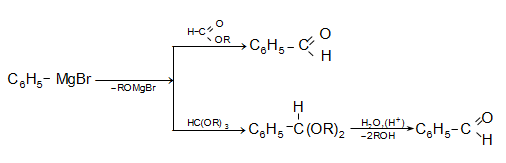
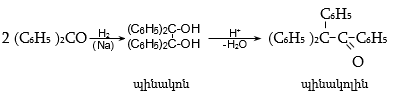
31.5.2 Փոխազդեցություն Գրինյարի ռեակտիվի հետ
Մագնեզիումհալոգենալկաններն ալդեհիդների և կետոնների հետ առաջացնում են միջանկյալ ալկոհոլատներ, որոնք հեշտությամբ հիդրոլիզվում են սպիրտների (տես «Սպիրտներ»).
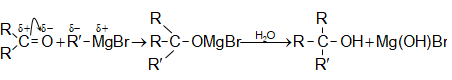
31.5.3. Նուկլեոֆիլ միացման ռեակցիաներ (AdN)
ա)
օքսոմիացությունների
և կապտաթթվի
փոխազդեցությամբ
ստացվում են ![]() օքսինիտրիլներ,
որոնց
հիդրոլիզով`
օքսինիտրիլներ,
որոնց
հիդրոլիզով` ![]() օքսիկարբոնաթթուներ.
օքսիկարբոնաթթուներ.
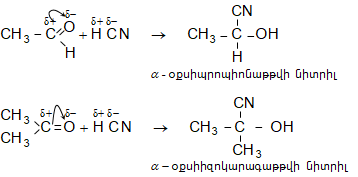
Նուկլեոֆիլ
միացման
ռեակցիան
երկփուլ է: Առաջին`
դանդաղ
փուլում,
կարբոնիլային
ածխածնի
ատոմին
միանում է
նուկլեոֆիլ ![]() մասնիկը`
առաջացնելով
միջանկյալ
անիոն, որը երկրորդ
փուլում
կապտաթթվի
մոլեկուլից
պոկում է
պրոտոն:
Ռեակցիան
կատալիզվում
է հիմքերով,
ալկալիական
մետաղների
ցիանիդներով,
իսկ հանքային
թթուների
ներկայությամբ`
դանդաղում է:
Հիմքի առկայությամբ
կապտաթթվի
դիսոցման
հավասարակշռությունը
տեղաշարժվում
է դեպի աջ,
մեծանում է
ցիան իոնների
կոնցենտրացիան,
որը նպաստում
է ռեակցիայի
արագության
մեծացմանը.
մասնիկը`
առաջացնելով
միջանկյալ
անիոն, որը երկրորդ
փուլում
կապտաթթվի
մոլեկուլից
պոկում է
պրոտոն:
Ռեակցիան
կատալիզվում
է հիմքերով,
ալկալիական
մետաղների
ցիանիդներով,
իսկ հանքային
թթուների
ներկայությամբ`
դանդաղում է:
Հիմքի առկայությամբ
կապտաթթվի
դիսոցման
հավասարակշռությունը
տեղաշարժվում
է դեպի աջ,
մեծանում է
ցիան իոնների
կոնցենտրացիան,
որը նպաստում
է ռեակցիայի
արագության
մեծացմանը.
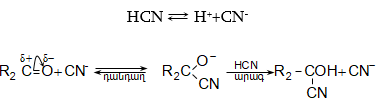
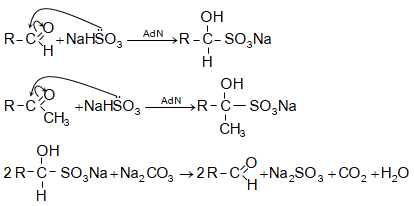
բ)
նատրիումի
հիդրոսուլֆիտի
միացումով
առաջանում են
բիսուլֆիտային
միացություններ,
որոնք բյուրեղային
նյութեր են,
կիրառվում են
ալդեհիդների
և կետոնների
որակական
բնորոշման ու
դրանց
խառնուրդներից
անջատելու,
մաքրելու համար:
Գոյացած
միացությունները
սոդայի կամ հանքային
թթուների
լուծույթների
հետ
տաքացնելիս
քայքայվում
են`
առաջացնելով
ազատ ալդեհիդ
կամ կետոն: Ռեակցիայի
մեջ մտնում են
այն
կետոնները,
որոնք ունեն ![]() խմբավորում:
խմբավորում:
31.5.4. Նուկլեոֆիլ միացման ռեակցիաներ
ա) ամոնիակի հետ ալդեհիդները և կետոնները ռեակցում են տարբեր ձևով: Ռեակցիան օգտագործվում է ալդեհիդները կետոններից տարբերելու համար:
Ալդեհիդներն ամոնիակի հետ ջուր անջատելով` առաջացնում են ալդիմին: Ռեակցիան տեղի է ունենում AdN և E2 հաջորդական մեխանիզմներով.
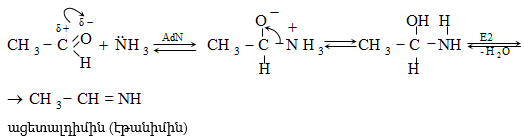
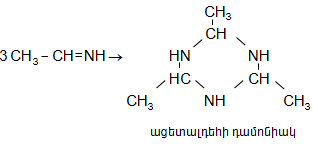
Վերջիններս հեշտությամբ ցիկլապոլիմերանում են` առաջացնելով ալդեհիդամոնիակ.
Ացետալդեհիդամոնիակը «Վուլկացիտ» անվան տակ օգտագործվում է կաուչուկների վուլկանացման գործընթացում որպես արագացուցիչ:
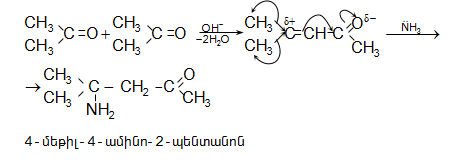
Կետոններն ամոնիակի հետ միանում են ավելի դանդաղ և բարդ ձևով. սկզբում կատարվում է կետոնի կրոտոնային կոնդենսացում, ապա առաջացած չհագեցած կետոնին միանում է ամոնիակի մոլեկուլ.
բ) հիդրօքսիլամինի հետ ալդեհիդները և կետոններն առաջացնում են օքսիմներ (ալդօքսիմ, կետօքսիմ).
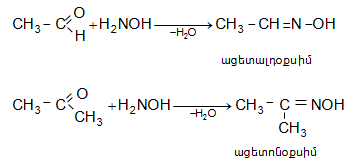
Ռեակցիան
ընթանում է
երկու փուլով.
առաջին փուլում
կատարվում է
հիդրօքսիլամինի
նուկլեոֆիլ հարձակում
օքսոխմբի
դրական
կենտրոնի վրա
(AdN)` խիստ
անկայուն
օքսիալկիլհիդրօքսիլամինի
գոյացումով,
որը
ենթարկվում է
դեհիդրատացման
(երկրորդ
փուլ` E2)`
առաջացնելով
օքսիմ: Ռեակցիան
կիրառվում է
կարբոնիլային
միացության քանակական
որոշման
համար:
Օգտագործելով
աղաթթվային
հիդրօքսիլամին
![]() անջատված
HCl-ի տիտրման
միջոցով
որոշվում է կարբոնիլային
միացության
քանակական
բաղադրությունը:
անջատված
HCl-ի տիտրման
միջոցով
որոշվում է կարբոնիլային
միացության
քանակական
բաղադրությունը:

գ) առանձնակի հետաքրքրություն է ներկայացնում կարբոնիլային միացությունների միացման ռեակցիան հիդրազինի և դրա ածանցյալների (ֆենիլհիդրազին, 2,4-դինիտրոֆենիլհիդրազին, սեմիկարբազիդ) հետ: Կախված պայմաններից, ռեակցիան կարող է ընթանալ 1:1 կամ 1:2 հարաբերությամբ: Մեկ մոլեկուլ կարբոնիլային միացության միացման դեպքում (1:1) առաջանում են հիդրազոններ, իսկ երկու մոլեկուլի (1:2) դեպքում` ազիններ (ալդազին, կետազին):
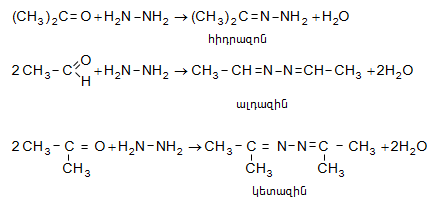
Հիդրազոնները պինդ KOH-ի հետ տաքացնելիս անջատում են ազոտ` առաջացնելով ալկաններ (Կիժների ռեակցիա).
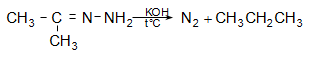
Տեղակալված հիդրազինի դեպքում ռեակցիան ընթանում է նույն ձևով` միացում-պոկում (AdN-E2).
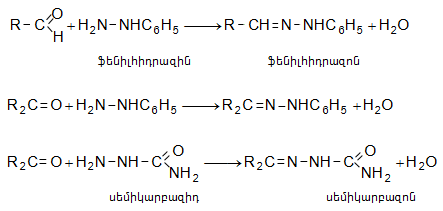
Ստացված բոլոր նյութերը բյուրեղային են: Ռեակցիաներն օգտագործվում են ալդեհիդների և կետոնների որակական և քանակական որոշման, դրանց բաժանման և մաքրման համար:
Նշված ռեակցիաներին բնորոշ է թթվային կատալիզը:
31.5.5. Ալդեհիդները սպիրտների հետ առաջացնում են կիսաացետալներ
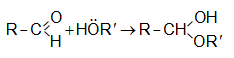
Հանքային թթուների հետքերի ներկայությամբ առաջանում են ացետալներ.
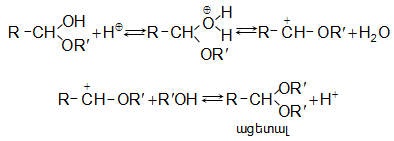
Ացետալները հաճելի եթերային հոտով միացություններ են, որոնք հանքային թթուների նոսր լուծույթների հետ տաքացնելիս ենթարկվում են հիդրոլիզի` գոյացնելով սպիրտ և ալդեհիդ:
Կետոնների ացետալներն ստացվում են ավելի բարդ ճանապարհով` կետոնի վրա ազդում են օրթոմրջնաթթվի էթիլեթերով` ![]() կամ օրթոսիլիկաթթվի էթիլեթերով`
կամ օրթոսիլիկաթթվի էթիլեթերով` ![]()
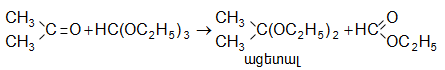
31.5.6.
Ալդեհիդները
և կետոնները ![]()
![]()
![]() և
և ![]() հետ
առաջացնում
են հեմինալ
դիհալոգենալկաններ.
հետ
առաջացնում
են հեմինալ
դիհալոգենալկաններ.
![]()
31.5.7. Օքսիդացման ռեակցիաներ
Ալդեհիդներն ավելի հեշտ են ենթարկվում օքսիդացման, քան կետոնները, ընդ որում` ալդեհիդների օքսիդացումն ընթանում է առանց շղթայի փոփոխության` համապատասխան թթվի առաջացումով:
![]()
ա) ալդեհիդներն արծաթի օքսիդի ամոնիակային լուծույթի հետ տաքացնելիս վերածվում են թթուների, փորձանոթի պատերին նստում է մետաղական արծաթ (արծաթահայելու ռեակցիա): Այս ռեակցիան օգտագործվում է ալդեհիդների որակական որոշման համար և լայն կիրառություն ունի տեխնիկայում:

բ)
ալդեհիդներին
բնորոշ է
ռեակցիան Ֆելինգի
լուծույթի
հետ (գինեթթվի
նատրիումկալիումական
աղի և պղնձի
հիդրօքսիդի
թույլ
ալկալիական
լուծույթ): Ռեակցիայի
ընթացքում
ալդեհիդն
օքսիդանում է
մինչև թթու,
իսկ Cu (II)-ը
վերականգնվում
է Cu (I)-ի` ![]() կարմիր
նստվածքի
տեսքով.
կարմիր
նստվածքի
տեսքով.
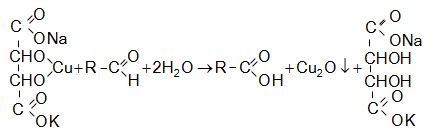
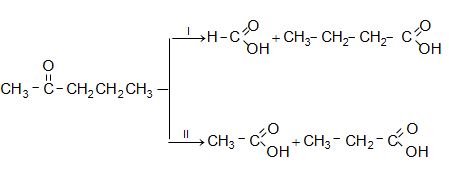
գ) կետոնների օքսիդացումն ուժեղ օքսիդիչներով ընթանում է կարբոնիլային խմբին կից C-C կապերի խզումով: Արդյունքում ստացվող զանազան միացությունների միջոցով կարելի է դատել կետոնի կառուցվածքի մասին.
31.5.8. Պոլիմերացման ռեակցիաներ
Պոլիմերացման ռեակցիաները բնորոշ են միայն ալդեհիդներին և ընթանում են թթվի ներկայությամբ.
Մեխանիզմը հետևյալն է.
Ալդեհիդները և կետոնները, որոնք ունեն
![]() ատոմ, ռեակցում են բրոմի և յոդի հետ նույն արագությամբ` անկախ հալոգենի կոնցենտրացիայից: Ռեակցիան արագանում է ինչպես թթվի, այնպես էլ հիմքի ներկայությամբ և ընթանում է միջանկյալ ենոլի առաջացումով.
ատոմ, ռեակցում են բրոմի և յոդի հետ նույն արագությամբ` անկախ հալոգենի կոնցենտրացիայից: Ռեակցիան արագանում է ինչպես թթվի, այնպես էլ հիմքի ներկայությամբ և ընթանում է միջանկյալ ենոլի առաջացումով.
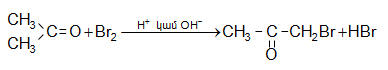
Հիմնային կատալիզ.
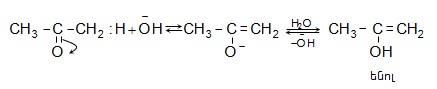
Թթվային կատալիզ.
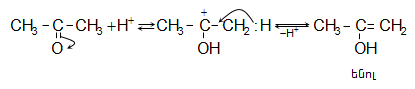
31.5.10. Կոնդենսացման ռեակցիաներ
ա) ալդեհիդները թույլ հիմնային միջավայրում (ացետատներ, կարբոնատներ, սուլֆատներ) ենթարկվում են ալդոլ կոնդենսացման (Ա.Պ.Բորոդին), առաջացնելով օքսիալդեհիդներ (ալդոլներ): Ռեակցիան կարբոնիլային խմբի միացման ռեակցիա է (AdN): Որպես նուկլեոֆիլ հանդես է գալիս ալդեհիդի երկրորդ մոլեկուլը, որի ![]() H-ը պոկվում և միանում է կարբոնիլային խմբին.
H-ը պոկվում և միանում է կարբոնիլային խմբին.
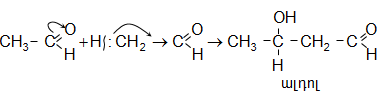
Ալդոլ
կոնդենսացման
մասնակցում
են
գերզուգորդման
հետևանքով
շարժունակ ![]() ունեցող
օքսոմիացությունները.
ունեցող
օքսոմիացությունները.
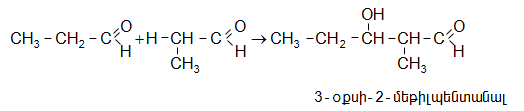
Մեխանիզմ.
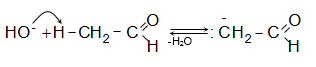
Առաջացած զուգորդված ենոլյատ անիոնն ուժեղ նուկլեոֆիլ է.
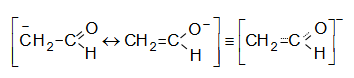
Հաջորդ փուլում ենոլյատ իոնը ռեակցում է ածխածնային կենտրոնով, որը պայմանավորված է թերմոդինամիկական գործոնով` ռեակցիան ածխածնային կենտրոնով էկզոթերմ է, իսկ թթվածնային կենտրոնով` էնդոթերմ.
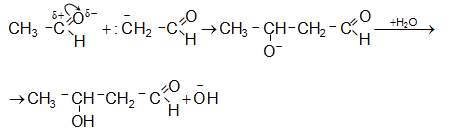
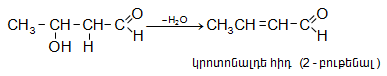
Ալդոլը տաքացնելիս (նույնիսկ առանց ջուր խլող նյութերի ներկայության) դեհիդրատանում է` առաջացնելով չհագեցած կրոտոն-ալդեհիդ (կրոտոնային կոնդենսացում)`
բ) ուժեղ հիմնային միջավայրում ալդոլ կոնդենսացման ենթակա ալդեհիդները խեժանում են, իսկ այն ալդեհիդները, որոնք ընդունակ չեն ալդոլ կոնդենսացման, ենթարկվում են օքսիդավերականգնման (Կանիցարոյի ռեակցիա).
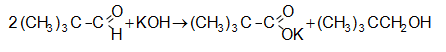
Մեխանիզմ.
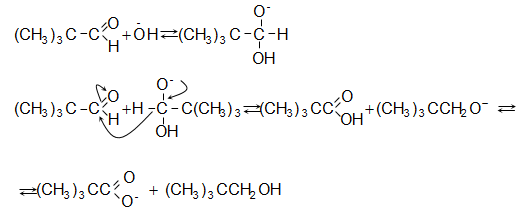
Կետոնների
ալդոլ
կոնդենսացումն
իրականացվում
է ավելի ուժեղ
հիմքերի
ներկայությամբ,
ինչպիսին ![]() է:
Առաջացած
է:
Առաջացած ![]() կետոսպիրտները
հեշտությամբ
կորցնում են
ջուր.
կետոսպիրտները
հեշտությամբ
կորցնում են
ջուր.
Ավելի խիստ պայմաններում (խիտ ծծմբական թթվի ներկայությամբ տաքացնելիս) կետոնները ենթարկվում են միջմոլեկուլային դեհիդրատացման` առաջացնելով չհագեցած կետոններ.
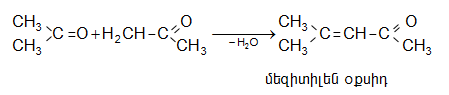
այնուհետև`
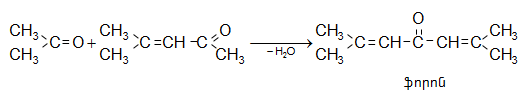
Կոնդենսացում է կատարվում նաև ալդեհիդների և կետոնների միջև:
գ) ալդեհիդներն անջուր միջավայրում ալյումինի ալկոհոլատի ներկայությամբ ենթարկվում են բարդ եթերային կոնդենսացման (Տիշչենկոյի ռեակցիա).
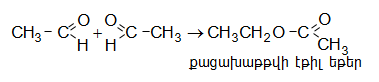
Մեխանիզմ.
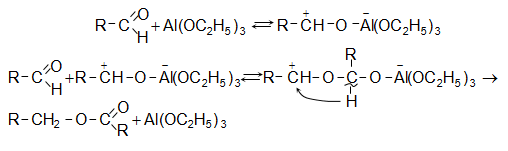
Ամփոփելով ալդեհիդների և կետոնների քիմիական հատկությունները` անհրաժեշտ է ուշադրություն դարձնել դրանց էական տարբերությունների վրա:
Ալդեհիդները հեշտությամբ ենթարկվում են օքսիդացման առանց շղթայի փոփոխության, իսկ կետոնները դժվար են օքսիդանում` ածխածնային շղթայի խզմամբ: Ալդեհիդները տալիս են արծաթահայելու ռեակցիա, կետոնները` ոչ:
Ալդեհիդները
թթվի
ներկայությամբ
պոլիմերանում
են ալդեհիդ-ամոնիակի,
սպիրտների
հետ առաջացնում
են ացետալներ,
ենթարկվում
են բարդ եթերային
կոնդենսացման,
ֆուքսինծծմբաթթվի
լուծույթի
հետ առաջացնում
են գունավորում,
Ֆելինգի
լուծույթի
հետ առաջացնում
են նստվածք`
![]() իսկ կետոններն
ընդունակ
չեն նման փոխարկումների:
իսկ կետոններն
ընդունակ
չեն նման փոխարկումների:
31.6.1.
Մրջնալդեհիդը (ֆորմալդեհիդ)` ![]() սուր, յուրահատուկ հոտով, թունավոր, շնչառական ուղիների վրա ազդող, արցունքաբեր, ջրում լավ լուծվող գազ է: Արտադրությունում ֆորմալդեհիդ ստանում են երկու եղանակով` մեթանի և դրա որոշ հոմոլոգների ոչ լրիվ օքսիդացումով և մեթանոլի օքսիդացումով կամ դեհիդրումով Ag կատալիզատորի ներկայությամբ
սուր, յուրահատուկ հոտով, թունավոր, շնչառական ուղիների վրա ազդող, արցունքաբեր, ջրում լավ լուծվող գազ է: Արտադրությունում ֆորմալդեհիդ ստանում են երկու եղանակով` մեթանի և դրա որոշ հոմոլոգների ոչ լրիվ օքսիդացումով և մեթանոլի օքսիդացումով կամ դեհիդրումով Ag կատալիզատորի ներկայությամբ ![]()
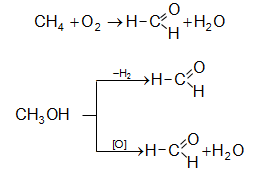
Ալկիլ խմբի բացակայության պատճառով ֆորմալդեհիդին բնորոշ են յուրահատուկ ռեակցիաներ:
Հիմնային միջավայրում ֆորմալդեհիդը ենթարկվում է օքսիդավերականգնման (Կանիցարո).
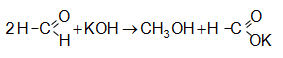
Մեխանիզմ.
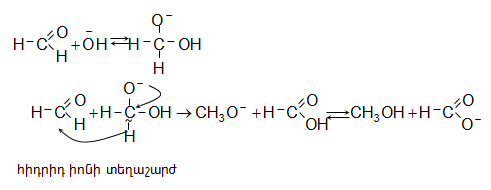
Ֆորմալդեհիդը կամ ֆորմալինն ամոնիակի հետ թույլ տաքացնելիս առաջանում է հեքսամեթիլենտետրամին (ուրոտրոպին), որն առաջին անգամ սինթեզել է Ա. Մ. Բուտլերովը:
![]()
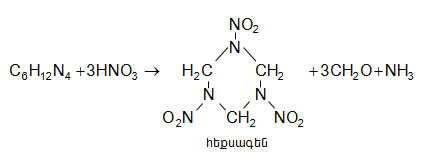
ՈՒրոտրոպինը մեծ քանակությամբ կիրառվում է ֆենոլֆորմալդեհիդային խեժերի և պայթուցիկ նյութերի (հեքսագեն) ստացման համար.
ՈՒրոտրոպինը լայնորեն կիրառվում է նաև բժշկության մեջ որպես միզամուղ միջոց, մտնում է հակահարբուխային «կալցեքս» դեղամիջոցի բաղադրության մեջ, օգտագործվում է երիկամների բուժման համար և այլն:
Հիմնային միջավայրում (կրակաթ) ֆորմալդեհիդը ենթարկվում է ալդոլ կոնդենսացման` հեքսոզների և ավելի բարդ շաքարների առաջացմամբ.
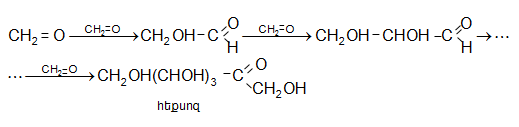
Այլ ալդեհիդների հետ համատեղ կոնդենսացումը բերում է բազմատոմ սպիրտների առաջացման: Օրինակ.
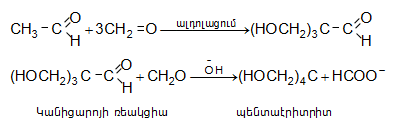
Պենտաէրիտրիտը կիրառվում է խեժերի և ուժեղ պայթուցիկ նյութերի (տետրանիտրոպենտաէրիտրիտ ![]() ստացման համար:
ստացման համար:
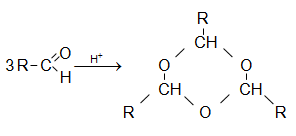
Ֆորմալդեհիդը պոլիմերանում է ինչպես ցիկլային, այնպես էլ գծային պոլիմերների առաջացմամբ: Նոսր թթուների ներկայությամբ ֆորմալդեհիդն առաջացնում է բյուրեղային ցիկլոտրիմեր` ![]()
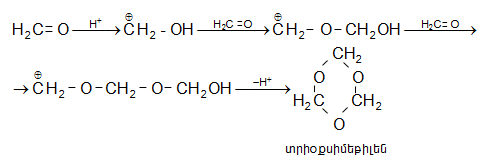
Տրիմերն
օժտված չէ
ալդեհիդային
հատկություններով,
սակայն
հեշտությամբ
կարող է վերածվել
ֆորմալդեհիդի:
Չոր, գազային
ֆորմալդեհիդը
կատալիզատորի
ներկայությամբ
(երկաթի
կարբոնիլ) առաջացնում
է
բարձրամոլեկուլային
ֆորմալդեհիդ ![]()
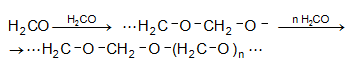
Ստացված
պոլիմերն
անլուծելի է
բոլոր լուծիչներում,
ունի մեծ
ամրություն և
օգտագործվում
է սինթետիկ
մանրաթելի և
տարբեր առարկաների
(խողովակներ,
թիթեղներ և
այլն) պատրաստման
համար: Ջրային
միջավայրում
ստացվող
պոլիմերը` ![]() երբ n=8…10,
կոչվում է
պարաֆորմ, որը
հիմնականում
օգտագործվում
է որպես
ֆորմալդեհիդի
հարմար տեղափոխման
միջոց, քանի
որ այն նոսր
երբ n=8…10,
կոչվում է
պարաֆորմ, որը
հիմնականում
օգտագործվում
է որպես
ֆորմալդեհիդի
հարմար տեղափոխման
միջոց, քանի
որ այն նոսր ![]() հետ
տաքացնելիս
նորից
առաջացնում է
գազային
ֆորմալդեհիդ:
ՈՒրոտրոպինը,
պարաֆորմը և
տրիօքսիմեթիլենը
հաբերի ձևով
օգտագործվում
են որպես
վառելիք (չոր
սպիրտ):
հետ
տաքացնելիս
նորից
առաջացնում է
գազային
ֆորմալդեհիդ:
ՈՒրոտրոպինը,
պարաֆորմը և
տրիօքսիմեթիլենը
հաբերի ձևով
օգտագործվում
են որպես
վառելիք (չոր
սպիրտ):
Ֆորմալդեհիդը կոնդենսանում է զանազան նյութերի հետ` առաջացնելով արհեստական խեժեր, որոնք ունեն արդյունաբերական նշանակություն: Այսպես, ֆենոլի հետ առաջացնում է ֆենոլֆորմալդեհիդային խեժ, միզանյութի կամ մելամինի հետ` կարբամիդային խեժ և այլն:
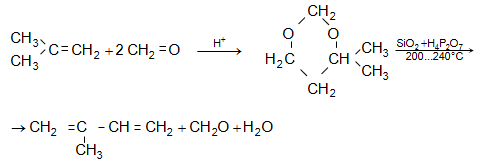
Պրինսի
ռեակցիա`
ֆորմալդեհիդը
կոնդենսանում
է իզոբութիլենի
հետ`
առաջացնելով
4,4-դիմեթիլ-1,3-դիօքսան,
որը կատալիզատորի
ներկայությամբ
![]()
![]() քայքայվում
է` առաջացնելով
իզոպրեն (տես
«Ալկեններ»).
քայքայվում
է` առաջացնելով
իզոպրեն (տես
«Ալկեններ»).
Ֆորմալդեհիդն օգտագործվում է գլիցերինի արտադրությունում, նիտրո և ամինոսպիրտների ստացման համար և այլն:
31.6.2.
Քացախաթթվական
ալդեհիդը
(ացետալդեհիդ)`
![]() տհաճ,
սուր հոտով
հեղուկ է:
Գոլորշիներն
առաջացնում
են
լորձաթաղանթի
բորբոքում,
գլխացավ,
շնչահեղձություն:
Ացետալդեհիդը
լավ է լուծվում
ջրում և
օրգանական
լուծիչներում:
տհաճ,
սուր հոտով
հեղուկ է:
Գոլորշիներն
առաջացնում
են
լորձաթաղանթի
բորբոքում,
գլխացավ,
շնչահեղձություն:
Ացետալդեհիդը
լավ է լուծվում
ջրում և
օրգանական
լուծիչներում:
Ացետալդեհիդի ստացման արդյունաբերական եղանակներ են ացետիլենի հիդրատացումը, էթիլսպիրտի դեհիդրումը, էթիլենօքսիդի իզոմերացումը, հագեցած ածխաջրածինների մասնակի օքսիդացումը, որոնց մասին արդեն նշվել է: Ժամանակակից ստացման եղանակ է էթիլենի կատալիզային օքսիդացումն ըստ հետևյալ սխեմայի.
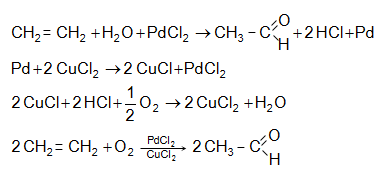
Քացախաթթվական ալդեհիդը հումք է արդյունաբերական մասշտաբով քացախաթթու, քացախաթթվական անհիդրիդ, էթիլսպիրտ, ալդոլ, բութիլսպիրտ, ացետալներ, ալդեհիդամոնիակ, էթիլացետատ, պենտաէրիտրիտ և այլ նյութերի ստացման համար:
Ացետալդեհիդը կոնդենսանում է ֆենոլի և այլ նյութերի հետ` առաջացնելով արհեստական խեժեր, որոնք օգտագործվում են պլաստիկ զանգվածների արտադրությունում:
Ծծմբական
թթվի
ներկայությամբ
ացետալդեհիդը
պոլիմերանում
է
պարալդեհիդի` ![]() և
մետալդեհիդի`
և
մետալդեհիդի` ![]() Պարալդեհիդը
հեղուկ է
Պարալդեհիդը
հեղուկ է ![]() իսկ
մետալդեհիդը`
բյուրեղային
նյութ: Թթվի հետքերի
ներկայությամբ
տաքացնելիս
երկուսն էլ
դեպոլիմերանում
են`
վերածվելով
ացետալդեհիդի:
Պարալդեհիդն
ամոնիակի հետ
առաջացնում է
2-մեթիլ-5-վինիլպիրիդին,
որն
օգտագործվում
է
կաուչուկների
արտադրությունում.
իսկ
մետալդեհիդը`
բյուրեղային
նյութ: Թթվի հետքերի
ներկայությամբ
տաքացնելիս
երկուսն էլ
դեպոլիմերանում
են`
վերածվելով
ացետալդեհիդի:
Պարալդեհիդն
ամոնիակի հետ
առաջացնում է
2-մեթիլ-5-վինիլպիրիդին,
որն
օգտագործվում
է
կաուչուկների
արտադրությունում.
31.6.3.
Տրիքլորքացախաթթվական
ալդեհիդը
(քլորալ)` ![]() անգույն,
սուր հոտով
հեղուկ է: Ջրի
հետ առաջացնում
է
բյուրեղահիդրատ`
քլորալհիդրատ,
որի կայունությունը
բացատրվում է
քլորի ուժեղ ինդուկտիվ
էֆեկտով.
անգույն,
սուր հոտով
հեղուկ է: Ջրի
հետ առաջացնում
է
բյուրեղահիդրատ`
քլորալհիդրատ,
որի կայունությունը
բացատրվում է
քլորի ուժեղ ինդուկտիվ
էֆեկտով.
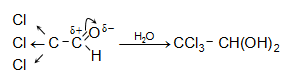
ՈՒնի քնաբեր հատկություն: Ստացվում է էթիլսպիրտի քլորացումով.
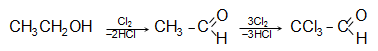
Արդյունաբերության մեջ քլորալի կոնդենսացումով քլորբենզոլի հետ ստանում են միջատասպան (ինսեկտիցիդ) նյութ, որը կոչվում է ԴԴՏ:
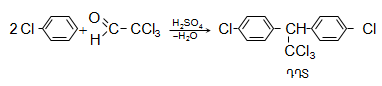
Արդյունաբերական մասշտաբով ալկալիների ազդեցությամբ քլորալից ստանում են քլորոֆորմ.
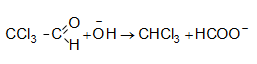
31.6.4. Ացետոն` ![]() անգույն, բնորոշ հոտով հեղուկ է, լավ լուծվում է ջրում և շատ օրգանական լուծիչներում:
անգույն, բնորոշ հոտով հեղուկ է, լավ լուծվում է ջրում և շատ օրգանական լուծիչներում:
Ստացվում է`
ա) իզոպրոպիլ սպիրտից` օքսիդացումով կամ դեհիդրումով,
բ) իզոպրոպիլբենզոլի օքսիդացումով` ֆենոլի հետ համատեղ,
գ) ածխաջրերից` ացետոն-բութանոլային խմորումով:
Ացետոնը լայն կիրառություն ունի լաքերի և ներկերի, ացետատային մետաքսի արտադրությունում, կինոժապավենների, անծուխ վառոդի ստացման համար` որպես լուծիչ: Ելանյութ է չջարդվող օրգանական ապակի, կետեն և այլ միացություններ ստանալու համար:
32. ՉՀԱԳԵՑԱԾ ԱԼԴԵՀԻԴՆԵՐ ԵՎ ԿԵՏՈՆՆԵՐ
Չհագեցած ալդեհիդներից կդիտարկենք ակրոլեինը և կրոտոնալդեհիդը:
32.1.
Ակրոլեինը` ![]() անգույն շատ սուր հոտով հեղուկ է, ուժեղ արցունքաբեր է: ԻԿ սպեկտրում
անգույն շատ սուր հոտով հեղուկ է, ուժեղ արցունքաբեր է: ԻԿ սպեկտրում ![]() խմբին յուրահատուկ
խմբին յուրահատուկ
![]() կլանումները զուգորդման հետևանքով տեղաշարժված են
կլանումները զուգորդման հետևանքով տեղաշարժված են ![]()
Ստացվում է`
ա) ֆորմալդեհիդի և ացետալդեհիդի ալդոլ կոնդենսացմամբ.
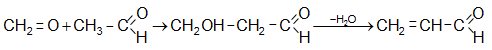
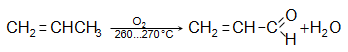
բ) պրոպիլենի անմիջական օքսիդացումով.
գ) գլիցերինի դեհիդրատացումով.
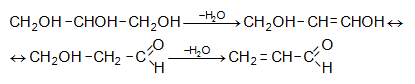
Ակրոլեինը
ցուցաբերում
է էթիլենային
ածխաջրածինների
և ալդեհիդների
բոլոր
հատկությունները,
սակայն
![]() զուգորդման
հետևանքով
այն օժտված
է որոշ առանձնահատկություններով:
զուգորդման
հետևանքով
այն օժտված
է որոշ առանձնահատկություններով:
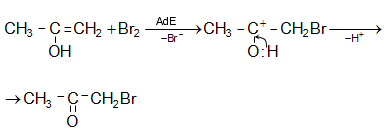
Հալոգենաջրածինները կրկնակի կապին միանում են հակառակ Մարկովնիկովի կանոնի.
![]()
Մեխանիզմ AdE
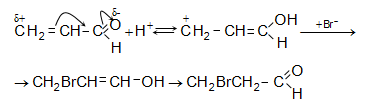
Նատրիումի հիդրոսուլֆիտը միանում է ոչ միայն կարբոնիլային խմբին, այլ նաև կրկնակի կապին.
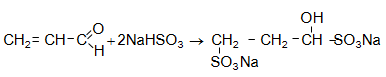
Կապտաթթուն միանում է կարբոնիլային խմբին`
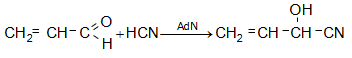
Ակրոլեինը մնալուց պոլիմերանում է: Հիդրոխինոնի փոքր քանակները կանխում են պոլիմերացումը:
Ակրոլեինն օգտագործվում է պլաստիկ զանգվածների արտադրությունում, ինչպես նաև գլիցերին և մեթիոնին ստանալու համար:
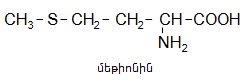
32.2.
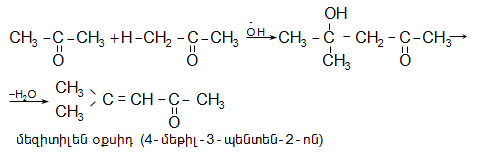
Կրոտոնալդեհիդը
(2-բութենալ)`
սուր հոտով
հեղուկ է, ![]() Ստացվում
է
ացետալդեհիդից
կրոտոնային
կոնդենսացումով:
Օգտագործվում
է
կարագալդեհիդի,
բութանոլի,
կարագաթթվի,
մալեինաթթվի
ստացման
համար:
Քիմիական
հատկություններով
նման է
ակրոլեինին:
Ստացվում
է
ացետալդեհիդից
կրոտոնային
կոնդենսացումով:
Օգտագործվում
է
կարագալդեհիդի,
բութանոլի,
կարագաթթվի,
մալեինաթթվի
ստացման
համար:
Քիմիական
հատկություններով
նման է
ակրոլեինին:
32.3.
Մեթիլվինիլկետոնը` հեղուկ է, ![]() չհագեցած կետոնների պարզագույն ներկայացուցիչն է:
չհագեցած կետոնների պարզագույն ներկայացուցիչն է:
Ստացվում է`
ա) վինիլացետիլենի հիդրատացումով.
![]()
բ) ֆորմալդեհիդի հետ ացետոնի կոնդենսացումով և ստացված օքսիկետոնի դեհիդրատացումով.
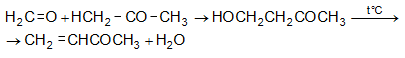
Մեթիլվինիլկետոնը ցուցաբերում է ինչպես կետոնների, այնպես էլ էթիլենային միացությունների հատկություններ: Ի տարբերություն ակրոլեինի` HCN-ը միանում է մեթիլվինիլկետոնի էթիլենային կապին.
![]()
Մեթիլվինիլկետոնը հեշտությամբ պոլիմերանում է` առաջացնելով թափանցիկ, անգույն, ապակենման զանգված, որն օգտագործվում է պլաստիկ զանգվածների արտադրությունում:
Կետեններն առանձնահատուկ միացություններ են, որոնք կառուցվածքով նման են չհագեցած կետոններին և ալկեններին: Առաջին ներկայացուցիչը կոչվում է կետեն`![]() սուր հոտով գազ է:
սուր հոտով գազ է:
Ստացվում է ացետոնի կամ քացախաթթվի պիրոլիզով.
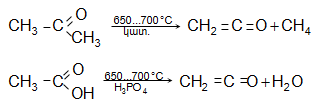
Կետենը
կետոններին
բնորոշ
հատկություններ
չունի,
մասնակցում
է ![]() խմբի միացման
ռեակցիաների:
Մնալուց
դիմերանում
է (դիկետեն):
Քիմիական
արդյունաբերությունում
կետենն
ունի
լայն
կիրառություն:
Դրանից
ստանում
են քացախաթթու,
քացախաթթվական
անհիդրիդ,
էթիլացետատ,
ացետոքացախաթթվական
եթեր,
դիկետեն
և այլն.
խմբի միացման
ռեակցիաների:
Մնալուց
դիմերանում
է (դիկետեն):
Քիմիական
արդյունաբերությունում
կետենն
ունի
լայն
կիրառություն:
Դրանից
ստանում
են քացախաթթու,
քացախաթթվական
անհիդրիդ,
էթիլացետատ,
ացետոքացախաթթվական
եթեր,
դիկետեն
և այլն.
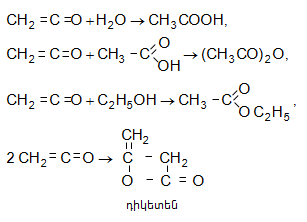
32.5. Դիալդեհիդներ և դիկետոններ
Այս միացությունների մոլեկուլում առկա են երկու կարբոնիլային խումբ, որոնց փոխադարձ դասավորությամբ պայմանավորված` լինում են ![]() դիալդեհիդներ և դիկետոններ.
դիալդեհիդներ և դիկետոններ.
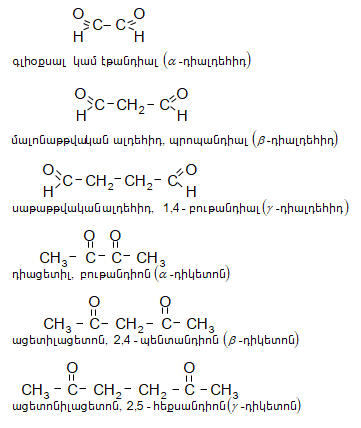
Գլիօքսալը դեղին
գույնի պինդ
նյութ է, ![]() Ստացվում
է էթիլսպիրտը,
ացետալդեհիդը,
էթիլենգլիկոլը
մեղմ
պայմաններում
օքսիդացնելիս.
Ստացվում
է էթիլսպիրտը,
ացետալդեհիդը,
էթիլենգլիկոլը
մեղմ
պայմաններում
օքսիդացնելիս.
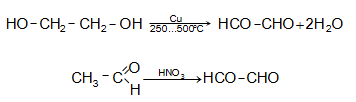
Գլիօքսալը ցուցաբերում է ալդեհիդներին բնորոշ հատկություններ: Ռեակցիաներին մասնակցում է ինչպես մեկ, այնպես էլ երկու կարբոնիլային խմբով: Հալված վիճակում արագորեն պոլիմերանում է` տալով անգույն պինդ տրիմեր:
Դիացետիլը
դեղին
գույնի,
սուր
հոտով
հեղուկ
է, ![]() Գոլորշիները
նույնպես
ունեն
դեղին
գույն:
Ստացվում
է մեթիլէթիլկետոնից`
ազոտային
թթվով
կամ ամիլնիտրիտով
ազդելիս`
Գոլորշիները
նույնպես
ունեն
դեղին
գույն:
Ստացվում
է մեթիլէթիլկետոնից`
ազոտային
թթվով
կամ ամիլնիտրիտով
ազդելիս`
Ստացված նիտրոզոկետոնն իզոմերվում է դիկետոնի մոնօքսիմի, որը նոսր ծծմբական թթվով տաքացնելիս փոխարկվում է դիացետիլի.
Դիացետիլին բնորոշ են կետոններին յուրահատուկ ռեակցիաներ: Դիացետիլի դիօքսիմը (դիմեթիլգլիօքսիմ) օգտագործվում է նիկելի հայտնաբերման համար (Չուգաևի ռեակցիա): Այն նիկելի աղերի հետ առաջացնում է վառ մանուշակագույն բյուրեղային նստվածք: Դիացետիլն օգտագործվում է սննդարդյունաբերության մեջ:
Արոմատիկ ալդեհիդները, որոնցում կարբոնիլային խումբը միացած է բենզոլային օղակի ածխածնի ատոմին, անվանվում են ըստ համապատասխան թթուների, իսկ կողմնային շղթայում ալդեհիդային խմբով միացությունները՝ որպես արիլ տեղակալված ալիֆատիկ ալդեհիդներ:
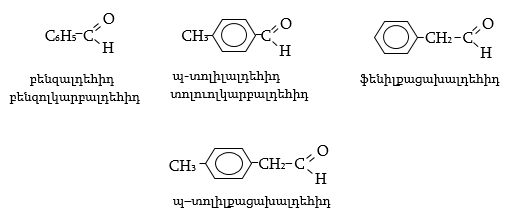
33.1. Ֆիզիկական հատկություններ
Արոմատիկ ալդեհիդները դառը նշի հոտով, ջրում անլուծելի հեղուկներ են: Արոմատիկ օղակից հեռացված կարբոնիլային խմբով ալդեհիդներն ունեն ավելի սուր հոտ: Բենզալդեհիդը ![]() խառնվում սպիրտի, եթերի, բենզոլի, քլորոֆորմի հետ, օդում մնալուց դեղնում է:
խառնվում սպիրտի, եթերի, բենզոլի, քլորոֆորմի հետ, օդում մնալուց դեղնում է:
33.2 Կիրառման բնագավառներ, թունավորություն
Արոմատիկ ալդեհիդներից կարևոր նշանակություն ունի բենզալդեհիդը, որը օդում արագ օքսիդանում է բեզոյական թթվի: Բենզալդեհիդը բնության մեջ տարածված է դառը նշի յուղում ամիգդալինի գլյուկոզիդի տեսքով ![]() բալի, ծիրանի, դեղձի կորիզներում: Բենզալդեհիդը լայն կիրառություն ունի օծանելիքի, ներկանյութերի, հոտավետ նյութերի արտադրությունում, ՍԹԿ-ն
բալի, ծիրանի, դեղձի կորիզներում: Բենզալդեհիդը լայն կիրառություն ունի օծանելիքի, ներկանյութերի, հոտավետ նյութերի արտադրությունում, ՍԹԿ-ն ![]() է: Դարչնալդեհիդը`
է: Դարչնալդեհիդը` ![]() կիրառվում է օծանելիքի արտադրությունում: Սալիցիլալդեհիդը (օ-օքսիբենզալդեհիդ) կիրառվում է որոշ ներկանյութերի, վանիլինի (պ-օքսի, մ-մեթօքսիբենզալդեհիդ), կումարինի (օ-դարչնաթթվի լակտոն) ստացման համար: Վերջիններս որպես հոտավետ նյութեր կիրառվում են օծանելիքի և սննդի արտադրություններում:
կիրառվում է օծանելիքի արտադրությունում: Սալիցիլալդեհիդը (օ-օքսիբենզալդեհիդ) կիրառվում է որոշ ներկանյութերի, վանիլինի (պ-օքսի, մ-մեթօքսիբենզալդեհիդ), կումարինի (օ-դարչնաթթվի լակտոն) ստացման համար: Վերջիններս որպես հոտավետ նյութեր կիրառվում են օծանելիքի և սննդի արտադրություններում:
Դիկումարինը (3,3-մեթիլեն-բիս-օքսիկումարին) և որոշ նմանատիպ միացություններ կիրառվում են բժշկության մեջ որպես արյան մակարդելիության դանդաղեցնողներ և սրտամկանի ինֆարկտի կանխարգելիչներ: Արոմատիկ ալդեհիդների մոլեկուլային զանգվածի աճով նվազում է գրգռիչ ազդեցությունը:
33.3.1. Ածխաջրածինների օքսիդացում. լաբորատոր պայմաններում ռեակցիան իրականացվում է քրոմիլքլորիդով (Էթարի ռեակցիա), արտադրական պայմաններում՝ քրոմաթթվով, օդի թթվածնով՝ կատալիզատորի ներկայությամբ (վանադիումի պենտօքսիդ) կամ մանգանի դիօքսիդով 65%-ոց ծծմբական թթվով ![]()
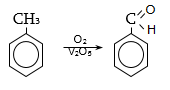
33.3.2.
Դիհալոգենածանցյալների
հիդրոլիզ ![]() երկաթի
կատալիզատորի
ներկայությամբ.
երկաթի
կատալիզատորի
ներկայությամբ.
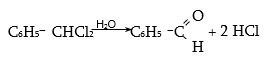
33.3.3. Բենզիլքլորիդի հիդրոլիզ օքսիդիչների ներկայությամբ.
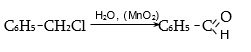
33.3.4.
Ստացման
ընդհանուր
եղանակ է ![]() փոխարկումը
ալդեհիդային
խմբի,
բենզիլքլորիդի
տաքացումով
ուրոտրոպինի
(հեքսամեթիլենտետրամին)
ջրային
լուծույթում (Սոմլե):
Փոխազդեցությունների
հավանական
հաջորդականությունը
կարելի է
ներկայացնել
հետևյալ
սխեմայով.
փոխարկումը
ալդեհիդային
խմբի,
բենզիլքլորիդի
տաքացումով
ուրոտրոպինի
(հեքսամեթիլենտետրամին)
ջրային
լուծույթում (Սոմլե):
Փոխազդեցությունների
հավանական
հաջորդականությունը
կարելի է
ներկայացնել
հետևյալ
սխեմայով.
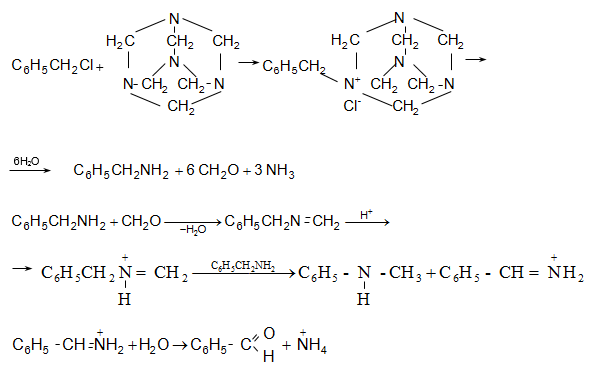
33.3.5.
Արոմատիկ
ածխաջրածինների
փոխազդեցություն
ածխածնի
օքսիդի (II) և
քլորաջրածնի
հետ ![]() (Լյուիսի
թթուներ) կատալիզատորների
ներկայությամբ
(Գատերման-Կոխ):
Ենթադրվում է,
որ միջանկյալ
փուլում
առաջանում է
ֆորմիլքլորիդ
(CO և HCl
փոխազդեցություն),
որը
փոխազդում է
որպես
էլեկտրոֆիլ
ռեագենտ ըստ Ֆրիդել-Կրաֆտսի.
(Լյուիսի
թթուներ) կատալիզատորների
ներկայությամբ
(Գատերման-Կոխ):
Ենթադրվում է,
որ միջանկյալ
փուլում
առաջանում է
ֆորմիլքլորիդ
(CO և HCl
փոխազդեցություն),
որը
փոխազդում է
որպես
էլեկտրոֆիլ
ռեագենտ ըստ Ֆրիդել-Կրաֆտսի.
![]()
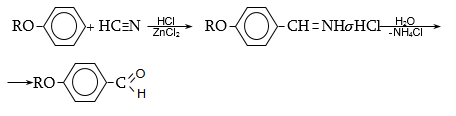
33.3.6. Ֆենոլներում և դրանց եթերներում ալդեհիդային խումբ ներմուծելու համար կիրառվում է Գատերման-Կոխի ռեակցիայի այն տարբերակը, երբ ածխածնի օքսիդի փոխարեն օգտագործվում է կապտաթթու, իսկ ալյումինի քլորիդի փոխարեն` ցինկի քլորիդ.
33.3.7. Ֆենոլների օրթո դիրք ալդեհիդային խումբ է մտցվում Ռեյմեր-Թիմանի եղանակով: ֆենոլի ուժեղ հիմնային լուծույթը, փոխազդելով քլորոֆորմի հետ, առաջացնում է օ-օքսիբենզալդեհիդ (սալիցիլալդեհիդ): Ենթադրվում է, որ ռեակցիայի խառնուրդում առաջանում է կարբեն (քլորոֆորմի փոխազդեցություն հիմքի հետ), որն էլ փոխազդում է ֆենոլյատի հետ (տես «Արոմատիկ օքսիմիացություններ»):
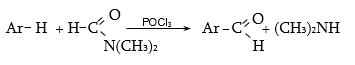
33.3.8. Արոմատիկ
ածխաջրածինների
(ամիններ,
ֆենոլներ,
եթերներ)
կոնդենսացում
մրջնաթթվի
դիալկիլամիդների
և ![]() հետ
(Վիլսմայեր).
հետ
(Վիլսմայեր).
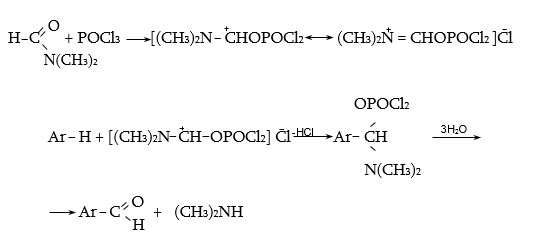
Ռեակցիայի հավանական ընթացքը հետևյալն է.
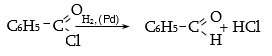
33.3.9. Կարբոնաթթուների ֆունկցիոնալ ածանցյալների վերականգնում պալադիումի կամ նիկելի կատալիզատորով ըստ Զայցև-Ռոզենմունդի.
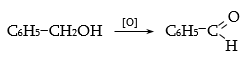
33.3.10. Արոմատիկ ալդեհիդների ստացման համար կարելի է կիրառել նաև ալիֆատիկ ալդեհիդների սինթեզի եղանակներ. առաջնային սպիրտների օքսիդացում, Գրինյարի ռեակտիվի և օքսոմիացությունների փոխազդեցություն և այլն.
Արոմատիկ ալդեհիդներին բնորոշ են ալիֆատիկ շարքի ալդեհիդների ռեակցիաները. արծաթի օքսիդով օքսիդանում են համապատասխան թթուների, միացնում են կապտաթթու և նատրիումի հիդրոսուլֆիտ, հիդրօքսիլամին: Հիդրազինը և ածանցյալներն առաջացնում են բյուրեղային նյութեր, որոնք կիրառվում են ալդեհիդի ինքնությունը պարզելու համար: Բենզալդեհիդը և նմանակները, որոնք ![]() ջրածին չունեն, ալդոլ կոնդենսացման չեն ենթարկվում:
ջրածին չունեն, ալդոլ կոնդենսացման չեն ենթարկվում:
33.4.1. Օքսիդացում
Արոմատիկ ալդեհիդներին (ինչպես նաև ալիֆատիկ նմանակներին) բնորոշ են երկու տիպի օքսիդացման ռեակցիաներ (հոմոլիտիկ-շղթայական և հետերոլիտիկ), որոնց վերջնական արդյունքում ստացվում են համապատասխան թթուներ: Օդում մնալուց ինքնաբերաբար օքսիդանում են, իսկ լույսի ազդեցությամբ, նաև անցողիկ մետաղների աղերի ներկայությամբ (Fe, Mn) ռեակցիան արագանում է (հոմոլիտիկ օքսիդացում).
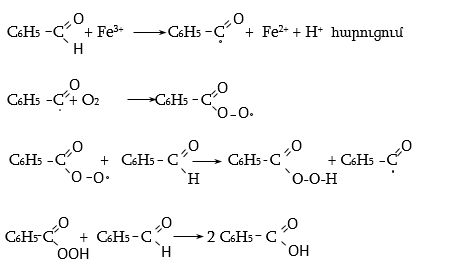
Գործընթացը կանխվում է չնչին քանակներով կանխարգելիչների ներկայությամբ:
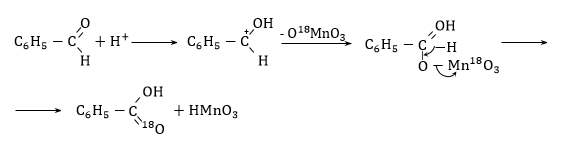
Հետերոլիտիկ օքսիդացումը կարելի է իրականացնել պերմանգանատով: Ռեակցիան կատալիզվում է թթվով: Փոխազդեցության մեխանիզմն ուսումնասիրվել է դեյտերացված բենզալդեհիդի և պերմանգանատում թթվածնի նշված ատոմի (18O) օգնությամբ: ՈՒսումնասիրությունների արդյունքում պարզվել է, որ դեյտերացված բենզալդեհիդը յոթ անգամ դանդաղ է օքսիդանում, նշանակում է ռեակցիայի արագությունը բնորոշող փուլում մասնակցում են C-D և C-H կապերը: Քանի որ ստացված բենզոյական թթուն պարունակում է 50% նշված ![]() թթվածին, ուրեմն օքսիդացումը կատարվում է ոչ թե ջրի, այլ պերմանգանատի թթվածնով: Հիմք ընդունելով վերը նշված փաստարկները` ռեակցիան կարելի է նկարագրել հետևյալ սխեմայով.
թթվածին, ուրեմն օքսիդացումը կատարվում է ոչ թե ջրի, այլ պերմանգանատի թթվածնով: Հիմք ընդունելով վերը նշված փաստարկները` ռեակցիան կարելի է նկարագրել հետևյալ սխեմայով.
33.4.2. Արոմատիկ ալդեհի դներն ամոնիակի հետ փոխազդում են 3:2 հարաբերությամբ` առաջացնելով հիդրոբենզամիդ, որը թթվային միջավայրում տաքացնելիս վերածվում է ամարինի.
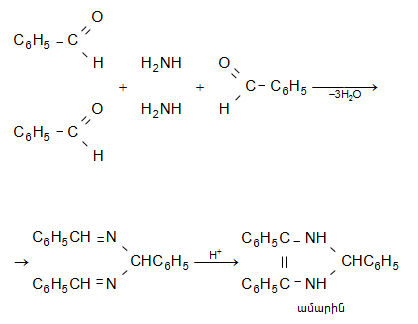
33.4.3. Հիմքի 50%-անոց ջրային կամ սպիրտային լուծույթում արոմատիկ ալդեհիդներն առաջացնում են համապատասխան սպիրտներ և թթվի աղեր (Կանիցարո).
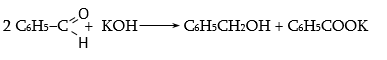
Այն ալիֆատիկ ալդեհիդները, որոնք ունեն α-ջրածին, այս պայմաններում խեժանում են, իսկ α-ջրածնի բացակայության դեպքում Կանիցարոյի օքսիդավերականգնման ռեակցիան ընթանում է բավականին հարթ.
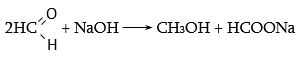
Արոմատիկ ալդեհիդի և մրջնալդեհիդի փոխազդեցության արդյունքում օքսիդանում է միայն մրջնալդեհիդը.
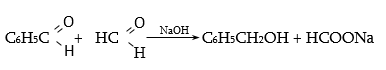
Կանիցարոյի ռեակցիայի մեխանիզմը տես «Ալդեհիդներ և կետոններ» բաժնում:
33.4.4. Կոնդենսացման ռեակցիաներ
ա) արոմատիկ ալդեհիդները հեշտությամբ կոնդենսանում են շարժունակ ջրածին ունեցող ալիֆատիկ ալդեհիդների, կետոնների, եթերների հետ (Կլայզենի կոնդենսացում).
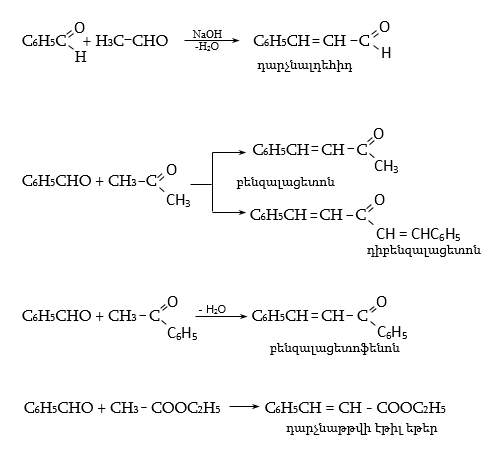
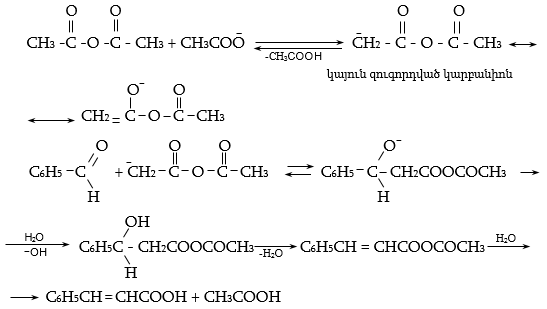
բ) Պերկինի ռեակցիա` կոնդենսացում թթվի անհիդրիդի հետ հիմնային միջավայրում (կողմնակի ռեակցիաներից խուսափելու համար կիրառվում է կարբոնաթթվի աղ): Ստացվում են α,β-չհագեցած թթուներ.

Ռեակցիան մանրամասն ուսումնասիրված է, հավանական մեխանիզմը հետևյալն է.
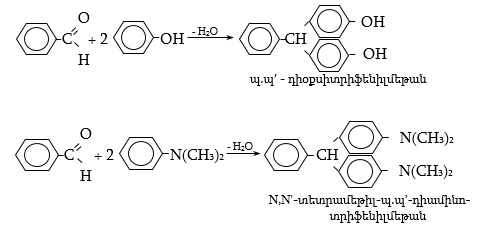
գ) ներկանյութերի սինթեզում մեծ նշանակություն ունի ալդեհիդների կոնդենսացման ռեակցիան ֆենոլների և արոմատիկ ամինների հետ.
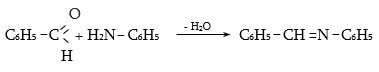
դ) արոմատիկ ալդեհիդները կոնդենսանում են առաջնային արոմատիկ ամինների հետ` առաջացնելով անիլների կամ ազոմեթինների (Շիֆի հիմքեր) դասի կարևորագույն միացություններ.
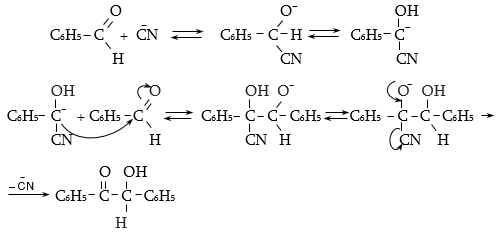
ե) արոմատիկ ալդեհիդները կալիումի ցիանիդի ազդեցությամբ ենթարկվում են բենզոինային կոնդենսացման (Զինին).
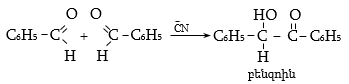
Առաջացած բենզոինը հեշտությամբ օքսիդանում է a-դիկետոնի` բենզիլի.
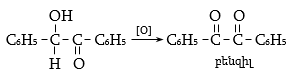
Ռեակցիայի մեխանիզմը հետևյալն է.
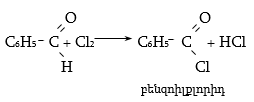
33.4.5. Քլորի ազդեցությամբ բենզալդեհիդը փոխարկվում է բենզոյական թթվի քլորանհիդրիդի, ինչին նպաստում է բենզոիլային խմբի թույլ էլեկտրոնադոնորությունը.
33.4.6. Կարբոնիլ խումբն էլեկտրոֆիլ տեղակալման ռեակցիաներում երկրորդ կարգի կողմնորոշիչ է, դժվարացնում է էլեկտրոֆիլ ռեագենտի մուտքը բենզոլային օղակ և այն կողմնորոշում մետա դիրք.
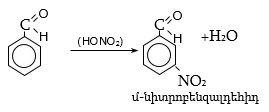
Ի տարբերություն ալիֆատիկ ալդեհիդների` արոմատիկ ալդեհիդները չեն պոլիմերանում:
Արոմատիկ կետոններում կարբոնիլային խումբը կարող է միացած լինել կամ անմիջապես բենզոլային օղակին կամ կողմնային շղթային: Լինում են մաքուր արոմատիկ և խառը` ալկիլ-արիլ կետոններ, կարդացվում են ըստ ռադիկալների կամ որպես ացիլված ածխաջրածին` ոն վերջավորությամբ.

34.1. Ֆիզիկական հատկություններ
Արոմատիկ կետոնները ջրում անլուծելի, ծաղկի հաճելի հոտով, հեղուկ կամ պինդ միացություններ են:
Ացետոֆենոնն անգույն յուղանման հեղուկ է
![]() կամ թխենու հոտով խոշոր դյուրահալ բյուրեղներ են
կամ թխենու հոտով խոշոր դյուրահալ բյուրեղներ են
![]() Լուծվում է սպիրտում, եթերում, քլորոֆորմում, բենզոլում, ջրում չի լուծվում:
Լուծվում է սպիրտում, եթերում, քլորոֆորմում, բենզոլում, ջրում չի լուծվում:
Բենզոֆենոնը
![]() հայտնի է կայուն և անկայուն ձևափոխություններով, լուծվում է օրգանական լուծիչներում, ջրում չի լուծվում: Գտնվում է քարածխային խեժի թորվածքի
հայտնի է կայուն և անկայուն ձևափոխություններով, լուծվում է օրգանական լուծիչներում, ջրում չի լուծվում: Գտնվում է քարածխային խեժի թորվածքի
![]() բաժնեմասում:
բաժնեմասում:
34.2. Կիրառման բնագավառներ, թունավորություն
Առավել կիրառական կետոններից են ացետոֆենոնը և բենզոֆենոնը, որոնք օրգանական սինթեզում լավագույն ելանյութեր են:
Ացետոֆենոնը կիրառվում է օծանելիքի արտադրությունում: Քնաբեր է, ազդում է նյարդային համակարգի վրա:
Բենզոֆենոնի տարբեր ածանցյալներ գտնվում են բույսերից առանձնացվող նյութերում: Այն կիրառվում է լուսակայուն, թթվային նաև դիֆենիլմեթանային ներկանյութերի ստացման համար:
34.3.1. Հիմնական ստացման եղանակը Ֆրիդել-Կրաֆտսի ռեակցիան է (արոմատիկ օղակի ացիլում).
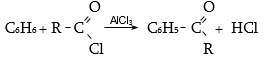
R-արոմատիկ կամ ալիֆատիկ ռադիկալ
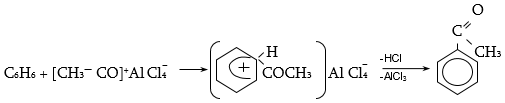
Ալյումինի քլորիդը կիրառվում է քլորանհիդրիդի նկատմամբ համարժեք քանակներով, քանի որ այն կոմպլեքս է առաջացնում.
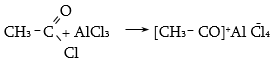
34.3.2. Արոմատիկ կետոնների ստացման համար կարելի է կիրառել ալիֆատիկ նմանակների ստացման եղանակները, օրինակ, երկրորդային արոմատիկ սպիրտների օքսիդացում.
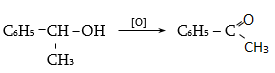
34.3.3. Արոմատիկ չհագեցած կետոններ ստացվում են արոմատիկ ալդեհիդների և ալիֆատիկ կետոնների կոնդենսացման ռեակցիայով.
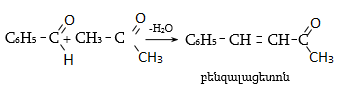
34.3.4. Ֆենոլների ացիլեթերներն ալյումինի քլորիդի ազդեցությամբ վերախմբավորվում են արոմատիկ օքսիկետոնների (Ֆրիսի ռեակցիա): Ցածր ջերմաստիճաններում գերակշռում է պ-տեղակալված իզոմերը, իսկ բարձր ջերմաստիճաններում` օ-իզոմերը.
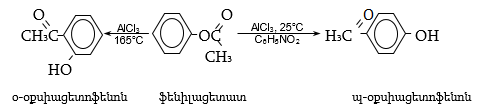
34.3.5. Արոմատիկ ֆենիլկետոններ կարելի է ստանալ նաև Հուբեն-Հեղի եղանակով՝ նիտրիլների և քլորաջրածնի փոխազդեցություն բազմատոմ ֆենոլների կամ դրանց եթերների հետ.
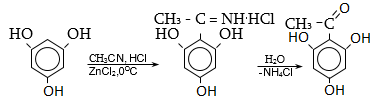
34.3.6. Մեծ կիրառություն ունի Գրինյարի ռեակտիվի և արոմատիկ նիտրիլների փոխազդեցության ռեակցիան.
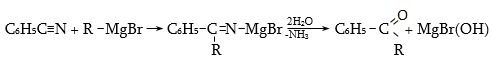
Արոմատիկ կետոններն ալիֆատիկ կետոններից պակաս ռեակցիոնունակ են (օրինակ, չեն փոխազդում նատրիումի հիդրոսուլֆիտի հետ): Ալկիլ-արիլ կետոնները, որոնք ունեն α-ջրածնի ատոմներ, ինչպիսին ացետոֆենոնն է, մասնակցում են ացետոնին բնորոշ բոլոր ռեակցիաներին. կարբոնիլային խմբի միացման և կարբոնիլային թթվածնի տեղակալման ռեակցիաներին, չեն պոլիմերանում այնպես, ինչպես բոլոր կետոնները, բայց կոնդենսանում են (ունեն շարժունակ ջրածին): Էլեկտրոֆիլ տեղակալման ռեակցիաներում կետոխումբը երկրորդ կարգի կողմնորոշիչ է, հաջորդ էլեկտրոֆիլին ուղղորդում է մետա դիրք:
34.4.1. Կոնդենսացման ռեակցիաներ
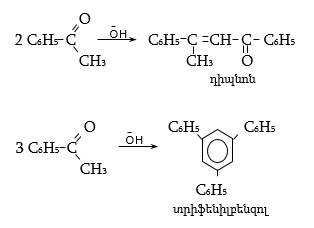
ա) ացետոֆենոնի կրոտոնային կոնդենսացման արդյունքում առաջանում է դիպնոն և տրիֆենիլբենզոլ (տես «Ալդեհիդներ, կետոններ»).
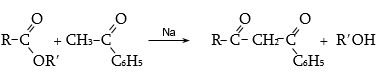
բ) թթուների ածանցյալների հետ կոնդենսացման արդյունքում առաջանում են 1,3-դիկետոններ (բարդ եթերային կոնդենսացում).
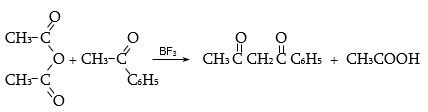
Նույն գործընթացը տեղի է ունենում թթուների անհիդրիդների հետ ըստ Մեյերվեյնի.
գ) Մանիխի ռեակցիա` ֆորմալդեհիդի, առաջնային կամ երկրորդային ամինի և աղաթթվի խառնուրդով ազդելով ացետոֆենոնի վրա (տաքացում), α-ջրածինը տեղակալվում է մոնոալկիլ կամ դիալկիլամինոմեթիլենային խմբով.
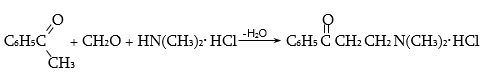
Ֆորմալդեհիդի և ամինի փոխազդեցության արդյունքում, որպես միջանկյալ միացություն, առաջանում է ամինի մեթիլոլային ածանցյալ.
Ռեակցիայի հավանական մեխանիզմը.
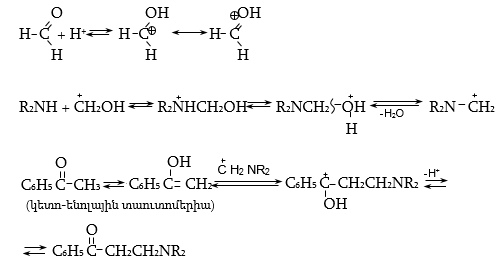
դ) Կլայզենի կոնդենսացում` ալկիլ-արիլ կետոնների α-ջրածինների շարժունակությունը հնարավոր է դարձնում դրանց կոնդենսացումը ալդեհիդների, կետոնների, բարդ եթերների հետ.
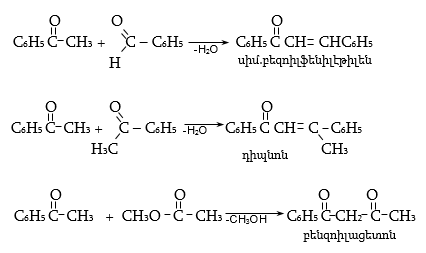
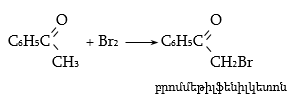
34.4.2. Շնորհիվ α-ջրածինների շարժունակության` ալկիլ-արիլ կետոններն ընդունակ են հալոգենացման (տես «Ալդեհիդներ, կետոններ»):
34.4.3. Մաքուր արոմատիկ կետոնների ճեղքումը նատրիումի ամիդով նկարագրվում է հետևյալ ռեակցիաների հաջորդականությամբ.
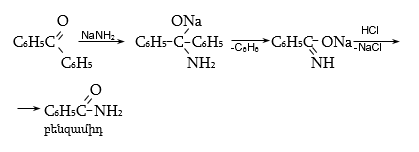
34.4.4. Կետոնները հիդրօքսիլամինի, հիդրազինի և հիդրազինի ածանցյալների հետ փոխազդում են սովորական սխեմայով (AdN, E2):
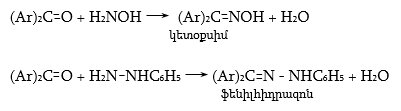
Հետաքրքրություն են ներկայացնում օքսիմները, որոնք գոյություն ունեն երկու երկրաչափական իզոմերների տեսքով. սին և անտի, նման` ցիս-տրանս իզոմերներին.

Ազոտի օրգանական միացությունների երկրաչափական իզոմերներն կոչվում են սին և անտի: Կայուն է անտի իզոմերը, որը կարելի է ստանալ սին իզոմերից թթվի ազդեցությամբ, իսկ հակառակ փոխարկումը հնարավոր է միայն ճառագայթումով: Խիտ հանքային թթուների, քլորանհիդրիդների և անհիդրիդների ազդեցությամբ սին և անտի օքսիմները ենթարկվում են Բեկմանի վերախմբավորման` առաջացնելով իզոմեր ամիդներ.
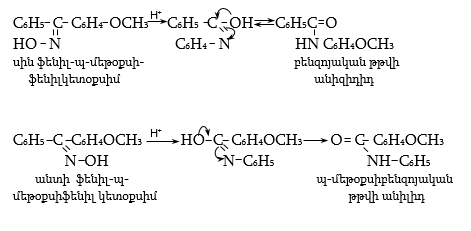
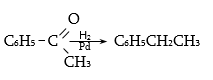
34.4.5. Ռեակցիայի տարբեր պայմաններում կետոնները վերականգնվում են ջրածնով` առաջացնելով զանազան արգասիքներ: Կատալիզային պայմաններում բենզոլային օղակի նկատմամբ α-կարբոնիլային խմբով կետոնները վերականգնվում են ածխաջրածինների:
Ապրոտոն լուծիչներում ալկալիական մետաղների ազդեցությամբ կետոնները վերականգնվում են պինակոնների, որոնք թթվային պայմաններում վերախմբավորվում են պինակոլինների (տես «Երկատոմ սպիրտներ»).
34.4.6. Մագնեզիումօրգանական միացությունները փոխազդում են կետոնների հետ` առաջացնելով ալկոհոլատներ: Վերջիններիս հիդրոլիզով գոյանում են երրորդային սպիրտներ.
1.
Գրել ![]() ընդհանուր
բանաձևով ալդեհիդների
և կետոնների
կառուցվածքային
բանաձևերը և
անվանել:
ընդհանուր
բանաձևով ալդեհիդների
և կետոնների
կառուցվածքային
բանաձևերը և
անվանել:
2. Ինչպիսի՞ էֆեկտներ են գործում հետևյալ միացություններում: Անվանել ռացիոնալ և IUPAC անվանակարգումով .
|
ա) |
CH3CHO, |
ե) |
CH3COCH2Cl, |
|
բ) |
CH3CH2CHO, |
զ) |
CH2=CHCHO, |
|
գ) |
ClCH2CHO, |
է) |
O2NCH2CHO, |
|
դ) |
H2NCH2CH2CHO, |
ը) |
CCl3CHO, |
3. Համապատասխան սպիրտների օքսիդացումով և կատալիզային դեհիդրոգենացումով ստանալ բութանոլ, բութանոն, 3-մեթիլ-2-պենտանոն, 2,2-դիմեթիլ–3–պենտանոն:
4. Ստանալ կարագալդեհիդ ալկենի օքսոսինթեզով, օզոնոլիզով, դիհալոգենածանցյալի հիդրոլիզով, սպիրտի օքսիդացումով և դեհիդրոգենացումով, կարբոնաթթվի աղի պիրոլիզով, ացիլքլորիդի վերականգնումով, Գրինյարի ռեակտիվով:
5. Համեմատել ացետոնի և պրոպիոնալդեհիդի ռեակցիաները: Գրել տարբերիչ ռեակցիաների հավասարումները:
6. Լրացնել հետևյալ փոխարկումները, նշել ռեակցիաների պայմանները.
7. Հետևյալ միացություններից ստանալ վինիլէթիլկետոն.
ա) ացետիլեն և անօրգանական ռեագենտներ,
բ) ացետիլեն և ֆորմալդեհիդ:
8. Գրել իզոկարագալդեհիդի և մեթիլէթիլկետոնի ընդհանուր ռեակցիաները:
9. Գրինյարի ռեակցիայով ստանալ 2–մեթիլբութանոլ, 5–մեթիլ–2–հեքսանոն: Գրել դրանց փոխազդեցության ռեակցիան հիմնային ռեագենտների հետ:
10. Իրականացնել հետևյալ փոխարկումները.
11.
Պարզել ![]() բաղադրությամբ
նյութի
կառուցվածքը,
որը փոխազդում
է
հիդրօքսիլամինի,
նատրիումի
հիդրոսուլֆիտի
հետ,
օքսիդանում է`
առաջացնելով
քացախաթթու և
ացետոն, արծաթահայելու
ռեակցիա չի
տալիս:
բաղադրությամբ
նյութի
կառուցվածքը,
որը փոխազդում
է
հիդրօքսիլամինի,
նատրիումի
հիդրոսուլֆիտի
հետ,
օքսիդանում է`
առաջացնելով
քացախաթթու և
ացետոն, արծաթահայելու
ռեակցիա չի
տալիս:
12. Նշված ալդեհիդներից որո՞նք են ենթարկվում ալդոլ կոնդենսացման, որո՞նք Կանիցարոյի ռեակցիայի: Բացատրել պատճառը և բերել ռեակցիաների մեխանիզմները.
ա) քացախալդեհիդ,
բ) կարագալդեհիդ,
գ) տրիմեթիլքացախալդեհիդ:
13. Իրականացնել հետևյալ փոխարկումները.
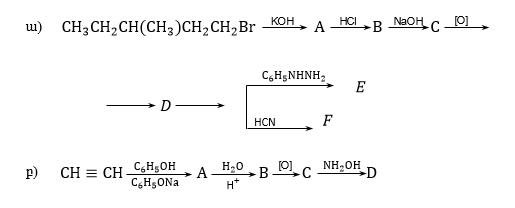
14. Գրել C4H8O բաղադրությամբ միացության կառուցվածքային բանաձևը, եթե այն փոխազդում է նատրիումի հիդրոսուլֆիտի և հիդրօքսիլամինի հետ, օքսիդանում է իզոկարագաթթվի և տալիս է արծաթահայելու ռեակցիա:
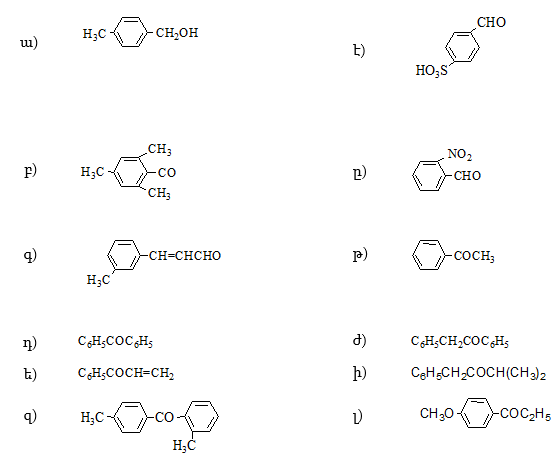
15. Անվանել հետևյալ միացությունները.
16. Համապատասխան թթուների կալցիումական աղերի պիրոլիզով ստանալ իզոկարագալդեհիդ և մեթիլէթիլկետոն:
17. Ստանալ 2,5-դիմեթիլբենզալդեհիդ Գատերման-Կոխի, Վիլսմայերի ֆորմիլացման ռեակցիաներով:
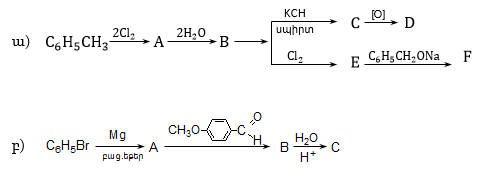
18. Լրացնել հետևյալ փոխարկումները.
19. Մ-տոլուիդինից ստանալ մ-քլորբենզալդեհիդ: Գրել վերջինիս փոխազդեցության ռեակցիաները դիմեթիլանիլինի (ավելցուկով), քացախաթթվի անհիդրիդի, ֆենիլհիդրազինի, հիդրօքսիլամինի, հիդրազինի հետ:
20. Ո՞ր զույգ միացություններով կընթանա ալդոլ կամ կրոտոնային կոնդենսացիա.
ա) բենզալդեհիդ և պ – տոլիլալդեհիդ,
բ) բենզալդեհիդ և պրոպիոնալդեհիդ,
գ) դարչնալդեհիդ և ֆենիլքացախալդեհիդ:
21. Գրել ռեակցիաների պայմանները.
ա)
տոլուոլ ![]() -
դինիտրոբենզալդեհիդ,
-
դինիտրոբենզալդեհիդ,
բ)
բենզոիլքլորիդ
![]() բենզալդեհիդ,
բենզալդեհիդ,
գ)
բենզոլ ![]() մ
–
նիտրոբենզալդեհիդ,
մ
–
նիտրոբենզալդեհիդ,
դ)
բենզոլ ![]() պ
–
քլորբենզալդեհիդ:
պ
–
քլորբենզալդեհիդ:
22. Գրել բենզալդեհիդի և ացետոֆենոնի կոնդենսացման ռեակցիաները հետևյալ միացությունների հետ (Կլայզեն), անվանել ստացվող արգասիքները.
|
ա) |
CH3CHO |
դ) |
CH3COC6H5 |
|
բ) |
CH3COCH3 |
ե) |
C6H5COC6H5 |
|
գ) |
CH3CH2COCH3 |
զ) |
C6H5CH2COCH2CH3 |
23. Նշված կարբոնիլային միացություններից ո՞րն ավելի հեշտ կփոխազդի նուկլեոֆիլ միացման ռեակցիաներում.
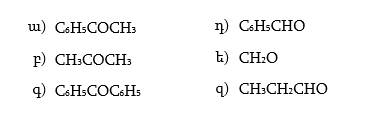
24.
Գրել ![]() բաղադրությամբ
միացության
կառուցվածքային
բանաձևը, եթե
այն
փոխազդում է
ֆենիլհիդրազինի
և նատրիումի
հիդրոսուլֆիտի
հետ, արծաթի օքսիդի
ամոնիակային
լուծույթով տալիս
է
արծաթահայելու
ռեակցիա և
օքսիդանում է
տերեֆտալաթթվի:
բաղադրությամբ
միացության
կառուցվածքային
բանաձևը, եթե
այն
փոխազդում է
ֆենիլհիդրազինի
և նատրիումի
հիդրոսուլֆիտի
հետ, արծաթի օքսիդի
ամոնիակային
լուծույթով տալիս
է
արծաթահայելու
ռեակցիա և
օքսիդանում է
տերեֆտալաթթվի:
25. Գրել բենզալդեհիդի և քացախալդեհիդի տարբերիչ ռեակցիաները:
26. Ստանալ ացետոֆենոն` սպիրտի օքսիդացումով, դիհալոգենածանցյալի հիդրոլիզով, Ֆրիդել-Կրաֆտսի ռեակցիայով: Գրել դրա փոխազդեցության ռեակցիաները կապտաթթվի, ֆենիլհիդրազինի, հիդրօքսիլամինի, բենզալդեհիդի հետ:
27. Բեկմանի վերախմբավորման արդյունքում ստացված միացության հիդրոլիզով առաջացել են պ–մեթօքսիբենզոյական թթու և պ–տոլուիդին: Ինչպիսի՞ն է սկզբնական օքսիմի կառուցվածքը:
28. Գրել ացետոֆենոնի և բենզոֆենոնի տարբերիչ ռեակցիաները:
29. Ստանալ ացետոֆենոն բոլոր հնարավոր ստացման եղանակներով: Գրել դրա փոխազդեցության ռեակցիան ֆորմալդեհիդի և աղաթթվային դիէթիլամինի հետ (Մանիխի ռեակցիա):
30. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.
|
ա) |
պրոպանալի դիմեթիլացետալ, |
|
բ) |
մեթիլերկր.բութիլկետոն, |
|
գ) |
b-քլորկարագալդեհիդ, |
|
դ) |
2-մեթիլ-4-օքսիհեքսանալ, |
|
ե) |
պ-մեթօքսիբենզալդեհիդի ֆենիլհիդրազոն, |
|
զ) |
պրոպանոնի հիդրազոն, |
|
է) |
2-պենտանոնի օքսիմ: |
31. Գրել ալդոլ կոնդենսացման արդյունքում ստացվող բոլոր արգասիքների կառուցվածքային բանաձևերը.
![]()
32. Լրացնել հետևյալ փոխարկումները.
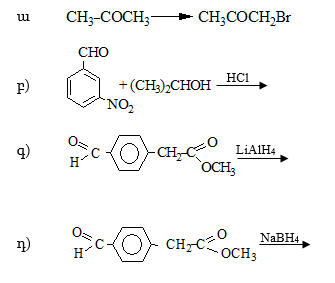
33. Հետևյալ միացությունների համար գրել ենոլային տաուտոմեր ձևերը: Ո՞ր միացություններում է ենոլ ձևը բացակայում և ինչու՞:
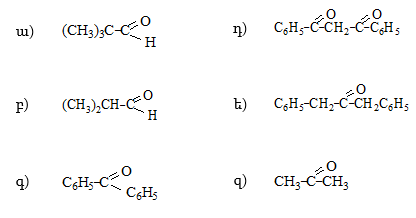
34. Լրացնել հետևյալ ռեակցիաները.
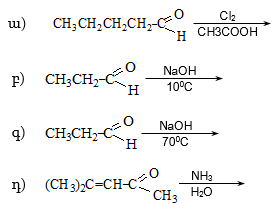
35. Հետևյալ միացությունները դասավորել ըստ թթվայնության աճի.
|
ա) |
C6H5COCH2C6H5 |
դ) |
(CH3)3CCOCH3 |
|
բ) |
C6H5COCH2CH2C6H5 |
ե) |
(CH3)3CCOCH(CH3)2 |
|
գ) |
C6H5COCH2CH2CH3 |
զ) |
(CH3)3CCOCH2CH3 |
36. Գրել հետևյալ փոխարկումը և ստացվող միացության կառուցվածքային բանաձևը.
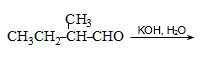
37. Ստանալ.
ա) իզոբութիլենից` 2,6-դիմեթիլ-6-հեպտեն-4-ոն,
բ) 2-քլորպրոպանից` 3-մեթիլ-1-բութանոն; 2,3,4- տրիմեթիլ-3-պենտանոլ; 2,4-դիմեթիլ-3պենտանոլ:
35. ԿԱՐԲՈՆԱԹԹՈՒՆԵՐ ԵՎ ԱԾԱՆՑՅԱԼՆԵՐ
Օրգանական թթուների դասին են պատկանում այն միացությունները, որոնք պարունակում են կարբօքսիլ բնորոշիչ խումբ.
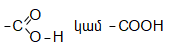
Կարբօքսիլ խումբը կարելի է դիտել որպես կարբոնիլային և հիդրօքսիլ խմբերի համակցում: Կարբոնաթթուները կարող են ունենալ մեկ կամ մի քանի կարբօքսիլ խումբ, որոնցով պայմանավորվում է թթվի հիմնայնությունը. տարբերում են միահիմն, երկհիմն և բազմահիմն թթուներ: Կախված կարբօքսիլ խմբին միացած ռադիկալի կառուցվածքից` թթուները դասակարգվում են հագեցած, չհագեցած թթուների:
35.1. Անվանակարգում իզոմերիա
Միահիմն սահմանային կարբոնաթթուները կարելի է դիտել որպես ալկանների ածանցյալներ, որոնցում ջրածնի ատոմներից մեկը տեղակալված է կարբօքսիլ խմբով: Կարբոնաթթուների ընդհանուր բանաձևն է.
![]()
Միահիմն կարբոնաթթուների իզոմերիան պայմանավորված է ածխածնային շղթայի կառուցվածքով և կարբօքսիլ խմբի դիրքով: Այն սկսվում է հոմոլոգիական շարքի չորրորդ անդամից, որն ունի երկու իզոմեր: Ածխածնային շղթայի աճին զուգընթաց մեծանում է իզոմերների թիվը:
Թթուները հաճախ անվանվում են հին անուններով (ըստ ծագման): Համաձայն ռացիոնալ անվանակարգման, կարդացվում են որպես քացախաթթվի ածանցյալներ (մեթիլ խմբի ջրածնի ատոմները տեղակալված ածխաջրածնային ռադիկալներով): IUPAC անվանակարգումով թթուները կարդացվում են ըստ համապատասխան ալկանի` ավելացնելով թթու բառը: Շղթայի համարակալումն սկսվում է կարբօքսիլ խմբի ածխածնի ատոմից:
HCOOH մրջնաթթու, մեթանաթթու
CH3COOH քացախաթթու, էթանաթթու
CH3CH2COOH պրոպիոնաթթու, մեթիլքացախաթթու,
պրոպանաթթու
CH3CH2CH2COOH կարագաթթու, էթիլքացախաթթու,
բութանաթթու
(CH3)2CHCOOH իզոկարագաթթու,դիմեթիլքացախաթթու,
2-մեթիլպրոպանաթթու
CH3CH2CH2CH2COOH վալերիանաթթու, պրոպիլքացախաթթու,
պենտանաթթու
CH3 CH2CH(CH3) COOH մեթիլէթիլքացախաթթու, 2-մեթիլբութանաթթու
(CH3)2 CHCH2COOH իզոպրոպիլքացախաթթու, 3-մեթիլբութանաթթու
(CH3)3 CCOOH տրիմեթիլքացախաթթու,
2,2-դիմեթիլպրոպանաթթու
Որոշ թթուների հին անվանումներ`
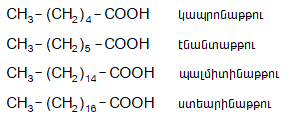
Թթուների
միավալենտ
մնացորդը ![]() կոչվում
է «ացիլ».
անվանվում է
հին կամ IUPAC
անվանակարգումով
(համապատասխան
ալկանի
անվանն ավելացվում
է «ոիլ»
վերջավորություն):
կոչվում
է «ացիլ».
անվանվում է
հին կամ IUPAC
անվանակարգումով
(համապատասխան
ալկանի
անվանն ավելացվում
է «ոիլ»
վերջավորություն):
35.2. Ֆիզիկական հատկություններ
Թթուների
հոմոլոգիական
շարքի
ցածրամոլեկուլային
անդամները
սուր, գրգռիչ հոտով
![]() կամ
դառնահամ,
տհաճ հոտով
կամ
դառնահամ,
տհաճ հոտով ![]() անգույն
հեղուկներ են:
Բարձրամոլեկուլային
հոմոլոգներն
անհոտ պինդ
նյութեր են:
անգույն
հեղուկներ են:
Բարձրամոլեկուլային
հոմոլոգներն
անհոտ պինդ
նյութեր են:
Շնորհիվ O-H կապի բարձր բևեռայնության, կարբոնաթթուներն առաջացնում են ավելի ամուր միջմոլեկուլային ջրածնական կապեր, քան սպիրտները: Ցածրամոլեկուլային կարբոնաթթուներն այդ պատճառով պակաս ցնդող են, քան կարելի էր սպասել ըստ դրանց մոլեկուլային զանգվածների: Ֆիզիկաքիմիական ուսումնասիրությունները ցույց են տալիս, որ հեղուկ, հատկապես գազ ֆազում, գերակշռում են դիմերները,
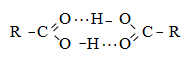
որոնք քայքայվում են լուծույթի խիստ նոսրացման ժամանակ կամ բարձր ջերմաստիճաններում: Ջրածնական կապերի առաջացումը պարզ պատկերվում է ինֆրակարմիր սպեկտրում: Քացախաթթվի սպեկտրում բացակայում է ազատ հիդրօքսիլ խմբերին բնորոշ կլանումը (3640 սմ-1), բայց ինչպես էթանոլի դեպքում, հայտնաբերվում են ասոցված O - H խմբերին բնորոշ կլանումներ: Սակայն 3000 սմ-1 տիրույթում կլանումն էապես շեղված է` համեմատած էթանոլի համապատասխան կլանման հետ (3350 սմ-1): Սա բացահայտում է քացախաթթվում ջրածնական կապերի առավել մեծ ամրությունը: Կարբոնիլային խմբին բնորոշ կլանման տիրույթը (1740 սմ-1) լայնացված է, բայց շեղված չէ` համեմատած քացախաթթվի անհիդրիդի համապատասխան կլանման տիրույթի հետ: Թթուները ջրածնական կապեր են առաջացնում նաև լուծիչների, օրինակ` ջրի հետ: Այդ պատճառով մրջնաթթուն, քացախաթթուն, պրոպիոնաթթուն և կարագաթթուն ջրի հետ խառնվում են բոլոր հարաբերություններով: Մոլեկուլային զանգվածի աճին զուգընթաց թթուների լուծելիությունը ջրում նվազում է, քանի որ ածխաջրածնային ռադիկալի հիդրոֆոբ հատկությունները գերիշխում են կարբօքսիլ խմբի հիդրոֆիլ հատկություններին: Միահիմն թթուների հալման ջերմաստիճանները ցուցաբերում են նույն օրինաչափությունները, ինչ ալկաններում:
35.3. Կիրառման բնագավառներ, թունավորություն
Կարբոնաթթուները կարևոր միացություններ են, լայն կիրառություն ունեն օրգանական սինթեզի տեխնոլոգիաներում և բազմաթիվ այլ քիմիատար բնագավառներում: Կարբոնաթթուները ելանյութեր են օրգանական սինթեզի միջանկյալ` կետեն, վինիլային եթերներ, հալոգենաթթուներ, հալոգենանհիդրիդներ, բարդ եթերներ, ամիդներ և այլ արգասիքներ ստանալու համար: Դրանց ալկալիական աղերն օգտագործվում են որպես օճառներ, էմուլգատորներ, քսայուղեր և այլն: Ծանր մետաղների աղերը կիրառվում են թունաքիմիկատների (ինսեկտիցիդներ, ֆունգիցիդներ) արտադրությունում, ցելյուլոզային եթերները` որպես լաքեր և պլաստիկ զանգվածներ: Լայն կիրառություն ունեն բարդ եթերները` որպես լուծիչներ օրգանական և նավթաքիմիական տեխնոլոգիաներում, թեթև արդյունաբերությունում, սննդի և հոտավետ նյութերի արտադրություններում: Լայն կիրառություն ունեն նաև թթուների ամիդները, անհիդրիդները և ամոնիումային աղերը:
Մրջնաթթուն կիրառվում է տեքստիլ, թղթի և սննդի արտադրություններում, քացախաթթուն` որպես լուծիչ համապատասխան ածանցյալների ստացման գործընթացում, ներկանյութերի, դեղանյութերի արտադրություններում: Կենցաղում օգտագործվում է քացախաթթվի 5…15%-ոց լուծույթը:
Լայն կիրառություն ունեն պրոպիոնաթթուն, կարագաթթուն, վալերիանաթթուն և դրանց ածանցյալները` դեղանյութերի, թունաքիմիկատների, պլաստիկ զանգվածների, օծանելիքի և սննդի արտադրություններում:
Թթուների հալոգենանհիդրիդները (գերազանցապես քլորանհիդրիդները) կիրառվում են լաբորատոր աշխատանքներում և արտադրության մեջ թթուների մյուս ածանցյալների ստացման համար: Քացախաթթվի անհիդրիդն օգտագործվում է որպես ացիլող միջոց և որպես լուծիչ ացետատային մետաքսի, դեղագործական, օծանելիքի արտադրություններում, ինչպես նաև օրգանական սինթեզում: Ցածրամոլեկուլային թթուների և սպիրտների բարդ եթերները ծաղկաբույրով կամ մրգի թարմացնող հոտով հեղուկներ են, կիրառվում են մրգի բնահյութեր ստանալու համար (իզոամիլացետատ` տանձի, իզոամիլիզովալերիատ` խնձորի, էթիլբութիրատ` արքայախնձորի և այլն): Շատ եթերներ (էթիլացետատ, բութիլացետատ, իզոամիլացետատ) կիրառվում են տեխնիկայում որպես արհեստական խեժերի, քսուքների լուծիչներ: Լայն են ամիդների և ամոնիումային կարբօքսիլատների կիրառական շրջանակները:
Քացախաթթվի համաշխարհային արտադրությունը 2001թ. կազմել է 4 մլն տոննա, մրջնաթթվինը նույն տարում` 400000 տոննա, պրոպիոնաթթվինը` 300000 տոննա: Հազարավոր տոննաների են հասնում մյուս, ավելի երկար ածխածնային շղթա ունեցող թթուների արտադրական ծավալները:
Քացախաթթուն թունավոր է, գրգռում է շնչառական օրգանները, լորձաթաղանթը, առաջացնում է մաշկի այրվածք, ՍԹԿ-ն մթնոլորտում կազմում է 0,06 մգ/մ3, աշխատանքային գոտում` 5 մգ/մ3: Առավել լայն օգտագործվող մրջնաթթվի և պրոպիոնաթթվի ՍԹԿ-ները գտնվում են այդ տիրույթներում: Ցածրամոլեկուլային թթուների` մինչև կապրոնաթթու, սահմանային թույլատրելի արժեքները տատանվում են 5 մգ/մ3-ի սահմաններում:
Պարզագույն կարբոնաթթուների հալոգենանհիդրիդները դյուրաեռ, սուր հեղձուցիչ հոտով հեղուկներ են, հաճախ` արցունքաբեր (լաքրիմատոր): Թունավորությամբ աչքի են ընկնում անհիդրիդներն ու ամիդները:
Կարբոնաթթուների ստացման արտադրական հիմնական եղանակներն են.
35.4.1. Հագեցած ածխաջրածինների օքսիդացում, որն իրականացվում է օդով կամ տեխնիկական թթվածնով, ջերմային կամ կատալիզային պայմաններում: Որպես կատալիզատոր կիրառվում են կոբալտի, մանգանի, երկաթի, նիկելի, ցերիումի աղեր: Ցածրամոլեկուլային ալկանների (C1…C3) օքսիդացումն իրականացվում է գոլորշի ֆազում, համապատասխանաբար 420, 280, 2700C, իսկ C4-ից բարձրի դեպքում` հիմնականում հեղուկ ֆազում` ճնշման տակ: Արդյունաբերական նշանակություն ունի քացախաթթվի, պրոպիոնաթթվի և մրջնաթթվի համատեղ ստացումը C4…C7 ալկանների օքսիդացումով.
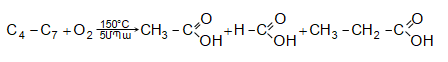
C10…C20
ալկանների
օքսիդացումից
ստացված
թթուներն օգտագործվում
են ![]() օճառի
ստացման
համար:
օճառի
ստացման
համար:
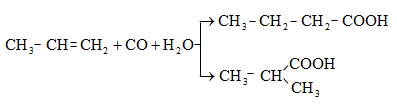
35.4.2. Օքսոսինթեզ, որը կիրառվում է երկու տարբերակով.
ա) օքսոսինթեզով ստացված ալդեհիդն օքսիդացվում է համապատասխան թթվի (տես «Ալդեհիդներ և կետոններ»),
բ)
ալկենների
փոխազդեցությամբ
ածխածնի օքսիդի
և ջրային
գոլորշու հետ
կատալիզատորների
ներկայությամբ
![]()
![]() ջերմաստիճանում,
200…500 մթն ճնշման
տակ ստացվում են
նորմալ և
իզոկառուցվածքով
թթուներ.
ջերմաստիճանում,
200…500 մթն ճնշման
տակ ստացվում են
նորմալ և
իզոկառուցվածքով
թթուներ.
35.4.3. Քանակական ելքերով (99%) թթուներ են ստացվում սպիրտների կարբոնիլացումով ռութենիումի աղերի ներկայությամբ.
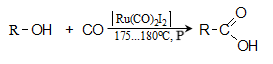
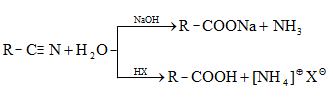
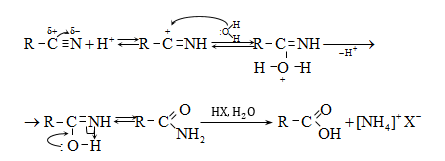
35.4.4. Թթուների ստացման կարևոր եղանակ է համապատասխան նիտրիլների հիդրոլիզը, որն իրականացվում է հիմնային կամ թթվային միջավայրում: Նիտրիլներ ստացվում են ալկալիական մետաղների ցիանիդների և առաջնային ալկիլհալոգենիդների փոխազդեցությամբ.
Հիմնային միջավայրում նիտրիլների հիդրոլիզն ընթանում է հետևյալ մեխանիզմով.
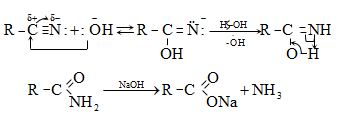
Թթվային հիդրոլիզի մեխանիզմ.
35.4.5. Մետաղօրգանական միացությունների կարբօքսիլացում և ստացված աղի հիդրոլիզ.
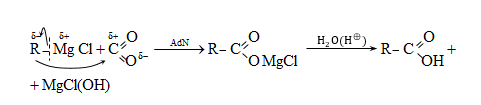
35.4.6.
Ալկենների
կարբօքսիլացումով
խիտ ծծմբական
թթվի և
մրջնաթթվի
խառնուրդով
ստացվում են երրորդային
կարբոնաթթուներ
(Կոխ-Հաաֆի
ռեակցիա)  :
Ռեակցիան
ընթանում է
միջանկյալ
կարբոնիում
իոնի
առաջացման
փուլով, որի
կայունությամբ
է
պայմանավորված
թթվի ելքը.
:
Ռեակցիան
ընթանում է
միջանկյալ
կարբոնիում
իոնի
առաջացման
փուլով, որի
կայունությամբ
է
պայմանավորված
թթվի ելքը.
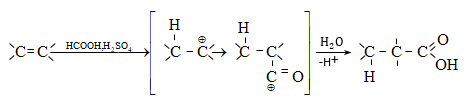
Օրգանական
թթուների
քիմիական
վարքը պայմանավորված
է կարբօքսիլ
խմբի
կառուցվածքով,
որտեղ առկա է ![]() զուգորդում
հիդրօքսիլ
խմբի թթվածնի
չբաշխված
էլեկտրոնային
զույգի և
կարբոնիլային
խմբի
զուգորդում
հիդրօքսիլ
խմբի թթվածնի
չբաշխված
էլեկտրոնային
զույգի և
կարբոնիլային
խմբի ![]() միջև.
միջև.
35.5.1. Թթվային հատկություններ
Շնորհիվ
կարբօքսիլ
խմբի ![]() զուգորդմամբ
ուժեղացված O-H
կապի
բևեռայնության`
կարբոնաթթուները
համեմատաբար
հեշտ են պոկում
պրոտոն`
ցուցաբերելով
թթվային հատկություններ:
Ջրային
լուծույթներում
դիսոցվում են
հետևյալ
սխեմայով.
զուգորդմամբ
ուժեղացված O-H
կապի
բևեռայնության`
կարբոնաթթուները
համեմատաբար
հեշտ են պոկում
պրոտոն`
ցուցաբերելով
թթվային հատկություններ:
Ջրային
լուծույթներում
դիսոցվում են
հետևյալ
սխեմայով.
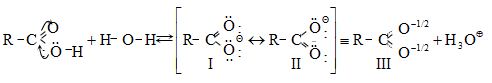
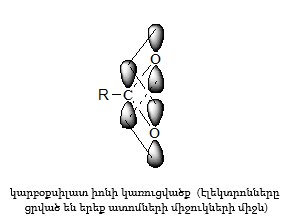
Կարբոնաթթուների դիսոցման ժամանակ առաջանում է զուգորդված կարբօքսիլատ անիոն (III), որի ռեզոնանսային վիճակներն արտահայտվում են I և II կառուցվածքներով: Կարբօքսիլատ անիոնում բացասական լիցքը հավասարաչափ բաշխված է երկու թթվածնի ատոմների միջև, որի շնորհիվ անիոնը ձեռք է բերում հարաբերական կայունություն: Ռենտգենկառուցվածքային վերլուծությունը, էլեկտրոնների դիֆրակցիան հաստատում են, որ կարբօքսիլատ անիոնը ռեզոնանսային հիբրիդ է, որտեղ երկու C-O կապերը համարժեք են:
Թթուների հոմոլոգիական շարքում ամենաուժեղը մրջնաթթուն է, իսկ տեղակալված թթուները թույլ թթուներ են, որը բացատրվում է ալկիլ խմբերի էլեկտրոնադոնոր ազդեցությամբ:
Կարբոնաթթուների թթվայնությունը գնահատվում է դիսոցման հաստատունով.
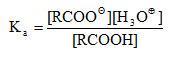
Էլեկտրոնադոնոր տեղակալիչներն ապակայունացնում են կարբօքսիլատ անիոնը և փոքրացնում Ka-ն, իսկ էլեկտրոնակցեպտոր տեղակալիչները, որոնք իրենց վրա են վերցնում բացասական լիցքի մի մասը և մասնակցում լիցքի բաշխմանը, մեծացնում են կարբօքսիլատ անիոնի կայունությունը և Ka-ն:

Ստորև բերված են որոշ կարբոնաթթուների դիսոցման հաստատունները.
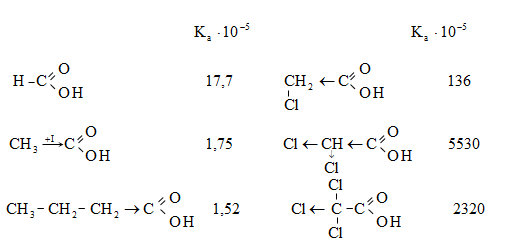
Կարբոնաթթուների թթվային հատկություններն արտահայտվում են մետաղների, դրանց օքսիդների և հիդրօքսիդների հետ փոխազդեցության ռեակցիաներում.
Կարբոնաթթուների
աղերը ջրում
հիդրոլիզվում
են. ունեն
հիմնային
ռեակցիա:
Աղերն ըստ դրանց
մնացորդի` ![]() կոչվում
են.
կոչվում
են. ![]() ֆորմիատ,
ֆորմիատ,
![]() ացետատ,
ացետատ,
![]() պրոպիոնատ,
պրոպիոնատ,
![]() բութիրատ
և այլն:
Գործնական
նշանակություն
ունեն
նատրիումի,
ալյումինի,
քրոմի,
երկաթի, պղնձի,
կապարի և այլ
մետաղների
քացախաթթվական
աղերը:
բութիրատ
և այլն:
Գործնական
նշանակություն
ունեն
նատրիումի,
ալյումինի,
քրոմի,
երկաթի, պղնձի,
կապարի և այլ
մետաղների
քացախաթթվական
աղերը:
Կարբոնաթթուների աղերը լայն կիրառություն ունեն օրգանական սինթեզում. ալկանների, ալդեհիդների և կետոնների, բարդ եթերների, թթուների անհիդրիդների և այլ նյութերի ստացման համար:
35.5.2. Ռեակցիաներ կարբոնիլային խմբի ածխածնի մասնակցությամբ
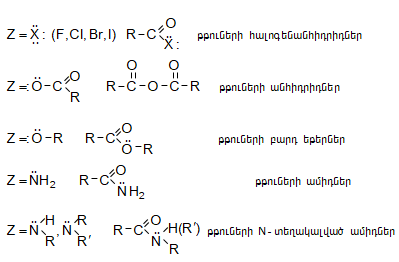
Կարբոնաթթուների
ածանցյալները
![]() ընդհանուր
բանաձևով
միացություններ
են, առաջանում
են թթվի
հիդրօքսիլ
խումբը
փոխարինելով որևէ
այլ խմբով:
Դրանք
հեշտությամբ հիդրոլիզվում
են
համապատասխան
թթվի: Կարևորագույն
ածանցյալներ
են
հալոգենանհիդրիդները,
անհիդրիդները,
բարդ
եթերները և
ամիդները.
ընդհանուր
բանաձևով
միացություններ
են, առաջանում
են թթվի
հիդրօքսիլ
խումբը
փոխարինելով որևէ
այլ խմբով:
Դրանք
հեշտությամբ հիդրոլիզվում
են
համապատասխան
թթվի: Կարևորագույն
ածանցյալներ
են
հալոգենանհիդրիդները,
անհիդրիդները,
բարդ
եթերները և
ամիդները.
Կարբոնաթթուների
և
ածանցյալների
համար ընդհանուր
ացիլ խմբում` ![]() ածխածնի
ատոմն ունի
էլեկտրոֆիլ
բնույթ և
կարող է
գրոհվել
նուկլեոֆիլ
ռեագենտի կողմից:
Կարբոնիլի
էլեկտրոֆիլությունը
ածխածնի
ատոմն ունի
էլեկտրոֆիլ
բնույթ և
կարող է
գրոհվել
նուկլեոֆիլ
ռեագենտի կողմից:
Կարբոնիլի
էլեկտրոֆիլությունը
![]() զուգորդման
հետևանքով
համեմատաբար
փոքր է, քան
ալդեհիդներում
և
կետոններում.
զուգորդման
հետևանքով
համեմատաբար
փոքր է, քան
ալդեհիդներում
և
կետոններում.
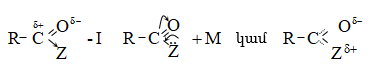
Հետևաբար,
թթուները և
ածանցյալները
միացման
ռեակցիաներ
չեն տալիս
այնպիսի
ռեագենտների
հետ, ինչպիսիք
են` նատրիումի
հիդրոսուլֆիտը,
հիդրօքսիլամինը,
կապտաթթուն և
այլն: Ի տարբերություն
ալդեհիդների
և կետոնների,
որոնք
նուկլեոֆիլի
ազդեցությամբ
հաճախ առաջացնում
են միացման
ռեակցիայի
արգասիքներ (AdN),
կարբոնաթթուների
և
ածանցյալների
համար
նուկլեոֆիլի
միացումը
միջանկյալ
փուլ է, քանի
որ ![]() հեշտ է
պոկվում:
Նուկլեոֆիլի
գրոհի
արդյունքը
կլինի
տեղակալման
ռեակցիան.
հեշտ է
պոկվում:
Նուկլեոֆիլի
գրոհի
արդյունքը
կլինի
տեղակալման
ռեակցիան.
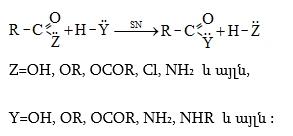
Այս ռեակցիաները հնարավորություն են տալիս օրգանական տարբեր միացությունների մեջ (H-Y) ներմուծելու ացիլ խումբ: Ռեակցիան կոչվում է ացիլում, իսկ կարբոնաթթուները և դրանց ածանցյալները` ացիլող միջոցներ: Ացիլող ազդակի կարբոնիլային ածխածնի ակտիվությունը նուկլեոֆիլ ռեակցիաներում գլխավորապես բնորոշվում է Z խմբի +M և -I էֆեկտների մեծությամբ.
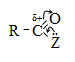
Z խմբերի +M էֆեկտը փոքրացնում, իսկ -I էֆեկտը մեծացնում է կարբոնիլային խմբի ածխածնի ատոմի էլեկտրոֆիլությունը: Ացիլման ռեակցիաներում մեծ ակտիվություն են ցուցաբերում թթուների այն ածանցյալները, որոնք ունեն թույլ +M և ուժեղ -I էֆեկտներով օժտված Z տեղակալիչ:
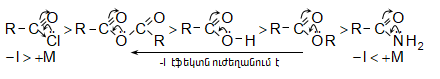
Ացիլումն ընթանում է երկու փուլով.
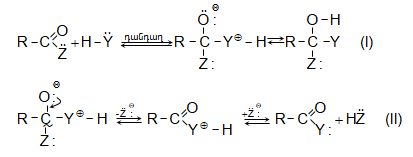
Առաջին` դանդաղ փուլում, նուկլեոֆիլը հարձակվում է կարբոնիլային ածխածնի վրա` առաջացնելով միջանկյալ արգասիք: Երկրորդ փուլում արագ պոկվում է HZ: Ացիլման ռեակցիայի արագության վրա ազդում են կատալիզատորները: Թթվային կատալիզի դեպքում մեծանում է կարբոնիլային ածխածնի էլեկտրոֆիլությունը, հետևաբար` աճում է ռեակցիայի արագությունը:
SN2 ռեակցիայի մեխանիզմը (AdN փուլի վրայով) թթվային կատալիզի պայմաններում.
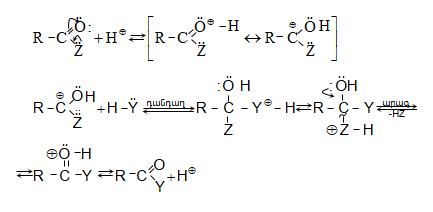
Հիմնային կատալիզի պայմաններում մեծանում է H-Y ռեագենտի նուկլեոֆիլությունը:
SN2 ռեակցիայի մեխանիզմը (AdN փուլի վրայով) հիմնային կատալիզի պայմաններում.
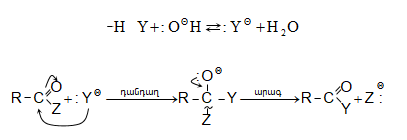
ա) թթուների քլորանհիդրիդներ (ացիլքլորիդներ) առաջանում են. կարբոնաթթուների վրա թիոնիլքլորիդով, ֆոսֆորի տրիքլորիդով կամ պենտաքլորիդով ազդելիս.
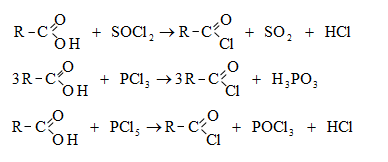
Ացիլբրոմիդները և ացիլյոդիդները կարող են առաջանալ նույն եղանակով:
Հալոգենանհիդրիդներն անվանվում են ըստ թթվի և հալոգենի անվան, բայց ավելի հաճախ` ըստ համապատասխան ացիլի.

Պարզագույն կարբոնաթթուների հալոգենանհիդրիդները հիանալի ացիլող միջոցներ են, հեշտությամբ փոխազդում են սոդայի (հիդրոլիզ), սպիրտների (ալկոհոլիզ), ամոնիակի (ամոնոլիզ) և այլ նուկլեոֆիլ ռեագենտների հետ:
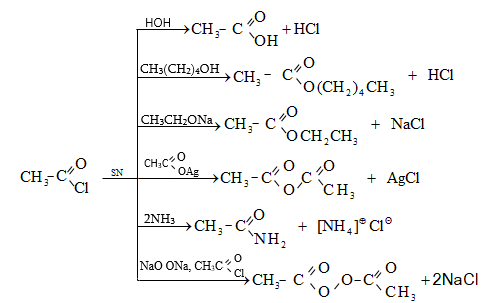
բ) թթուների անհիդրիդներ առաջանում են կարբոնաթթուների դեհիդրատացումով.
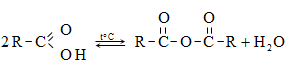
Քացախաթթվի անհիդրիդն ստացվում է բարձր ջերմաստիճանում քացախաթթվի գոլորշիները Al2O3-ի վրայով անցկացնելով: Ռեակցիայի արգասիքներն արագ սառեցնում են և առանձնացնում ջուրը` անհիդրիդի հիդրոլիզից խուսափելու համար: Բարձրամոլեկուլային թթուների անհիդրիդներն ստանում են ավելի ուժեղ ջուր խլող միջոցների (քացախաթթվի անհիդրիդ կամ P2O5) օգնությամբ:
Թթուների անհիդրիդների ստացման համար ավելի կիրառական նշանակություն ունի կարբոնաթթուների աղերի ացիլումը թթուների քլորանհիդրիդներով.
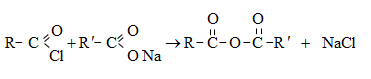
Քացախաթթվի անհիդրիդը լայն կիրառություն ունի որպես ացիլող միջոց: Արտադրական ստացման եղանակներ են քացախալդեհիդի օքսիդացումն օդի թթվածնով պղինձ-կոբալտ կատալիզատորի ներկայությամբ և քացախաթթվի փոխազդեցությունը կետենի հետ.
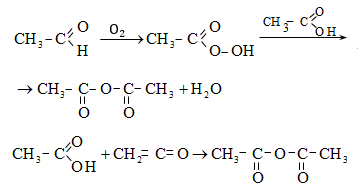
Ցածրամոլեկուլային թթուների անհիդրիդները սուր հոտով հեղուկներ են, եռում են ավելի բարձր ջերմաստիճաններում, քան համապատասխան թթուները, վատ են լուծվում կամ բոլորովին չեն լուծվում ջրում: Չափազանց ռեակցիոնունակ են, կիրառվում են որպես լավ ացիլող միջոցներ: Դանդաղ հիդրոլիզվում են համապատասխան թթուների, ռեակցիան կատալիզվում է ալկալիների ներկայությամբ.
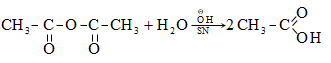
Սպիրտների հետ առաջացնում են բարդ եթերներ.
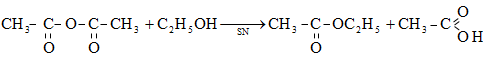
Փոխազդում են ամոնիակի, առաջնային և երկրորդային ամինների հետ` առաջացնելով թթուների ամիդներ.
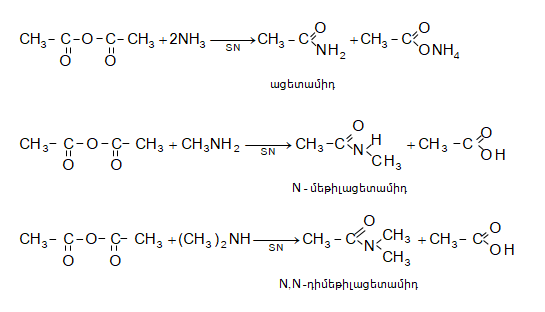
գ) թթուների ամիդներ ստացվում են կարբոնաթթուների գոլորշիների և ամոնիակի խառնուրդն անցկացնելով դեհիդրատացնող կատալիզատորների վրայով.
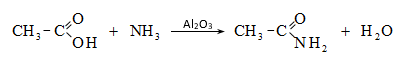
Ամիդներ ստացվում են նաև կարբոնաթթուների ամոնիումային աղերի չոր թորմամբ, ամոնիակի փոխազդեցությամբ հալոգենանհիդրիդների կամ անհիդրիդների հետ, նիտրիլների ոչ լրիվ հիդրոլիզով.
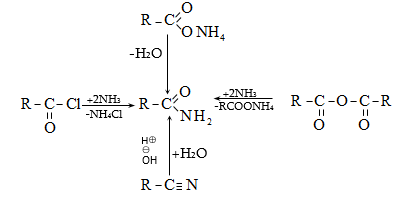
Թթուների
ամիդները
բյուրեղային
նյութեր են
(հեղուկ է
մրջնաթթվի
ամիդը`
ֆորմամիդը),
ավելի թույլ
հիմքեր են քան
ամոնիակը, որը
բացատրվում է
ազոտի ատոմի
էլեկտրոնային
խտության
փոքրացումով`
պայմանավորված ![]() զուգորդմամբ.
զուգորդմամբ.
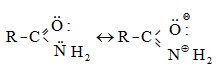
Ամիդների աղեր առաջանում են ուժեղ թթուների հետ. պրոտոնանում է թթվածնի ատոմը, քանի որ այս դեպքում առաջացած կատիոնը կայունանում է զուգորդման շնորհիվ.
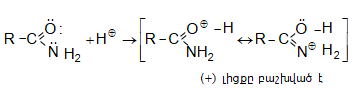
Ամիդները թույլ թթուներ են, փոխազդում են նատրիումի, նատրիումի ամիդի կամ սնդիկի օքսիդի հետ, առաջացնելով աղեր.
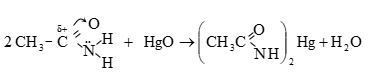
Ֆոսֆորի պենտօքսիդի հետ տաքացնելիս ամիդները փոխարկվում են նիտրիլների.
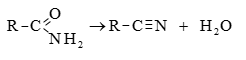
Ալկալիների կամ հանքային թթուների ջրային լուծույթների հետ եռացնելիս ամիդները հիդրոլիզվում են կարբոնաթթուների կամ թթուների աղերի.
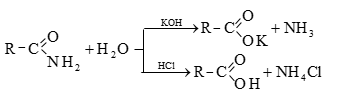
Թթվային հիդրոլիզի մեխանիզմ (SN2` AdN փուլի վրայով).
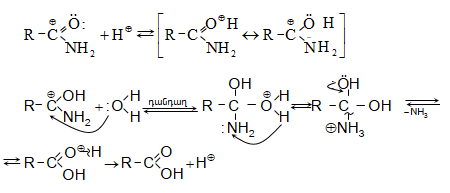
Հիմնային հիդրոլիզի մեխանիզմ (SN2` AdN փուլի վրայով).
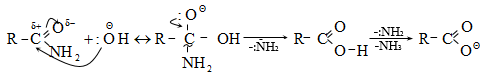
Ամիդների վերականգնումով նատրիումով էթանոլում կամ լիթիումալյումինհիդրիդով (LiAlH4), առաջանում են ամիններ.
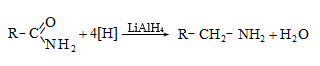
դ) բարդ եթերներ առաջանում են կարբոնաթթուների և սպիրտների փոխազդեցությամբ` թթվային կատալիզի պայմաններում (եթերացման ռեակցիա).
Ռեակցիան դարձելի է: Պարզագույն սպիրտների և թթուների դեպքում հավասարակշռություն է հաստատվում, երբ ծախսվում է ելանյութերի քանակի 2/3-ը (Բերտլո, 1862 թ.): Եթերացումը, ինչպես նաև եթերի հիդրոլիզը տեղի են ունենում միացում-պոկում մեխանիզմով (SN2` AdN փուլի վրայով)
Իզոտոպային եղանակով պարզվել է, որ ռեակցիայի արդյունքում առաջացող ջրի մոլեկուլի թթվածնի ատոմը պոկվել է թթվի մոլեկուլից:
Եթերացման ռեակցիայի արագությունը կախված է թթվի և սպիրտի կառուցվածքներից: Սպիրտում և թթվում ռեակցիոն կենտրոնին մոտ գտնվող ծավալուն խմբերը տարածական դժվարություն են ստեղծում և դանդաղեցնում եթերացման ռեակցիան (նաև` հետադարձ հիդրոլիզի ռեակցիան):
Սպիրտների և թթուների ռեակցիոնունակությունը եթերացման ռեակցիաներում.
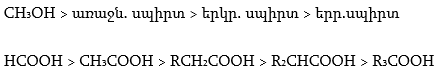
Բարդ եթերներ ստացվում են նաև կարբոնաթթուների աղերի կամ թթուների հալոգենանհիդրիդների փոխազդեցությամբ սպիրտների և ալկոհոլատների հետ, ինչպես նաև սպիրտների և թթուների անհիդրիդների փոխազդեցությամբ:
Բարդ եթերներն անվանվում են ըստ համապատասխան թթվի և սպիրտի: Դիտվում են նաև որպես թթվի ացիլածանցյալներ` նշելով համապատասխան կարբօքսիլատ իոնը:
Բարդ եթերների կարևորագույն ռեակցիան հիդրոլիզն է, որը կատալիզվում է և´ թթվով, և´ հիմքով.
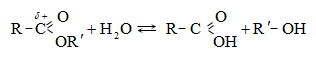
Թթվային հիդրոլիզի մեխանիզմը նման է եթերացման մեխանիզմին:
Դիտարկենք հիմնային հիդրոլիզի (օճառացում) մեխանիզմը.
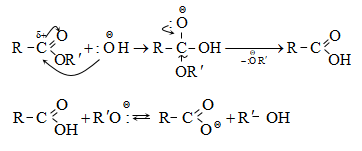
Բարդ եթերները փոխազդում են սպիրտների հետ ինչպես թթվային, այնպես էլ հիմնային կատալիզի պայմաններում.
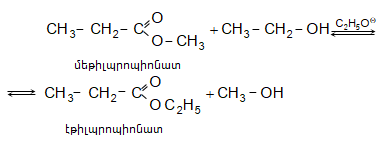
Այս ռեակցիան կոչվում է վերաեթերացում (ալկոհոլիզ) և կիրառվում է բարձրամոլեկուլային կարբոնաթթուների բարդ եթերների ստացման համար:
Ամոնիակի, առաջնային և երկրորդային ամինների հետ բարդ եթերներն առաջացնում են համապատասխան ամիդներ.
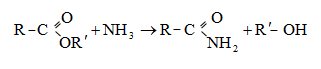
Այս ռեակցիաներն ընթանում են համեմատաբար մեղմ պայմաններում, քանի որ ամինային բաղադրիչն օժտված է առավել բարձր նուկլեոֆիլությամբ, քան սպիրտները:
35.5.3. Ածխաջրածնային մնացորդի ռեակցիաներ (հալոգենացում)
Կարբոնաթթուների անմիջական հալոգենացումը դժվար է իրականացվում, առավել հեշտ հալոգենանում են հալոգենանհիդրիդները և թթուների անհիդրիդները: Փոքր քանակներով ֆոսֆորի ներկայությամբ կարբոնաթթուները փոխազդում են քլորի և բրոմի հետ (Գել-Ֆոլգարտ-Զելինսկու ռեակցիա): Քլորով տեղակալվում են առաջին հերթին α-ջրածինները, ապա` մյուս դիրքերի ջրածինները: Բրոմացումը տեղի է ունենում բացառապես α-ածխածնի մոտ: Ռեակցիան կարող է ծառայել որպես α-ջրածնի ատոմների հայտնաբերման որակական ռեակցիա:
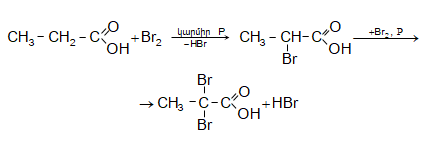
Ռեակցիայի միջավայրում գոյացող PCl3-ը կամ PBr3-ը փոխազդում են թթուների հետ` առաջացնելով անհիդրիդներ, որոնք տաուտոմերվում են ենոլ ձևի, որը հալոգենանում է (AdE).
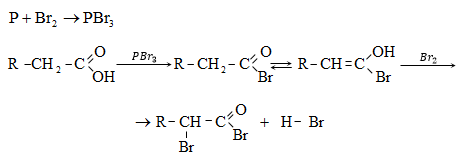
35.6. Առանձին ներկայացուցիչներ
35.6.1.
Մրջնաթթու
(մեթանաթթու) ![]()
Անջուր
մրջնաթթուն
սուր հոտով, ![]() եռման
ջերմաստիճանով
հեղուկ է:
Բոլոր հարաբերություններով
խառնվում է
ջրի, էթանոլի
և դիէթիլեթերի
հետ:
Տեխնիկական
թթուն 77,5%
մրջնաթթու
պարունակող
եռման
ջերմաստիճանով
հեղուկ է:
Բոլոր հարաբերություններով
խառնվում է
ջրի, էթանոլի
և դիէթիլեթերի
հետ:
Տեխնիկական
թթուն 77,5%
մրջնաթթու
պարունակող ![]() եռման
ջերմաստիճանով
ազեոտրոպ
խառնուրդ է:
եռման
ջերմաստիճանով
ազեոտրոպ
խառնուրդ է:
Տեխնիկայում
մրջնաթթու
ստանում են
ածխածնի
օքսիդից (II) և
ալկալուց ![]() մթն
ճնշման տակ.
մթն
ճնշման տակ.
Մրջնաթթուն ավելի ուժեղ թթու է, քան հոմոլոգները: Աղերը (ֆորմիատները), բացառությամբ արծաթի և կապարի աղերի, լուծվում են ջրում: Մրջնաթթվին բնորոշ են թթուների բոլոր հատկությունները: Այն ունի նաև յուրահատուկ ռեակցիաներ:
ՈՒժեղ վերականգնիչ է. արծաթի օքսիդի ամոնիակային լուծույթից դուրս է մղում արծաթ, վերականգնում է կալիումի պերմանգանատի լուծույթը, սնդիկի օքսիդը.
ՈՒնի
ոչ մեծ
ջերմակայունություն:
Ճնշման տակ
մինչև ![]() տաքացնելիս
քայքայվում է
ածխածնի
դիօքսիդի և
ջրածնի.
տաքացնելիս
քայքայվում է
ածխածնի
դիօքսիդի և
ջրածնի.
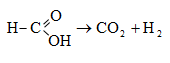
Խիտ ծծմբական թթվի ազդեցությամբ մրջնաթթուն քայքայվում է մինչև ածխածնի օքսիդի (II) և ջրի.
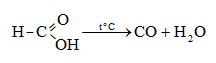
Ալկալիական մետաղների ֆորմիատները հալելիս փոխարկվում են թրթնջկաթթվի աղերի (օքսալատներ).
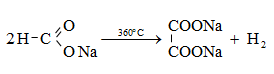
Մրջնաթթուն կիրառվում է թեթև, սննդի, քիմիական արդյունաբերություններում, բժշկության մեջ և այլն:
35.6.2.
Քացախաթթու
(էթանաթթու) ![]()
Անջուր
քացախաթթուն
սուր հոտով, ![]() եռման
ջերմաստիճանով
հեղուկ է, ջրի
հետ խառնվում
է բոլոր
հարաբերություններով:
Պնդանում է
սառցե
բյուրեղների
ձևով
եռման
ջերմաստիճանով
հեղուկ է, ջրի
հետ խառնվում
է բոլոր
հարաբերություններով:
Պնդանում է
սառցե
բյուրեղների
ձևով ![]() («սառցային
քացախաթթու»):
Սառցային
քացախաթթուն
լավ լուծիչ է
բազմաթիվ
օրգանական
նյութերի
համար: Ջրային
լուծույթները
կենցաղում կիրառվում
են որպես քացախ
(5...8%) և
քացախաթթվի
էսենցիա (70...80%):
Խիտ քացախաթթուն
առաջացնում է
մաշկի
այրվածք:
(«սառցային
քացախաթթու»):
Սառցային
քացախաթթուն
լավ լուծիչ է
բազմաթիվ
օրգանական
նյութերի
համար: Ջրային
լուծույթները
կենցաղում կիրառվում
են որպես քացախ
(5...8%) և
քացախաթթվի
էսենցիա (70...80%):
Խիտ քացախաթթուն
առաջացնում է
մաշկի
այրվածք:
Արտադրության մեջ քացախաթթուն ստանում են`
ա) քացախալդեհիդի օքսիդացումով.
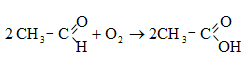
բ) C4 ... C7 ալկանների օքսիդացումով.
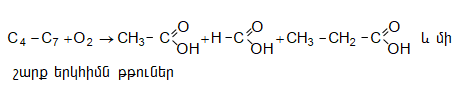
գ) մեթանոլի կարբոնիլացումով.
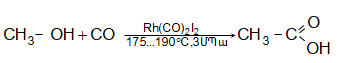
դ) ացետոնից.
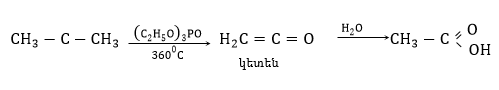
(ԴԻԿԱՐԲՈՆԱԹԹՈՒՆԵՐ)
Երկհիմն
հագեցած
թթուները ![]() ընդհանուր
բանաձևով
միացություններ
են: Ըստ
Ժնևյան
անվանակարգման,
երկհիմն
թթուն կարդացվում
է կարբօքսիլ
խմբեր
պարունակող
ածխածնային
շղթային
համապատասխանող
ալկանի անվանն
ավելացնելով
դիթթու վերջավորությունը:
ընդհանուր
բանաձևով
միացություններ
են: Ըստ
Ժնևյան
անվանակարգման,
երկհիմն
թթուն կարդացվում
է կարբօքսիլ
խմբեր
պարունակող
ածխածնային
շղթային
համապատասխանող
ալկանի անվանն
ավելացնելով
դիթթու վերջավորությունը:

36.1. Ֆիզիկական հատկություններ, կիրառման
բնագավառներ, թունավորություն
Երկհիմն
թթուները
պինդ նյութեր
են: Շարքի ցածրամոլեկուլային
անդամները
ջրում լավ են
լուծվում, իսկ
օրգանական
լուծիչներում`
չնչին
քանակներով:
Ինչպես
միահիմն
թթուներում, զույգ
թվով ածխածնի
ատոմներով
հոմոլոգների
հալման
ջերմաստիճանները
բարձր են կենտ
թվով հարևան
հոմոլոգների
հալման
ջերմաստիճաններից:
Այսպես, ադիպինաթթվի
հալման
ջերմաստիճանը ![]() իսկ
գլուտարաթթվինը
և
պիմելինաթթվինը`
համապատասխանաբար
իսկ
գլուտարաթթվինը
և
պիմելինաթթվինը`
համապատասխանաբար ![]()
Անջուր
թրթնջկաթթուն
![]() հալման
ջերմաստիճանով
բյուրեղային
նյութ է: Ջրային
լուծույթներից
բյուրեղանում
է դիհիդրատի
հալման
ջերմաստիճանով
բյուրեղային
նյութ է: Ջրային
լուծույթներից
բյուրեղանում
է դիհիդրատի ![]() տեսքով,
լուծվում է
էթիլսպիրտում,
գործնականում
չի լուծվում
եթերում:
Թրթնջկաթթուն
և աղերը`
օքսալատները,
թունավոր են
ՍԹԿ-ն ջրում 1 մգ/լ:
Թրթնջկաթթուն
կիրառվում է
տեքստիլ և կաշեգործական,
ինչպես նաև
փայտամշակման
արտադրություններում,
որոշ
մետաղների
(ալյումին,
տիտան, անագ)
ստացման
էլեկտրաքիմիական
գործընթացներում,
պոլիկոնդենսացման
ռեակցիաներում
որպես
կատալիզատոր
(ֆենոլֆորմալդեհիդային
խեժերի
արտադրություն):
Բնության մեջ
հանդիպում է
թրթնջուկում`
կալիումի օքսալատի
տեսքով:
տեսքով,
լուծվում է
էթիլսպիրտում,
գործնականում
չի լուծվում
եթերում:
Թրթնջկաթթուն
և աղերը`
օքսալատները,
թունավոր են
ՍԹԿ-ն ջրում 1 մգ/լ:
Թրթնջկաթթուն
կիրառվում է
տեքստիլ և կաշեգործական,
ինչպես նաև
փայտամշակման
արտադրություններում,
որոշ
մետաղների
(ալյումին,
տիտան, անագ)
ստացման
էլեկտրաքիմիական
գործընթացներում,
պոլիկոնդենսացման
ռեակցիաներում
որպես
կատալիզատոր
(ֆենոլֆորմալդեհիդային
խեժերի
արտադրություն):
Բնության մեջ
հանդիպում է
թրթնջուկում`
կալիումի օքսալատի
տեսքով:
Մալոնաթթուն
բյուրեղային
նյութ է, ![]() Մալոնաթթուն
և մալոնաթթվի
դիէթիլեթերը
լայն կիրառություն
ունեն
օրգանական
սինթեզում
միահիմն,
երկհիմն,
բազմահիմն
հագեցած և
չհագեցած
թթուների,
ամինաթթուների
և այլ միացությունների
ստացման
համար: Մալոնաթթուն
կիրառվում է
դեղագործության
մեջ
բարբիտուրատների
սինթեզի, սննդարդյունաբերության
մեջ` հոտավետ
միջոցների
ստացման
համար:
Մալոնաթթուն
և մալոնաթթվի
դիէթիլեթերը
լայն կիրառություն
ունեն
օրգանական
սինթեզում
միահիմն,
երկհիմն,
բազմահիմն
հագեցած և
չհագեցած
թթուների,
ամինաթթուների
և այլ միացությունների
ստացման
համար: Մալոնաթթուն
կիրառվում է
դեղագործության
մեջ
բարբիտուրատների
սինթեզի, սննդարդյունաբերության
մեջ` հոտավետ
միջոցների
ստացման
համար:
Սաթաթթու
(բութանդիթթու)`
HOOC–(CH2)2–COOH
բյուրեղային
նյութ է, ![]() Սաթաթթվի
ՍԹԱ-ն ջրում 0,01
մգ/լ է:
Լայնորեն
կիրառվում է
ներկանյութերի,
պլաստիկ
նյութերի, պոլիեթերների,
խեժերի,
ֆոտոնյութերի,
դեղամիջոցների
արտադրություններում,
եթերները` սննդի
և օծանելիքի
արտադրություններում,
միջատասպան
միջոցների
ստացման
համար և այլն: Դիէթիլսուկցինիմիդը
կիրառվում է
որպես հիանալի
հոտավետ
միջոց
սննդարդյունաբերության
մեջ: ՈՒնի ծաղկի
բուրմունք և
կարևոր
բաղադրամաս է
օծանելիքի
արտադրությունում:
Սաթաթթվի
անհիդրիդը
կիրառվում է
դեղագործության
մեջ, էպօքսիդային
խեժերի
արտադրությունում,
թունաքիմիկատների
ստացման
համար: Այն
թունավոր է,
ազդում է աչքի
լորձաթաղանթի
և շնչառական
ուղիների վրա:
Սաթաթթվի
ՍԹԱ-ն ջրում 0,01
մգ/լ է:
Լայնորեն
կիրառվում է
ներկանյութերի,
պլաստիկ
նյութերի, պոլիեթերների,
խեժերի,
ֆոտոնյութերի,
դեղամիջոցների
արտադրություններում,
եթերները` սննդի
և օծանելիքի
արտադրություններում,
միջատասպան
միջոցների
ստացման
համար և այլն: Դիէթիլսուկցինիմիդը
կիրառվում է
որպես հիանալի
հոտավետ
միջոց
սննդարդյունաբերության
մեջ: ՈՒնի ծաղկի
բուրմունք և
կարևոր
բաղադրամաս է
օծանելիքի
արտադրությունում:
Սաթաթթվի
անհիդրիդը
կիրառվում է
դեղագործության
մեջ, էպօքսիդային
խեժերի
արտադրությունում,
թունաքիմիկատների
ստացման
համար: Այն
թունավոր է,
ազդում է աչքի
լորձաթաղանթի
և շնչառական
ուղիների վրա:
Ադիպինաթթուն
անգույն
բյուրեղային նյութ
է, ![]() (ՍԹԿ` 4
մգ/մ3), լավ է
լուծվում
ջրում,
էթիլսպիրտում,
իսկ եթերում`
սահմանափակ
քանակներով:
Կարևոր ելանյութ
է նայլոնի
ստացման
համար (տես
«Ամիններ»): Եթերները
կիրառվում են
որպես
պլաստիֆիկատոր,
քսայուղ,
պոլիեթերային
խեժերի
պնդացնող:
Ադիպինաթթվի
ածանցյալներն
օգտագործվում
են որպես
սննդանյութերի
հավելիչներ
(ոչ
ալկոհոլային
խմիչքներին
թթվայնություն
հաղորդելու
համար):
Ադիպինաթթվի
համաշխարհային
արտադրությունը
2003 թ. կազմել է 2 միլիոն
տոննա:
(ՍԹԿ` 4
մգ/մ3), լավ է
լուծվում
ջրում,
էթիլսպիրտում,
իսկ եթերում`
սահմանափակ
քանակներով:
Կարևոր ելանյութ
է նայլոնի
ստացման
համար (տես
«Ամիններ»): Եթերները
կիրառվում են
որպես
պլաստիֆիկատոր,
քսայուղ,
պոլիեթերային
խեժերի
պնդացնող:
Ադիպինաթթվի
ածանցյալներն
օգտագործվում
են որպես
սննդանյութերի
հավելիչներ
(ոչ
ալկոհոլային
խմիչքներին
թթվայնություն
հաղորդելու
համար):
Ադիպինաթթվի
համաշխարհային
արտադրությունը
2003 թ. կազմել է 2 միլիոն
տոննա:
Դիկարբոնաթթուներն ստանում են հետևյալ ընդհանուր եղանակներով`
36.2.1. Երկառաջնային գլիկոլների օքսիդացում
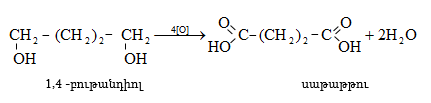
36.2.2. Առաջնային օքսիթթուների օքսիդացում
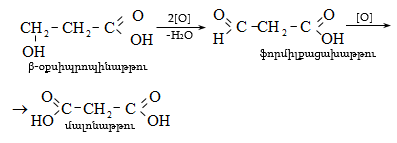
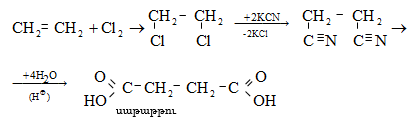
36.2.4. Երկհիմն թթուների կարևոր ներկայացուցիչների արտադրական ստացման եղանակներ
ա) թրթնջկաթթու ստանում են փայտի տաշեղների օքսիդացումով օդի թթվածնով` հալված կծու կալիումի հետ տաքացնելիս: Ժամանակակից եղանակ է կալիումի կամ նատրիումի ֆորմիատի արագ տաքացումը թթվային միջավայրում:
Խիտ ծծմբական թթվի հետ տաքացնելիս թրթնջկաթթուն քայքայվում է ածխածնի օքսիդի, դիօքսիդի և ջրի.
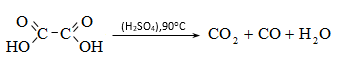
բ) մալոնաթթու և մալոնաթթվի դիէթիլեթեր ստանում են քլորքացախաթթվից` համաձայն հետևյալ սխեմայի.
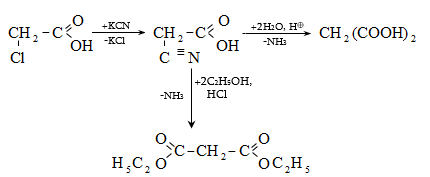
գ) սաթաթթու ստանում են մալեինաթթվի կատալիզային հիդրումով, ինչպես նաև սաթի թափոնների թորումով.
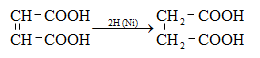
Սաթաթթուն էթիլենգլիկոլի հետ առաջացնում է պոլիեթեր.
դ) ադիպինաթթվի հիմնական ստացման եղանակը ցիկլոհեքսանոնի օքսիդացումն է ազոտական թթվով կամ օդի թթվածնով կատալիզատորի ներկայությամբ (մանգանի աղեր).
Լաբորատորիայում ստանում են մալոնաթթվական եթերի հետ զուգընթաց սինթեզով` օգտագործելով նատրիումմալոնաթթվական եթեր և 1,2-դիբրոմէթան 2:1 մոլային հարաբերությամբ:
Շնորհիվ երկու կարբօքսիլ խմբերի փոխազդեցության` դիկարբոնաթթուներն ավելի ուժեղ թթուներ են, քան միահիմն թթուները.
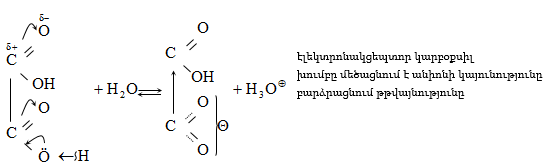
Կարբօքսիլ խմբերի ազդեցությունը միմյանց վրա ավելի ուժեղ է, երբ դրանք բավականաչափ մոտ են: Այդ պատճառով դիկարբոնաթթուների շարքի ամենաուժեղ թթուն թրթնջկաթթուն է, այդ են վկայում թթուների դիսոցման հաստատունները.
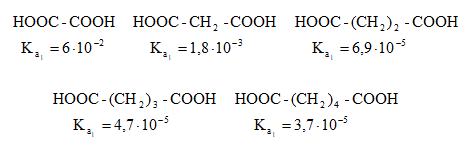
Թրթնջկաթթվի երկրորդ կարբօքսիլ խմբի իոնացումն ավելի դժվար է կատարվում, քանի որ սկզբնական իոնացման ժամանակ առաջացած բացասական լիցքավորված COO- խումբը փոքրացնում է երկրորդ COO- խմբի կայունությունը.
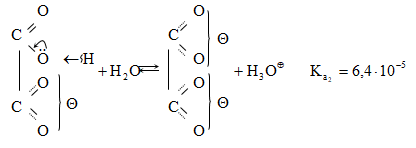
Դիկարբոնաթթուներին բնորոշ են նույն քիմիական հատկությունները, ինչ մոնոկարբոնաթթուներին: Քիմիական փոխարկումներին մասնակցում են մեկ կամ երկու կարբօքսիլ խմբերով` առաջացնելով երկու շարքի ածանցյալներ. թթու և չեզոք աղեր, լրիվ և ոչ լրիվ եթերներ, հալոգենանհիդրիդներ, ամիդներ և անհիդրիդներ.
Բացի կարբոնաթթուներին բնորոշ ռեակցիաներից, դիկարբոնաթթուներին հատուկ են երկու կարբօքսիլ խմբերի առկայությամբ պայմանավորված յուրահատուկ փոխարկումներ: Երկհիմն թթուների քիմիական վարքի յուրահատկությունն առաջին հերթին բացահայտվում է դրանց տաքացման ժամանակ` պայմանավորված երկու կարբօքսիլ խմբերը բաժանող շղթայի երկարությամբ:
36.3.1. Թրթնջկաթթուն և մալոնաթթուն, ինչպես նաև վերջինիս տեղակալված հոմոլոգներն իրենց հալման ջերմաստիճանից փոքր-ինչ բարձր ջերմաստիճանում տաքացնելիս դեկարբօքսիլանում են և փոխարկվում համապատասխան մոնոկարբոնաթթվի.
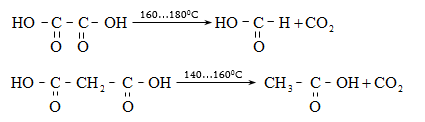
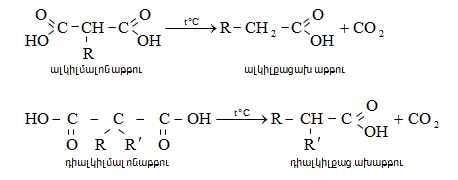
Մալոնաթթվի և հոմոլոգների հեշտ դեկարբօքսիլացումը կարելի է բացատրել նրանով, որ ածխածնի դիօքսիդի պոկումը կարբօքսիլատ իոնից առաջացնում է ռեզոնանսորեն կայունացված կարբանիոն, որը համեմատաբար հեշտ է գոյանում, քանի որ բացասական լիցքը ցրված է ամբողջ համակարգով.
36.3.2. Ադիպինաթթվի և պիմելինաթթվի տաքացման ժամանակ տեղի է ունենում դեկարբօքսիլացում և դեհիդրատացում: Արդյունքում առաջանում են կայուն հինգանդամ և վեցանդամ ցիկլային կետոններ.
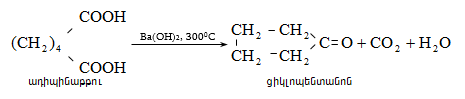
36.3.3. Տարբեր կարբոնաթթուների ստացումը մալոնաթթվական եթերի օգնությամբ կոչվում է «մալոնաթթվական սինթեզ», որը հիմնված է մալոնաթթվական եթերի մեթիլենային խմբի ջրածնի ատոմների բարձր թթվայնության և մալոնաթթվի (նաև տեղակալված մալոնաթթվի) հեշտ դեկարբօքսիլացման համակցման վրա: Մալոնաթթվի եթերի մեթիլենային խմբի ջրածնի ատոմները գտնվում են երկու կարբոնիլ խմբերի նկատմամբ α-դիրքում և շնորհիվ երկու էլեկտրոնակցեպտոր խմբերի ազդեցության (σ-π-զուգորդում), օժտված են բարձր պրոտոնացման ունակությամբ: Պրոտոնի պոկումով առաջանում է չափազանց կայուն կարբանիոն, որի կարբոնիլային խմբերի թթվածնի երկու ատոմները նպաստում են բացասական լիցքի բաշխմանը.
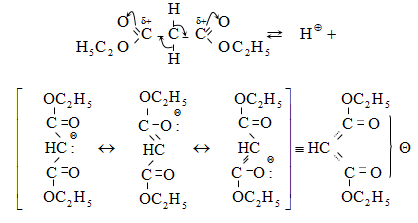
Մալոնաթթուն C-H թթու է, ավելի ուժեղ, քան մեկ կարբօքսիլ խումբ ունեցող միացությունները:
Մալոնաթթվական եթերի փոխազդեցությամբ մետաղական նատրիումի կամ նատրիումի ալկոհոլատի հետ բացարձակ եթերում մեկ կամ երկու շարժուն σ-ջրածինները տեղակալվում են նատրիումով` առաջացնելով նատրիում կամ դինատրիումմալոնաթթվական եթեր.
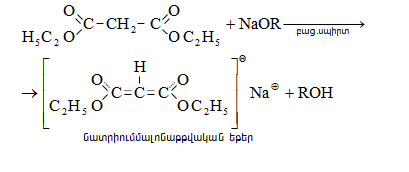
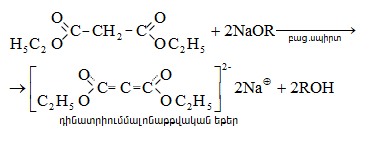
Նատրիումմալոնաթթվական
եթերի և
հալոգենածանցյալների
(հալոգենալկաններ,
դիհալոգենածանցյալներ,
σ-հալոգենտեղակալված
թթուների
եթերներ)
փոխազդեցությամբ
նուկլեոֆիլ
տեղակալման
մեխանիզմով
կարելի է ստանալ
տեղակալված
մալոնաթթվական
եթերներ և հոմոլոգներ,
որոնց հետագա
հիդրոլիզով`
թթուներ (Կոնրադի
սինթեզ):
Նուկլեոֆիլի
դեր է
կատարում ![]() կարբանիոնը:
Դեկարբօքսիլացումով
կարելի է
հեռացնել
«մալոնային»
կարբօքսիլներից
մեկը և ստանալ
քացախաթթվի
հոմոլոգներ,
տարբեր
կարբոնաթթուներ
և դրանց
հոմոլոգները:
Ստորև բերված
են Կոնրադի
սինթեզի
օրինակներ.
կարբանիոնը:
Դեկարբօքսիլացումով
կարելի է
հեռացնել
«մալոնային»
կարբօքսիլներից
մեկը և ստանալ
քացախաթթվի
հոմոլոգներ,
տարբեր
կարբոնաթթուներ
և դրանց
հոմոլոգները:
Ստորև բերված
են Կոնրադի
սինթեզի
օրինակներ.
ա) քացախաթթվի հոմոլոգների սինթեզ.
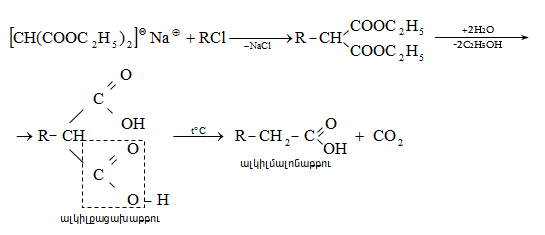
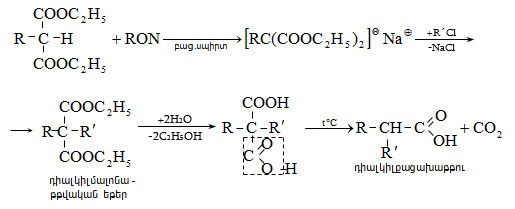
բ) սաթաթթվի և հոմոլոգների սինթեզ.
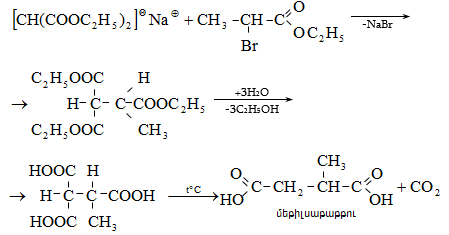
գ) գլուտարաթթվի և այլ երկհիմն թթուների սինթեզ.
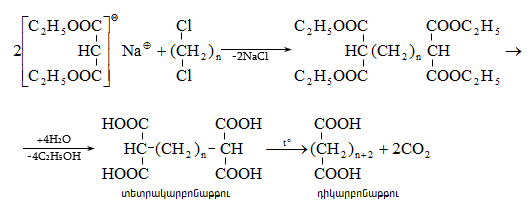
Մալոնաթթվի կամ մալոնաթթվական եթերի կոնդենսացմամբ տարբեր կարբոնիլային միացությունների (ալդեհիդներ, կետոններ) հետ հիմքերի ներկայությամբ ստացվում են չհագեցած թթուներ: Ռեակցիան կատարվում է ալդոլ և կրոտոնային կոնդենսացումների նմանատիպ մեխանիզմով (AdN-E).
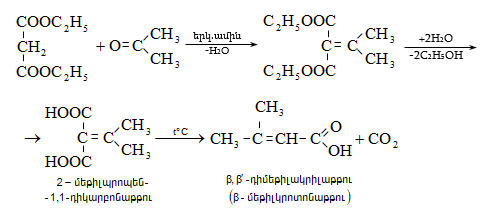
Էթիլենային
շարքի
չհագեցած
թթուներն
ունեն ![]() ացետիլենային
և դիենային
շարքի
թթուները`
ացետիլենային
և դիենային
շարքի
թթուները` ![]() ընդհանուր
բանաձևը.
ընդհանուր
բանաձևը.

Չհագեցած
թթուներին
բնորոշ է
շղթայի ճյուղավորման,
կարբօքսիլ
խմբի
նկատմամբ
կրկնակի կամ եռակի
կապի դիրքի,
ինչպես նաև տարածական
(ցիս-տրանս)
իզոմերիա:
Այսպես,
կրոտոնաթթուն
հայտնի է
երկու
ձևափոխություններով.
պինդ`
![]() և
հեղուկ`
և
հեղուկ` ![]() Յոդի
կամ բրոմի
ներկայությամբ
արևի լույսի
ազդեցության
տակ անկայուն
(լաբիլ) հեղուկ
ձևը
քանակապես
փոխարկվում է
կայուն (ստաբիլ)
պինդ ձևի:
Կրոտոնաթթվի
երկու ձևերի
նշված
տարբերությունները
հետևանք են
կրկնակի կապի
նկատմամբ
ատոմների և
ատոմական
խմբերի տարածական
տարբեր
դասավորության.
Յոդի
կամ բրոմի
ներկայությամբ
արևի լույսի
ազդեցության
տակ անկայուն
(լաբիլ) հեղուկ
ձևը
քանակապես
փոխարկվում է
կայուն (ստաբիլ)
պինդ ձևի:
Կրոտոնաթթվի
երկու ձևերի
նշված
տարբերությունները
հետևանք են
կրկնակի կապի
նկատմամբ
ատոմների և
ատոմական
խմբերի տարածական
տարբեր
դասավորության.

37.1. Ստացման եղանակներ
Չհագեցած թթուներ ստանում են թթուների ստացման ընդհանուր, նաև որոշ յուրահատուկ եղանակներով:
37.1.1. Չհագեցած կապ ունեցող միացության մեջ ներմուծվում է կարբօքսիլ խումբ (չհագեցած սպիրտների և ալդեհիդների օքսիդացում, նիտրիլների հիդրոլիզ և այլն): Վինիլքացախաթթու կարելի է ստանալ համաձայն հետևյալ սխեմայի.
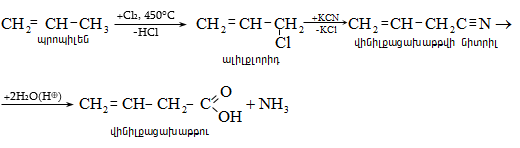
37.1.2. Հալոգեն կամ օքսի խումբ պարունակող հագեցած թթուները դեհիդրոհալոգենացումով կամ դեհիդրատացումով փոխարկվում են չհագեցած թթուների: Ակրիլաթթու կարելի է ստանալ α-բրոմպրոպիոնաթթուն ալկալու սպիրտային լուծույթում տաքացնելով (դեհիդրոհալոգենացում), իսկ մեթակրիլաթթուն` 2-օքսի-2-մեթիլպրոպիոնաթթվից (դեհիդրատացում).
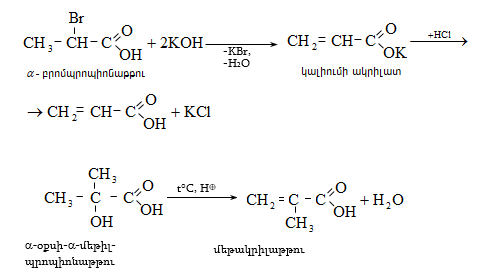
37.2. Ֆիզիկական և քիմիական հատկություններ
Ցածրամոլեկուլային և որոշ բարձրամոլեկուլային չհագեցած թթուները հեղուկներ են, մյուսները` պինդ նյութեր: Ցածրամոլեկուլային թթուները սուր և ուժեղ հոտ ունեն, լավ լուծվում են ջրում: Սահմանային թթուներից տարբերվում են ավելի մեծ խտությամբ և մեծ թթվայնությամբ.
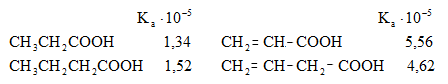
Չհագեցած թթուները փոխազդում են կարբօքսիլ խմբի և կրկնակի կապի մասնակցությամբ: Ստացվում են թթուների բոլոր ածանցյալները` աղեր, հալոգենածանցյալներ, բարդ եթերներ, ամիդներ և այլն: Ի հաշիվ կրկնակի կապի` մտնում են միացման, օքսիդացման, պոլիմերացման ռեակցիաների մեջ:
α,β-չհագեցած
թթուների
քիմիական
հատկությունները
յուրահատուկ
են ![]() զուգորդման
հետևանքով:
զուգորդման
հետևանքով:
Էլեկտրոֆիլ միացումը կատարվում է զուգորդված համակարգի 1,4-դիրքերում, ինչպես 1,3-դիեններում.
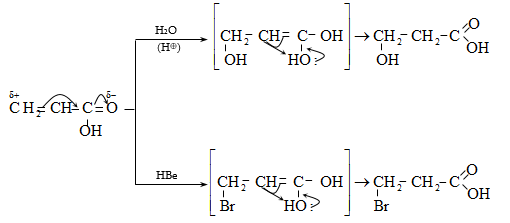
Այս միացություններում AdE միացումը կատարվում է հակառակ Մարկովնիկովի կանոնի:
AdE մեխանիզմ.
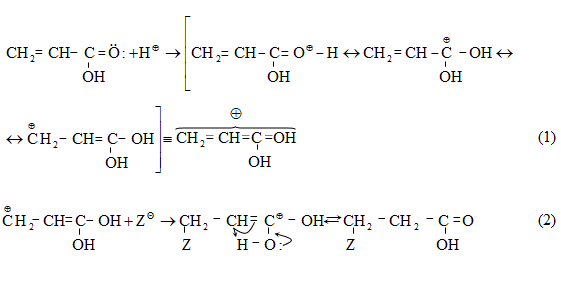
Ռեակցիան ընթանում է երկու փուլով: Առաջին փուլում կատարվում է էլեկտրոֆիլի միացում զուգորդված համակարգի ծայրային ատոմին` թթվածնին, որը բերում է կայուն ռեզոնանսային կարբկատիոնի: Երկրորդ փուլում բացասական լիցքավորված ռեագենտը միանում է կարբկատիոնի β-ածխածնին` առաջացնելով հագեցած կարբոնիլային միացության ենոլային ձև, որը տաուտոմեր փոխարկման է ենթարկվում` վերածվելով կետո-ձևի:
Չհագեցած թթուները և դրանց եթերները ենթարկվում են պոլիմերացման` առաջացնելով արժեքավոր պոլիմերներ, որոնք թափանցիկ են և անտարբեր տաքացման ու լույսի նկատմամբ: Կիրառվում են օրգանական ապակու արտադրության մեջ, սոսնձի, թաղանթների ստացման համար:
37.3. Առանձին ներկայացուցիչներ
37.3.1. Ակրիլաթթու
(պրոպենաթթու)` սուր,
գրգռիչ հոտով
հեղուկ է, ![]() խտությունը`
1,0621: Ակրիլաթթվի
արդյունաբերական
ստացման
եղանակներն
են`
խտությունը`
1,0621: Ակրիլաթթվի
արդյունաբերական
ստացման
եղանակներն
են`
ա) պրոպիլենի գազաֆազ օքսիդացում.
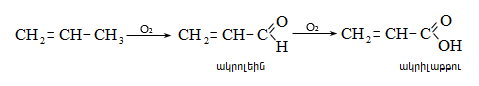
բ) ակրիլոնիտրիլի հիդրոլիզ նոսր ծծմբական թթվով.
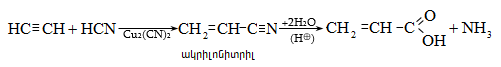
գ) ացետիլենի կարբոնիլացում.
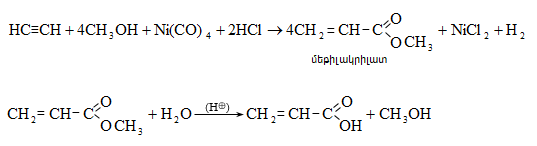
դ) պրոպենի օքսիդացումով և ամոնոլիզով սկզբում ստացվում է ակրիլոնիտրիլ, որը հիդրոլիզվում է ակրիլաթթվի.
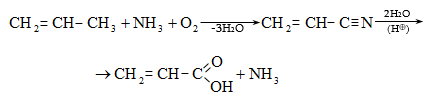
Մեթիլակրիլատ ստանում են վերը նկարագրված եղանակով կամ ակրիլոնիտրիլի ալկոհոլիզով.
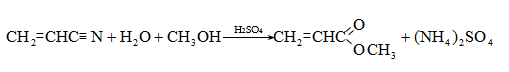
37.3.2.
Մեթակրիլաթթու` ![]() հեղուկ
է,
հեղուկ
է, ![]() խտությունը`
1,0153: Այն ստանում
են նմանատիպ
եղանակներով,
ինչ
ակրիլաթթուն`
խտությունը`
1,0153: Այն ստանում
են նմանատիպ
եղանակներով,
ինչ
ակրիլաթթուն`
ա) իզոբութիլենից.
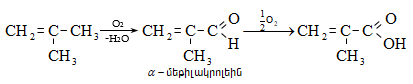
բ) ացետոնից.
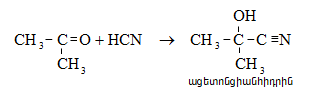
Ացետոնցիանհիդրինը ծծմբական թթվով տաքացնելիս ենթարկվում է դեհիդրատացման և հիդրոլիզի, առաջանում է մեթակրիլաթթու, իսկ մեթանոլի միջավայրում` մեթիլմեթակրիլատ.
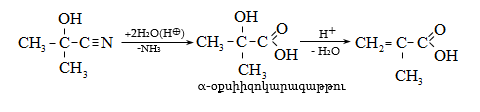
37.3.3.
Բարձրամոլեկուլային
էթիլենային
թթուներից
կարևոր
նշանակություն
ունի օլեինաթթուն`
![]() Z-իզոմերը:
Z-իզոմերը:
Անհամ, անհոտ, յուղանման հեղուկ է, հանդիպում է բոլոր բնական ճարպերի և յուղերի մեջ, որոնցից կարող է ստացվել հիդրոլիզով: Երկար ժամանակ մնալուց, ՈՒՄ-ճառագայթման կամ ազոտի օքսիդների ազդեցությամբ իզոմերվում է էլաիդինաթթվի (E-իզոմեր), որը պինդ նյութ է.
Օլեինաթթվին բնորոշ են չհագեցած թթուների բոլոր հատկությունները:
Երկհիմն չհագեցած թթուների պարզագույն ներկայացուցիչները չորս ածխածնի ատոմ ունեցող թթուներն են` էթիլեն-1,2-դիկարբոնաթթուն և ացետիլենդիկարբոնաթթուն:
![]() էթիլեն-1,2-դիկարբոնաթթու
(բութենդիթթու)
էթիլեն-1,2-դիկարբոնաթթու
(բութենդիթթու)
![]() ացետիլենդիկարբոնաթթու
(բութինդիթթու)
ացետիլենդիկարբոնաթթու
(բութինդիթթու)
Էթիլեն-1,2-դիկարբոնաթթուն բազմաթիվ չհագեցած թթուների նման գոյություն ունի երկու երկրաչափական իզոմերների տեսքով. մալեինաթթու (ցիս-իզոմեր) և ֆումարաթթու (տրանս-իզոմեր):
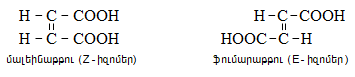
38.1. Ֆիզիկական հատկություններ
Ֆումարաթթուն
և
մալեինաթթուն
ֆիզիկական և որոշ
քիմիական հատկություններով
կտրուկ
տարբերվում
են միմյանցից:
Բյուրեղային
նյութեր են,
հալվում են
համապատասխանաբար
![]() Ֆումարաթթուն
վատ է
լուծվում
ջրում (0,7 գ թթու
100 մլ ջրում
Ֆումարաթթուն
վատ է
լուծվում
ջրում (0,7 գ թթու
100 մլ ջրում ![]() իսկ
մալեինաթթուն`
լավ (78,8 գ թթու 100
մլ ջրում
իսկ
մալեինաթթուն`
լավ (78,8 գ թթու 100
մլ ջրում ![]() Այրման
ջերմությունները
տարբեր են.
մալեինաթթվինը`
1369,1 կՋ/մոլ,
ֆումարաթթվինը`
1339 կՋ/մոլ:
Մալեինաթթուն
ավելի ուժեղ թթու
է, քան
ֆումա-րաթթուն,
մալեինաթթվի
թթվայնության
հաստատունը
Այրման
ջերմությունները
տարբեր են.
մալեինաթթվինը`
1369,1 կՋ/մոլ,
ֆումարաթթվինը`
1339 կՋ/մոլ:
Մալեինաթթուն
ավելի ուժեղ թթու
է, քան
ֆումա-րաթթուն,
մալեինաթթվի
թթվայնության
հաստատունը ![]() իսկ
ֆումարաթթվինը`
իսկ
ֆումարաթթվինը`
![]() Մալեինաթթուն,
ինչպես
ցիս-իզոմերների
մեծամասնությունը,
անկայուն է.
հալոգենաջրածնական
թթուների ազդեցությամբ,
բրոմով արևի
ճառագայթների
տակ և մինչև
հալման
ջերմաստիճանը
տաքացմամբ
իզոմերվում է
ֆումարաթթվի:
Առավել
կայուն
ֆումարաթթվի
փոխարկումը
մալեինաթթվի
իրականացվում
է թթվի ջրային
լուծույթի
ճառագայթմամբ
ուլտրամանուշակագույն
լույսով
Մալեինաթթուն,
ինչպես
ցիս-իզոմերների
մեծամասնությունը,
անկայուն է.
հալոգենաջրածնական
թթուների ազդեցությամբ,
բրոմով արևի
ճառագայթների
տակ և մինչև
հալման
ջերմաստիճանը
տաքացմամբ
իզոմերվում է
ֆումարաթթվի:
Առավել
կայուն
ֆումարաթթվի
փոխարկումը
մալեինաթթվի
իրականացվում
է թթվի ջրային
լուծույթի
ճառագայթմամբ
ուլտրամանուշակագույն
լույսով ![]()
38.2. Կիրառման բնագավառներ, թունավորություն
Մալեինաթթուն
կիրառվում է
գինեթթվի և
խնձորաթթվի,
մակերևութային
ակտիվ
նյութերի, պոլիմերների,
խեժերի
արտադրություններում:
Ֆումարաթթուն
կիրառվում է
եթերային
յուղերի ստացման
համար, ինչպես
նաև
սննդարդյունաբերությունում
որպես
լիմոնաթթվի և
գինեթթվի փոխարինող:
Մալեինաթթվի
ՍԹԿ-ն
բնակավայրերի
համար ![]() իսկ
արտադրական
կառույցներում`
իսկ
արտադրական
կառույցներում`
![]()
Լայն
կիրառություն
ունի
մալեինանհիդրիդը,
որն անգույն
բյուրեղային
նյութ է, ![]() լուծվում
է ջրում`
վերածվելով
մալեինաթթվի: Կիրառվում
է չհագեցած
պոլիմերային
խեժերի,
ֆումարաթթվի
և խնձորաթթվի,
ֆունգիցիդների
արտադրություններում:
Կարևորագույն
դիենոֆիլ է
Դիլս-Ալդերի
ռեակցիայում`
1,3-դիենների
հայտնաբերման
համար:
Թունավոր է, ՍԹԿ-ն
լուծվում
է ջրում`
վերածվելով
մալեինաթթվի: Կիրառվում
է չհագեցած
պոլիմերային
խեժերի,
ֆումարաթթվի
և խնձորաթթվի,
ֆունգիցիդների
արտադրություններում:
Կարևորագույն
դիենոֆիլ է
Դիլս-Ալդերի
ռեակցիայում`
1,3-դիենների
հայտնաբերման
համար:
Թունավոր է, ՍԹԿ-ն
![]() գրգռում
է աչքերը և
շնչառական
օրգանները: Մալեինանհիդրիդով
թունավորումն
ուղեկցվում է
բրոնխիտով,
աղեստամոքսային
համակարգի
խանգարումներով:
Այս նյութի
համաշխարհային
արտադրությունը
2000 թվականին
կազմել է մոտ 700000
տոննա:
գրգռում
է աչքերը և
շնչառական
օրգանները: Մալեինանհիդրիդով
թունավորումն
ուղեկցվում է
բրոնխիտով,
աղեստամոքսային
համակարգի
խանգարումներով:
Այս նյութի
համաշխարհային
արտադրությունը
2000 թվականին
կազմել է մոտ 700000
տոննա:
Չհագեցած թթուներն ստացվում են հետևյալ եղանակներով.
38.3.1. Մալեինաթթու արտադրության մեջ ստացվում է օդի թթվածնով բենզոլի և նավթալինի կատալիզային օքսիդացումով.
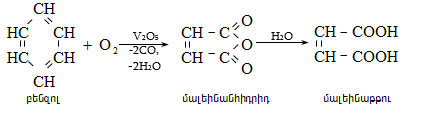
Մալեինաթթվի և մալեինանհիդրիդի հետ զուգահեռ ռեակցիայի ընթացքում ստացվում է նաև կրոտոնալդեհիդ:
38.3.2.
Մալեինաթթու
և
ֆումարաթթու
ստացվում են
օքսիսաթաթթվի
(խնձորաթթու)
դեհիդրատացումով.
ցածր
ջերմաստիճանում
հիմնականում
ստացվում է
մալեինաթթու,
իսկ բարձր
ջերմաստիճանում
![]() ֆումարաթթու:
ֆումարաթթու:
38.3.3. Քլորսաթաթթվից, ալկալու սպիրտային լուծույթի ազդեցությամբ, ստացվում է ֆումարաթթու (աղի տեսքով).
38.3.4. Ալկալու սպիրտային լուծույթի ազդեցությամբ դիբրոմսաթաթթվի, ինչպես նաև քլոր կամ բրոմմալեինաթթվի, բրոմֆումարաթթվի վրա` առաջանում է ացետիլենդիկարբոնաթթու.
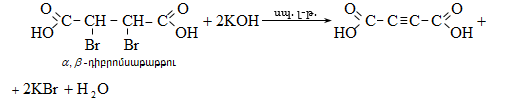
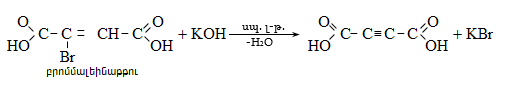
38.4.1. Չհագեցած դիկարբոնաթթուներին բնորոշ են կրկնակի կապի բոլոր ռեակցիաները. հիդրոգենացում, հալոգենացում, հիդրատացում և այլն: Ե´վ ֆումարաթթվից, և´ մալեինաթթվից առաջանում են սաթաթթվի միևնույն ածանցյալները.
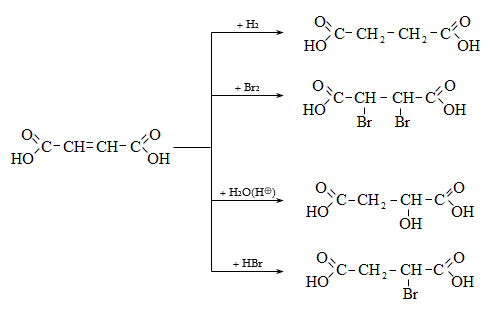
38.4.2. Կալիումի պերմանգանատի ալկալիական լուծույթով ցածր ջերմաստիճանում մալեինաթթուն դանդաղ օքսիդանում է մեզոգինեթթվի, իսկ ֆումարաթթուն` խաղողաթթվի.
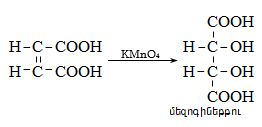
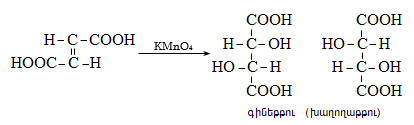
Աղաթթվի միջավայրում և´ ցիս, և´ տրանս իզոմերները վերածվում են մեզոգինեթթվի:
38.4.3. Չհագեցած երկհիմն թթուներն առաջացնում են աղեր, բարդ եթերներ և թթուների այլ ածանցյալներ: Մալեինաթթուն տաքացման պայմաններում դեհիդրատանում է ցիկլային անհիդրիդի, քանի որ երկու կարբօքսիլ խմբերը տարածականորեն մոտ են իրար.
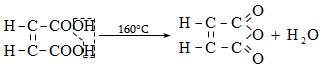
Ֆումարաթթուն նույն պայմաններում անհիդրիդ չի առաջացնում: Ֆոսֆորի անհիդրիդի հետ տաքացնելիս վերախմբավորվում է մալեինաթթվի, իսկ վերջինս փոխարկվում է անհիդրիդի.
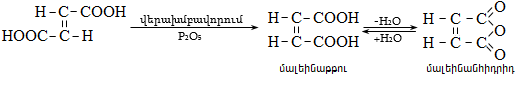
Մալեինանհիդրիդը հիդրատացումով փոխարկվում է խնձորաթթվի, որը կիրառվում է սննդարդյունաբերության մեջ.
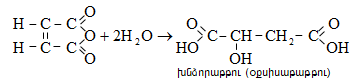
Մալեինաթթուն դեկարբօքսիլանում է ակրիլաթթվի: Ֆումարաթթվի քլորացումով առաջանում է ֆումարոիլքլորիդ:
Արոմատիկ
կարբոնաթթուներ
են կոչվում
այն միացությունները,
որոնք
բենզոլային
օղակին կից
ունեն
կարբօքսիլ ![]() բնորոշիչ
խումբ:
Բենզոլային
օղակի կողմնային
շղթայում
կարբօքսիլ
խմբով միացությունները
դիտարկվում
են որպես
տեղակալված
ալիֆատիկ
թթուներ: Ըստ
կարբօքսիլ
խմբի թվի,
թթուները
կարող են
լինել
միահիմն,
երկհիմն և
այլն:
Արոմատիկ
կարբոնաթթուները
հիմնականում
անվանվում են
ըստ
համապատասխան
արոմատիկ
ածխաջրածնի:
բնորոշիչ
խումբ:
Բենզոլային
օղակի կողմնային
շղթայում
կարբօքսիլ
խմբով միացությունները
դիտարկվում
են որպես
տեղակալված
ալիֆատիկ
թթուներ: Ըստ
կարբօքսիլ
խմբի թվի,
թթուները
կարող են
լինել
միահիմն,
երկհիմն և
այլն:
Արոմատիկ
կարբոնաթթուները
հիմնականում
անվանվում են
ըստ
համապատասխան
արոմատիկ
ածխաջրածնի:
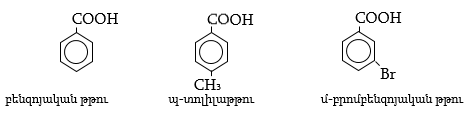
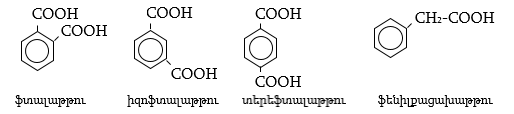
39.1. Ֆիզիկական հատկություններ
Արոմատիկ թթուներն անգույն, բյուրեղային նյութեր են: Պարա դիրքում տեղակալիչ ունեցող թթուների հալման ջերմաստիճաններն ավելի բարձր են, քան դրանց իզոմերներինը: Արոմատիկ թթուների եռման և հալման ջերմաստիճաններն ավելի բարձր են, քան նույն թվով ածխածնի ատոմ պարունակող սահմանային թթուներինը: Վատ են լուծվում սառը ջրում, լավ՝ տաք ջրում: Լուծվում են բևեռային լուծիչներում: ՈՒնեն ավելի մեծ դիսոցման հաստատուն, քան քացախաթթվի հոմոլոգները`
բենզոյական թթու` Kդիս.=6.6.10-5
քացախաթթու` Kդիս.=1.8.10-5
39.2. Կիրառման բնագավառներ, թունավորություն
Բենզոյական
թթուն ![]() ազատ
վիճակում
գտնվում է
որոշ բնական
խեժերում,
հիպուրաթթվի
տեսքով
(բենզոիլգլիցին)`
խոտակեր
անասունների
մեզում:
Բենզոիլքլորիդը,
բենզոիլպերօքսիդը
կիրառվում են
որպես բենզոիլացնող
միջոցներ և
որպես
բարձրաեռ լուծիչներ:
Բենզոիլքլորիդն
ուժեղ
արցունքաբեր
է
ազատ
վիճակում
գտնվում է
որոշ բնական
խեժերում,
հիպուրաթթվի
տեսքով
(բենզոիլգլիցին)`
խոտակեր
անասունների
մեզում:
Բենզոիլքլորիդը,
բենզոիլպերօքսիդը
կիրառվում են
որպես բենզոիլացնող
միջոցներ և
որպես
բարձրաեռ լուծիչներ:
Բենզոիլքլորիդն
ուժեղ
արցունքաբեր
է ![]() Բենզոիլպերօքսիդը լավագույն
հարուցիչ է
պոլիմերացման
գործընթացում:
Տոլուիլաթթուները
(մեթիլբենզոյական
թթուներ)
միջատների
դեմ պայքարի
միջոցներ են:
Պոլիեթերային
խեժերի
արտադրությունում
լայն
կիրառություն
ունի
պ-երրբութիլբենզոյական
թթուն:
Ֆենիլքացախաթթուն
և եթերները կիրառվում
են օծանելիքի
արտադրությունում:
Նիտրո և
հալոգենբենզոյական
թթուները
թունավոր են,
ազդում են
մաշկի, շնչուղիների
լորձաթաղանթների
վրա,
առաջացնում
են տևական
թունավորում:
Պ-նիտրոբենզոյական
թթվի ՍԹԿ-ն
Բենզոիլպերօքսիդը լավագույն
հարուցիչ է
պոլիմերացման
գործընթացում:
Տոլուիլաթթուները
(մեթիլբենզոյական
թթուներ)
միջատների
դեմ պայքարի
միջոցներ են:
Պոլիեթերային
խեժերի
արտադրությունում
լայն
կիրառություն
ունի
պ-երրբութիլբենզոյական
թթուն:
Ֆենիլքացախաթթուն
և եթերները կիրառվում
են օծանելիքի
արտադրությունում:
Նիտրո և
հալոգենբենզոյական
թթուները
թունավոր են,
ազդում են
մաշկի, շնչուղիների
լորձաթաղանթների
վրա,
առաջացնում
են տևական
թունավորում:
Պ-նիտրոբենզոյական
թթվի ՍԹԿ-ն ![]()
Դարչնաթթուն հոտավետ է, կիրառվում է օծանելիքի արտադրության մեջ, նաև` բժշկության բնագավառում:
Միահիմն արոմատիկ կարբոնաթթուներն ստացվում են սահմանային թթուների ստացման բոլոր եղանակներով: Այստեղ դիտարկված են ավելի հաճախ կիրառվող ռեակցիաներ:
39.3.1. Արոմատիկ ածխաջրածինների օքսիդացում քրոմաթթվով, կալիումի պերմագանատի հիմնային լուծույթով կամ նոսր ազոտական թթվով (արտադրական եղանակ).
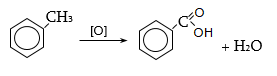
Բենզոլի բարձրագույն հոմոլոգները նույնպես օքսիդանում են բենզոյական թթվի (օքսիդացումը կատարվում է բենզոլային օղակի նկատմամբ α-ածխածնի մոտ).
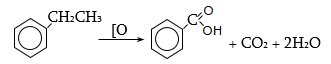
39.3.2. Արոմատիկ կետոնների օքսիդացում հիպոհալոգենիտներով.
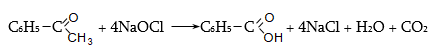
39.3.3. Բենզոտրիհալոգենիդի հիդրոլիզ.
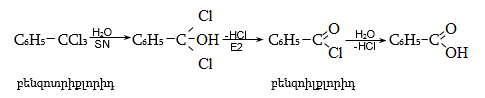
39.3.4. Նիտրիլների հիդրոլիզ.
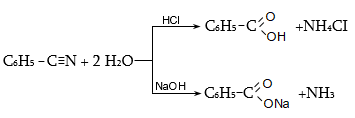
Արոմատիկ նիտրիլներն ստացվում են դիազոմիացություններից և հալոգենբենզոլներից պղնձի ցիանիդով պիրիդինում կամ սուլֆոնատների միահալումով կալիումի ցիանիդի հետ.
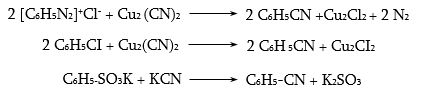
39.3.5. Բենզոլային օղակ կարբօքսիլ խումբ կարելի է ներմուծել ըստ Ֆրիդել-Կրաֆտսի` որպես ացիլող միջոց կիրառելով ածխաթթվի հալոգենածանցյալ (ֆոսգեն) կամ քլորածխաթթվի եթերներ: Կատալիզատոր է ալյումինի քլորիդը.
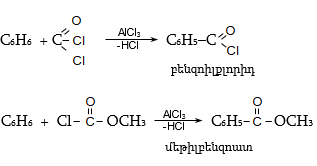
39.3.6. Մետաղօրգանական միացությունների փոխազդեցություն ածխածնի դիօքսիդի հետ: Հիմնականում կիրառվում են լիթիում և մագնեզիումօրգանական միացություններ.
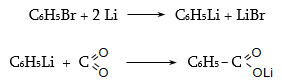
Արոմատիկ թթուներին բնորոշ են սահմանային թթուների բոլոր հատկությունները: Թթուներին բնորոշ բոլոր ածանցյալներն ստացված են նաև բենզոյական թթվի համար:
39.4.1. Աղերն ստացվում են թթուների և ալկալիների կամ կարբոնատների փոխազդեցության արդյունքում:
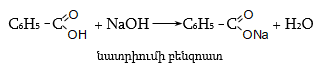
39.4.2. Թթվի և սպիրտի փոխազդեցությամբ ծծմբական թթվի ներկայությամբ ստացվում են բարդ եթերներ:
![]()
Կարբօքսիլ խմբի նկատմամբ օրթո դիրքում տեղակալիչի առկայության դեպքում ռեակցիայի արագությունը նվազում է, իսկ երկու օրթո դիրքերի զբաղված լինելու դեպքում եթերացում չի գնում (տարածական դժվարություն): Օ-տեղակալված բենզոյական թթվի եթեր կարելի է ստանալ թթվի արծաթի աղերի և հալոգենածանցյալների փոխազդեցությամբ.
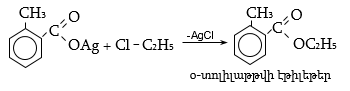
Ստացված եթերները հիդրոլիզվում են ինչպես թթվային, այնպես էլ հիմնային միջավայրում.
![]()
39.4.3. Հալոգենացնող միջոցներով կարբոքսիլ խմբի OH-ը տեղակալվում է հալոգենով:
ա) թիոնիլքլորիդով կամ ֆոսֆորի հալոգենիդներով փոխազդեցության արդյունքում թթուներից ստացվում են հալոգենածանցյալներ:
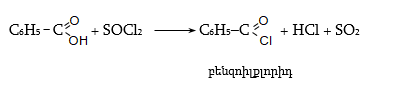
բ) բենզոիլքլորիդ կարելի է ստանալ նաև բենզոտրիքլորիդի մասնակի հիդրոլիզով.
![]()
գ) բենզալդեհիդի քլորացումով.
![]()
Բեզոիլքլորիդը կարևոր արտադրական նշանակություն ունի: Կիրառվում է բենզոիլ և հիդրոբենզոիլպերօքսիդների ստացման համար, նաև որպես ացիլող միջոց: Բենզոիլքլորիդով ացիլվում են սպիրտները, ֆենոլները, ամինները, բենզոլային օղակը (Ֆրիդել-Կրաֆտս):
Բենզոիլքլորիդն ավելի դանդաղ է հիդրոլիզվում, քան սահմանային թթուների քլորանհիդրիդները: Այս հանգամանքն օգտագործվում է Շոտեն-Բաումանի ռեակցիայում` բենզոիլացում ջրահիմնային միջավայրում.
![]()
Ֆենոլների և ամինների բենզոիլացումը կատարվում է նաև անջուր լուծույթներում երրորդային ամինների կամ պիրիդինի ներկայությամբ:
Թթուների քլորանհիդրիդների բարձր ռեակցիոնունակությունը նուկլեոֆիլ ռեագենտների նկատմամբ բացատրվում է կարբոնիլային խմբի ածխածնի ատոմի վրա էլեկտրոնային ամպի խտության փոքրացմամբ` ինչպես թթվածնի, այնպես էլ քլորի ատոմի կողմից էլեկտրոնների տեղաշարժի հետևանքով:
Բենզոիլքլորիդի ածխածնի ատոմի էլեկտրոնային ամպի խտության փոքրացումը որոշ չափով փոխհատուցվում է բենզոլային օղակի կողմից:
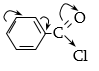
39.4.4. ա) բենզոիլքլորիդի փոխազդեցությամբ նատրիումի պերօքսիդի հետ առաջանում է բենզոիլպերօքսիդ, որը բազմաթիվ ռադիկալային և շղթայական ռեակցիաների և պոլիմերացման հարուցիչ է.
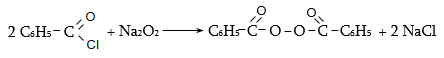
բ) հիմնային միջավայրում ջրածնի պերօքսիդով ստացվում է բենզոիլհիդրոպերօքսիդի նատրիումական աղ.
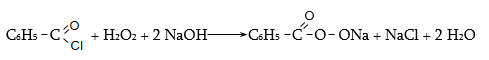
գ) բենզոիլհիդրոպերօքսիդ ստացվում է նաև նատրիումի մեթիլատով ազդելով բենզոիլպերօքսիդի վրա:
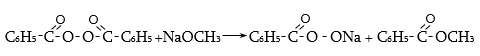
դ) բենզոիլհիդրոպերօքսիդը կիրառվում է չհագեցած միացություններից α-օքսիդներ ստանալու համար (Պրիլեժաև).
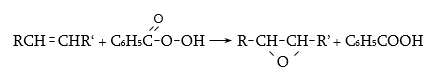
39.4.5. ա) բենզոյական թթվի անհիդրիդ ստացվում է արոմատիկ թթվի թորումով քացախաթթվի անհիդրիդի հետ ֆոսֆորական թթվի ներկայությամբ.
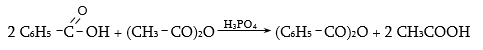
բ) քլորանհիդրիդի և աղի փոխազդեցությամբ.
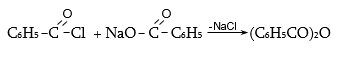
39.4.6. Բենզոնիտրիլ կարելի է ստանալ թթվի ամիդի դեհիդրատացումով ֆոսֆորի (V) օքսիդով.
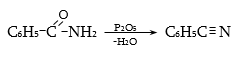
Բենզոնիտրիլն օժտված է նիտրիլներին բնորոշ բոլոր հատկություններով:
39.4.7. Արոմատիկ կարբոնաթթվի աղի և ալկալու միահալումով տեղի է ունենում դեկարբօքսիլացում:
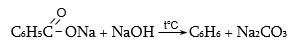
Կարբոնաթթուները, որոնք ունեն ալդեհիդային կամ կետոնային խմբավորում, համապատասխանաբար, կոչվում են ալդեհիդո- կամ կետո- թթուներ: Կարբօքսիլ կամ կարբոնիլ խմբերի փոխադարձ դասավորվածությամբ պայմանավորված` օքսոթթուները դիտվում են որպես α, β, γ և այլ ալդեհիդո- կամ կետո- թթուներ:

α-կետոթթուներն ստացվում են`
ա) α , α -դիհալոգենկարբոնաթթուների հիդրոլիզով.
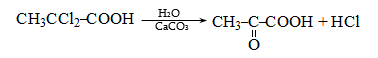
բ) α -օքսիթթուների օքսիդացումով.
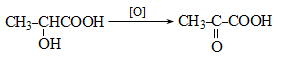
գ) α -կետոթթուների նիտրիլների հիդրոլիզով.
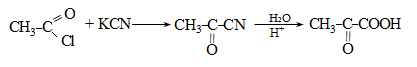
դ) կարբոնաթթուների եթերների կոնդենսացումով թրթնջկաթթվի հետ (Կլայզենի խաչաձև կոնդենսացում) և ստացված միացության թթվային ճեղքումով.
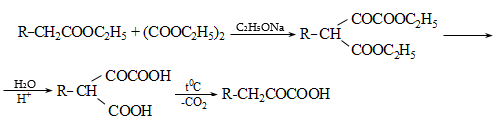
41. ԱՑԵՏՈՔԱՑԱԽԱԹԹՎԱԿԱՆ ԷԹԻԼԵԹԵՐ
Ացետոքացախաթթվական էթիլեթերն ստացվում է Կլայզենի բարդեթերային կոնդենսացումով.
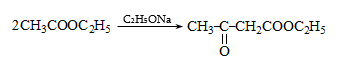
Էթիլացետատը CH-թթու է, ալկոհոլի ազդեցությամբ վերածվում է ենոլյատ իոնի, որն ուժեղ նուկլեոֆիլ է, գրոհում է հաջորդ մոլեկուլի դրական կենտրոնին, իսկ առաջացած միջանկյալ անիոնը կայունանում է` պոկելով էթօքսիդ իոն.
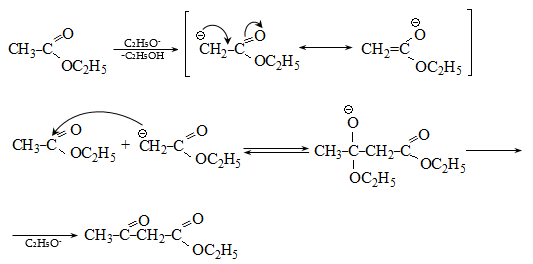
Ացետոքացախաթթվական եթերը կետո-ենոլ տաուտոմեր ձևերի հավասարակշռային խառնուրդ է .

Տաուտոմերների հարաբերությունը կախված է լուծիչի բնույթից: Հեքսանում ենոլի պարունակությունը հասնում է 49%-ի, իսկ ջրում կտրուկ նվազում է: Անցումը մի ձևից մյուսին իրականացվում է պրոտոնի փոխանցումով` ռեզոնանսորեն կայունացված միջանկյալ անիոնի առաջացմամբ.
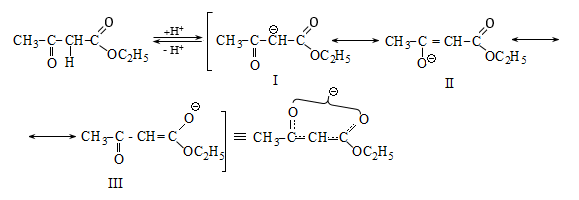
Ացետոքացախաթթվական եթերի ենոլ ձևի մեծ կայունությունը բացատրվում է զուգորդված π-կապերի համակարգով, որը ներմոլեկուլային ջրածնական կապի միջոցով ներփակված է որպես վեցանդամ կեղծ արոմատիկ ցիկլ.
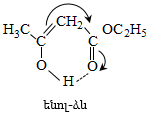
41.1. Սինթեզներ ացետոքացախաթթվական եթերի հիման վրա
Ացետոքացախաթթուն անկայուն է, հիմքի ներկայությամբ տաքացնելիս դեկարբօքսիլանում է, իսկ եթերները կայուն միացություններ են` օժտված մեծ ռեակցիոնունակությամբ.
![]()
41.1.1. Ացետոքացախաթթվական եթերը հիդրոլիզվում է` առաջացնելով թթու և սպիրտ.
![]()
41.1.2. Որպես կետոն ռեակցում է հիդրօքսիլամինի, ցիանաջրածնի, ֆենիլհիդրազինի հետ` առաջացնելով համապատասխան արգասիքներ.
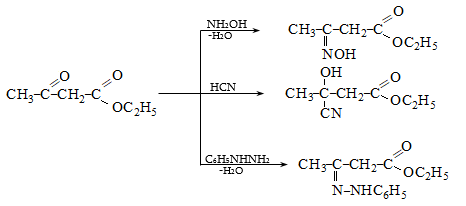
Որպես
ենոլ
ացետոքացախաթթվական
եթերը
ցուցաբերում
է
CH-թթվայնություն
և ֆենոլի նման
կարմիր
գունավորում
է առաջացնում
երկաթի (III)
քլորիդի հետ:
Փոխազդում է ացետիլքլորիդի,
ֆոսֆորի
քլորիդի, ![]() հետ`
մեթանի
անջատումով (Չուգաև,
Ցերեվիտինով),
գունազրկում
է բրոմաջուրը,
ցածր
ջերմաստիճանում
լուծվում է
2%-ոց KOH-ի
լուծույթում.
հետ`
մեթանի
անջատումով (Չուգաև,
Ցերեվիտինով),
գունազրկում
է բրոմաջուրը,
ցածր
ջերմաստիճանում
լուծվում է
2%-ոց KOH-ի
լուծույթում.

Ացետոքացախաթթվական եթերը հիմքի ազդեցությամբ փոխարկվում է երկբևեռ (ամբիդենտ) իոնի.
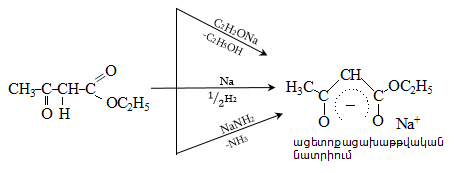
Անիոնի և հալոգենալկանի փոխազդեցությամբ գոյանում են O- կամ C- տեղակալման արգասիքներ.
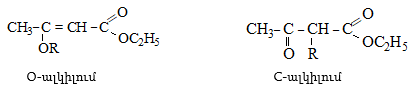
Ռեակցիայի ուղղությունը պայմանավորված է հալոգենալկանի կառուցվածքով և ռեակցիայի պայմաններով: Կարևոր կիրառական նշանակություն ունի C-ալկիլումը, որը կատարվում է այնպիսի ալկիլհալոգենիդներով, որոնց բնորոշ է SN2 տեղակալման ռեակցիան: α-տեղակալված ացետոքացախաթթվական եթերն ավելի թույլ CH-թթու է, հետևաբար իոնացումը կատարվում է ավելի ուժեղ հիմքով.
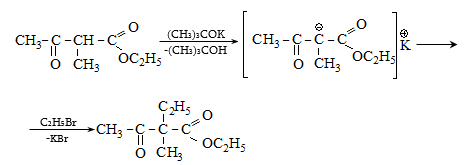
Մոնո- և դիտեղակալված ացետոքացախաթթվական եթերները կիրառվում են համապատասխան կետոնների և թթուների ստացման համար:
41.1.3. Կետոնների ստացում: Թթուների և հիմքերի ջրային լուծույթներում ացետոքացախաթթվական եթերները (ալկիլ, դիալկիլ- տեղակալված) հիդրոլիզվում են համապատասխան թթուների, որոնց դեկարբօքսիլացումից ստացվում են կետոններ.
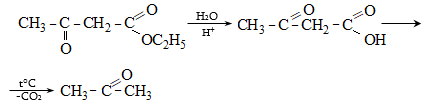
Ենթադրվում է, որ β-կետոթթուների դեկարբօքսիլացումով առաջանում է կետոնի ենոլ ձևը, որը փոխարկվում է կետո ձևի.
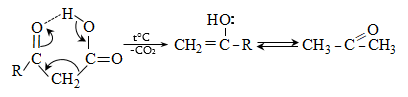
41.1.4. Թթուների ստացում: Ացետոքացախաթթվական եթերների թթվային ճեղքումը կատարվում է խիտ ալկալիների ազդեցությամբ. այս ռեակցիան Կլայզենի բարդ եթերային կոնդենսացման հակառակ գործընթացն է.
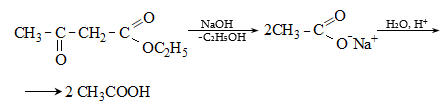
Թթվային ճեղքումը կատարվում է որպես and և E ռեակցիաների հաջորդականություն.
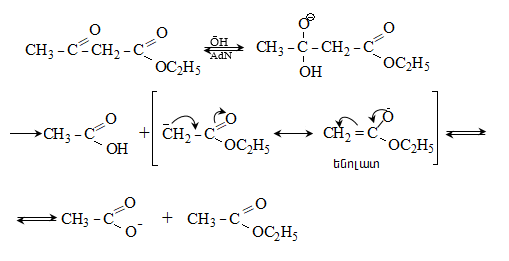
Առաջին փուլում հիդրօքսիդ իոնը գրոհում է կարբոնիլ խմբի վրա (AdN), առաջացած միջանկյալ անիոնից պոկվում է ենոլյատ իոնը, ապա կատարվում է թթվահիմնային փոխազդեցություն: Եթե թթվային ճեղքման են ենթարկվում տեղակալված ացետոքացախաթթվական եթերները, ապա քացախաթթվի հետ միասին ստացվում է ալկիլ կամ դիալկիլքացախաթթու:
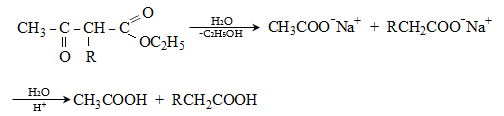
41.2. Ացետոքացախաթթվական եթերի երկբևեռ հատկությունները
Ալկիլհալոգենիդների հետ փոխազդեցության արդյունքում, միջավայրի բնույթից կախված, ստացվում են O- կամ C-ալկիլված միացություններ: Այսպես, սպիրտում ենոլյատ իոնի առավել էլեկտրոնակցեպտոր թթվածնի ատոմն ուժեղ սոլվատացված է, ածխածնի ատոմը ցուցաբերում է մեծ նուկլեոֆիլություն, և տեղի է ունենում C-ալկիլում: Դիմեթիլֆորմամիդում երկու նուկլեոֆիլ կենտրոններն էլ սոլվատացված չեն. այս դեպքում գերակշռում է O-ալկիլումը:
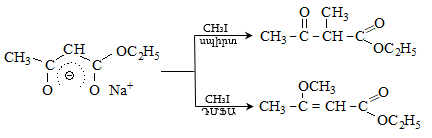
Ալկիլումը կատարվում է և´ մեթիլենային, և´ մեթիլ խմբերում: Երկու խմբերն էապես տարբերվում են իրենց թթվայնությամբ. մեթիլենային խմբի PKα-ն 10,7 է, իսկ մեթիլ խմբի PK α-ն` 20: Այդ պատճառով մեկ մոլ հիմքի ներկայությամբ որպես ռեակցիոն կենտրոն հանդես է գալիս մեթիլենային խմբի իոնացման արդյունքում առաջացած կարբանիոնը (I ուղղություն), իսկ 2 մոլ ուժեղ հիմքի ներկայությամբ (լիթիումի դիիզոպրոպիլամիդ) երկու թթվային կենտրոններն էլ իոնանում են (II ուղղություն): Մեթիլ խմբից առաջացած կարբանիոնը, որն առավել ուժեղ հիմք է (որպես ավելի թույլ թթվի զուգորդված հիմք), հետևաբար, ավելի ուժեղ նուկլեոֆիլ` գործում է որպես ռեակցիոն կենտրոն.
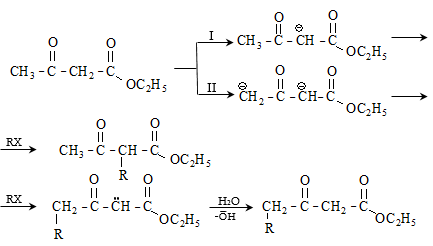
Միքայելի ռեակցիա: Ացետոքացախաթթվական եթերի ենոլյատ իոնը կարող է փոխազդել նաև զուգորդված համակարգերի հետ (α, β-չհագեցած կարբոնիլային միացություններ)
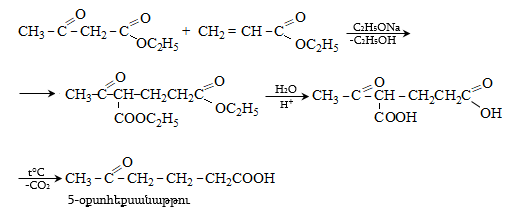
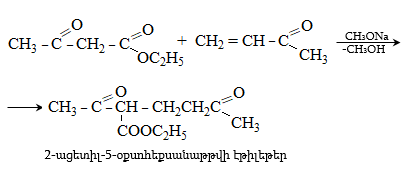
1. Ինչպիսի՞ էլեկտրոնային էֆեկտներ են գործում հետևյալ միացություններում.
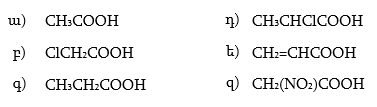
2. Անվանել հետևյալ միացությունները`
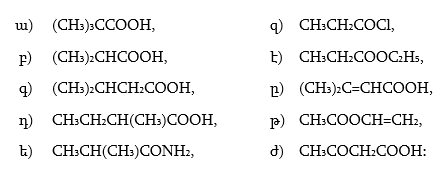
3. Հետևյալ միացությունները դասակարգել ըստ թթվայնության մեծացման.
|
ա) |
պրոպանաթթու, |
դ) |
պենտան, |
|
բ) |
ացետիլեն, |
ե) |
2-քլորպրոպանաթթու, |
|
գ) |
1-պրոպանոլ , |
զ) |
3-քլորպրոպանաթթու: |
4. Թթուների ստացման բոլոր եղանակներով ստանալ պենտանաթթու, 2-մեթիլբութանաթթու, 3-մեթիլբութանաթթու:
5. Իրականացնել հետևյալ փոխարկումները.
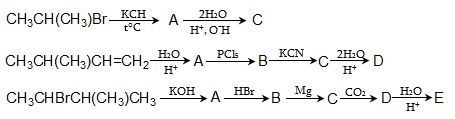
6. Գրել ռեակցիաների հավասարումները, որոնց օգնությամբ իզոկարագաթթվից կստացվեն հետևյալ միացությունները: Կիրառել անհրաժեշտ ռեագենտները.
|
ա) |
իզոկարագաթթվի էթիլեթեր, |
|
բ) |
իզոկարագաթթվի նատրիումական աղ, |
|
գ) |
իզոբութիլսպիրտ, |
|
դ) |
իզոկարագաթթվի ամիդ, |
|
ե) |
իզոկարագաթթվի քլորանհիդրիդ: |
7. Գրել ռեակցիաների հավասարումները, որոնց օգնությամբ բենզոյական թթուն կփոխարկվի հետևյալ միացությունների.
|
ա) |
նատրիումի բենզոատ, |
ե) |
պրոպիլբենզոատ, |
|
բ) |
բենզոիլքլորիդ, |
զ) |
պ - տոլիլբենզոատ, |
|
գ) |
բենզամիդ, |
է) |
մ - բրոմֆենիլբենզոատ, |
|
դ) |
բենզոլ, |
ը) |
բենզիլսպիրտ |
8. Գրել ![]() բաղադրությամբ
նյութի
կառուցվածքային
բանաձևը, որն
օժտված է
օպտիկական
ակտիվությամբ
և ունի
թթվային
ռեակցիա, HCl-ի
հետ
առաջացնում է
բաղադրությամբ
նյութի
կառուցվածքային
բանաձևը, որն
օժտված է
օպտիկական
ակտիվությամբ
և ունի
թթվային
ռեակցիա, HCl-ի
հետ
առաջացնում է ![]() բաղադրությամբ
միացություն,
իսկ
բաղադրությամբ
միացություն,
իսկ ![]() հետ`
հետ`
![]() Նոսր
ծծմբական
թթվի հետ
տաքացնելիս
վերածվում է
Նոսր
ծծմբական
թթվի հետ
տաքացնելիս
վերածվում է ![]() ալդեհիդի:
Բերել
ռեակցիաների
հավասարումները
և անվանել
ստացվող
միացությունները:
ալդեհիդի:
Բերել
ռեակցիաների
հավասարումները
և անվանել
ստացվող
միացությունները:
9. Իրականացնել հետևյալ փոխարկումները.
10. Բացատրել հետևյալ օրգանական թթուների թթվային հատկությունների տարբերությունը.
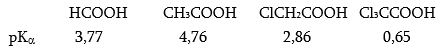
11. Ի՞նչ միացություններ են առաջանում պրոպիոնաթթվի և իզոկարագաթթվի նատրիումական աղերի ջրային լուծույթի էլեկտրոլիզով: Բացատրել կատոդի և անոդի վրա կատարվող երևույթները:
12. 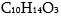 բաղադրությամբ
միացությունը
փոխազդում է ջրի
հետ` առաջացնելով
բաղադրությամբ
միացությունը
փոխազդում է ջրի
հետ` առաջացնելով
 որը
HBr-ի հետ գոյացնում
է
որը
HBr-ի հետ գոյացնում
է 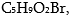 իսկ
իսկ  հետ`
հետ` 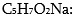 Վերջինիս
էլեկտրոլիզով
անոդի վրա անջատվում
է 2,5-դիմեթիլ-1,5-հեքսադիեն:
Գրել ռեակցիաների
հավասարումները
և անվանել ստացվող
նյութերը:
Վերջինիս
էլեկտրոլիզով
անոդի վրա անջատվում
է 2,5-դիմեթիլ-1,5-հեքսադիեն:
Գրել ռեակցիաների
հավասարումները
և անվանել ստացվող
նյութերը:
13. Իրականացնել հետևյալ փոխարկումները.
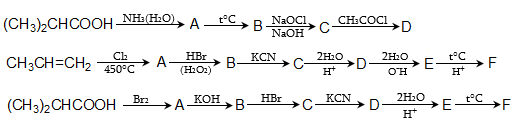
14. Համեմատել կարբօքսիլ և կարբօքսիլատ իոնները: Որտե՞ղ է առավելապես արտահայտված զուգորդման էֆեկտը:
15. ![]() բաղադրությամբ
նյութն
օժտված է
թթվայնությամբ,
հիդրոգենացումով
վերածվում է
սաթաթթվի,
տաքացմամբ
ջուր է
անջատում և
փոխարկվում
բաղադրությամբ
նյութն
օժտված է
թթվայնությամբ,
հիդրոգենացումով
վերածվում է
սաթաթթվի,
տաքացմամբ
ջուր է
անջատում և
փոխարկվում ![]() միացության,
որը
գունազրկում
է բրոմաջուրը և
կալիումի
պերմանգանատի
ջրային
լուծույթը:
Գրել
ելանյութի
կառուցվածքային
բանաձևը:
միացության,
որը
գունազրկում
է բրոմաջուրը և
կալիումի
պերմանգանատի
ջրային
լուծույթը:
Գրել
ելանյութի
կառուցվածքային
բանաձևը:
16. Պարզել
![]() բաղադրությամբ
նյութի
կառուցվածքը,
որն օժտված է
ամֆոտեր
հատկությամբ,
ազոտային
թթվի հետ
փոխազդեցության
ժամանակ
անջատում է
ազոտ,
տաքացմամբ
փոխարկվում է
C6H10O2N2-ի,
իսկ
էթիլսպիրտի
հետ
գոյացնում է
բաղադրությամբ
նյութի
կառուցվածքը,
որն օժտված է
ամֆոտեր
հատկությամբ,
ազոտային
թթվի հետ
փոխազդեցության
ժամանակ
անջատում է
ազոտ,
տաքացմամբ
փոխարկվում է
C6H10O2N2-ի,
իսկ
էթիլսպիրտի
հետ
գոյացնում է ![]()
17. Ացետոքացախաթթվից ստանալ. իզոպրոպիլ, բութիլ, էթիլ, պրոպիլ ացետոքացախաթթվական եթերներ:
18. Ինչու՞ բարդ եթերի առաջացման ռեակցիան կատալիզվում է միայն թթվով, իսկ դարձելի գործընթացը` բարդ եթերի հիդրոլիզը և´ հիմքով, և´ թթվով: Քննարկել ալկիլ խմբերի ազդեցությունը հիդրոլիզի արագության վրա:
19. Անվանել հետևյալ թթուները.
20. Գրել կարբոնաթթուների և ածանցյալների կառուցվածքային բանաձևերը.
|
ա) |
օ-ամինոբենզոյական թթու, |
ե) |
սալիցիլաթթվի ֆենիլեթեր, |
|
բ) |
սալիցիլաթթու, |
զ) |
բենզոիլքլորիդ, |
|
գ) |
պ–մեթօքսիբենզոյական թթու, |
է) |
իզոֆտալաթթվի դիամիդ, |
|
դ) |
մ–նիտրոբենզոյական թթվի էթիլեթեր, |
ը) |
ֆենիլքացախաթթվի նիտրիլ: |
21. Գրել բենզոիլքլորիդի ռեակցիաները հետևյալ միացությունների հետ.

22. Լրացնել բերված փոխարկումները.
23. Լրացնել հետևյալ փոխարկումները, նշել ռեագենտները.
ա)
տոլուոլ ![]() ֆենիլքացախաթթու,
ֆենիլքացախաթթու,
բ)
պ–տոլուիդին ![]() պ–տոլիլաթթու,
պ–տոլիլաթթու,
գ)
պ–տոլուիդին ![]() պ
-ամինոբենզոյական
թթու,
պ
-ամինոբենզոյական
թթու,
դ)
բենզալդեհիդ ![]() դարչնաթթու,
դարչնաթթու,
ե)
տոլուոլ ![]() 3-նիտրո-5-բրոմբենզոյական
թթու,
3-նիտրո-5-բրոմբենզոյական
թթու,
զ)
տոլուոլ ![]() նիտրոբենզոյական
թթվի
իզոմերներ,
նիտրոբենզոյական
թթվի
իզոմերներ,
է )
պ–նիտրոտոլուոլ ![]() պ–նիտրոբենզոյական
թթու:
պ–նիտրոբենզոյական
թթու:
24. Գրել.
1. պ–տոլիլաթթվի ռեակցիաները հետևյալ ռեագենտների հետ`
2. բենզոիլքլորիդի ռեակցիաները բերված ռեագենտների հետ`
3. բենզամիդի ռեակցիաները հետևյալ ռեագենտների հետ`
![]()
25. Յուրաքանչյուր խմբում դասավորել միացություններն ըստ թթվայնության նվազման`
ա) բենզոյական թթու, մ–կրեզոլ, բենզիլսպիրտ,
բ) պ–մեթօքսիբենզոյական թթու, պ–տոլիլաթթու,
մ–նիտրոբենզոյական թթու:
26. Առաջարկել տոլուոլից 3-բրոմ-4-մեթիլբենզոյական թթվի ստացման առավել նպատակահարմար հաջորդական ռեակցիաները:
27. ![]() բաղադրությամբ
նյութը
լուծվում է
նատրիումի
հիդրոկարբոնատի
ջրային
լուծույթում
գազի
անջատմամբ,
կալիումի
պերմանգանատի
ջրային
լուծույթով օքսիդանում
է
դիկարբոնաթթվի,
որը
բաղադրությամբ
նյութը
լուծվում է
նատրիումի
հիդրոկարբոնատի
ջրային
լուծույթում
գազի
անջատմամբ,
կալիումի
պերմանգանատի
ջրային
լուծույթով օքսիդանում
է
դիկարբոնաթթվի,
որը
![]() դեհիդրատանում
է`
փոխարկվելով
ցիկլային անհիդրիդի:
Գրել
միացության
կառուցվածքային
բանաձևը և ռեակցիաները:
դեհիդրատանում
է`
փոխարկվելով
ցիկլային անհիդրիդի:
Գրել
միացության
կառուցվածքային
բանաձևը և ռեակցիաները:
28. Բերված թթուների և էթիլսպիրտի փոխազդեցության արդյունքում ի՞նչ եթերներ են ստացվում: Թթուները դասավորել ըստ ռեակցիոնունակության աճի.
ա) պ–նիտրոբենզոյական թթու,
բ) պ–մեթօքսիբենզոյական թթու,
գ) 2,6-դիֆտորբենզոյական թթու:
29. Ացետոքացախաթթվական եթերից ստանալ.
ա) 5-մեթիլ-2-հեքսանոն, դ) իզոկարագաթթու,
բ) 3-մեթիլ-2-պենտանոն, ե) սաթաթթու,
գ) վալերիանաթթու, զ) 5-օքսոհեքսանաթթու:
Արոմատիկ
սուլֆաթթուները
նավթի որոշ
ածանցյալների
վերականգնման
արգասիքներն
են, որոնց
հիման վրա ստացվում
են
մակերևութային
ակտիվ
նյութեր: Սուլֆաթթուների
ընդհանուր
բանաձևն է ![]() Լինում
են մոնո, դի,
տրիսուլֆաթթուներ.
Լինում
են մոնո, դի,
տրիսուլֆաթթուներ.
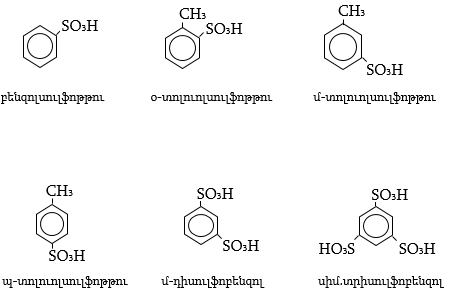
42.1. Ֆիզիկական հատկություններ
Սուլֆաթթուներին բնորոշ են ուժեղ բևեռային միացությունների հատկություններ, բյուրեղային նյութեր են, լավ լուծվում են ջրում, ուժեղ թթուներ են.
![]()
Սուլֆաթթուները լուծվում են բոլոր բևեռային լուծիչներում, սակայն անլուծելի են օրգանական լուծիչներում: Դժվարաեռ են, տաքացման դեպքում քայքայվում են եռման ջերմաստիճանից ցածր ջերմաստիճանում:
Սուլֆաբենզոլն
անգույն, բյուրեղային
նյութ է ![]()
42.2. Կիրառման բնագավառներ, թունավորություն
Արոմատիկ սուլֆոթթուները լայն կիրառություն ունեն տեխնիկայում: Նատրիումսուլֆոնատներից ստանում են ֆենոլներ: Նատրիումսուլֆոնատային խմբերը ներկանյութերը դարձնում են ջրում լուծելի: Ամիդային ածանցյալները կիրառություն ունեն բժշկության մեջ` պ-ամինոբենզոլսուլֆամիդ (ստրեպտոցիդ):
Բենզոլսուլֆաքլորիդը` ![]() օդում
ծխացող
հեղուկ է
օդում
ծխացող
հեղուկ է ![]() ջրում
չի լուծվում,
լուծվում է
օրգանական լուծիչներում:
Կիրառվում է
բենզոլսուլֆամիդի,
բենզոլսուլֆաթթվի
ալկիլեթերների
ստացման
համար: Գոլորշիներն
ուժեղ
գրգռում են
աչքի և
շնչուղիների լորձաթաղանքները
ջրում
չի լուծվում,
լուծվում է
օրգանական լուծիչներում:
Կիրառվում է
բենզոլսուլֆամիդի,
բենզոլսուլֆաթթվի
ալկիլեթերների
ստացման
համար: Գոլորշիներն
ուժեղ
գրգռում են
աչքի և
շնչուղիների լորձաթաղանքները
![]()
Տարբեր
սուլֆաթթուների
աղերի
խառնուրդները ![]() որոնք
ստացվում են
ալկանների
սուլֆուրացման
ժամանակ,
մակերևութային
ակտիվ
նյութեր են և
կիրառվում են
որպես լվացող
միջոցներ:
որոնք
ստացվում են
ալկանների
սուլֆուրացման
ժամանակ,
մակերևութային
ակտիվ
նյութեր են և
կիրառվում են
որպես լվացող
միջոցներ:
Պ-սուլֆատոլուոլն անգույն, բյուրեղային նյութ է, լավ լուծվում է ջրում և օրգանական լուծիչներում, կիրառվում է բազմաթիվ օրգանական սինթեզներում որպես թթվային կատալիզատոր:
Սուլֆաթթուներ ստանում են բենզոլի կամ դրա ածանցյալների անմիջական սուլֆուրացումով ծխացող ծծմբական թթվով՝ սենյակային պայմաններում.
![]()
Թթվի կոնցենտրացիայի փոքրացումը մինչև 65% կանխում է սուլֆուրացումը: Թթուն ամբողջությամբ օգտագործելու նպատակով ռեակցիան տարվում է բենզոլի ավելցուկում և տաքացմամբ: Անջատված ջուրը թորվում է ավելցուկ բենզոլի հետ, որը ջրից անջատվելուց հետո վերադարձվում է ռեակցիայի միջավայր: Սուլֆաթթուն առանձնացվում է բարիումի կամ կալցիումի անլուծելի աղի ձևով, որոնք հետագայում վերածվում են լուծելի նատրիումական աղի:
Սուլֆուրացումն ընթանում է էլեկտրոֆիլ տեղակալման մեխանիզմով (տես «SE ռեակցիաներ»): Ակտիվ էլեկտրոֆիլ ռեագենտ է հիդրոսուլֆոնիում իոնը.
![]()
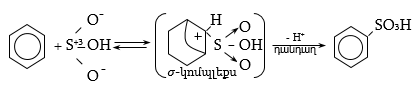
Ավելի ակտիվ էլեկտրոֆիլ է ծծմբի օքսիդը (VI).
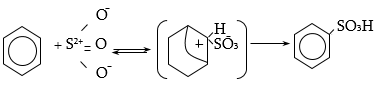
Ծխացող ծծմբական թթվով և ծծմբի օքսիդով սուլֆուրացման ժամանակ առաջանում է նաև քիչ քանակով սուլֆոն, որը ջրում անլուծելի է և հեշտությամբ հեռացվում է խառնուրդից.
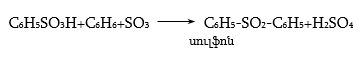
Իզոտոպային եղանակով պարզվել է, որ սուլֆուրացման ռեակցիայի արագությունը բնորոշող փուլը σ-կոմպլեքսից սուլֆաբենզոլի առաջացումն է (դեյտերացված բենզոլի սուլֆուրացման ռեակցիայի արագությունը երկու անգամ փոքր է, քան բենզոլինը):
Դի և
տրիսուլֆաթթուներ
ստացվում են
արոմատիկ
ածխաջրածինների
սուլֆուրացումով`
ծխացող ծծմբական
թթվով
տաքացմամբ,
կատալիզատորների
![]() ներկայությամբ:
Սուլֆախումբը
հաջորդին
ուղարկում է
մետա դիրք,
իսկ բենզոլի
հոմոլոգները
սուլֆուրանում
են օրթո և
պարա
դիրքերում:
ներկայությամբ:
Սուլֆախումբը
հաջորդին
ուղարկում է
մետա դիրք,
իսկ բենզոլի
հոմոլոգները
սուլֆուրանում
են օրթո և
պարա
դիրքերում:
Սուլֆաթթունների ռեակցիաները կարելի է բաժանել երեք խմբի.
1) սուլֆախմբի ռեակցիաներ,
2) սուլֆախմբի տեղակալման ռեակցիաներ այլ խմբերով,
3) բենզոլային օղակի ռեակցիաներ:
1. Սուլֆախմբի ռեակցիաներ
ա) թթվայնություն և աղերի առաջացում.
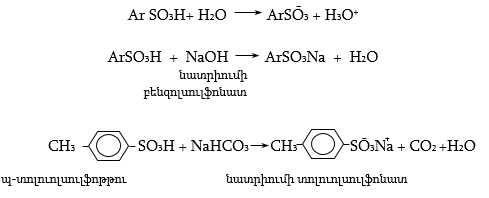
բ) քլորանհիդրիդների առաջացում թթվից.

Սովորաբար սուլֆաքլորիդներ ստանում են քլորսուլֆաթթվով.
![]()
գ) սուլֆաքլորիդներից կարելի է ստանալ եթերներ, ամիդներ և թթվի այլ ածանցյալներ.
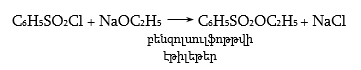
Սուլֆաթթվի եթերները հեղուկ կամ պինդ նյութեր են և լավ ալկիլող միջոցներ.
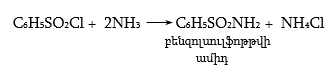
Սուլֆաթթվի ամիդները բյուրեղային նյութեր են:
դ) ցինկի փոշով ծծմբական թթվի լուծույթում սուլֆաթթուները վերականգնվում են` առաջացնելով թիոլներ.
![]()
2. Սուլֆախմբի տեղակալման ռեակցիաներ
ա) գերտաք գոլորշով թթվային միջավայրում սուլֆաթթուները փոխարկվում են ելային ածխաջրածնի.
![]()
բ) սուլֆաթթուների աղերի և ալկալիների միահալումով առաջանում են ֆենոլյատներ, որոնք կարևորագույն միացություններ են ներկանյութերի արտադրության համար.
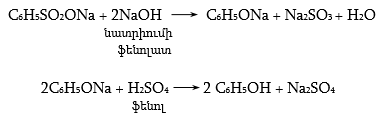
գ) ցիանիդների հետ միահալման ռեակցիայով ստացվում են նիտրիլներ, որոնք կիրառվում են արոմատիկ թթուների ստացման համար.
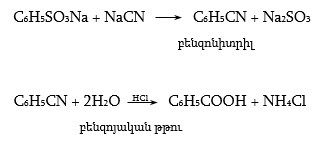
1. Բենզոլային օղակի ռեակցիաներ
Սուլֆախումբն էլեկտրոֆիլ տեղակալման ռեակցիաներում երկրորդ կարգի տեղակալիչ է, դժվարացնում է ռեակցիան (էլեկտրոնակցեպտոր է) և հաջորդ տեղակալիչը ուղղորդում է մետա դիրք (տես «SE ռեակցիաներ»).
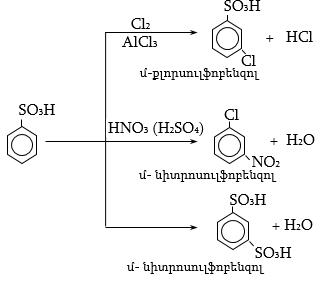
1. Գրել հետևյալ միացություների կառուցվածքային բանաձևերը.
ա) բենզոլսուլֆաթթու, դ) օ–իզոպրոպիլբենզոլսուլֆաթթու,
բ) տոլուոլսուլֆաթթվի իզոմերներ, ե) պ–սուլֆաբենզոյական թթու,
գ) պ–քլորբենզոլսուլֆաթթու, զ) սիմ. բենզոլտրիսուլֆաթթու:
2. Նկարագրել բենզոլի սուլֆուրացումը խիտ ծծմբական թթվով, քննարկել մեխանիզմը և ցույց տալ ռեակցիայի առանձնահատկությունը` մյուս SE ռեակցիաների հետ համեմատած:
3. Հետևյալ միացությունները դասավորել սուլֆուրացման գործընթացում ըստ ակտիվության աճի.
ա) մ – նիտրոտոլուոլ, դ) պ – քլորտոլուոլ,
բ) բենզոլ, ե) պ - բրոմբենզոյական թթու,
գ) կումոլ, զ) տոլուոլ:
4. Կազմել հետևյալ փոխարկումների սխեման.
ա)
տոլուոլ ![]() 4–նիտրո–2–տոլուոլսուլֆաթթու,
4–նիտրո–2–տոլուոլսուլֆաթթու,
բ)
բենզոլ ![]() 2
–քլոր–5–նիտրոբենզոյական
թթվի
քլորանհիդրիդ,
2
–քլոր–5–նիտրոբենզոյական
թթվի
քլորանհիդրիդ,
գ)
պ–օքսիսուլֆաթթու
![]() օ–քլորֆենոլ,
օ–քլորֆենոլ,
դ)
պ–տոլուոլսուլֆաթթու
![]() օ-բրոմտոլուոլ,
օ-բրոմտոլուոլ,
ե)
պ–տոլուոլսուլֆաթթու
![]() տոլուոլ,
տոլուոլ,
զ)
պ–տոլուոլսուլֆաթթու
![]() պ–կրեզոլ,
պ–կրեզոլ,
է )
պ–տոլուոլսուլֆաթթու
![]() պ–տոլիլաթթու:
պ–տոլիլաթթու:
5. Լրացնել բերված փոխարկումները.
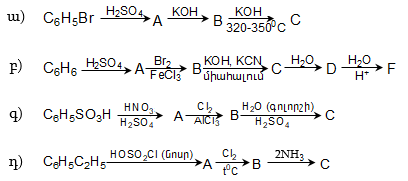
6. Ինչպե՞ս է ազդում սուլֆախումբը բենզոլային օղակի էլեկտրոնային խտության բաշխման վրա: Սուլֆաբենզոլից ստանալ.
ա) սուլֆաթթվի նատրիումական աղ, դ) ամիդ,
բ) բենզոնիտրիլ, ե) էթիլեթեր (երեք եղանակով),
գ) քլորանհիդրիդ (երկու եղանակով), զ) բենզոլ:
7. Ինչպիսի՞ ռեագենտների օգնությամբ կիրականացվեն հետևյալ փոխարկումները.
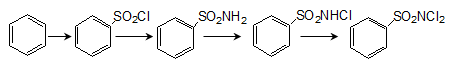
8.
![]() բաղադրությամբ
միացությունը
բաղադրությամբ
միացությունը
![]() հետ
առաջացնում է
հետ
առաջացնում է ![]() ջրային
գոլորշիներով
թորմամբ
ջրային
գոլորշիներով
թորմամբ ![]() փոխարկվում
է
փոխարկվում
է ![]() իսկ KOH-ի
հետ
փոխազդելով`
պ-կրեզոլի:
Գրել նյութի
կառուցվածքը:
իսկ KOH-ի
հետ
փոխազդելով`
պ-կրեզոլի:
Գրել նյութի
կառուցվածքը:
9. Ինչպե՞ս կարելի է բաժանել առաջնային, երկրորդային և երրրորդային ամինները բենզոլսուլֆաքլորիդի օգնությամբ: Գրել ռեակցիաները.
10. ![]() բաղադրությամբ
նյութի
դեսուլֆուրացումով
առաջանում է
օ-բրոմտոլուոլ,
օքսիդացումով`
բաղադրությամբ
նյութի
դեսուլֆուրացումով
առաջանում է
օ-բրոմտոլուոլ,
օքսիդացումով`
![]() թթու, որը
պինդ ալկալու
հետ տաքացնելիս
փոխարկվում է
մ-բրոմֆենոլի:
Պարզել միացության
կառուցվածքը:
թթու, որը
պինդ ալկալու
հետ տաքացնելիս
փոխարկվում է
մ-բրոմֆենոլի:
Պարզել միացության
կառուցվածքը:
11. ![]() միացության
օքսիդացմամբ
ստացվում է
սուլֆաբենզոյական
թթու,
կատալիզատորի
ներկայությամբ
հալոգենացումով` միայն մեկ
հալոգենածանցյալ:
Ինչպիսի՞
կառուցվածք
ունի
միացությունը:
միացության
օքսիդացմամբ
ստացվում է
սուլֆաբենզոյական
թթու,
կատալիզատորի
ներկայությամբ
հալոգենացումով` միայն մեկ
հալոգենածանցյալ:
Ինչպիսի՞
կառուցվածք
ունի
միացությունը:
Սահմանային
նիտրոմիացությունների
ընդհանուր
բանաձևն է ![]()
Դրանք էապես տարբերվում են իրենց իզոմերներից` ազոտային թթվի եթերներից (ալկիլնիտրիտներ` R–ONO):
Ալկիլնիտրիտները եռում են ավելի ցածր ջերմաստիճանում, քան նիտրոմիացությունները, հեշտությամբ օճառանում են ալկալիներով և հանքային թթուներով` համապատասխան սպիրտների և ազոտային թթվի կամ աղերի:
Նիտրոմիացությունները բևեռային են, ունեն մեծ դիպոլային մոմենտ:
Նիտրոմիացությունները վերականգնվում են ամինների, իսկ ալկիլնիտրիտները` սպիրտների և հիդրօքսիլամինի.
![]()
Բնորոշիչ խմբում թթվածնի ատոմներից մեկը ազոտի հետ առաջացնում է կրկնակի, մյուսը` սեմիպոլյար կապ: Այս բանաձևը բացահայտում է նիտրոմիացության բևեռայնության պատճառը: Իրականում երկու N–O կապերը չեն տարբերվում միմյանցից: Նիտրոմիացությունների բանաձևն առավել ճիշտ արտահայտվում է երկու սահմանային կառուցվածքներով.
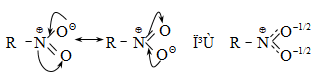
Տարբերվում են առաջնային, երկրորդային, երրորդային նիտրոմիացություններ.
![]()
Նիտրոմիացությունները կարդացվում են ըստ համապատասխան ալկանի` ավելացնելով նիտրո նախածանցը, թվով նշվում է բնորոշիչ խմբի դիրքը:

43.2. Ֆիզիկական հատկություններ
Նիտրոմիացությունները
հաճելի հոտով
հեղուկներ են,
թորվում են
առանց
քայքայվելու,
ջրում վատ են
լուծվում,
թունավոր են,
մետաղները կոռոզիայի
չեն
ենթարկում,
քանի որ
ջրային
լուծույթները
չեզոք են:
Նիտրոմիացությունների
խտությունը
մինչև ![]() մեծ
է մեկից,
մեծ
է մեկից, ![]() և
բարձր` փոքր է
մեկից:
Բևեռային
միացություններ
են, դիպոլային
մոմենտները 3,5…4,0
D, եռում են
ավելի բարձր
ջերմաստիճանում,
քան համապատասխան
սպիրտները և
կարբոնիլային
միացությունները:
ԻԿ սպեկտրում
ունեն
արտահայտված
կլանման
ալիքների երկարություն
և
բարձր` փոքր է
մեկից:
Բևեռային
միացություններ
են, դիպոլային
մոմենտները 3,5…4,0
D, եռում են
ավելի բարձր
ջերմաստիճանում,
քան համապատասխան
սպիրտները և
կարբոնիլային
միացությունները:
ԻԿ սպեկտրում
ունեն
արտահայտված
կլանման
ալիքների երկարություն
![]() տիրույթում:
տիրույթում:
Նիտրոմեթանն
անգույն, դառը
նշի հոտով
հեղուկ է ![]() վատ է
լուծվում
ջրում, լավ`
օրգանական
լուծիչներում:
վատ է
լուծվում
ջրում, լավ`
օրգանական
լուծիչներում:
43.3. Կիրառման բնագավառներ, թունավորություն
Նիտրոմիացությունները լայն կիրառություն ունեն օրգանական սինթեզում որպես միջանկյալ միացություններ: Տեխնիկայում կիրառվում են որպես լուծիչներ, ելանյութեր են ալդեհիդների, թթուների, պայթուցիկ նյութերի, ռետինի արտադրություններում: Լավ վուլկանացնող միջոցներ են պլաստիկ զանգվածների արդյունաբերությունում: Նիտրոմեթանը կիրառվում է քլորպիկրինի, նիտրոսպիրտների, պայթուցիկ նյութերի արտադրություններում: Հրթիռային շարժիչների վառելանյութ է և դիզելային վառելիքի հավելիչ:
Նիտրոալկանները
թունավոր են,
ազդում են նյարդային
համակարգի,
մաշկի վրա:
Նիտրոմեթանի
ՍԹԿ-ն ![]()
Նիտրոմիացությունների ստացման եղանակները տես «Ալկաններ» և «Հալոգենալկաններ» բաժիններում:
43.4.1. Նիտրոալկանների լաբորատոր ստացման եղանակ է ալկիլնիտրոմալոնաթթվական եթերի հիդրոլիզը.
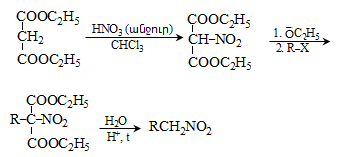
43.4.2. Քլորքացախաթթվի նատրիումական աղի և նատրիումի նիտրիտի փոխազեցությամբ ստացվում է նիտրոմեթան (լաբորատոր եղանակ).
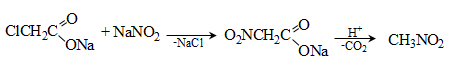
Նիտրոմիացությունների փոխարկումները բացատրվում են նիտրո խմբի յուրահատուկ կառուցվածքով:
43.5.1. Նիտրոմիացությունները վերականգնվում են առաջնային ամինների (տես «Ամիններ»).
![]()
43.5.2. Առաջնային և երկրորդային նիտրոմիացությունները լուծվում են ալկալիներում` առաջացնելով աղեր: Սա բացատրվում է նիտրո խմբի նկատմամբ α-ածխածնին կից ջրածինների շարժունակությամբ (առաջացած անիոնը կայունացված է զուգորդմամբ): Ալկալիական միջավայրում նիտրոմիացությունները վերախմբավորվում են ացինիտրո ձևի (թթվային): Նշանակում է, նիտրոմիացությունները նիտրո և ացինիտրո ձևերում ռեակցող տաուտոմեր նյութեր են: Նիտրոալկանների մեծ մասը կայուն են նիտրո ձևում: Եթե նիտրոմիացության ալկալիական լուծույթը մշակվի հանքային թթվով, առաջանում է ուժեղ թթվային ացի ձևը, որը հետագայում հեշտությամբ իզոմերվում է սովորական չեզոք ձևի.
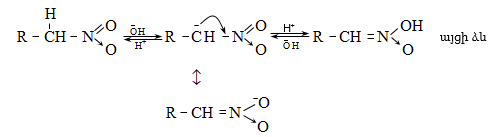
Նիտրոմիացությունները համարվում են «կեղծ թթուներ» (CH-թթուներ), որոնք չեզոք են, օժտված չեն էլեկտրահաղորդականությամբ, առաջացնում են ալկալիական մետաղների աղեր:
43.5.3. Նիտրոխմբի հետ անմիջապես կապված ածխածնի ատոմի ջրածինների (α-ջրածիններ) ակտիվությունն արտահայտվում է նաև մի շարք ռեակցիաներում:
Առաջնային և երկրորդային նիտրոմիացությունները ռեակցում են ազոտային թթվի հետ, իսկ երրորդայինները չեն փոխազդում (որակական ռեակցիա).
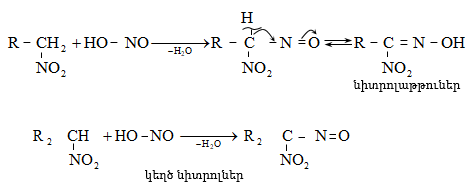
Նիտրոլաթթուների ալկալիական աղերը լուծույթում ունեն կարմիր գույն: Կեղծ նիտրոլները լուծույթներում և հալույթներում գունավորվում են կապույտ կամ կապտականաչավուն:
43.5.4. Առաջնային և երկրորդային նիտրոմիացություններն ալկալիների ներկայությամբ կոնդենսանում են ալդեհիդների հետ` առաջացնելով նիտրոսպիրտներ: Նիտրոալկանի անիոնը մեթիլենային բաղադրիչ է կոնդենսացման ռեակցիաներում.
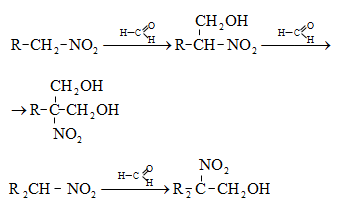
Ռեակցիայի մեխանիզմը նկարագրվում է այսպես.
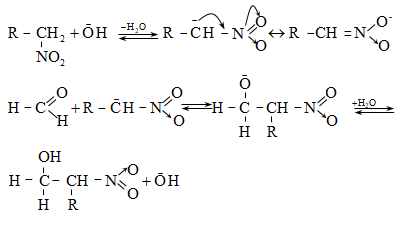
Նիտրոսպիրտը ռեակցիայի պայմաններում ենթարկվում է դեհիդրատացման` առաջացնելով նիտրոալկեն (Հենրիի ռեակցիա):
Նիտրոմեթանը ֆորմալդեհիդի հետ առաջացնում է տրիօքսիմեթիլնիտրոմեթան, որի վերականգնումով ստացվում է ամինոսպիրտ: Վերջինս կիրառվում է լվացող նյութերի և էմուլգատորների արտադրությունում.
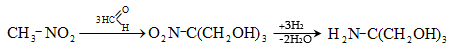
Նիտրոսպիրտների
ազոտաթթվական
եթերներն արժեքավոր
պայթուցիկ
նյութեր են,
օրինակ` ![]()
43.5.5. Առաջնային նիտրոալկանները փոխազդում են ալկիլհալոգենիդների հետ հիմնային միջավայրում: Գործընթացի ուղղությունը կախված է ալկիլհալոգենիդի բնույթից: Ոչ ակտիվ առաջնային և երկրորդային ալկիլքլորիդների դեպքում նուկլեոֆիլ անիոնը գրոհում է նիտրոխմբի թթվածնի ատոմին, հիմնականում առաջանում են նիտրոնաթթվի եթերներ: Ալկիլյոդիդիների հետ փոխազդեցության ռեակցիայի արդյունքում կատարվում է նաև C-ալկիլում:

Ակտիվ հալոգենիդների հետ փոխազդեցության ժամանակ (օրինակ, ալիլհալոգենիդի հետ) առաջին փուլում նույնպես առաջանում են նիտրոնաթթվի եթերներ, ապա հաջորդում է հիդրիդ իոնի ներմոլեկուլային փոխանցում` N-C կապի խզումով: Արդյունքում ստացվում են կարբոնիլային միացություն և օքսիմ: Այսպիսով, նիտրոալկանները կարող են կիրառվել որպես ելանյութ` ալիլհալոգենիդներից α, β-չհագեցած կարբոնիլային միացություններ ստանալու համար.
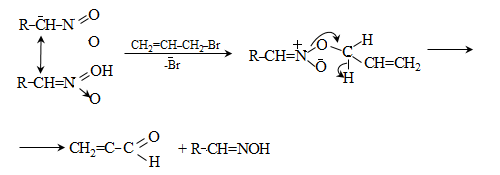
43.5.6. Նիտրոմիացությունները հեշտությամբ ենթարկվում են ամինոմեթիլացման (Մանիխ)` առաջացնելով վիցինալ նիտրոամիններ (տես «Արոմատիկ կետոններ»).
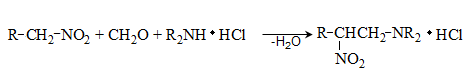
43.5.7. Նիտրոմիացությունների բրոմացումով հիմնային միջավայրում ռեագենտների հարաբերությամբ պայմանավորված, առաջանում են մոնո և դիբրոմածանցյալներ.
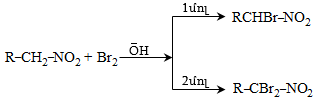
Նիտրոալկանի և բրոմի 1:0,5 հարաբերության դեպքում տեղի են ունենում հետևյալ փոխարկումները.
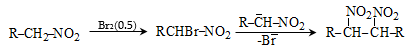
43.5.8. Նիտրոալկանի բարձր CH-թթվայնությունը հնարավորություն է ստեղծում քանակապես փոխարկվելու համապատասխան անիոնի, որը որպես նուկլեոֆիլ միանում է ակտիվացված կրկնակի կապին (Միքայելի ռեակցիա).
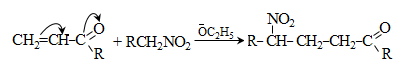
43.5.9. Առաջնային և երկրորդային նիտրոմիացությունների ացի ձևերի աղերի ջրային լուծույթները սառը պայմաններում հանքային թթուների ազդեցությամբ փոխարկվում են ալդեհիդների կամ կետոնների (միջանկյալ ացի ձևը հիդրոլիզվում է).

43.5.10. Առաջնային նիտրոմիացությունները 85%-ոց ծծմբական թթվով տաքացնելիս փոխարկվում են կարբոնաթթուների, անջատվում է հիդրօքսիլամին: Որոշ թթուների և հիդրօքսիլամինի արտադրական ստացման եղանակ է: Միջանկյալ առաջանում է հիդրօքսամաթթու.
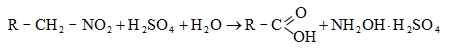
Ենթադրվում է ռեակցիայի հետևյալ մեխանիզմը.
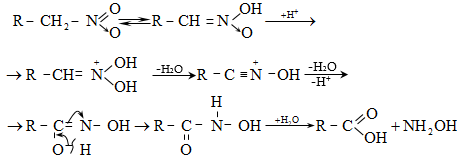
44. ԱՐՈՄԱՏԻԿ ՆԻՏՐՈՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
Շնորհիվ ստացման հեշտ եղանակների, այս միացություններն ունեն ավելի մեծ արդյունաբերական նշանակություն, քան ալիֆատիկ նմանակները:
Արոմատիկ նիտրոմիացություններ են կոչվում բենզոլային օղակում նիտրոխմբով միացությունները.
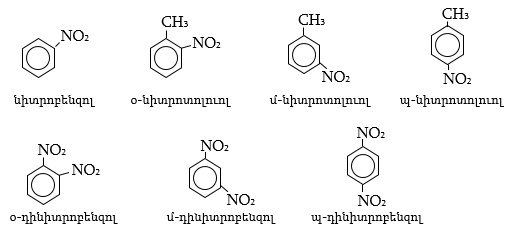
Կողմնային շղթայում նիտրոխմբով արոմատիկ ածխաջրածիններն իրենց հատկություններով նման են տեղակալված ալիֆատիկ նիտրոմիացություններին.
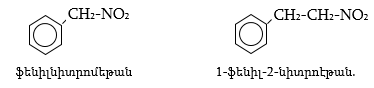
44.1. Ֆիզիկական հատկություններ
Նիտրոմիացություններն անգույն կամ բաց դեղնավուն, հեղուկ կամ պինդ, ջրում անլուծելի, ջրից ծանր, դառը նշի հոտով թունավոր նյութեր են: Նիտրոբենզոլն ավելի դժվար է հեռացվում օրգանիզմից, քան հոմոլոգները: ՈՒնեն բարձր եռման ջերմաստիճան՝ պայմանավորված նիտրոխմբի բևեռայնությամբ (ուժեղ փոխազդեցություն մոլեկուլների միջև): Շնորհիվ մեծ բևեռայնության լավ լուծիչներ են:
Նիտրոբենզոլը
յուղանման
հեղուկ է ![]() բոլոր
հարաբերություններով
խառնվում է էթանոլի,
բենզոլի,
դիէթիլեթերի
և այլ
օրգանական
լուծիչների
հետ: Լավ
լուծիչ է շատ
խեժերի և
անօրգանական
աղերի համար:
Թորվում է
ջրային
գոլորշիներով,
առաջացնում է
ազեոտրոպ
խառնուրդ:
բոլոր
հարաբերություններով
խառնվում է էթանոլի,
բենզոլի,
դիէթիլեթերի
և այլ
օրգանական
լուծիչների
հետ: Լավ
լուծիչ է շատ
խեժերի և
անօրգանական
աղերի համար:
Թորվում է
ջրային
գոլորշիներով,
առաջացնում է
ազեոտրոպ
խառնուրդ:
44.2. Կիրառման բնագավառներ, թունավորություն
Արոմատիկ նիտրոմիացությունները կիրառվում են ներկանյութերի, պայթուցիկ նյութերի արտադրության մեջ: Լավ լուծիչներ են, հոտավետ են:
Նիտրոբենզոլը ելանյութ է անիլինի, բենզիդինի, մ-դինիտրոբենզոլի, մ-նիտրոբենզոսուլֆոթթվի ստացման գործընթացներում: Լավ լուծիչ է նավթի քսայուղերի մաքրման համար: Մեղմ օքսիդիչ է, կիրառվում է ֆուքսինի և խինոլինի ստացման գործընթացում:
Նիտրոբենզոլը
թունավոր է,
ազդում է
կենտրոնական
նյարդային,
աղեստամոքսային
համակարգերի
վրա,
առաջացնում է
տևական
թունավորում ![]()
44.3.1. Նիտրոբենզոլ ստացվում է անիլինի օքսիդացումով (տես «Արոմատիկ ամիններ»):
44.3.2. Բենզոլային օղակում նիտրոխմբով արոմատիկ ածխաջրածիններն ստացվում են ածխաջրածինների նիտրացման ռեակցիայով` ազոտական և ծծմբական թթուների խառնուրդով (նիտրացնող խառնուրդ).
![]()
Ապացուցված է, որ նիտրացնող խառնուրդում ստեղծվում է հետևյալ հավասարակշռությունը.
![]()
Նիտրացումը կարելի է իրականացնել նաև միայն ազոտական թթվով.
![]()
Նիտրոնիում
իոնի ![]() առկայությունը
խառնուրդում
հաստատված է մի
քանի
եղանակով.
էլեկտրոլիզի
պայմաններում
այն
տեղաշարժվում
է դեպի
կատոդը,
կոմբինացիոն
ցրման
սպեկտրում
հայտնաբերվել
է բնորոշ
հաճախականություն,
անջատվել է
նիտրոնիում
իոնի և
քլորաթթվի
աղ`
առկայությունը
խառնուրդում
հաստատված է մի
քանի
եղանակով.
էլեկտրոլիզի
պայմաններում
այն
տեղաշարժվում
է դեպի
կատոդը,
կոմբինացիոն
ցրման
սպեկտրում
հայտնաբերվել
է բնորոշ
հաճախականություն,
անջատվել է
նիտրոնիում
իոնի և
քլորաթթվի
աղ` ![]() բաղադրությամբ:
բաղադրությամբ:
Ռեակցիայի մեխանիզմը հետևյալն է.
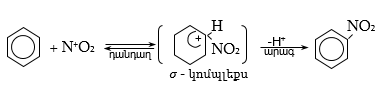
Նիտրոբենզոլի
հետագա
նիտրացումը
կատարվում է
ավելի խիստ
պայմաններում
![]() խումբը
էլեկտրոնակցեպտոր
է,
դժվարացնում
է SE ռեակցիան):
Երկրորդ
նիտրոխումբն
ուղարկվում է
մետա դիրք,
իսկ
տրինիտրոբենզոլ
առաջանում է`
բենզոլը
ծխացող
նիտրացնող
խառնուրդի ավելցուկում
հինգ oր
տաքացնելով (45%
ելք).
խումբը
էլեկտրոնակցեպտոր
է,
դժվարացնում
է SE ռեակցիան):
Երկրորդ
նիտրոխումբն
ուղարկվում է
մետա դիրք,
իսկ
տրինիտրոբենզոլ
առաջանում է`
բենզոլը
ծխացող
նիտրացնող
խառնուրդի ավելցուկում
հինգ oր
տաքացնելով (45%
ելք).

Օ- և
պ-դինիտրոբենզոլներ
կարելի է
ստանալ անիլինի
նիտրացումով ![]() խումբն
առաջին կարգի
տեղակալիչ է)
և ստացված նիտրոանիլինի
հետագա
օքսիդացումով.
խումբն
առաջին կարգի
տեղակալիչ է)
և ստացված նիտրոանիլինի
հետագա
օքսիդացումով.

Բենզոլային օղակում էլեկտրոնադոնոր տեղակալիչների առկայությամբ նիտրացումն իրականացվում է սենյակային ջերմաստիճանում.

Տրինիտրոտոլուոլը
(դեղին
բյուրեղներ, ![]() արժեքավոր
պայթուցիկ
նյութ է:
արժեքավոր
պայթուցիկ
նյութ է:
Երկտեղակալված բենզոլի հոմոլոգների նիտրացման ժամանակ առկա է տարածական գործոնը՝ նիտրոխումբը տեղ է գտնում փոքր տեղակալիչին կից ածխածնի մոտ.
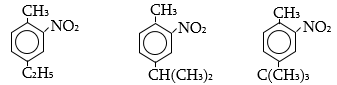
Նիտրացման ռեակցիայի արագությունը պայմանավորված է նիտրացվող միացության բնույթով և նիտրացնող խառնուրդի բաղադրությամբ. այսպես, նիտրոբենզոլի նիտրացումն արդյունավետ է 90%-ոց ծծմբական թթվով: 80%-ոց ծծմբական թթվով ռեակցիան դանդաղում է 3000 անգամ:
Նիտրոմիացությունների քիմիական հատկությունները պայմանավորված են նիտրոխմբի և բենզոլային օղակի փոխադարձ ազդեցությամբ: Նիտրոխումբը կարելի է պատկերել երկու սահմանային կառուցվածքներով.
44.4.1. Նիտրոխմբի կարևորագույն հատկությունը վերականգնումն է ամինոխմբի: Առաջին անգամ 1842թ. Ն.Ն. Զինինը վերականգնել է նիտրոբենզոլը ամոնիումի սուլֆիդով: Որպես վերականգնիչ հիմնականում կիրառվում են անագ և աղաթթու, երկաթ և աղաթթու.

44.4.2. Նիտրոմիացություններին բնորոշ են էլեկտրոֆիլ տեղակալման ռեակցիաներ: Նիտրոխումբը դժվարացնում է հաջորդ էլեկտրոֆիլ ռեագենտի մուտքը բենզոլային օղակ և ուղարկում մետա դիրք (տես «SE ռեակցիաներ»).
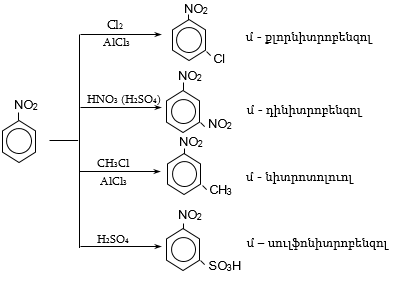
44.4.3. Նուկլեոֆիլ տեղակալման (SN) ժամանակ նոր տեղակալիչն ուղղորդվում է օրթո և պարա դիրքեր:
ա) շնորհիվ ուժեղ արտահայտված էլեկտրոնակցեպտոր հատկության, նիտրոխումբը մեծ ազդեցություն է գործում օրթո և պարա դիրքերում գտնվող ածխածնի ատոմի վրա, որի արդյունքում այս դիրքերում գտնվող հալոգենի ատոմը հեշտությամբ տեղակալվում է նուկլեոֆիլով: Նիտրոխմբի ազդեցությամբ օրթո և պարա դիրքերի ածխածինները լիցքավորվում են մասնակի դրական լիցքով և հեշտ փոխազդում նուկլեոֆիլ ռեագենտների հետ` առաջացնելով զուգորդված կայուն միջանկյալ σ-կոմպլեքս (տես «Արոմատիկ հալոգենածանցյալներ»).
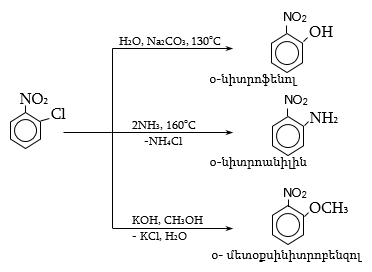
Հիդրօքսիլ, ալկօքսի կամ ամինոխմբերով տեղակալվում է նաև օ- կամ պ- նիտրոբենզոլի նիտրոխմբերից մեկը:
բ) փոշի KOH-ի հետ տաքացման դեպքում առաջանում են օ- և պ-նիտրոֆենոլյատներ.
44.4.4. Մեծ շարժունակություն է ձեռք բերում նիտրոխմբին կից կարբօքսիլ խումբը. տրինիտրոբենզոյական թթուն ջրում տաքացնելիս դեկարբօքսիլանում է.
44.4.5. Նիտրոխմբի ազդեցությամբ շարժունակ են դառնում նաև օրթո և պարա դիրքերում գտնվող մեթիլ խմբի ջրածինները:
ա) պ-նիտրոտոլուոլը KOH-ի սպիրտային լուծույթով տաքացնելիս օքսիդանում է օդի թթվածնով` առաջացնելով դինիտրոստիլբեն.
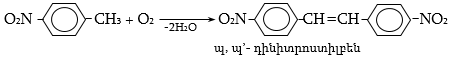
բ) դի և տրինիտրոտոլուոլները կոնդենսանում են բենզալդեհիդի հետ` առաջացնելով դի և տրինիտրոստիլբեն.
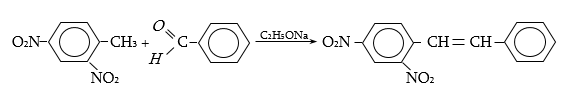
44.4.6. Նիտրոխումբը շարժունակ է դարձնում նաև բենզոլային օղակի ջրածնի ատոմը:
ա) տրինիտրոբենզոլն օքսիդանում է կալիումի ֆերոռոդանիդով հիմնային միջավայրում.
բ) հիդրօքսիլամինի հետ առաջանում է պիկրամիդ.
1. Անվանել հետևյալ միացությունները.
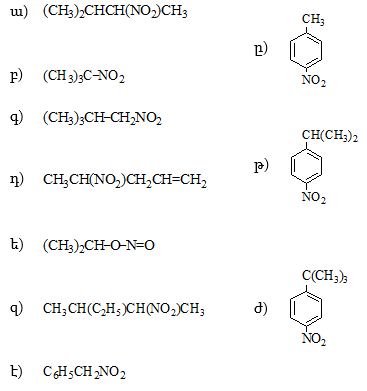
2. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.
2-նիտրոպենտան, 3-մեթիլ-2-նիտրոբութան, 4,4-դիմեթիլ-2-նիտրոհեքսան, 4-նիտրո-2-պենտեն, 3-մեթիլ-5-նիտրո-2-հեքսեն, օ-նիտրոտոլուոլ, 4-նիտրո-3-քլորտոլուոլ, պ-տոլիլհիդրօքսիլամին, մեթիլֆենիլնիտրոմեթան:
3. Գրել այն նիտրոմիացությունների կառուցվածքային բանաձևերը, որոնք իզոմեր են ազոտային թթվի բութիլեթերին: Անվանել IUPAC անվանակարգումով:
4. Ինչո՞վ է պայմանավորված ֆենիլնիտրոմեթանի մեթիլենային խմբի ջրածնի ակտիվությունը: Արտահայտել մոլեկուլի տաուտոմեր ձևերի և դրանց մեզոմեր իոնի կառուցվածքը: Ո՞ր միացություններն են կոչվում կեղծ թթուներ: Դրանք ինչո՞վ են տարբերվում իրական թթուներց:
5. Նիտրոէթանի և 2-նիտրոբութանի կառուցվածքներն արտահայտել Լյուիսի (օկտետային) բանաձևերով և ցույց տալ քիմիական կապերի տեսակները:
6. Գրել իզոբութանի նիտրացման ռեակցիան ազոտական թթվով` ըստ Կոնովալովի: Քննարկել մեխանիզմը:
7. Ի՞նչ միացություններ են ստացվում 1-բրոմբութանի և արծաթի նիտրիտի փոխազդեցությամբ եթերային միջավայրում: Գրել ռեակցիաները, քննարկել մեխանիզմը: Ո՞ր արգասիքն է մեծ ելքով ստացվում և ինչու՞:
8. Գրել պրոպիլբրոմիդի փոխազդեցության ռեակցիան նատրիումի նիտրիտի հետ դիմեթիլֆորմամիդի (ԴՄՖԱ) միջավայրում: Քննարկել ռեակցիայի մեխանիզմը
9.
Գրել ![]() բաղադրությամբ
նիտրոմիացությունների
կառուցվածքային
բանաձևերը և
անվանել:
Նկարագրել
բաղադրությամբ
նիտրոմիացությունների
կառուցվածքային
բանաձևերը և
անվանել:
Նկարագրել ![]() խմբի
կապերի
տեսակները:
խմբի
կապերի
տեսակները:
10.
Պարզել ![]() բաղադրությամբ
նյութի
կառուցվածքը,
եթե այն
վերականգնվում
է
բաղադրությամբ
նյութի
կառուցվածքը,
եթե այն
վերականգնվում
է ![]() իսկ NaOH-ի և
հանքային
թթվի հետ
հաջորդաբար
փոխազդելով`
վերածվում է
կարագալդեհիդի:
Գրել համապատասխան
ռեակցիաները:
իսկ NaOH-ի և
հանքային
թթվի հետ
հաջորդաբար
փոխազդելով`
վերածվում է
կարագալդեհիդի:
Գրել համապատասխան
ռեակցիաները:
11. Իրականացնել հետևյալ փոխարկումները.
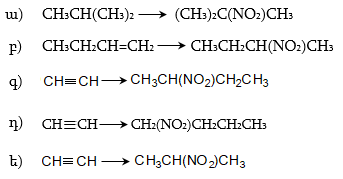
12. Գրել 1-նիտրոպրոպանի տաուտոմեր ձևերի սահմանային (ռեզոնանսային), ինչպես նաև մեզոմեր անիոնի կառուցվածքային բանաձևերը: Քննարկել մոլեկուլում էլեկտրոնային խտության բաշխումը նիտրոխմբի ազդեցության տակ:
13. Ո՞ր միացությունները կփոխազդեն ալկալու ջրային լուծույթի հետ և ինչու՞.
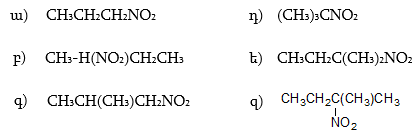
14.
Գրել ![]() բաղադրությամբ
միացության
կառուցվածքային
բանաձևը, եթե
այն չի
փոխազդում
ազոտային թթվի
և ալկալու
ջրային լուծույթի
հետ,
վերականգնվում
է
բաղադրությամբ
միացության
կառուցվածքային
բանաձևը, եթե
այն չի
փոխազդում
ազոտային թթվի
և ալկալու
ջրային լուծույթի
հետ,
վերականգնվում
է ![]() բաղադրությամբ
նյութի:
բաղադրությամբ
նյութի:
15. Լրացնել հետևյալ փոխարկումները.
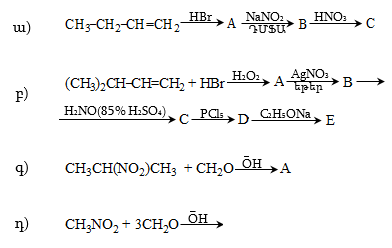
16. Ի՞նչ
կառուցվածք
ունի
![]() բաղադրությամբ
երրորդային
նիտրոմիացությունը,
եթե դրա
հիմքում
ընկած
ածխաջրածինն
ստացվում է առաջնային
ալկիլհալոգենիդից
Վյուրցի սինթեզով:
բաղադրությամբ
երրորդային
նիտրոմիացությունը,
եթե դրա
հիմքում
ընկած
ածխաջրածինն
ստացվում է առաջնային
ալկիլհալոգենիդից
Վյուրցի սինթեզով:
17. Լրացնել հետևյալ փոխարկումները.
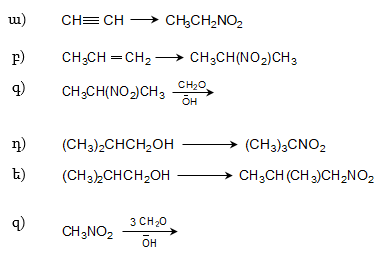
18. ![]() միացությունն
ացետալդեհիդի
հետ
առաջացնում է
միացությունն
ացետալդեհիդի
հետ
առաջացնում է ![]() որի
դեհիդրատացումով
ստացվում է
4-մեթիլ-3-նիտրո-2-պենտեն:
Գրել նյութի
կառուցվածքային
բանաձևը:
որի
դեհիդրատացումով
ստացվում է
4-մեթիլ-3-նիտրո-2-պենտեն:
Գրել նյութի
կառուցվածքային
բանաձևը:
19. Գրել հետևյալ ածխաջրածինների կառուցվածքային բանաձևերը.
|
ա) |
օ-տոլուիդին, |
զ) |
մ-նիտրոբենզոյական թթու, |
|
բ) |
օ-նիտրոտոլուլ, |
է) |
նիտրոֆենիլմեթան, |
|
գ) |
4-նիտրո-2-քլորտոլուոլ, |
ը) |
2,4-դինիտրոանիլին, |
|
դ) |
մ-տոլիլհիդրօքսիլամին, |
թ) |
2-նիտրոբեզալդեհիդ: |
|
ե) |
օ-նիտրոկումոլ, |
20. Գրել հետևյալ միացությունների նիտրացման ռեակցիան նիտրացնող խառնուրդով: Քննարկել բենզոլային օղակում էլեկտրոֆիլ տեղակալման ռեակցիան:
|
ա) |
տոլուոլ, |
դ) |
բենզոյական թթու, |
|
բ) |
էթիլբենզոլ, |
ե) |
բենզալդեհիդ, |
|
գ) |
նիտրոբենզոլ, |
զ) |
պ-բրոմնիտրոբենզոլ: |
21. Տոլուոլից ստանալ.
|
ա) |
4-ամինո-2-բրոմտոլուոլ, |
գ) |
2-նիտրո-4-բրոմբենզալդեհիդ, |
|
բ) |
2,4-դինիտրոտոլուոլ, |
դ) |
2,4-դինիտրոբենզիլքլորիդ: |
22. Քննարկել բենզոլային օղակում գտնվող նիտրոխմբի ազդեցությունը հետևյալ միացությունների հիմնայնության և թթվայնության վրա.
|
ա) |
4-նիտրոանիլին, 2,4-դինիտրոանիլին, |
|
2,4,6- տրինիտրոանիլին, |
|
|
բ) |
2-նիտրոֆենոլ, 2,4-դինիտրոֆենոլ, |
|
2,4,6- տրինիտրոֆենոլ: |
23. Պարզել
![]() բաղադրությամբ
սուր գրգռող
հոտով նյութի
կառուցվածքը,
որը սոդայի
ջրային
լուծույթով եռացնելիս
փոխարկվում է
բաղադրությամբ
սուր գրգռող
հոտով նյութի
կառուցվածքը,
որը սոդայի
ջրային
լուծույթով եռացնելիս
փոխարկվում է ![]() սպիրտի,
իսկ
օքսիդացնելիս`
պ-նիտրոբենզոյական
թթվի:
սպիրտի,
իսկ
օքսիդացնելիս`
պ-նիտրոբենզոյական
թթվի:
24. Գրել և անվանել նիտրոբենզոլի վերականգնման գործընթացում առաջացող միջանկյալ նյութերը:
25. Կարդալ հետևյալ միացությունները IUPAC անվանակարգումով.

Ամիններն
ամոնիակի
ածանցյալներ
են: Ամոնիակի
մոլեկուլում
ջրածնի մեկ,
երկու կամ
երեք ատոմները
տեղակալելով
ալկիլ կամ
արիլ
տեղակալիչներով`
համապատասխանաբար,
ստացվում են
առաջնային ![]() երկրորդային
երկրորդային
![]() և
երրորդային
և
երրորդային ![]() ամիններ:
ամիններ:
45.1. Իզոմերիա, անվանակարգում
Ամինների իզոմերիան պայմանավորված է ածխածնային շղթայում ամինոխմբի դիրքով և ածխածնային շղթայի ճյուղավորումով: Միևնույն մոլեկուլային բաղադրությամբ ամինները կարող են լինել և´ առաջնային, և´ երկրորդային, և´ երրորդային: Նման երևույթը կոչվում է մետամերիա: Մետամերներ են պրոպիլ, մեթիլէթիլ և տրիմեթիլամինները:
Ռացիոնալ անվանակարգումով ազոտի հետ կապված ալկիլ խմբերի անվանն ավելացվում է ամին բառը.
![]()
Ժնևյան
անվանակարգումով
հիմք է
ընդունվում
ամենաերկար
շղթայով
ածխաջրածինը
և անվանվում
տեղակալված
ամինոխմբերը
որպես
նախածանց, ինչպես
![]() ամինո,
ամինո, ![]() մեթիլամինո,
մեթիլամինո,
![]() դիմեթիլամինո
և այլն.
դիմեթիլամինո
և այլն.
Երկրորդային
և երրորդային
ամինները
կարդացվում
են որպես
ալկանամինների
N-տեղակալված ածանցյալներ.
![]() N-էթիլէթանամին:
N-էթիլէթանամին:
Ստացվող արգասիքների հարաբերությունը կախված է փոխազդող նյութերի հարաբերությունից:
45.4.5.
Ջրածնի
միջավայրում
սպիրտների
վերականգնողական
ամինացում`
հիդրող և
դեհիդրող
կատալիզատորների
ներկայությամբ
(Ni, Co, Cu, Fe, ![]() բարձր
ճնշում):
Սպիրտների
փոխարեն
կարելի է օգտագործել
ալդեհիդ և
կետոն:
Ռեակցիան
արտադրական և
լաբորատոր
լայն
կիրառություն
ունի օրգանական
սինթեզում.
բարձր
ճնշում):
Սպիրտների
փոխարեն
կարելի է օգտագործել
ալդեհիդ և
կետոն:
Ռեակցիան
արտադրական և
լաբորատոր
լայն
կիրառություն
ունի օրգանական
սինթեզում.
Առաջնային ամինի փոխազդեցության արդյունքում ստացվում է երկրորդային ամին.
Միջանկյալ առաջանում է իմին, որն այնուհետև վերականգնվում է ամինի.
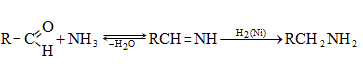
Այսպիսի փոխարկման են ենթարկվում և´ ալիֆատիկ, և´ արոմատիկ ալդեհիդները և կետոնները:
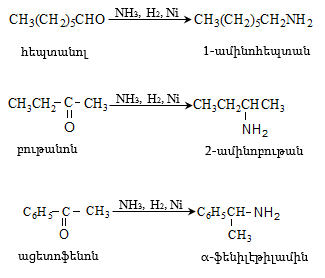
Կետոնների վերականգնողական ամինացման ժամանակ առաջանում են երկրորդային ալկիլ խմբերով ամիններ, որոնք դժվար են ստացվում ալկիլհալոգենիդների ամոնոլիզով, քանի որ երկրորդային ալկիլհալոգենիդները հակված են պոկման ռեակցիայի:
45.4.6.
Նիտրիլների
վերականգնում
ջրածնով`
կատալիզատորների
(Pt, Ni, Pd)
ներկայությամբ,
![]() Գրեթե
քանակական
ելքով
ստացվում է
առաջնային
ամին.
Գրեթե
քանակական
ելքով
ստացվում է
առաջնային
ամին.
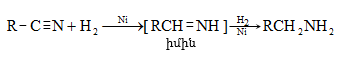
Իզոնիտրիլների վերականգնումով նույն կատալիզատորներով հիմնականում առաջանում են երկրորդային ամիններ.
![]()
Լաբորատոր
աշխատանքներում,
որպես ջրածնի
աղբյուր,
կիրառվում է
լիթիումալյումինհիդրիդ
կամ դիբորան ![]() Առաջարկվող
եղանակը
հարմար է
երկար ածխաջրածնային
շղթայով,
նորմալ կառուցվածքով
առաջնային և
երկրորդային
ամինների
ստացման
համար:
Առաջարկվող
եղանակը
հարմար է
երկար ածխաջրածնային
շղթայով,
նորմալ կառուցվածքով
առաջնային և
երկրորդային
ամինների
ստացման
համար:
Լիթիումալյումինհիդրիդով և դիբորանով վերականգնվում են նաև ամիդները` առաջացնելով առաջնային, երկրորդային, երրորդային ամիններ:
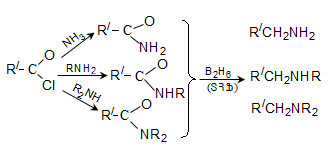
45.4.7. Առաջնային ամինների ստացում նիտրոմիացություններից: Որպես կատալիզատոր օգտագործվում են մետաղական Pt, Pd, Ni: Գործընթացն իրականացվում է գոլորշի կամ հեղուկ ֆազում.
![]()
45.4.8. Լաբորատոր աշխատանքներում կիրառվում է ամինների ստացումը Հոֆմանի հիպոհալոգենիտային ռեակցիայով` ամիդների և հալոգենների (բացառությամբ ֆտորի) հիմնային լուծույթների փոխազդեցություն: Փոխազդեցության արդյունքում ստացվում են առաջնային ամիններ.
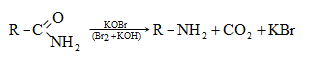
Հոֆմանի վերախմբավորման համար առաջարկվել է հետևյալ մեխանիզմը.
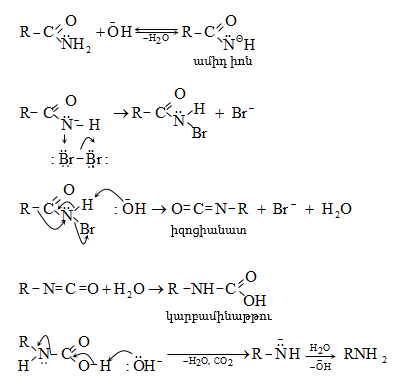
Համաձայն բերված սխեմայի` հիմնային միջավայրում ամիդ անիոնից ստացվում է անկայուն N-բրոմամիդ, որը փոխարկվում է իզոցիանատի: Վերջինիս հիդրոլիզի և հետագա դեկարբօքսիլացման արդյունքում գոյանում է ամին: Գործընթացը համաձայնեցված է. HBr-ի պոկումը և անիոնի թռիչքը կատարվում են միաժամանակ:
Գոյություն ունի ռեակցիայի ընթացքի բնութագրման մեկ այլ ուղղություն, ըստ որի իզոցիանատի առաջացումը բացատրվում է միջանկյալ նիտրենի գոյացմամբ.
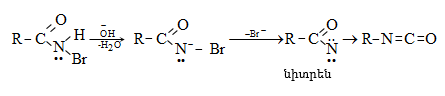
Հաստատված է, որ հեռացող խումբը պահպանում է փոխդասավորությունը, այսինքն` Հոֆմանի վերախմբավորման ժամանակ ազատ կարբանիոնի տեղաշարժ չի կատարվում.

45.4.9.
Նմանատիպ
գործընթաց է
ամինների
ստացումը թթուների
քլորանհիդրիդների
և նատրիումի
ազիդի ![]() փոխազդեցությամբ:
Որպես
միջանկյալ
միացություն,
այստեղ ևս դիտարկվում
է իզոցիանատի
առաջացում:
Ռեակցիան
հայտնի է Կուրցիուսի
վերախմբավորում
անվամբ և
ներկայացվում
է հետևյալ
ձևով.
փոխազդեցությամբ:
Որպես
միջանկյալ
միացություն,
այստեղ ևս դիտարկվում
է իզոցիանատի
առաջացում:
Ռեակցիան
հայտնի է Կուրցիուսի
վերախմբավորում
անվամբ և
ներկայացվում
է հետևյալ
ձևով.
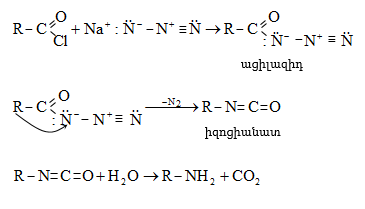
Ամինները քիմիական հատկություններով նման են ամոնիակին: Ազոտի մոտ գտնվող չբաշխված էլեկտրոնային զույգով պայմանավորված է դրանց նուկլեոֆիլությունը և հիմնայնությունը:
45.5.1. Ամինների հիմնայնությունը բացատրվում է պրոտոնի հետ փոխազդեցությամբ` ամոնիումային աղերի առաջացումով: Ամինները հանքային թթուների հետ առաջացնում են ալկիլամոնիումային աղեր.
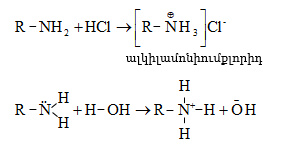
Այս
ռեակցիայի
հավասարակշռության
հաստատունը
բնորոշում է
ամինի հիմնայնությունը
և կոչվում է
ամինի հիմնայնության
հաստատուն ![]()
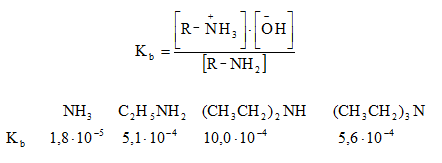
Էլեկտրոնադոնոր ալկիլ խմբերը մեծացնում են ամինների հիմնայնությունը: Երկրորդային ամիններն ավելի ուժեղ հիմքեր են, քան առաջնային ամինները, իսկ երրորդայիններն այս օրինաչափությանը չեն ենթարկվում: Սա բացատրվում է ազոտի ատոմի շուրջ ալկիլ խմբերի ստեղծած տարածական բարդությամբ. պրոտոնի մոտեցումն ազոտին դժվարացված է:
Գազային ֆազում ալկիլ խմբերի էլեկտրոնադոնոր ազդեցության օրինաչափությունը պահպանվում է.
![]()
Ամինները, որպես հիմքեր, աղեր են առաջացնում նույնիսկ այնպիսի թույլ թթուների հետ, ինչպիսիք են ածխաթթուն, ծծմբաջրածնական թթուն և կապտաթթուն: Ջրի հետ առաջացնում են ալկիլամոնիումի հիդրօքսիդ, որը դիսոցվում է իոնների (հիմնային ռեակցիա).
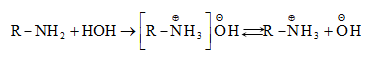
ՈՒժեղ հիմքերի (մետաղական Li կամ Na, ալկալիական մետաղների ամիդներ և այլն) ներկայությամբ ամինները ցուցաբերում են թթվային հատկություն.

45.5.2. Ամինները հեշտությամբ ալկիլվում են ալկիլհալոգենիդներով` առաջացնելով չորրորդային ամոնիումային աղեր (նուկլեոֆիլություն).
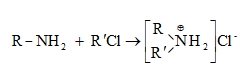
45.5.3. Առաջնային և երկրորդային ամինները հեշտությամբ ացիլվում են թթուներով, հալոգենանհիդրիդներով, թթուների անհիդրիդներով, բարդ եթերներով.
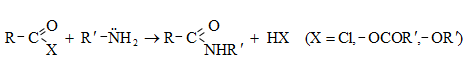
Առաջացած HX-ը կապում է համարժեք քանակությամբ ելային ամին: Նման խնդիր կա նաև ամինների ալկիլման ժամանակ: Այս գործընթացը կասեցնելու համար ալկիլումն ու ացիլումն իրականացվում են հիմնային միջավայրում: Ացիլման ռեակցիան բնորոշ նուկլեոֆիլ տեղակալում է (SN1 կամ SN2):
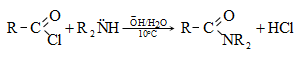
Երրորդային ամիններն ալկիլհալոգենիդների և քլորանհիդրիդների հետ առաջացնում են չորրորդային ամոնիումային աղեր, որոնք ավելի լավ ացիլող միջոցներ են, քան քլորանհիդրիդները, քանի որ ամոնիումային խումբն ավելի հեշտ հեռացող խումբ է, քան քլորը.
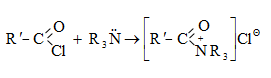
45.5.4. Կիրառական նշանակություն ունի ամինների փոխազդեցությունն էթիլենօքսիդի հետ, որի արդյունքում ստացվում են ամինո-սպիրտներ.
45.5.5. Ամինների բնորոշման կարևոր ռեակցիա է փոխազդեցությունն ազոտային թթվի հետ: Առաջնային ամինները փոխազդում են ազոտային թթվի սառը ջրային լուծույթի հետ` առաջացնելով ալկիլդիազոնիումի աղեր (դիազոտացման ռեակցիա), որոնք քայքայվում են տարբեր միացությունների.
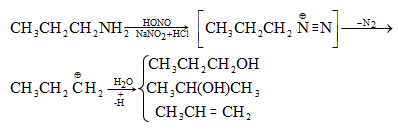
Երկրորդային ամիններն ազոտային թթվի հետ առաջացնում են N-նիտրոզոամիններ.
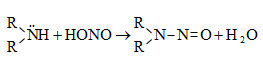
Ռեակցիայի
միջավայրում
առաջանում են
մի շարք
ռեագենտներ ![]() NO, NOCl, HONO),
որոնց
ազդեցությունը
կախված է
ռեակցիայի պայմաններից,
ինչպես նաև
դիազոտացվող
միացության
կառուցվածքից:
Դիտարկենք
NO, NOCl, HONO),
որոնց
ազդեցությունը
կախված է
ռեակցիայի պայմաններից,
ինչպես նաև
դիազոտացվող
միացության
կառուցվածքից:
Դիտարկենք ![]() ազդեցությունը.
ազդեցությունը.
![]()
![]() ամինների
նիտրոզացումը
կատարվում է
հետևյալ
սխեմայով.
ամինների
նիտրոզացումը
կատարվում է
հետևյալ
սխեմայով.
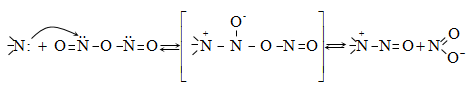
Առաջնային ամինների դեպքում գոյացած կատիոնը կորցնում է պրոտոն, վերածվում նիտրոզոամինի, որը թթվային միջավայրում փոխարկվում է անկայուն դիազոնիումի աղի, իսկ վերջինս քայքայվում է կարբկատիոնի և ազոտի.
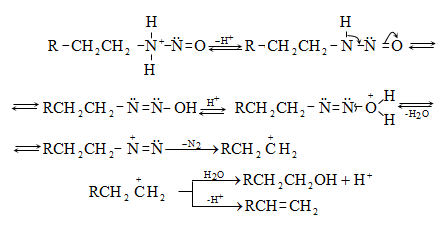
Երկրորդային ամինների դեպքում կատիոնը կորցնում է պրոտոն և վերածվում նիտրոզոամինի.
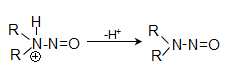
Նիտրոզոամինները դեղին կամ նարնջագույն թունավոր նյութեր են, քաղցկեղի հարուցիչներ:
Երրորդային ամինները սառը պայմաններում ազոտային թթվի հետ չեն փոխազդում: Թույլ թթվային միջավայրում տաքացման պայմաններում երրորդային ամիններն առաջացնում են նիտրոզոամոնիումային կատիոն, որը պոկում է նիտրօքսիլ (HNO)` փոխարկվելով ամոնիումային իոնի, որն իր հերթին հիդրոլիզվում է համապատասխան ալդեհիդի և ամինի:
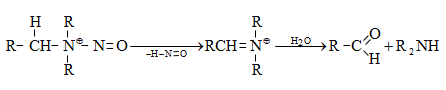
45.5.6. Առաջնային ամինների համար բնութագրական է նաև ալկալու սպիրտային լուծույթում քլորոֆորմի հետ փոխազդեցության ռեակցիան: Առաջանում են չափազանց տհաճ հոտով կարբիլամիններ (իզոնիտրիլներ).
![]()
Ամինի հետ որպես էլեկտրոֆիլ ռեագենտ փոխազդում է դիքլորկարբենը.
![]()
Նմանօրինակ եզակի փոխազդեցություն է կատարվում առաջնային ամինների և ծծմբածխածնի հետ. արդյունքում գոյանում են ալկիլթիոկարբամատի ամոնիումային աղեր:
45.5.7. Պայմանավորված օքսիդիչի բնույթով, ամիններն օքսիդանում են` առաջացնելով տարբեր արգասիքներ: Թույլ օքսիդիչների (ջրածնի պերօքսիդ) ազդեցությամբ երրորդային ամինները փոխարկվում են օքսիդների.
![]()
Եթե առաջնային ամինի ամինոխումբը գտնվում է երրորդային ածխածնի ատոմի մոտ, օքսիդացման ընթացքում հաջորդաբար առաջանում են` ալկիլհիդրօքսիլամին, նիտրոզոմիացություն, նիտրոմիացություն.
![]()
Եթե
ամինի
մոլեկուլում
առկա է β-ջրածնի
ատոմ, գոյացած
օքսիդը ![]() քայքայվում
է ալկենի և
ալկիլհիդրօքսիլամինի
(Կոուպ).
քայքայվում
է ալկենի և
ալկիլհիդրօքսիլամինի
(Կոուպ).
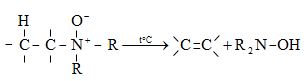
Մոլեկուլում
երկու
ամինոխումբ
ունեցող միացությունները
կոչվում են
դիամիններ:
Դիամինների
ներկայացուցիչ
է հիդրազինը ![]() որն իր
քիմիական
հատկություններով
նման է առաջնային
ամիններին:
որն իր
քիմիական
հատկություններով
նման է առաջնային
ամիններին:
Լայն կիրառություն ունեն ստորև բերված ամինները.

Դիամիններ ստացվում են առաջնային ամինների ստացման եղանակներով. Դինիտրոմիացությունների, դինիտրիլների վերականգնումով, ամոնիակի փոխազդեցությամբ դիհալոգենիդների հետ և այլն: Ցածրամոլեկուլային դիամինները լավ լուծվում են ջրում, ավելի ուժեղ հիմքեր են, քան մոնոալկիլամինները: Դիամիններն առաջացնում են աղեր երկու համարժեք թթվի հետ, ալկիլանում և ացիլանում են ինչպես մեկ, այնպես էլ երկու ամինոխմբով:
Կարևոր արտադրական նշանակություն ունի հեքսամեթիլենդիամինը, որն ստացվում է ադիպինաթթվից: Վերջինիս ամոնիումային աղը ենթարկվում է դեհիդրատացման, առաջացած դինիտրիլը կատալիզատորի ներկայությամբ վերականգնվում է հեքսամեթիլենդիամինի.
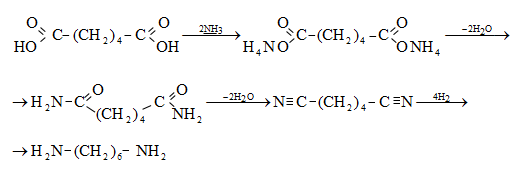
Արտադրությունում հեքսամեթիլենդիամին ստանում են դիվինիլից.
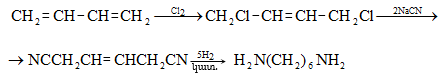
Ադիպինաթթվի և հեքսամեթիլենդիամինի պոլիկոնդենսացումով ստացվում են բարձր հալման ջերմաստիճան ունեցող պոլիամիդներ, որոնք կիրառվում են արհեստական թելերի արտադրությունում (նայլոն): Ստացվող արհեստական թելերն իրենց հատկություններով նման են բնական մետաքսին:
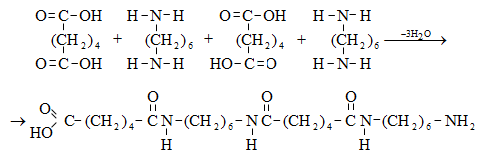
Պոլիամիդներում ![]() պոլիմեթիլենային
խմբերը մեկը
մյուսին միացված
են մետաքսին և
սպիտակուցային
նյութերին
բնորոշ
ամիդային
խմբավորումներով.
պոլիմեթիլենային
խմբերը մեկը
մյուսին միացված
են մետաքսին և
սպիտակուցային
նյութերին
բնորոշ
ամիդային
խմբավորումներով.
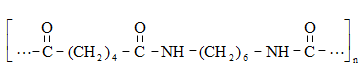
Արոմատիկ,
ինչպես և
ալիֆատիկ
ամիններն
ամոնիակի
ածանցյալներ
են. լինում են
առաջնային՝ ![]() երկրորդային՝
Ar-NH-Ar,
երրորդային՝
երկրորդային՝
Ar-NH-Ar,
երրորդային՝ ![]() Երկրորդային
և երրորդային
ամիններում
խմբերը կարող
են լինել
ինչպես
արոմատիկ,
այնպես էլ
ալիֆատիկ
շարքի
ռադիկալներ:
Երկրորդային
և երրորդային
ամիններում
խմբերը կարող
են լինել
ինչպես
արոմատիկ,
այնպես էլ
ալիֆատիկ
շարքի
ռադիկալներ:

47.1. Ֆիզիկական հատկություններ
Արոմատիկ ամինները բնորոշ տհաճ հոտով, հեղուկ կամ պինդ, խիստ թունավոր միացություններ են, ջրում վատ են լուծվում, լուծելի են քիչ բևեռային լուծիչներում (սպիրտ, բենզոլ), հիմնականում անգույն են, սակայն օքսիդանալու հետևանքով, սովորաբար, գունավորված են: Հեշտությամբ ներծծվում են մաշկի մեջ, որը կարող է խիստ վնասակար լինել մարդու առողջության համար:
Անիլինը
![]() անգույն
բնորոշ հոտով,
վատ է
լուծվում
ջրում, լուծվում
է օրգանական
լուծիչներում:
անգույն
բնորոշ հոտով,
վատ է
լուծվում
ջրում, լուծվում
է օրգանական
լուծիչներում:
47.2. Կիրառման բնագավառներ, թունավորություն
Արոմատիկ ամինների պարզագույն ներկայացուցիչ է անիլինը:
Անիլինը կիրառվում է ներկանյութերի (սև անիլին, ինդիգո և այլն), դեղագործական և օրգանական սինթեզի արտադրություններում: Կիրառվում է գործնական անալիտիկական քիմիայում նավթի մեջ արոմատիկ ածխաջրածինների որոշման համար (ըստ անիլինային կետի): Անիլինի մեթիլացման արգասիքները` մոնո և դիմեթիլանիլինները գործնական կիրառություն են գտել ներկանյութերի և պայթուցիկ նյութերի արտադրություններում: Անիլինի ածանցյալները կիրառվում են նաև որպես ֆոտոերևակիչներ (պ-ամինոֆենոլ և այլն), կաուչուկի վուլկանացման արագացուցիչներ:
Ացետանիլիդն արդյունաբերությունում կիրառվում է պ-նիտրո-անիլինի ստացման համար, որը կարևոր կիսահումք է ներկանյութերի ստացման գործընթացում:
Անիլինը թունավոր է, ունի քաղցկեղածին հատկություն, ազդում է կենտրոնական նյարդային համակարգի և արյան վրա` օքսիհեմոգլոբինը փոխարկում է մեթհեմոգլոբինի: ՍԹԿ-ն` կենցաղային օգտագործման ջրերում 0,1 մգ/լ է: Անիլինը ներթափանցում է մաշկի մեջ անգամ նոսր ջրային լուծույթներից:
Անիլինին բնորոշ ֆիզիոլոգիական ակտիվությամբ են օժտված տոլուիդինները, որոնցից առավել թունավոր է պ-տոլուիդինը` ՍԹԿ-ն օդում 0,005 մգ/լ:
47.3.1. Արոմատիկ առաջնային ամինների ստացում
ա) արոմատիկ ամինների ստացման հիմնական արդյունաբերական եղանակ է նիտրոմիացությունների վերականգնումը: Առաջին անգամ 1842թ. Ն.Ն. Զինինը վերականգնել է նիտրոբենզոլն ամոնիումի սուլֆիդով: Այս ռեակցիայի իրականացման համար որպես վերականգնիչ կիրառվում են նաև անագ և աղաթթու, երկաթ և աղաթթու, լիթիումալյումինհիդրիդ և այլն.
![]()
բ) արոմատիկ հալոգենածանցյալների և ամոնիակի (կամ նատրիումի ամիդի) փոխազդեցություն ավտոկլավում կատալիզատորի ներկայությամբ բարձր ջերմաստիճանի և ճնշման պայմաններում (տես «Արոմատիկ հալոգենածանցյալներ»).
գ) Հոֆմանի հիպոհալոգենիտային ռեակցիա. կարբոնաթթուների ամիդների փոխազդեցություն քլորի, բրոմի, յոդի հիմնային լուծույթների հետ (Հոֆմանի վերախմբավորում, տես «Ամիններ»).
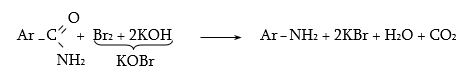
47.3.2. Արոմատիկ երկրորդային ամինների ստացում
ա) ալկիլ-արիլ երկրորդային ամիններ ստացվում են առաջնային ամինների ալկիլման ռեակցիայով: Որպես ալկիլող միացություններ կիրառվում են հալոգենածանցյալներ կամ սպիրտներ.
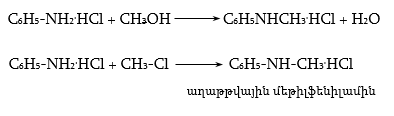
Առաջացած երկրորդային ամինը փոխարկվում է երրորդային ամինի.
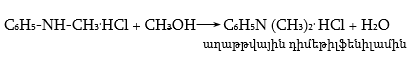
բ) մաքուր երկրորդային ամիններ ստացվում են N-ացիլամինների հիդրոլիզով.
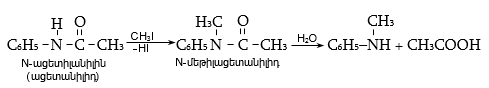
գ) Շիֆի հիմքերի (ազոմեթին) հիդրոգենացումով.
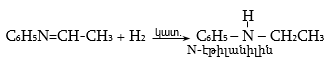
դ) առաջնային ամինների և դրանց աղերի ջերմային տաքացումով.
![]()
47.3.3. Արոմատիկ երրորդային ամինների ստացում
ա) մաքուր արոմատիկ, ինչպես նաև ալկիլ-արիլ երրորդային ամիններ ստացվում են առաջնային, երկրորդային ամինների ալկիլման կամ արիլման ռեակցիայով:
![]()
բ) առավել դժվարամատչելի արոմատիկ երրորդային ամիններն ստացվում են երկրորդային ամինների և արիլյոդիդի տաքացումով պղնձի փոշու (Ուլմանի կատալիզատոր) ներկայությամբ.
![]()
Ամիններն (I,II,III) ամոնիակի նման, ազոտի ատոմի վրա ունեն չբաշխված էլեկտրոնային զույգ, որը պայմանավորում է դրանց հիմնայնությունը, նուկլեոֆիլությունը, արոմատիկ օղակի չափազանց բարձր ռեակցիոնունակությունը: Արոմատիկ ամիններն օժտված են ավելի թույլ արտահայտված հիմնայնությամբ, քան ալիֆատիկ ամինները, որը բացատրվում է ազոտի չբաշխված էլեկտրոնային զույգի և արոմատիկ օղակի էլեկտրոնների զուգորդմամբ: Այսպիսի զուգորդումը դժվարացնում է պրոտոնի միացումն ազոտի էլեկտրոնային զույգին:
Բենզոլային օղակում էլեկտրոնակցեպտոր խմբերի առկայությունը փոքրացնում, իսկ էլեկտրոնադոնոր խմբերի ներկայությունը մեծացնում է ամինի հիմնայնությունը.
![]()
Ազոտին կից ալկիլ խմբերը մեծացնում են ամինի հիմնայնությունը, իսկ արիլ խմբերը` փոքրացնում: Այսպես, տրիֆենիլամինը գործնականում զուրկ է հիմնայնությունից:
Արոմատիկ ամինները քիմիական փոխարկման են ենթարկվում ինչպես ամինոխմբի, այնպես էլ արոմատիկ օղակի մասնակցությամբ:
47.4.1. Ալկիլում` առաջնային և երկրորդային ամիններն ընդունակ են ամինոխմբի ջրածինը տեղակալել ալկիլ կամ արիլ խմբերով (SN ռեակցիա).
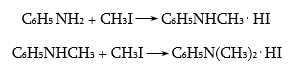
47.4.2. Ացիլում` ացիլող միջոցներով (թթուներ, թթուների անհիդրիդներ, թթուների հալոգենածանցյալներ) առաջնային և երկրորդային ամինների ամինոխմբի ջրածինը տեղակալվում է ացիլ խմբով: Անիլինը քացախաթթվի անհիդրիդի կամ քացախաթթվի հետ տաքացնելիս փոխարկվում է ացետանիլիդի.
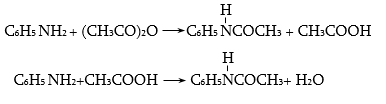
Արոմատիկ ամինների ացիլածանցյալները զուրկ են հիմնայնությունից, բարձր հալման կետով բյուրեղային նյութեր են, կայուն են օքսիդացման նկատմամբ:
47.4.3. Առաջնային ամիններն արոմատիկ ալդեհիդների հետ թույլ տաքացնելիս վերածվում են Շիֆի հիմքերի (ազոմեթիններ).
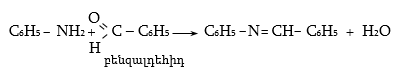
Շիֆի հիմքերը նոսր թթվային միջավայրում քայքայվում են ելանյութերի.
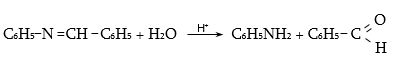
47.4.4. Առաջնային ամինները քլորոֆորմի և ալկալու սպիրտային լուծույթի հետ տաքացնելիս փոխարկվում են տհաճ հոտով կարբիլամինների (իզոցիանիդներ): Առաջնային ամինների հայտնաբերման ռեակցիա է.
![]()
47.4.5. Ամինների փոխազդեցություն ազոտային թթվի հետ
I, II, III ամինների որակական ռեակցիաներ.
ա) առաջնային արոմատիկ ամիններն ազոտային թթվի հետ առաջացնում են դիազոնիումային աղեր, որոնք չափազանց ռեակցիոնունակ միացություններ են, կիրառվում են բազմաթիվ օրգանական նյութերի ստացման համար (տես «Արոմատիկ դիազոմիացություններ»).
![]()
բ) երկրորդային արոմատիկ ամիններն ազոտային թթվի հետ առաջացնում են N-նիտրոզոամիններ, որոնք դեղին գույնի, չեզոք, նոսր հանքային թթուներում անլուծելի միացություններ են.

N-նիտրոզոամինները հանքային թթուների ազդեցությամբ վերախմբավորվում են նիտրոզոխմբի տեղաշարժով բենզոլային օղակի պարա դիրք.
գ) երրորդային արոմատիկ ամիններն ազոտային թթվի հետ ցածր ջերմաստիճաններում առաջացնում են պ-նիտրոզոմիացություններ.
Արոմատիկ
օղակում
նիտրոզացումն
էլեկտրոֆիլ
տեղակալում է`
հարձակվող
ռեագենտը`
նիտրոզոնիում
![]() իոնն է (կամ
այլ
մասնիկներ`
իոնն է (կամ
այլ
մասնիկներ`
![]() կամ NOCl,
որոնք
կամ NOCl,
որոնք ![]() խումբը
կարող են
փոխանցել
բենզոլի
օղակ).
խումբը
կարող են
փոխանցել
բենզոլի
օղակ).
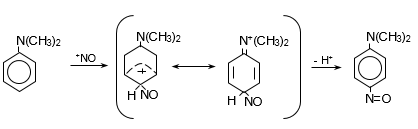
47.4.6. Ի տարբերություն ալիֆատիկ ամինների, արոմատիկ ամինները հեշտությամբ օքսիդանում են: Թթվային միջավայրում անիլինից առաջանում է խինոն, քրոմաթթվով՝ ներկանյութ «սև անիլին»:
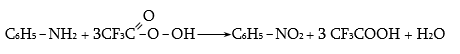
Օդի թթվածնով միավալենտ պղնձի քլորիդի ներկայությամբ ստացվում է ազոբենզոլ.
![]()
47.4.7. Արոմատիկ ամինները հեշտությամբ են փոխազդում էլեկտրոֆիլ ռեագենտների հետ: Հիմնականում ստացվում են պ-իզոմերներ: Ամինոխումբն առաջին կարգի տեղակալիչ է, հաջորդ էլեկտրոֆիլ ռեագենտին կողմնորոշում է օրթո կամ պարա դիրքեր (տես «SE ռեակցիաներ»):
ա) հալոգենացումը տեղի է ունենում շատ արագ, այնպես, որ անիլինի բրոմացման ժամանակ ստացվում է 2,4,6-տրիբրոմանիլին: Ռեակցիան ուղեկցվում է օքսիդացումով.
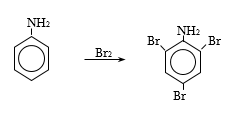
Ամինոխմբի ակտիվությունը թուլացնելու նպատակով, ինչպես նաև օքսիդացումից խուսափելու համար այն նախօրոք ացիլվում է (պաշտպանվում է).
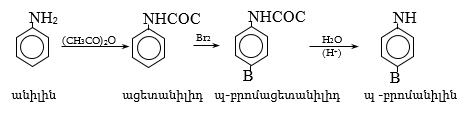
բ) նիտրացումը նույնպես իրականացվում է ամինոխումբը պաշտպանելուց հետո, քանի որ ազոտական թթուն օքսիդիչ է: Ամինների ռեակցիոնունակ օղակը չափազանց զգայուն է օքսիդացման նկատմամբ, և սովորական նիտրացման ժամանակ նյութի մեծ քանակ ծախսվում է օքսիդացման խեժանման արգասիքների առաջացման վրա: Ացիլված ամինների նիտրացումը հարթ է ընթանում (պ-իզոմեր` 90%, օ-իզոմեր` 10%).
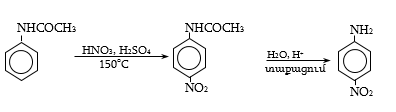
գ) արոմատիկ
ամինների
սուլֆուրացումն
իրականացվում է խիտ
ծծմբական
թթվով, ![]() միահալումով:
Հիմնականում
ստացվում է
պ-իզոմեր.
միահալումով:
Հիմնականում
ստացվում է
պ-իզոմեր.
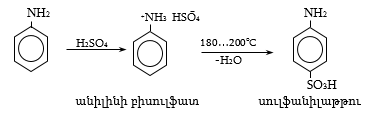
Սուլֆոնիլաթթուն առկա է ներքին աղի տեսքով (դիպոլյար կամ ցվիտտեր իոն), անլուծելի է ջրում և օրգանական լուծիչներում: Ամինները լուծվում են նոսր անօրգանական թթուներում` փոխարկվելով ջրում լուծելի աղերի:
Սուլֆոնիլաթթուն նույն պայմաններում անլուծելի է, իսկ հիմքերի ջրային լուծույթներում՝ լուծելի.
47.4.8. Երրորդային արոմատիկ ամինները հեշտությամբ փոխազդում են թույլ էլեկտրոֆիլ ռեագենտների հետ, ինչպիսիք ալդեհիդներն են` առաջացնելով դի և տրիֆենիլմեթանի ածանցյալներ.

47.4.9. Անիլինի հիդրումով նիկելի ներկայությամբ ստացվում է ցիկլոհեքսիլամին: Այս ռեակցիան ուղեկցվում է կողմնակի գործընթացներով, որոնց արդյունքում ստացվում են բենզոլ, ցիկլոհեքսան և ամոնիակ:
Ռեակցիան ունի արդյունաբերական նշանակություն.
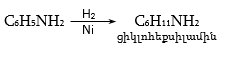
1. Անվանել հետևյալ միացությունները.
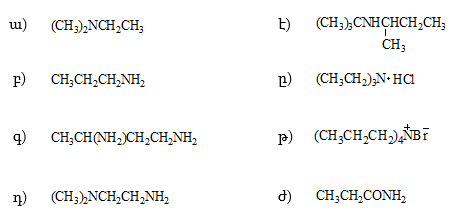
2. Գրել այն ռեակցիաների հավասարումները, որոնց միջոցով էթիլենից կարելի է ստանալ էթիլամին, պրոպիլամին, տրիէթիլամին, տետրաէթիլամոնիումի քլորիդ:
3. Հոֆմանի վերախմբավորումով և Գաբրիելի ֆտալիմիդային եղանակով ստանալ պրոպիլամին: Ցույց տալ այս ռեակցիաների առավելությունն ալկիլհալոգենիդների
4. Հետևյալ սխեմայում գրել միջանկյալ և վերջնական արգասիքների բանաձևերը.
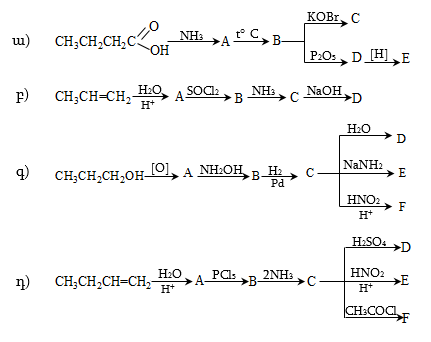
5. Քննարկել էթիլամինի մոլեկուլի էլեկտրոնային և տարածական կառուցվածքը:
6. Գրել ![]() բաղադրությամբ
իզոմեր
ամինների
կառուցվածքային
բանաձևերը և
կարդալ:
բաղադրությամբ
իզոմեր
ամինների
կառուցվածքային
բանաձևերը և
կարդալ:
7. Իրականացնել հետևյալ փոխարկումները.
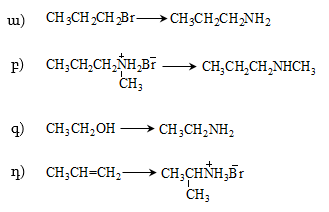
8. Ստանալ իզոպրոպիլամին` օգտագործելով հետևյալ ելանյութերը.
|
ա) |
իզոպրոպիլսպիրտ, |
գ) |
իզովալերիանաթթու, |
|
բ) |
իզոկարագաթթու, |
դ) |
պրոպիլեն: |
9. Ինչպիսի՞ ռեակցիաների օգնությամբ կիրականացվեն հետևյալ փոխարկումները.
|
ա) |
իզովալերիանալդեհիդ
|
|
բ) |
ացետիլեն
|
|
գ) |
ացետիլեն
|
|
դ) |
ադիպինաթթու
|
10. Գնահատել և հիմնավորել բերված միացությունների հիմնայնությունը.
|
ա) |
մեթիլամին, դիմեթիլամին, տրիմեթիլամին, |
|
բ) |
դիէթիլամին, տրիէթիլամոնիումի հիդրօքսիդ, ացետամիդ: |
11. Ինչու՞ նիտրոմիացություններում α-ածխածնի ատոմի մոտ գտնվող ջրածինը շարժունակ է, իսկ ամիններում ամինո խմբի նկատմամբ նույն դիրքում գտնվող ջրածինը նման ակտիվություն չի ցուցաբերում:
12. Ստանալ պենտիլամին և գրել դրա փոխազդեցութան ռեակցիաները աղաթթվի, ազոտային թթվի, մեթիլյոդիդի և քացախաթթվի անհիդրիդի հետ:
13. Բութանոնից ստանալ 2-ամինոբութան և ստացված միացությունն ալկիլել մեթիլքլորիդով: Համեմատել առաջնային, երկրորդային, երրորդային ամինների հիմնային հատկություները:
14. Հոֆմանի ռեակցիայով 1-հեպտանոլից ստանալ հեքսիլամին:
15. Պարզել
![]() նյութի
կառուցվածքը,
եթե այն
փոխազդում է
ազոտային
թթվի հետ`
առաջացնելով
նյութի
կառուցվածքը,
եթե այն
փոխազդում է
ազոտային
թթվի հետ`
առաջացնելով ![]() ավելցուկով,
ապա AgOH-ով և
հետագա
տաքացումով
առաջանում են
տրիմեթիլամին,
պրոպիլեն և
ջուր:
ավելցուկով,
ապա AgOH-ով և
հետագա
տաքացումով
առաջանում են
տրիմեթիլամին,
պրոպիլեն և
ջուր:
16. Ինչպիսի՞ն
է ![]() բաղադրությամբ
ամինի
կառուցվածքը,
եթե այն չի
փոխազդում
քացախաթթվի
անհիդրիդի
հետ և
փոխազդում է
միայն մեկ
մոլեկուլ
մեթիլյոդիդի
հետ:
բաղադրությամբ
ամինի
կառուցվածքը,
եթե այն չի
փոխազդում
քացախաթթվի
անհիդրիդի
հետ և
փոխազդում է
միայն մեկ
մոլեկուլ
մեթիլյոդիդի
հետ:
17. Լրացնել հետևյալ փոխարկումները.
18. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը և նշել արոմատիկ, ալիֆատիկ և խառը ամինները.
|
ա) |
անիլին, |
է) |
N,N-դիէթիլ-պ-տոլուիդին, |
|
բ) |
դիֆենիլամին, |
ը) |
պ-նիտրոանիլին, |
|
գ) |
N,N-դիէթիլանիլին, |
թ) |
պ-բրոմացետանիլիդ, |
|
դ) |
բենզիլամին, |
ժ) |
մ-տոլուիդին, |
|
ե) |
դիֆենիլբենզիլամին, |
ի) |
պ-ֆենիլենդիամին, |
|
զ) |
օ-տոլիլամին, |
լ) |
2,4,6-տրինիտրոանիլին: |
19. Քննարկել անիլինի մոլեկուլի կառուցվածքը: Էլեկտրոնային էֆեկտների օգնությամբ բնորոշել ամինոխմբի և բենզոլային օղակի փոխադարձ ազդեցությունը: Նկարագրել մոլեկուլում էլեկտրոնային խտության բաշխումը ռեզոնանսային եղանակով: Գնահատել հետևյալ ամինների համեմատական հիմնայնությունը.
|
ա) |
մեթիլամին, |
ե) |
դիֆենիլամին, |
|
բ) |
դիմեթիլամին, |
զ) |
տրիֆենիլամին, |
|
գ) |
տրիէթիլամին, |
է) |
N-մեթիլանիլին, |
|
դ) |
անիլին, |
ը) |
N,N-դիմեթիլանիլին: |
20. Լրացնել հետևյալ փոխարկումները.
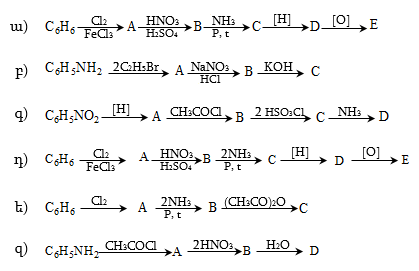
21. Գրել անիլինի և օ-, պ-տոլուիդինների արտադրական ստացման եղանակները: Նշել ռեակցիաների պայմանները:
22. Իրականացնել հետևյալ փոխարկումները.
|
ա) |
տոլուոլ
|
|
բ) |
անիլին
|
|
գ) |
պ-տոլիլաթթու
|
|
դ) |
նիտրոբենզոլ
|
|
ե) |
բենզիլքլորիդ
|
|
զ) |
բենզոնիտրիլ
|
|
է) |
ֆենիլքացախաթթու
|
23. Համապատասխան առաջնային ամիններից ստանալ հետևյալ միացությունները և անվանել.
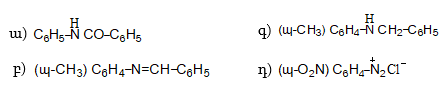
24. Բենզոլից ստանալ պ-բրոմանիլին և գրել փոխազդեցության ռեակցիաները հետևյալ ռեագենտների հետ: Անվանել ստացվող միացությունները.
|
ա) |
HBr |
դ) |
(CH3CO)2O |
|
բ) |
CH3Br |
ե) |
C6H5CHO |
|
գ) |
HNO2 |
զ) |
CHCl3 (NaOH,t) |
25. Իրականացնել նշված փոխարկումները.
|
ա) |
անիլին
|
|
բ) |
անիլին
|
|
գ) |
անիլին
|
|
դ) |
անիլին
|
|
ե) |
տոլուոլ
|
|
զ) |
տոլուոլ
|
|
է) |
քլորբենզոլ
|
26. Քննարկել բենզոլային օղակում տեղակալիչների ազդեցությունն ամինոխմբի հիմնայնության վրա հետևյալ միացություններում.
|
ա) |
պ-նիտրոանիլին, |
գ) |
պ-տոլուիդին, |
|
բ) |
մ-նիտրոանիլին, |
դ) |
մ-տոլուիդին: |
27. Յուրաքանչյուր խմբում դասավորել միացություններն ըստ հիմնայնության աճի.
|
ա) |
անիլին, բենզիլամին, N,N-դիմեթիլանիլին, |
|
բ) |
մեթիլամին, դիմեթիլամին, տրիմեթիլամին, |
|
գ) |
N-մեթիլանիլին, դիֆենիլամին, ֆենիլբենզիլամին: |
28. Ինչպիսի՞ ռեագենտների օգնությամբ և ինչ՞ պայմաններում կիրականացվեն հետևյալ փոխարկումները.

48. ԱՐՈՄԱՏԻԿ ԴԻԱԶՈՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
Արոմատիկ
դիազոմիացությունները
(Պ.Գրիս, 1858թ.) ![]() ընդհանուր
բանաձևով
միացություններ
են` երկու
ազոտից
բաղկացած
բնորոշ
խմբավորումով,
որը միացած է
միայն մեկ
ածխաջրածնային
ռադիկալի հետ:
ընդհանուր
բանաձևով
միացություններ
են` երկու
ազոտից
բաղկացած
բնորոշ
խմբավորումով,
որը միացած է
միայն մեկ
ածխաջրածնային
ռադիկալի հետ:
Դիազոաղերը
![]() բանաձևով
միացություններ
են` բաղկացած
դիազոկատիոնից
և X ցանկացած
անիոնից: Այս
միացությունները
բնույթով
նման են
ամոնիումային
աղերին:
բանաձևով
միացություններ
են` բաղկացած
դիազոկատիոնից
և X ցանկացած
անիոնից: Այս
միացությունները
բնույթով
նման են
ամոնիումային
աղերին:
Դիազոկատիոնը զուգորդված իոն է. յուրաքանչյուր ազոտ կրում է մասնակի դրական լիցք.
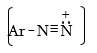
Դիազոաղերը կոչում են արոմատիկ միացության ռադիկալի անվանն ավելացնելով դիազոնիում բառը` նշելով անիոնի անվանումը:

Ազոմիացություններում
երկու ազոտի
ատոմները
միացած են
ած-խաջրածնային
ռադիկալների
հետ ![]()
Ավելի
բարդ
ազոմիացությունները
կարդացվում
են ![]() (արիլազո)
խումբը
դիտարկելով
որպես
տեղակալիչ.
(արիլազո)
խումբը
դիտարկելով
որպես
տեղակալիչ.
48.1. Ֆիզիկական հատկություններ, կիրառման բնագավառներ
Չոր
դիազոնիումի աղերը
բյուրեղային,
պայթյունավտանգ
նյութեր են,
անկայուն են,
այդ պատճառով
դիազոաղերը հազվադեպ
են
առանձնացվում
մաքուր ձևով:
Սովորաբար,
օգտագործվում
են թարմ
պատրաստված դիազոաղերի
լուծույթները ![]() ոչ
բարձր
ջերմաստիճանում:
ոչ
բարձր
ջերմաստիճանում:
Արոմատիկ դիազոմիացությունները լայն կիրառություն ունեն բազմաթիվ օրգանական միացությունների սինթեզում: Կիրառվում են դեղամիջոցների, ազոներկանյութերի արտադրություններում: Դիազոմիացությունների լուսազգայունության հիման վրա կատարվում են գծագրերի, տեքստերի պատճենահանում, տպագրական աշխատանքներ, մանավանդ լուսազգայուն են դիազոխմբի նկատմամ օ- կամ պ-դիրքերում օքսի կամ ամինոխումբ պարունակող միացությունները: Որոշ դիազոմիացություններ պոլիմերացման հարուցիչներ են:
Դիազոմիացությունների կայուն աղերը կիրառվում են գործվածքների գունավորման և դաջման համար:
Դիազոմիացությունների
ստացումն
առաջնային
ամիններից
կոչվում է
դիազոտացման
ռեակցիա, որն
իրականացվում
է ամինի
ջրային
լուծույթի
վրա ազդելով
իր աղերից
ստացվող
ազոտային թթվով
հանքային
թթվի
ավելցուկի
ներկայությամբ
(ամինի նկատմամբ
2,5 համարժեք):
Թթվի
ավելցուկը
կանխում է
կողմնակի
ռեակցիաների
ընթացքը,
ինչպես նաև`
դիազոամինոմիացության
առաջացումը:
Դիազոնիումի
աղերը
զգայուն են
ջերմաստիճանի
նկատմամբ
(տաքացնելիս
քայքայվում
են), ուստի ռեակցիան
տարվում է ![]() ոչ բարձր ջերմաստիճանում:
ոչ բարձր ջերմաստիճանում:
![]()
Ամիններից
դիազոմիացությունների
առաջացումը
կարելի է պատկերացնել
հետևյալ կերպ.
ազոտային
թթուն
թթվային
միջավայրում
գոյացնում է
մի քանի
դիազոտացնող
միջոց ![]() որոնցից
յուրաքանչյուրի
դերը
պայմանավորված
է թթվի
խտությամբ և
ամինի
հիմնայնությամբ:
Փոխազդելով
ամինի հետ`
դրանցից
յուրաքանչյուրն
առաջացնում է
նիտրոզոամին,
որը
հետագայում
փոխարկվում է
դիազոնիումի
աղի:
որոնցից
յուրաքանչյուրի
դերը
պայմանավորված
է թթվի
խտությամբ և
ամինի
հիմնայնությամբ:
Փոխազդելով
ամինի հետ`
դրանցից
յուրաքանչյուրն
առաջացնում է
նիտրոզոամին,
որը
հետագայում
փոխարկվում է
դիազոնիումի
աղի:
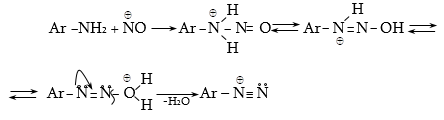
Դիազոաղերի լուծույթներն ալկալու լուծույթով մշակելիս` առաջանում են մի քանի միացություններ, որոնց միջև ստեղծվում է հավասարակշռություն:
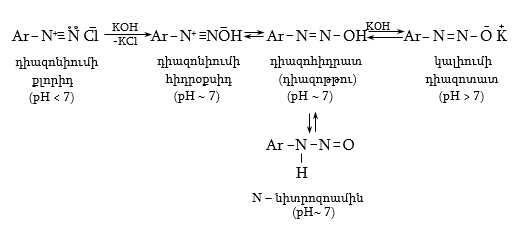
Դիազոհիդրատի առաջացումը բացատրվում է նրանով, որ դիազոկատիոնի և հիդրօքսիլ իոնի փոխազդեցության ժամանակ, դրական լիցքն ամբողջովին տեղաշարժվում է ծայրային ազոտի վրա, հիդրօքսիլի և ազոտի միջև գոյանում է կովալենտ կապ.
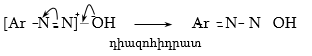
Դիազոհիդրատներն ազատ վիճակում չեն ստացվել: Ջրային լուծույթում ունեն ամֆոտեր հատկություններ. թթվի ազդեցությամբ վերածվում են դիազոնիումի աղերի, հիմքերի ազդեցությամբ` դիազոտատների:
Դիազոաղերի և ալկալու գումարային ռեակցիան հետևյալն է.
![]()
Դիազոտատի թթվեցման ժամանակ առաջանում են տաուտոմեր միացություններ` դիազոհիդրատ և նիտրոզոամին.

Այսպիսով,
դիազոմիացությունների
լուծույթներում
առկա են
դիազոկատիոններ ![]() և
դիազոանիոններ
և
դիազոանիոններ
![]() Այս կամ
այն իոնի
կոնցենտրացիան
կախված է լուծույթի
pH-ից (Բ.Ա.
Պորայ-Կոշից):
Այս կամ
այն իոնի
կոնցենտրացիան
կախված է լուծույթի
pH-ից (Բ.Ա.
Պորայ-Կոշից):
Դիազոտատները, դիազոցիանիդները և նմանատիպ միացությունները գոյություն ունեն երկու երկրաչափական իզոմերների տեսքով. սին և անտի.
Դիազոմիացությունների ռեակցիաները կարող են ընթանալ ազոտի անջատումով և առանց ազոտի անջատման:
48.3.1. Ռեակցիաներ ազոտի անջատումով (դիազոնիումաղի քայքայումը կատարվում է հետերոլիտիկ խզումով):
ա) ազոտի անջատումով ռեակցիաները կատարվում են դիազոխմբի տեղակալմամբ անիոններով: Դիազոնիումի աղերի թթվային լուծույթների տաքացումով լավ ելքերով ստացվում են ֆենոլներ: Աղերի հիդրոլիզն ընթանում է միջանկյալ արոմատիկ կատիոնի առաջացմամբ: Կողմնակի ռեակցիաներից խուսափելու համար ֆենոլների ստացման համար նպատակահարմար է կիրառել ծծմբական թթվի աղեր, քանի որ հիդրոսուլֆատ իոնը քլորիդ իոնի համեմատ ավելի թույլ նուկլեոֆիլ է և ֆենիլ կատիոնի հետ միացման գործընթացում չի կարող մրցակցել ջրի մոլեկուլի հետ: Ռեակցիան կարելի է նկարագրել երկու փուլով.
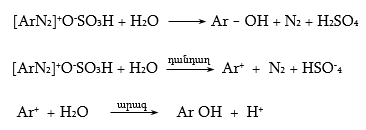
բ) Բալց-Շիմանի ռեակցիա. պինդ տետրաֆտորբորատի ջերմային քայքայում` ֆտորբենզոլի առաջացումով.
![]()
Ռեակցիան ընթանում է միջանկյալ ֆենիլ կատիոնի գոյացմամբ.
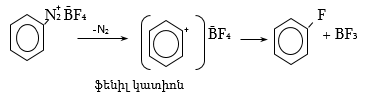
Ֆենիլ
կատիոնի
կառուցվածքի
յուրահատկությունն
այն է, որ
ածխածնի ![]() հիբրիդային
ազատ
օրբիտալը
գտնվում է
օղակի հարթության
մեջ և չի
կարող զուգորդվել
π-էլեկտրոնային
համակարգի
հետ:
հիբրիդային
ազատ
օրբիտալը
գտնվում է
օղակի հարթության
մեջ և չի
կարող զուգորդվել
π-էլեկտրոնային
համակարգի
հետ:
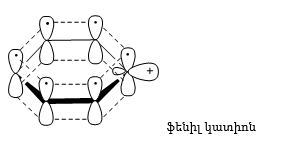
Ֆենիլ կատիոնի առաջացման ապացույց է այն, որ լուծույթում գտնվող ցանկացած նուկլեոֆիլ կարող է միանալ կատիոնի հետ: Այսպես, մեթանոլի ջրային լուծույթում ֆենիլդիազոնիումի քայքայման արգասիքներն են ֆենոլը և անիզոլը: Քլոր իոնի ներկայությամբ ստացվում է քլորբենզոլ:
գ) Զանդմեյերի
և Գատերմանի
ռեակցիաներ. արոմատիկ
դիազոմիացություններում
![]() խումբը
քլորով կամ
բրոմով
կարելի է
տեղակալել`
ազդելով միավալենտ
պղնձի հալոգենիդներով
համապատասխան
հալոգենաջրածնական
թթվի
ներկայությամբ
(Զանդմեյեր)
կամ
մետաղական
պղնձով և
հալոգենաջրածնական
թթվով (Գատերման):
խումբը
քլորով կամ
բրոմով
կարելի է
տեղակալել`
ազդելով միավալենտ
պղնձի հալոգենիդներով
համապատասխան
հալոգենաջրածնական
թթվի
ներկայությամբ
(Զանդմեյեր)
կամ
մետաղական
պղնձով և
հալոգենաջրածնական
թթվով (Գատերման):
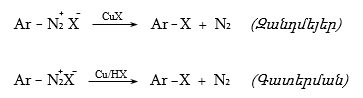
Ստորև բերված են նմանատիպ որոշ ռեակցիաներ.
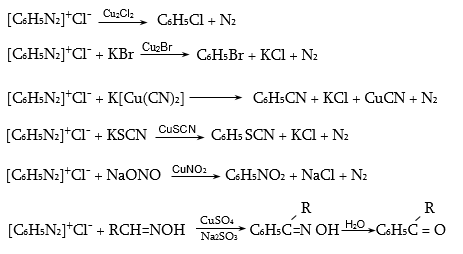
Պղնձի աղերի կատալիզող ազդեցությունը նպաստում է արիլ ռադիկալների առաջացմանը: Պղնձի իոնն էլեկտրոնի փոխանցիչ է և ապահովում է ռեակցիայի ռադիկալային բնույթը.
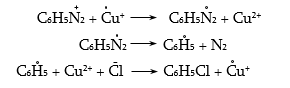
Ռադիկալային մեխանիզմը հաստատվում է դիֆենիլ և ազոբենզոլ կողմնակի միացությունների առաջացմամբ.
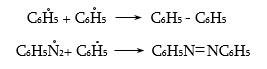
դ) մետաղօրգանական միացությունների ստացում դիազոնիումի կրկնակի աղերից մետաղների փոշու ներկայությամբ (Ա.Ն.Նեսմեյանով): Դիազոխումբը տեղակալվում է մետաղով.
ե)
որոշ
վերականգնիչներով
![]() նատրիումի
ստաննիտ, ֆորմալդեհիդի
հիմնային
լուծույթ)
դիազոխումբը տեղակալվում
է ջրածնով.
նատրիումի
ստաննիտ, ֆորմալդեհիդի
հիմնային
լուծույթ)
դիազոխումբը տեղակալվում
է ջրածնով.
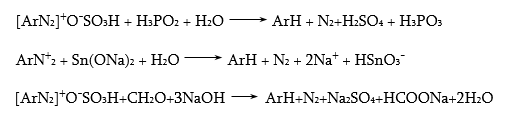
Առաջնային սպիրտներով դիազոմիացությունների վերականգնումը սահմանափակ կիրառություն ունի, քանի որ ռեակցիան ուղեկցվում է ալկօքսիմիացությունների գոյացումով.

զ) դիազոխումբն ուժեղ էլեկտրոնակցեպտոր է, ակտիվացնում է բենզոլային օղակի օրթո և պարա դիրքերը` նուկլեոֆիլի հարձակման համար.
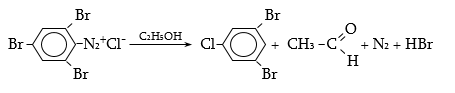
Բրոմի
տեղակալումը
քլորով
կատարվում է ![]() խմբի
առկայության
շնորհիվ:
խմբի
առկայության
շնորհիվ:
48.3.2. Ռեակցիաներ` առանց ազոտի անջատման
Այսպիսի ռեակցիաներ են վերականգման, օքսիդացման և ազոհամակցման ռեակցիաները:
ա) մեղմ պայմաններում, անագի քլորիդի աղաթթվային լուծույթում կամ ցինկի փոշով քացախաթթվում, դիազոաղերը վերականգնվում են արիլհիդրազինների.
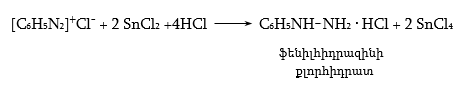
Արիլհիդրազինները կիրառվում են դեղամիջոցների, ներկանյութերի արտադրություններում և որպես ռեագենտ` ալդեհիդները և կետոնները հայտնաբերելու համար:
բ) դիազոտատների օքսիդացումով ջրածնի պերօքսիդով ստացվում են նիտրոամիններ և նիտրոզոհիդրօքսիլամիններ.

գ) դիազոնիում իոնները թույլ էլեկտրոֆիլներ են, փոխազդում են միայն ուժեղ էլեկտրոնադոնոր տեղակալիչ ունեցող (ամինո, հիդրօքսիլ) արոմատիկ միացությունների հետ ազոմիացությունների առաջացումով: Ռեակցիան արոմատիկ օղակի էլեկտրոֆիլ տեղակալման ռեակցիա է: Ակտիվ ռեագենտ է միայն դիազոկատիոնը, մյուս դիազոձևերը ազոհամակցման չեն մասնակցում: Ազոհամակցումն ուժեղ թթվային միջավայրում չի ընթանում, քանի որ ամինոխումբը փոխարկվում է արոմատիկ օղակն անգործունյա դարձնող ամոնիումային խմբի: Ֆենոլների հետ ազոհամակցումը տարվում է թույլ հիմնային, իսկ ամինների հետ` թույլ թթվային միջավայրում: Համակցումը հիմնականում գնում է պարա դիրք, իսկ եթե այն զբաղված է, ապա` օրթո դիրք.
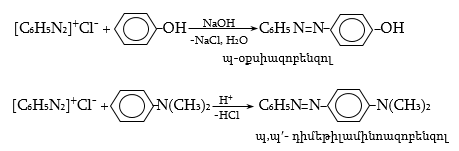
մեխանիզմ.
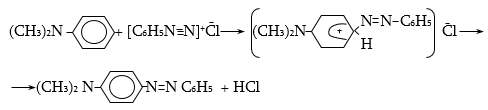
Էլեկտրոնակցեպտոր տեղակալիչները մեծացնում են դիազոնիում իոնի էլեկտրոֆիլությունը և ակտիվացնում մոլեկուլը ազոհամակցման նկատմամբ:
Ստորև բերված շարքում ձախից աջ նվազում է մոլեկուլի ակտիվությունն ազոհամակցման նկատմամբ:

դ) առաջնային և երկրորդային ամինների հետ փոխազդելու դեպքում, ազոխումբը մտնում է ոչ թե արոմատիկ օղակ, այլ ամինոխումբ` դիազոամինոմիացությունների (տրիազեն) առաջացումով: Ռեակցիան տարվում է չեզոք կամ թույլ թթվային միջավայրում.
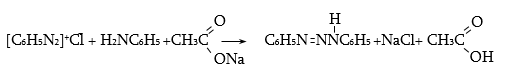
Թթուների ազդեցությամբ դիազոամինոմիացությունները փոխարկվում են ամինոազոմիացությունների` առաջացնելով միջանկյալ դիազոաղեր.
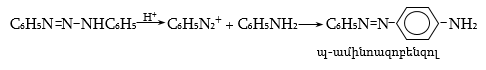
Շնորհիվ -N=N- քրոմոֆոր խմբի, որը նպաստում է լույսի կլանմանը սպեկտրի տեսանելի տիրույթում, ազոմիացությունները գունավոր նյութեր են: Աուքսոքրոմ օքսի և ամինո խմբերը խորացնում են գունավորումը և մատչելի դարձնում ներկանյութերի կլանումը մանրաթելի կողմից: Ժամանակակից տեխնիկայում կիրառվում են բազմաթիվ ազոներկանյութեր: Լաբորատորիայում որպես ինդիկատոր օգտագործվում է մեթիլօրանժ (հելիանտին).
Մեթիլօրանժի գունափոխությունը միջավայրի pH-ից կախված` նկարագրվում է հետևյալ հավասարակշռությամբ.
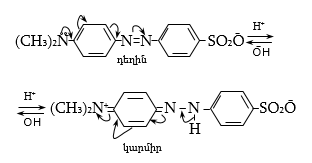
Ստորև բերված են հայտնի ազոներկանյութեր և ստացումները.
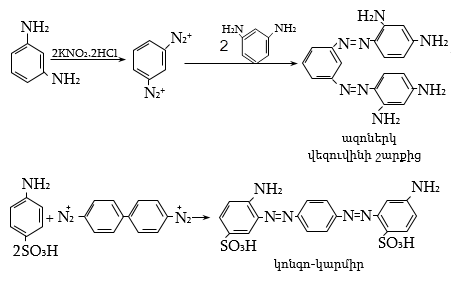
1. Գրել հետևյալ միացությունների կառուցվածքային բանաձևերը.
ա) ֆենիլդիազոնիումսուլֆատ,
բ) պ–նիտրոֆենիլդիազոնիումքլորիդ,
գ) պ-ամինոսուլֆաբենզոլ,
դ) ազոբենզոլ,
ե) 2,4-դիօքսի–4´-(N,N-դիմեթիլամինո)-ազոբենզոլ,
զ) բենզիդին,
է ) պ-ֆենիլազոանիլին,
ը) պ–նիտրոֆենիլդիազոնիումնիտրատ,
թ) պ,պ’-դիմեթիլամինոազոբենզոլ:
2. Գրել պ-նիտրոֆենիլդիազիոնիումսուլֆատի փոխազդեցությունը հետևյալ ռեագենտների հետ.
ա) մ–ֆենիլդիամին, դ) CuCl,
բ) պ–կրեզոլ, ե) CuCN,
գ)
KI, ![]()
3. Բենզոլից և տոլուոլից ստանալ հետևյալ միացությունները` կիրառելով անօրգանական ռեագենտներ.
ա) վեց իզոմեր դիբրոմտոլուոլ,
բ) երեք իզոմեր քլորբենզոյական թթու,
գ) երեք իզոմեր ֆտորքլորբենզոլ,
դ) երեք իզոմեր յոդֆենոլ:
4. Բենզոլից և տոլուոլից ստանալ հետևյալ միացությունները.
ա) պ-քլորտոլուոլ, զ) 2-բրոմ–4–մեթիլբենզոյական թթու,
բ) պ-յոդբենզոյական թթու, է) 3-բրոմ–4-մեթիլբենզոյական թթու,
գ) մ–քլորֆենոլ, ը) պ–օքսիֆենիլքացախաթթու,
դ) մ-բրոմանիլին, թ) 3,5-դիբրոմանիլին,
ե) մ-էթիլֆենոլ, ժ) 2-ամինո– 4–մեթիլֆենոլ:
5. Բենզոլից և տոլուոլից ստանալ հետևյալ ազոմիացությունները` օգտագործելով օրգանական և անօրգանական ռեագենտներ.

6. Լրացնել հետևյալ ռեակցիաները.
7. Բենզոյական թթվից ստանալ ֆենիլքացախաթթու:
8. Ինչպիսի՞ փոխարկումների է ենթարկվում անիլինը դիազոտացման ռեակցիայի պայմաններում միջավայրի pH-ից կախված, եթե pH-ը փոփոխվում է 3…10 սահմաններում:
9. Ո՞ր ռեակցիաներում է ֆենիլդիազոնիում իոնը փոխարկվում միջանկյալ ֆենիլ կատիոնի:
10. Ի՞նչ դեր են կատարում կատալիզատորի մասնիկները Զանդմեյերի ռեակցիաներում: Բերել օրինակներ:
11. Լրացնել հետևյալ փոխարկումները.
|
ա) |
մ-քսիլոլ
|
|
բ) |
բենզոլ
|
|
գ) |
բենզոլ
|
|
դ) |
բենզոլ
|
12. Պ-տոլիլաթթվից ստանալ 4-մեթիլ-2-քլորբենզոյական թթու, բենզոյական թթվից` պ-նիտրոբենզոյական թթու:
13. Իրականացնել հետևյալ փոխարկումները.
|
ա) |
տոլուոլ
|
|
բ) |
անիլին
|
|
գ) |
էթիլբենզոլ
|
|
դ) |
տոլուոլ
|
|
ե) |
տոլուոլ
|
|
զ) |
էթիլբենզոլ
|
14. Պ-նիտրոանիլինից ստանալ հետևյալ միացությունները.
|
ա) |
3,4,5-տրիբրոմանիլին, |
գ) |
2,6-դիքլոր-4-նիտրոանիլին, |
|
բ) |
3,5-դիքլորանիլին, |
դ) |
1,3,5-տրիբրոմբենզոլ: |
15. Լրացնել ռեակցիան, գրել ստացվող արգասիքի ռեզոնանսային կառուցվածքները:
49. ՄԵՏԱՂՕՐԳԱՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐ
Մետաղօրգանական
միացություններում
ածխածնի
ատոմն
անմիջապես
միացած է
մետաղի ատոմի
հետ: C-M կապը
լինում է
կովալենտ կամ
իոնական: C-M
կապի
բևեռայնությունը
փոխվում է
լայն միջակայքում`
կախված
պարբերական
համակարգում
մետաղի
դիրքից: Եթե
ալկիլ խմբի
չափերը փոքր
են, C-M կապի
բարձր
իոնական
բնույթը
մոլեկուլին
հաղորդում է
անօրգանական
աղերին բնորոշ
հատկություններ.
![]() Ածխածին-մետաղ
կովալենտ
կապի
էլեկտրոնային
ամպի
խտությունը տեղաշարժված
է դեպի ածխածինը:
Մետաղօրգանական
միացությունները
լինում են մաքուր,
երբ մետաղի
ատոմը միացած
է միայն
ածխածնի ատոմի
հետ և խառը, երբ
բացի ածխածնի
ատոմից
մետաղը
միացած է հալոգենի
կամ թթվածնի
ատոմի հետ:
Ածխածին-մետաղ
կովալենտ
կապի
էլեկտրոնային
ամպի
խտությունը տեղաշարժված
է դեպի ածխածինը:
Մետաղօրգանական
միացությունները
լինում են մաքուր,
երբ մետաղի
ատոմը միացած
է միայն
ածխածնի ատոմի
հետ և խառը, երբ
բացի ածխածնի
ատոմից
մետաղը
միացած է հալոգենի
կամ թթվածնի
ատոմի հետ:
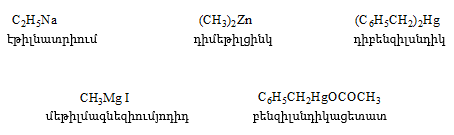
49.1. Ֆիզիկական հատկություններ
Մետաղօրգանական միացությունները ցնդող նյութեր են, որոնց համար կարելի է որոշել գոլորշիների խտությունը, թունավոր են, մանավանդ սնդիկի և բերիլիումի միացությունները: Բացառիկ ռեակցիոնունակությունը դժվարացնում է դրանց ֆիզիկական հատկությունների գնահատումը: Մեծամասամբ ստանում և կիրառում են առանց նախնական առանձնացման և մաքրման:
Միջին ռեակցիոնունակությամբ մետաղները (Li, Be, Mg, Ca, Si, Ba, Al, Zn,) փոխազդելով ալկիլհալոգենիդների հետ անջուր իներտ միջավայրում (եթեր, ՏՀՖ), առաջացնում են մետաղօրգանական միացություններ.
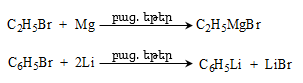
Պակաս ռեակցիոնունակ ծանր մետաղներն (Hg, Pb) ալկիլհալոգենիդների հետ փոխազդում են միայն նատրիումական համաձուլվածքների տեսքով.

Ավելի ակտիվ ալկալիական մետաղների և ալկիլհալոգենիդների փոխազդեցության ժամանակ մետաղօրգանական միացություններն առաջանում են որպես միջանկյալ արգասիքներ, քանի որ ռեակցում են ալկիլհալոգենիդի հաջորդ մոլեկուլի հետ` գոյացնելով ածխաջրածին (Վյուրցի ռեակցիա, տես «Ալկաններ»):
Խառը մագնեզիումօրգանական միացություններն առանձնահատուկ տեղ են գրավում օրգանական սինթեզում: 1900թ. առաջին անգամ ֆրանսիացի գիտնական Վ. Գրինյարն ստացել է մագնեզիումօրգանական միացություններ (1912թ. Գրինյարն արժանացել է Նոբելյան մրցանակի):
Ռեակցիան կիրառական առումով շատ մատչելի է: Չոր եթերում ալկիլհալոգենիդի և մագնեզիումի փոխազդեցությամբ խառնման պայմաններում տեղի է ունենում բուռն ռեակցիա` լուծույթը եռում է, մգանում, իսկ մագնեզիումը` լուծվում: Ստացված լուծույթը կոչվում է Գրինյարի ռեակտիվ (RMgX):
Հալոգենալկանների ռեակցիոնունակությունն աճում է հետևյալ շարքում.
![]()
Ալկիլհալոգենիդները ցուցաբերում են ավելի մեծ ակտիվություն, քան մյուս հալոգենիդները.
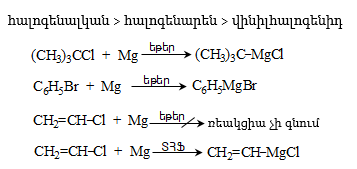
Վինիլմագնեզիումհալոգենիդները (Նորմանի ռեակտիվ) լայն կիրառություն ունեն չհագեցած մետաղօրգանական միացությունների ստացման համար:
Գրինյարի ռեակտիվի կամ լիթիումօրգանական միացության և մետաղի հալոգենիդի հետ փոխազդեցությամբ ստացվում են այլ մետաղօրգանական միացություններ. կատարվում է փոխանակային հավասարակշռային գործընթաց: Քանի որ հալոգենն ավելի էլեկտրաբացասական է, քան ածխածինը, այն կապ է առաջացնում ավելի էլեկտրադրական մետաղի հետ.
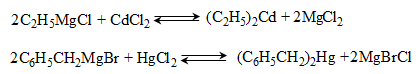
Եթե հավասարակշռությունը տեղաշարժված է դեպի աջ, ապա հակադարձելի ռեակցիան կարելի է հաշվի չառնել.
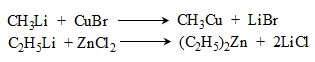
49.3.1. Գրինյարի ռեակտիվներն, ինչպես նաև մյուս մետաղօրգանական միացություններն ուժեղ հիմքեր են, պրոտոն են պոկում այն միացություններից, որոնց թթվայնությունը մեծ է ածխաջրածինների թթվայնությունից.
![]()
Գրինյարի ռեակտիվի փոխարկումները.
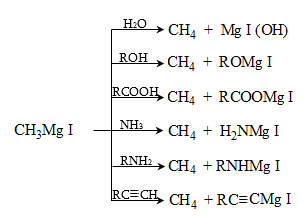
Բերված ռեակցիաներից յուրաքանչյուրն ընթանում է քանակական ելքով և ունի անալիտիկական նշանակություն (Չուգաև-Ցերեվիտինով): Անջատված մեթանի ծավալով որոշվում է փոխազդող միացության քանակը:
49.3.2. Հալոգենալկանների և հալոգենարենների վերականգնում մինչև ածխաջրածիններ.
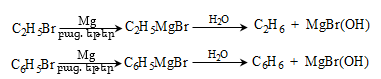
Գրինյարի ռեակտիվի միջոցով կարելի է ստանալ դեյտերացված ածխաջրածին.
![]()
49.3.3.
Նուկլեոֆիլ
տեղակալում:
Այս
ռեակցիաներում
ալկիլմագնեզիումհալոգենիդները
պակաս ռեակցիոնունակ
են, շատ
դանդաղ են
փոխազդում հալոգենալկանների
հետ,
հիմնականոււմ
![]() մեխանիզմով:
Մինչդեռ ալիլ
և
բենզիլհալոգենիդներն
ալկիլ և
վինիլմագնեզիումհալոգենիդների
հետ
փոխազդում են
ավելի հեշտ.
մեխանիզմով:
Մինչդեռ ալիլ
և
բենզիլհալոգենիդներն
ալկիլ և
վինիլմագնեզիումհալոգենիդների
հետ
փոխազդում են
ավելի հեշտ.
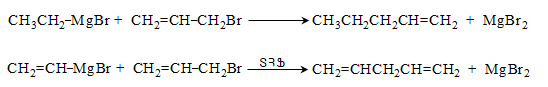
Լիթիումօրգանական միացությունները նույնպես դժվար են փոխազդում ալկիլհալոգենիդների հետ, իսկ պղնձի աղերի ներկայությամբ ռեակցիան արագանում է: Լիթիումացետիլենիդներն, ընդհակառակը, հեշտ են փոխազդում առաջնային ալկիլհալոգենիդների հետ.
![]()
49.3.4. Նուկլեոֆիլ միացում: Գրինյարի ռեակտիվը հեշտությամբ փոխազդում է օքսոմիացությունների հետ: Առաջացած աղերի թթվային հիդրոլիզով ստացվում են համապատասխան սպիրտներ (տես «Սպիրտներ», «Ալդեհիդներ և կետոններ»): Նույն մեխանիզմով փոխազդում է նաև ածխածնի դիօքսիդի հետ.

Գրինյարի ռեակտիվը կիրառվում է ալդեհիդային խմբի ստացման համար: Տրիալկիլօրթոֆորմիատի հետ փոխազդեցությամբ առաջացած ացետալի հիդրոլիզով գոյանում է համապատասխան ալդեհիդ (Զելինսկի).
![]()
Լիթիումօրգանական միացություններին հատուկ են վերը նշված բոլոր միացման ռեակցիաները (AdN), նույնիսկ տարածական դժվարություն ներկայացնող կետոնների հետ, որը Գրինյարի ռեակտիվով չի հաջողվել իրականացնել.
![]()
49.3.5. Օքսիդացում: Մագնեզիումօրգանական միացությունների մեծ մասն օդի թթվածնով օքսիդանում է: Նատրիումի, կալիումի միացություններն ինքնաբոցավառվում են օդում.
![]()
Մետաղօրգանական միացությունների հակումն օքսիդացման նկատմամբ դժվարացնում է կիրառումը, այդ պատճառով բոլոր սինթեզներն իրականացվում են իներտ միջավայրում (ազոտ կամ արգոն):
Մեծ կիրառություն ունեն նաև եռակի կապով մետաղօրգանական միացությունները (Իոցիչի ռեակտիվներ), որոնց օգնությամբ կարելի է ստանալ բազմաթիվ ացետիլենային միացություններ.
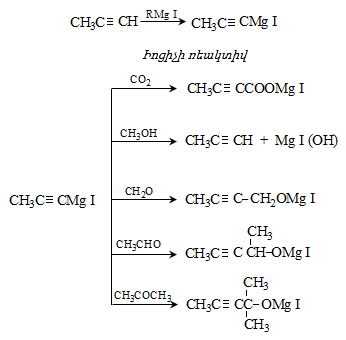
49.4. Սնդիկօրգանական միացություններ
Մեկ ածխաջրածնային ռադիկալով սնդիկօրգանական միացություններն անգույն բյուրեղային նյութեր են, դիալկիլսնդիկը` անգույն հեղուկ: Բոլոր սնդիկօրգանական միացությունները չափազանց թունավոր են, C-Hg կապի բևեռայնությունը փոքր է, հետևաբար, այս միացությունները կայուն են ջրում և անտարբեր` բևեռային ռեագենտների նկատմամբ: ՈՒժեղ թթուներով դանդաղ քայքայվում են.
49.4.1. Ստացվում են
ա) յոդալկանի և սնդիկի փոխազդեցությամբ ուլտրամանուշակագույն ճառագայթման պայմաններում.
բ) նատրիումամալգամով ալկիլհալոգենիդներից.
![]()
գ) Գրինյարի ռեակտիվից` սնդիկի (II) քլորիդով.
![]()
դ) սնդիկացետատի և ալկենների փոխազդեցությամբ (օքսիմերկուրացում).
Ի տարբերություն ալկենների անմիջական հիդրատացման, երբ հնարավոր է միջանկյալ կարբկատիոնի վերախմբավորում կողմնակի սպիրտների առաջացումով, օքսիմերկուրացման ժամանակ գործնականում բացակայում են կողմնակի միացությունները:
Սա բացատրվում է միջանկյալ առաջացող սնդիկօրգանական կարբկատիոնի համեմատական կայունությամբ: Ենթադրվում է, որ այն ունի ցիկլային կառուցվածք, որը գերակշռում է ռեակցիայի միջավայրում.
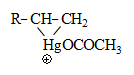
Ռեակցիայի մեխանիզմը հետևյալն է.
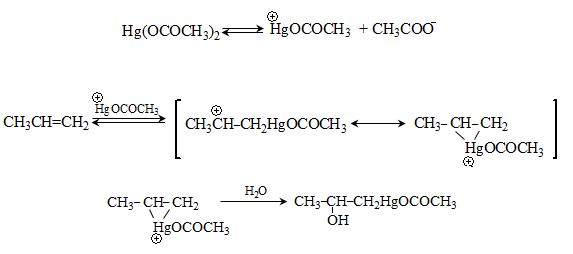
Դեմերկուրացում կատարվում է սնդիկօրգանական միացության վերականգնումով: Որպես վերականգնիչ, սովորաբար, կիրառվում է նատրիումբորհիդրիդ.
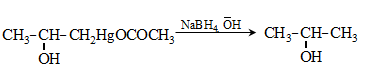
1. Անվանել հետևյալ միացությունները.
2. Անվանել հետևյալ միացությունները.
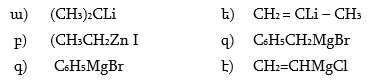
3. Գրել մանգանի և լիթիումի փոխազդեցությունը հետևյալ միացությունների հետ.
|
ա) |
պ-բրոմֆտորբենզոլ, |
ե) |
դիիզոպրոպիլամին, |
|
բ) |
ալիլքլորիդ, |
զ) |
1-բրոմպրոպան, |
|
գ) |
բութիլբրոմիդ, |
է) |
պրոպին: |
4. Լրացնել հետևյալ փոխարկումները.
5. Ո՞ր ուղղությամբ է տեղաշարժված բերված ռեակցիաների հավասարակշռությունը.
6. Ո՞ր ուղղությամբ է տեղաշարժված հետևյալ ռեակցիաների հավասարակշռությունը.
7. Նկարագրել hետևյալ ռեակցիայի մեխանիզմը.
![]()
8. Հետևյալ հալոգենիդները դասավորել Գրինյարի ռեակցիայում ըստ ակտիվության աճի.
![]()
Ինչպե՞ս է շարքը համաձայնեցվում Գրինյարի ռեակցիայի մեխանիզմի հետ:
9. Լրացնել հետևյալ ռեակցիաները: Ո՞ր ուղղությամբ է տեղաշարժված ռեակցիաների հավասարակշռությունը.
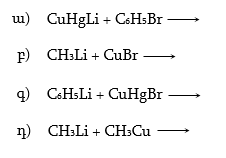
10. Գրել մեթիլմագնեզիումյոդիդի փոխազդեցության ռեակցիաները հետևյալ ռեագենտների հետ.
|
ա) |
ջուր, |
զ) |
դիմեթիլամին, |
|
բ) |
էթանոլ, |
է) |
պրոպին, |
|
գ) |
քացախաթթու |
ը) |
ֆորմալդեհիդ, |
|
դ) |
ամոնիակ, |
թ) |
բենզալդեհիդ, |
|
ե) |
բութիլամին, |
ժ) |
ածխածնի դիօքսիդ, |
|
ի) |
ալիլբրոմիդ: |
11. Գրել բութիլլիթիումի փոխազդեցության ռեակցիաները հետևյալ ռեագենտների հետ.

12. Ինչպիսի՞ ելանյութեր պետք է օգտագործել` մետաղօրգանական միացության միջոցով մեթիլէթիլիզոպրոպիլկարբինոլ սինթեզելու համար: Գրել հնարավոր տարբերակները:
13. Էթիլսպիրտից սինթեզել 3-մեթիլ-1-պենտանոն` օգտագործելով անօրգանական ռեագենտեներ:
14. Իզոպրոպիլբրոմիդից ստանալ լիթիում, ցինկ և սնդիկօրգանական միացություններ: Անվանել ստացված արգասիքները:
15. Գրել հետևյալ նատրիումօրգանական միացությունների ստացման ռեակցիաները. ալիլնատրիում, նատրիումի վինիլացետիլենիդ:
16. Գրել պրոպիլմագնեզիումյոդիդի, իզոբութիլմագնեզիումբրոմիդի օքսիդացման ռեակցիաները օդի թթվածնով: Քննարկել ստացված միացությունների հիդրոլիզը:
17. Ավարտել ռեակցիաների հավասարումները.
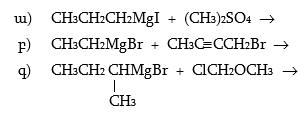
18. Համապատասխան ացետիլենային ածխաջրածիններից ստանալ հետևյալ մագնեզիումօրգանական միացությունները.
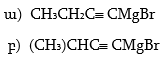
19. Լրացնել հետևյալ ռեակցիաները.

20. Գրել մեթիլմագնեզիումյոդիդի փոխազդեցության ռեակցիան հետևյալ միացությունների հետ.
ա) 1-պրոպանոլ,
բ) քացախաթթու,
գ) քացախաթթվի ամիդ,
դ) էթիլամին:
21. Ինչպիսի՞ սպիրտներ կստացվեն ներքոհիշյալ միացությունների փոխազդեցության և հետագա հիդրոլիզի արդյունքում: Գրել ռեակցիաների հավասարումները և անվանել միացությունները.
ա) ացետոն և պրոպիլմագնեզիումբրոմիդ,
բ) ֆորմալդեհիդ և էթիլմագնեզիումբրոմիդ:
22. Ացետոնի փոխազդեցությամբ Գրինյարի ռեակտիվի հետ և հետագա հիդրոլիզով ստացվել է սպիրտ, որի դեհիդրատացումով` 2-մեթիլ-2-բութեն: Գրել մագնեզիումօրգանական միացության բանաձևը:
23. Ինչպիսի՞ սպիրտներ կստացվեն ֆորմալդեհիդի և հետևյալ միացությունների փոխազդեցության արդյունքում.
ա) երրբութիլմագնեզիումբրոմիդ,
բ) ալիլմագնեզիումբրոմիդ,
գ) ֆենիլմագնեզիումբրոմիդ:
24. Ինչու՞ Գրինյարի ռեակտիվի ստացման ժամանակ կիրառվող եթերը պետք է զերծ լինի ջրի և սպիրտի խառնուրդից:
1. R.T. Morrison, R.N. Boyd, Organic chemistry, Boston, “all. And bacon, inc.”, 1966, 1204 p.
2. П.Каррер, Курс органической химии, Л.: 1962., 1216 с.
3. А.А.Петров, Х.В.Бальян, А.Т.Трощенко, Органическая химия, М.: Высшая школа, 1981, 592 с.
4. А.Н.Несмеянов, Н. А.Несмеянов, Начала органической химии, М.: Химия, 1969, Т.1 663 с. Т.2 824 с.,
5. К.Ингольд, Теоретические основы органической химии, М.: Мир, 1973, 1055 с.
6. Р.Моррисон, Р.Бойд, Органическая химия, М.: Мир,1974,1132 с.
7. Г.Беккер, Введение в электронную теорию органических реакций, М.: Мир, 1977.
8. П.Сайкс, Механизмы реакций в органической химии, М.: Химия, 1991, 447 с.
9. Л.А.Яновская, Современные теоретические основы органической химии, М.: Химия, 1978, 360 с.
10. А.Терней, Современная органическая химия, М.: Мир, 1981, Т.1 678 с., Т. 2 650 с.
11. Дж.Марч, Органическая химия, М.: Мир, 1987, Т.1 381с., Т.2, 504 с. Т.3 459 с., Т.4 468 с.
12. Б.Д.Березин, Д.Б.Березин, Курс современной органической химии, М.: Высшая школа, 2001, 768 с.
13. А.М.Ким, Органическая химия, Новосибирск, СУИ, 2004, 844 с.
14. В.Ф.Травень, Органическая химия, М.: ИКЦ Академкнига, 2005, Т.1 582с., Т.2 727 с.
15. Л.Физер, М.Физер, Реагенты для органического синтеза, М.: Мир, 1970, Т.1 448с.,Т.2 479 с.,Т.3 478 с.,Т.4 288 с.,Т.5 720 с.
16. Л.Физер, М.Физер, Органическая химия, М.: Химия, 1970, Т.1, 688 с., Т. 2, 799 с.
17. Б.В.Пассет, Основные процессы химического синтеза биологически активных веществ,М.: ГЕОТАР-МЕД, 2002, 375 с.
18. Н.А. Тюкавкина, .И. Баюков, Биоорганическая химия, 5-ое изд., М.: Дрофа, 2006, 544 с.
19. Краткая химическая энциклопедия, т.т. I-V, Совет.энцикл, 1961-1967,
20. А.Е. Чичибабин, Основы начала органической химии, 7-ое изд./под.ред. П.Г.Сергеева, А.Л.Либермана/ М.: Госхимиздат, 1963, Т.1 910 с., Т.2 767 с.
21. Հ.Է.Քառյան, Զ.Ս. Առաքելյան, Ս.Ե. Սերոբյան, Քիմիական ռեակտիվներ, տեղեկատու, Երևան, «Միտք», 1997, 128 էջ:
22. Գ.Հ. Թորոսյան, Ա.Հ. Չերքեզյան, Օրգանական քիմիա, ձեռնարկ, «Ճարտարագետ», Երևան, 2005, 357 էջ
23. Կ.Ծ.Թահմազյան, Ա.Հ. Չերքեզյան, Թ.Հ. Զապրոսյան, Յու.Ֆ.Կարաչանսկայա, Օրգանական քիմիա, դաս.տեքստ.,Մաս 1 «ՀՊՃՀ տպարան», Երևան, 1995, 100 էջ:
24. Կ.Ծ.Թահմազյան, Ա.Հ. Չերքեզյան, Թ.Հ. Զապրոսյան, Յու.Ֆ.Կարաչանսկայա, Օրգանական քիմիա, դաս.տեքստ.,Մաս 2 «ՀՊՃՀ տպարան», Երևան, 1998, 187 էջ:
25. Գ.Հ. Թորոսյան, Ա.Հ. Չերքեզյան, Կ.Ծ.Թահմազյան, Օրգանական քիմիա, դաս.տեքստ.,Մաս 3 «ՀՊՃՀ տպարան», Երևան, 2003, 103 էջ: