ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ
ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
Քիմիական տեխնոլոգիաների և Բնապահպանական Ճարտարագիտության դեպարտամենտ
Տեսական քիմիայի սեկտոր
ֆ.Հ.Գրիգորյան
Ա.Շ.Գրիգորյան
Լուծույթներ, լուծույթների հատկություններ
Ուսումնական ձեռնարկ
Ե Ր Ե Վ Ա Ն 2004
ՀՏԴ 541(64)
Լուծույթներ, լուծույթների հատկություններ
Ուսումնական ձեռնարկ
Հայաստանի պետական ճարտարագիտական համալսարան: Երևան, 2003թ; 25 էջ:
Նախատեսված է քիմիատեխնոլոգիական և բնապահպանական ճարտարագիտության մասնագիտության ուսանողների, մագիստրանտների և ասպիրանտների համար:
Գրախոսներ՝ պրոֆեսոր Ռ.Միրզախանյան
պրոֆեսոր Հ.Մխիթարյան
Բովանդակություն
6.2. Լուծույթների ընդհանուր բնութագիրը
6.3. Լուծույթների բաղադրության և կոնցենտրացիաների արտահայտման եղանակները
6.7. Ոչ էլեկտրոլիտների նոսր լուծույթների կոլիգատիվ հատկությունները
6. ԼՈՒԾՈՒՅԹՆԵՐ
6.1 Դիսպերս համակարգեր
![]() Երկու կամ ավելի նյութերից
բաղկացած համակարգերը, որոնցում մեկ (կամ մի քանի) նյութը մանր մասնիկների ձևով
բաշխված է մի այլ նյութի մեջ, կոչվում են դիսպերս համակարգեր (ըստ լատ. dispersus
- ցրված): Այն նյութը, որը մանր մասնիկների ձևով բաշխված է մյուսի մեջ, կոչվում է
դիսպերս ֆազ, իսկ այն նյութը, որում բաշխված է ֆազը, կոչվում է դիսպերս միջավայր:
Երկու կամ ավելի նյութերից
բաղկացած համակարգերը, որոնցում մեկ (կամ մի քանի) նյութը մանր մասնիկների ձևով
բաշխված է մի այլ նյութի մեջ, կոչվում են դիսպերս համակարգեր (ըստ լատ. dispersus
- ցրված): Այն նյութը, որը մանր մասնիկների ձևով բաշխված է մյուսի մեջ, կոչվում է
դիսպերս ֆազ, իսկ այն նյութը, որում բաշխված է ֆազը, կոչվում է դիսպերս միջավայր:
Քանի որ նյութերի հիմնական ագրեգատային վիճակները երեքն են՝ պինդ (Պ), հեղուկ (Հ) և գազային (Գ), ապա հնարավոր դիսպերս համակարգերը ըստ ագրեգատային վիճակի կլինեն հետևյալ ինը տեսակի՝
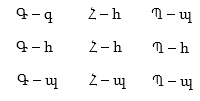
որտեղ մեծատառերով նշված է միջավայրը, իսկ փոքրատառերով՝ ֆազը:
Ըստ դիսպերս ֆազի գծային չափերի դիսպերս համակարգերը դասակարգվում են՝ կոպիտ դիսպերսիաներ կամ կախույթներ, կոլոիդ լուծույթներ և իսկական կամ մոլեկուլային լուծույթներ:
Կախույթներում դիսպերս ֆազի մասնիկների չափերը՝ δ>100նմ: Դրանց բնորոշ առանձնահատկությունը անկայունությունն է: Ժամանակի ընթացքում դիսպերս ֆազի մասնիկները կամ նստում են, կամ բարձրանում միջավայրի մակերեսին, կախված ֆազի և միջավայրի խտությունների հարաբերությունից: Եթե կախույթում դիսպերս ֆազը կազմըված է պինդ նյութի մասնիկներից, իսկ դիսպերս միջավայրը հեղուկ է, ապա կախույթը կոչվում է սուսպենզիա. օրինակ կավճի փոշին ջրի մեջ: Եթե դիսպերս ֆազը ևս հեղուկ է, բաշխված մի այլ հեղուկի մեջ (հետերոգենության պահպանումով), ապա կախույթը կոչվում է էմուլսիա, օրինակ կաթը, որտեղ յուղի փոքր մասնիկները բաշխված են ջրում:
Իսկական կամ մոլեկուլային լուծույթներում դիսպերս ֆազը մանրացված է մինչև առանձին մոլեկուլներ« ատոմներ կամ իոններ: Մասնիկների չափերը այս դեպքում՝ δ<1նմ –ից, օրինակ շաքար, աղի ջրային լուծույթները:
Կոլոիդ լուծույթներում դիսպերս ֆազի մասնիկների չափերը` 1<δ<100նմ է: Սրանք միջանկյալ դիրք են գրավում կախույթների և իսկական լուծույթների միջև: Այդպիսիք են օրինակ սոսնձի, ժելատինի լուծույթները: Եթե դիսպերս միջավայրը գազ է, իսկ ֆազը հեղուկ, կամ պինդ, ապա կոլոիդ համակարգը կոչվում է աերոզոլ, օրինակ մառախուղը կամ ծուխը համապատասխանաբար:
Մենք կուսումնասիրենք հեղուկ դիսպերս համակարգերը, դրանցից իսկական լուծույթները, մասնավորապես, երբ հեղուկ միջավայրը ջուրն է:
6.2. Լուծույթների ընդհանուր բնութագիրը
Լուծույթները համասեռ համակարգեր են, կազմված երկու կամ ավելի բաղադրամասերից, որոնց բաղադրությունը կարելի է փոխել որոշակի տիրույթում առանց համասեռությունը խախտելու: Յուրաքանչյուր լուծույթ կազմված է երկու տեսակի բաղադրամասերից՝ լուծիչ և լուծվող նյութ (նյութեր):
Լուծիչ կոչվում է այն բաղադրամասը, որն առանձին վերցրած ունի նույն ագրեգատային վիճակը, ինչ որ լուծույթը: Օրինակ, եթե շաքարը և ջուրը խառնվեն այնպիսի հարաբերությամբ, որ ստացված լուծույթը լինի հեղուկ«ապա լուծիչը ջուրն է, իսկ եթե շաքարի կտորի վրա մեկ, երկու կաթիլ ջուր է ավելացված« ապա ջուրն է դիսպերսված շաքարի մեջ: Եթե երկու բաղադրիչներն էլ ունեն նույն ագրեգատային վիճակը, ապա լուծիչն այն է, որը քանակով ավելի շատ է:
Իրենց համասեռությամբ և լուծման պրոցեսում դիտվող ջերմային երևույթների առկայությամբ լուծույթները նման են քիմիական միացություններին: Սակայն լուծույթներն ունեն իրենց բաղադրիչ մասերի հատկությունները և դրանց բաղադրությունը կարելի է փոխել լայն միջակայքում: Այս հատկանիշներով լուծույթները նման են խառնուրդներին: Ուստի լուծույթները միջանկյալ դիրք են գրավում խառնուրդների և քիմիական միացությունների միջև:
6.3. Լուծույթների բաղադրության և կոնցենտրացիաների արտահայտման եղանակները
Լուծույթների բաղադրութունը քանակապես կարելի է արտահայտել չափողականություն չունեցող բաժիններով (զանգվածային կամ մոլային), ինչպես նաև չափողական մեծություններով՝ կոնցենտրացիաներով: Դրանցից յուրաքանչյուրն ունի իր կիրառման հարմար դեպքը: Լուծույթների բաղադրութունն արտահայտվում է հետևյալ եղանակներով:
1. Զանգվածային բաժին` արտահայտված տոկոսներով (w): Այն ցույց է տալիս, թե լուծված A նյութի զանգվածը (mA) ամբողջ լուծույթի
Զանգվածի (mլ) որ տոկոսն է կազմում՝
![]()
այսինքն` ցույց է տալիս 100գ լուծույթում լուծված նյութի գրամների քանակը:

2. Ծավալային բաժին` արտահայտված տոկոսներով (φ) : Ցույց է տալիս լուծված նյութի ծավալը (VA ) ամբողջ լուծույթի ծավալի որ
տոկոսն է կազմում:
![]()
այսինքն 100 ծավալ լուծույթում լուծված նյութի ծավալը: Ծավալային բաժինը հատկապես օգտագործվում է գազերի կամ հեղուկների խառնուրդների բաղադրությունները որոշելիս:

3. Մոլային բաժին (N). Ցույց է տալիս լուծված նյութի մոլերի թվի (VA) հարաբերությունը լուծույթում եղած բոլոր նյութերի՝ լուծիչի (Vլ-չ) և լուծված նյութերի մոլերի թվերի գումարին՝

![]() Լուծույթի վիճակի
հիմնական
չափանիշը
նրա
կոնցենտրացիան է:
Լուծույթի վիճակի
հիմնական
չափանիշը
նրա
կոնցենտրացիան է:
Լուծույթի կոնցենտրացիան լուծված նյութի քանակն է լուծույթի կամ լուծիչի որոշակի ծավալում կամ զանգվածում:
Որակապես կոնցենտրացիան արտահայտվում է երկու ձևով, խիտ լուծույթներ, երբ լուծված նյութի քանակը համեմատելի է լուծիչի քանակի հետ և նոսր՝ երբ լուծված նյութի քանակը զգալիորեն փոքր է լուծիչի քանակից:
Կան լուծույթների կոնցենտրացիաների արտահայտման բազմաթիվ քանակական եղանակներ:
1. Մոլային կոնցենտրացիա Cմ: Ցույց է տալիս լուծված նյութի (A) մոլերի թվի (VA) հարաբերությունը լուծույթի ծավալին (Vլ), այսինքն 1լ լուծույթում լուծված նյութի մոլերի թիվը:
![]()
Քանի որ լուծված նյութի մոլերի թիվը` VA = mA / MA, ապա
![]()
Մոլային կոնցենտրացիան օգտագործվում է այն դեպքերում, երբ անհրաժեշտ է իմանալ լուծույթի ցանկացած ծավալում լուծված նյութի մասնիկների (մոլերի) թիվը:
2. Նորմալ կոնցենտրացիա Cն: Ցույց է տալիս լուծված նյութի համարժեքների թվի (VA = mA /эА) հարաբերությունը լուծույթի ծավալին (Vլ), այսինքն 1լ լուծույթում:
![]()

Նորմալ կոնցենտրացիան հարմար է օգտագործել այն դեպքերում, երբ լուծված նյութերը պետք է փոխազդեն իրար հետ: Միատեսակ նորմալ կոնցենտրացիա ունեցող տարբեր լուծույթների հավասար ծավալներում կպարունակվեն հավասար համարժեքներ, իսկ նյութերը իրար հետ փոխազդում են իրենց համարժեքներին համեմատական քանակներով: Հետևաբար V1Cն1=V2Cն2, որտեղ V1 և V2 լուծույթների փոխազդած ծավալներն են:
3. Մոլալ կոնցենտրացիա Cm: Ցույց է տալիս 1000գ լուծիչում լուծված նյութի մոլերի թիվը:

![]()

Մոլալ կոնցենտրացիան օգտագործվում է այն դեպքերում, երբ չափվում են լուծույթի այնպիսի հատկություններ, որոնք ուղեկցվում են նրա ջերմաստիճանի փոփոխությամբ, քանի որ լուծույթի ծավալը ջերմաստիճանից կախված է, իսկ զանգվածը`ոչ:

6.4. Լուծման պրոցեսը
Լուծման պրոցեսը ընթանում է երկու փուլերով.
1. Լուծիչի մոլեկուլների ազդեցության տակ լուծվող նյութի բյուրեղային ցանցը կամ մոլեկուլների միջև կապերը քայքայվում են: Այդ պրոցեսը ընթանում է ջերմության կլանումով ΔH1>0: Այդ քայքայումը հնարավոր է այն դեպքերում, երբ ձգողության ուժերը լուծվող նյութի և լուծիչի մասնիկների միջև համաչափելի են լուծվող նյութի մասնիկների միջև եղած ձգողության ուժերին: Այդ դեպքում տեղի է ունենում ֆազային անցում` ΔH1=ΔH որտեղ ΔHֆ-ն ֆազային անցման ջերմությունն է:
2. Լուծվող նյութի մասնիկների փոխազդեցությունը լուծիչի մոլեկուլների հետ` սոլվատացում (ջրի դեպքում հիդրատացում) և այս դեպքում էներգիա անջատվում է ΔHս<0:
Oրինակ`
![]()
ընդհանուր լուծման ջերմությունը`
![]()
![]()
Ջերմության այն քանակությունը, որը կլանվում կամ անջատվում է 1 մոլ նյութ լուծելիս, կոչվում է լուծման ջերմություն:
Կախված այն բանից, թե լուծման ջերմության բաղադրիչներից որն է բացարձակ արժեքով ավելի մեծ, այն կարող է լինել ինչպես դրական, այնպես էլ բացասական:
Օրինակ ծծմբական թթվի լուծման դեպքում` ΔHս-ն շատ ավելի մեծ է ΔHֆ-ից, ուստի դիտվում է տաքացում`ΔH< 0, իսկ բյուրեղային նյու թերի, օրինակ NaCl–ի լուծման դեպքում, հակառակն է, բյուրեղային ցանցի քայքայման ΔHֆ< 0 և չնայած` ΔHս< 0, բայց ΔHֆ >> |ΔHս | և ΔH> 0, դիտվում է սառեցում:
Էնտրոպիայի
փոփոխությունը լուծման
պրոցեսում ևս
հավասար է
ֆազային անցման
և սոլվատացման
էնտրոպիաների փոփոխությունների
գումարին` ![]()
Բյուրեղային նյութերի լուծման դեպքում բյուրեղի հանգույցներում կանոնավոր դասավորված մասնիկները լուծման հետևանքով անցնում են խիստ անկարգավորված վիճակի: ՈՒստի էնտրոպիան խիստ մեծանում է` ΔS >> 0: Այդ պատճառով, չնայած պինդ բյուրեղային նյութերի մեծ մասի լուծման դեպքում ΔH> 0, TΔS շատ մեծ է ΔH-ից և ΔG-ն (ΔG = ΔH - TΔS) ստացվում է փոքր զրոյից, ուստի լուծման պրոցեսը ընթանում է ինքնաբերաբար:
Գազերի լուծման դեպքում ΔH< 0` լուծման պրոցեսը ընթանում է ջերմության անջատումով, դիտվում նաև է ծավալի կրճատում և ΔS< 0:
Լուծումը ինքնաբերաբար ընթացող պրոցես է (ΔG < 0): Լուծման զուգահեռ ընթանում է նաև հակառակ պրոցեսը` և համակարգը հասնում է հավասարակշռության` ΔG = 0: Լուծույթը դառնում է հագեցած:
![]()
![]()
Հագեցած կոչվում են այն լուծույթները, որոնք շարժուն հավասարակըշռության մեջ են գտնվում լուծվող նյութի ավելցուկի հետ:
![]() 6.5.Լուծելիություն
6.5.Լուծելիություն
Նյութի` այս կամ այն լուծիչի մեջ լուծվելու ընդունակությունը կոչվում է լուծելիություն:
Նյութի լուծելիության չափանիշը տվյալ պայմաններում նրա հագեցած լուծույթի կոնցենտրացիան է: Լուծելիությունը կարելի է արտահայտել նույն եղանակներով, ինչ լուծույթի բաղադրությունը:
Մեծ մասամբ լուծելիությունը արտահայտում են լուծելիության գործակցով, դա տվյալ պայմաններում 100գ լուծիչում հագեցած վիճակում լուծված նյութի գրամների քանակն է հագեցած վիճակում:
Լուծելիությունը կախված է լուծվող նյութի և լուծիչի բնույթից, ջերմաստիճանից, իսկ գազերի լուծման դեպքում նաև ճնշումից և կարող է փոխվել լայն միջակայքում:
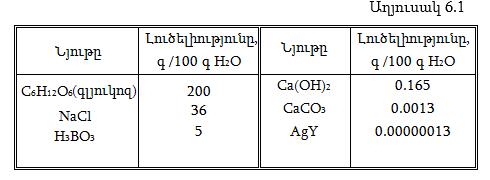
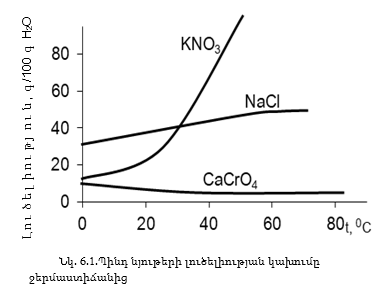
Պինդ նյութերի լուծելիությունը կախված է ջերմաստիճանից: Դրանց մեծ մասի լուծելիությունը ջերմաստիճանի բարձրացումից մեծանում է: Լուծելիության կախումը ջերմաստիճանից հարմար է արտահայտել լուծելիության կորերով (նկ. 6.1):
Քանի որ լուծման պրոցեսը դարձելի է և հասնում է հավասարակշռությանը, ապա համաձայն Լե Շատելյեի սկզբունքի, այն նյութերի, որոնց լուծման պրոցեսը ջերմակլանիչ է` ΔH>0, ջերմաստիճանի բարձրացումից հավասարակշռությունը տեղաշարժվում է դեպի ջերմակլանիչ կողմը, և լուծելիությունը մեծանում է, օրինակ KNO3–ի լուծման դեպքում (նկ. 6.1): Ջերմաստիճանի բարձրացումից NaCl-ի լուծելիությունը քիչ է մեծանում, որովհետև նրա լուծման ջերմությունը (ΔH>0) մեծ չէ: Կալցիումի քրոմատի լուծելիությունը ջերմաստիճանի բարձրացումից փոքրանում է, քանի որ նրա լուծման պրոցեսը ջերմանջատիչ է` ΔH< 0:
1. Անսահմանափակ լուծելիություն, երբ հեղուկները լուծվում են իրար մեջ բոլոր հարաբերություններով, օրինակ ջուրը և էթիլ սպիրտը
2. Սահմանափակ լուծելիություն, եթե հեղուկները իրար մեջ լուծվում են որոշակի հարաբերությամբ, օրինակ անիլինը և ջուրը:
3. Գործնականորեն անլուծելի, երբ հեղուկները գործնականորեն իրար մեջ չեն լուծվում, օրինակ բենզոլը և ջուրը:
Ջերմաստիճանի բարձրացումից հեղուկների փոխադարձ լուծելիությունը մեծ մասամբ աճում է, քանի որ այդ պրոցեսը հիմնականում ջերմակլանիչ է: Այդ պատճառով ջերմաստիճանի բարձրացումից հեղուկների փոխադարձ լուծելիությունը մեծանում է, և որոշ ջերմաստիճանից բարձր սահմանափակ լուծելիությունը վեր է ածվում անսահմանափակի: Հեղուկների սահմանափակ լուծելիություն նկատվում է, օրինակ ջրի և անիլինի խառնման ժամանակ (նկ. 6.3): Նկարում բերված կորը բաժանում է համակարգի համասեռ և անհամասեռ մասերը: Նրբագծված մասը հեղուկների շերտավորման մարսն է:
Գծագրից երևում է, որ 1600C-ում անիլինի 50%-անոց ջրային լուծույթը շերտավորվում է երկու փոխադարձաբար հագեցած լուծույթների (C և D)` անիլինը ջրում և ջուրը անիլինում: K կետին համապատասխանում է կրիտիկական ջերմաստիճանը, որից բարձր երկու հեղուկներն ունեն անսահմանափակ լուծելիություն: Փոխադարձ լուծելիության մեծացումը ջերմաստիճանի բարձրացումից տվյալ դեպքում հետևանք է այն բանի, որ պրոցեսը ջերմակլանիչ է:

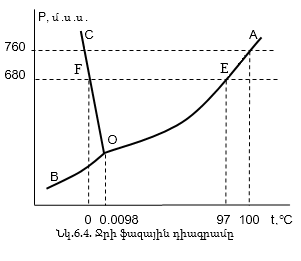
Հավասարակշռության պահին հեղուկի վրա եղած գոլորշիները կոչվում են հագեցած գոլորշիներ, իսկ նրանց առաջացրած ճնշումը` հագեցած գոլորշիների ճնշում:
Ջերմաստիճանը բարձրացնելիս ըստ Լե Շատելյեի սկզբունքի հավասարակշռությունը կտեղաշարժվի գոլորշիացման կողմը և գոլորշիների ճնշումը կմեծանա: Դա արտահայվում է OA կորով, հետևաբար OA-ն արտահայտում է հավասարակշռությունը հեղուկ և գոլորշի ֆազերի միջև և կոչվում է եռման կոր: OB կորը բաժանում է սառույց և գոլորշի մարզերը, և ցույց է տալիս սառույցի վրա հագեցած գոլորշիների ճնշման կախումը ջերմաստիճանից և կոչվում է սուբլիմացման կոր: OC կորը ցույց է տալիս հավասարակշռությունը սառույց և հեղուկ ֆազերի միջև և կոչվում է հալման կոր: O կետը կոչվում է եռակի կետ: Այդ պայմաններում` 0.00980C և 4.6մմ.ս.ս. երեք ագրեգատային վիճակներն էլ միաժամանակ առկա են: Հեղուկի եռման ջերմաստիճան կոչվում է այն ջերմաստիճանը, որի դեպքում նրա վրա հագեցած գոլորշիների ճնշումը հավասարվում է արտաքին ճնշմանը: E կետը հեղուկի եռման կետն է 1մթ ճնշման դեպքում` 1000C: Երևանում ճնշումը 680մմ.ս.ս. է, եռման ջերմաստիճանը 970C:
Հեղուկի կարծրացման ջերմաստիճան կոչվում է այն ջերմաստիճանը, որի դեպքում նրա վրա հագեցած գոլորշիների ճնշումը հավասարվում է կարծր ֆազի վրա եղած գոլորշիների ճնշմանը: F կետում ունենք սառույց P = 760մմ.ս.ս. դեպքում: OC կորի թեքությունից երևում է, որ ջրի հալման ջերմաստիճանը նվազում է ճնշման մեծացման դեպքում: Դա ջրի առանձնահատկություններից մեկն է: Ընդհանրապես մնացած համարա բոլոր նյութերի դեպքում OC կորը գտնվում է ավելի վեր և աջ:
6.7. Ոչ էլեկտրոլիտների նոսր լուծույթների կոլիգատիվ հատկությունները
Լուծույթների կոլիգատիվ հատկություններ կոչվում են այն հատկությունները, որոնք կախված են միայն լուծված նյութի մասնիկների թվից և կախված չեն լուծվող նյութի բաղադրությունից կամ տեսակից: Այդ հատկությունները ավելի պարզ են արտահայտվում և քանակապես ավելի պարզ հավասարումներով են բնութագրվում նոսր լուծույթների համար, որովհետև այդպիսի լուծույթներում լուծված նյութի մասնիկները գտնվում են իրարից մեծ հեռավորության վրա, նրանց փոխադարձ ազդեցությունը կարելի է բացառել, և լուծիչը գործնականորեն չի փոխում իր հատկությունները: Կդիտարկենք այնպիսի լուծույթները, որոնցից ջերմաստիճանի փոփոխման դեպքում անջատվում է (գոլորշիանում կամ բյուրեղանում) միայն լուծիչը:
Լուծույթների կոլիգատիվ հատկություններն են` 1) լուծույթի վրա լուծիչի հագեցած գոլորշիների ճնշման անկումը, 2) եռման ջերմաստիճանի բարձրացումը, 3) կարծրացման ջերմաստիճանի իջեցումը, 4) օսմոտիկ ճնշումը:
1. Լուծույթի վրա լուծիչի հագեցած գոլորշիների ճնշումը: Ենթադրենք որոշակի ջերմաստիճանում հեղուկը հավասարակշռության մեջ է գտնվում իր գոլորշիների հետ: Եթե հեղուկում լուծենք չցնդող նյութ (օրինակ ջրում շաքար) լուծույթում լուծիչի կոնցենտրացիան կպակասի:
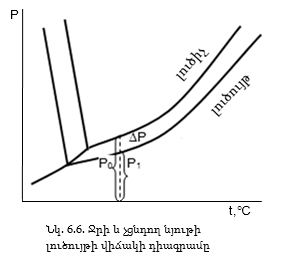
Հավասարակշռությունը ըստ Լե Շատելյեի սկզբունքի կխախտվի և կտեղաշարժվի դեպի գոլորշու կոնդենսացման կողմը և գոլորշիների ճնշումը կփոքրանա: Դա տեղի կունենա ցանկացած ջերմաստիճանում: Այսպիսով լուծույթի վրա գոլորշիների P1 ճնշումը ավելի փոքր է, քան մաքուր լուծիչի վրա P0 ճնշումը (նկ. 6.6): Որքան մեծ լինի լուծույթի կոնցենտրացիան գոլորշիների ճնշման անկումը կլինի այնքան մեծ: Գոլորշիների ճնշման բացարձակ անկումը` ΔP = P0 - P1: ΔP/P0-կլինի գոլորշիների ճնշման հարաբերական անկումը: Այդ անկումը հավասար է լուծված նյութի մոլային բաժնին: Այս օրինաչափությունը կոչվում է Ռաուլի օրենք (1886 թ): Օրենքը ճիշտ է նոսր լուծույթների դեպքում:
![]() Լուծույթի
վրա լուծիչի հագեցած գոլորշիների ճնշման հարաբերական անկումը հավասար է լուծված
նյութի մոլային բաժնին:
Լուծույթի
վրա լուծիչի հագեցած գոլորշիների ճնշման հարաբերական անկումը հավասար է լուծված
նյութի մոլային բաժնին:
![]()
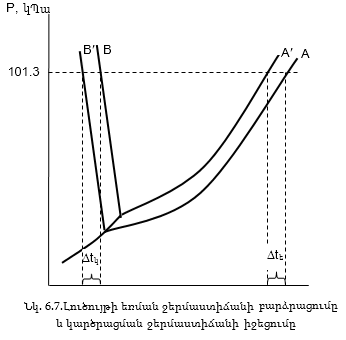
Ռաուլի օրենքից ստացվում են երկու հետևություններ.
I հետևություն: Ինչպես արդեն ասվել է, լուծույթը եռում է այն ջերմաստիճանում, երբ հագեցած գոլորշիների ճնշումը հավասարվում է արտաքին ճնշմանը: Քանի որ լուծույթի վրա հագեցած գոլորշիների ճնշումը ավելի փոքր է, քան լուծիչի վրա, լուծիչի եռման ջերմաստիճանում լուծույթը չի եռա: Այն պետք է ավելի տաքացնել, որպեսզի գոլորշիների ճնշումը հասնի արտաքին ճնշմանը (նկ.6.7), ընդ որում, որքան մեծ լինի լուծույթի կոնցենտրացիան, այնքան եռման ջերմաստիճանի այս բարձրացումը կլինի ավելի մեծ:
![]() Հետևաբար`
Հետևաբար`
Լուծույթը եռում է ավելի բարձր ջերմաստիճանում, քան լուծիչը: Եռման ջերմաստիճանի բարձրացումը ուղիղ համեմատական է լուծույթի կոնցենտրացիային:
Այսինքն`
![]()
Այս օրինաչափությունը ճիշտ է նոսր լուծույթների դեպքում:
Համեմատականության Kէբ հաստատունը կոչվում է էբուլիոսկոպիկ հաստատուն (ebullire` եռում): Այս դեպքում կոնցենտրացիան արտահայտվում է մոլալությամբ, քանի որ մոլալ կոնցենտրացիան արտահայտում է լուծված նյութի մոլերի թիվը 1000գ լուծիչում, իսկ լուծիչի զանգվածը ջերմաստիճանից կախված չէ: Բանաձևից երևում է, որ եթե Cm = 1, ապա Kէբ = Δtեռ: Հետևաբար, որոշակի մոտավորությամբ կարելի է ասել, որ`
![]() Էբուլիոսկոպիկ
հաստատունը հավասար է այնպիսի լուծույթի եռման ջերմաստիճանի բարձրացմանը, որի
1000գ լուծիչում լուծված է 1 մոլ նյութ:
Էբուլիոսկոպիկ
հաստատունը հավասար է այնպիսի լուծույթի եռման ջերմաստիճանի բարձրացմանը, որի
1000գ լուծիչում լուծված է 1 մոլ նյութ:
![]()
II հետևություն: Նկ.6.7-ից երևում է, որ եթե ջուրը 1մթն. ճնշման տակ կարծրանում է մոտ 00C–ում (կետ B),ապա լուծույթը կկարծրանա ավելի ցածր ջերմաստիճանում (կետ B¢):
Հետևաբար.
Որոշակի մոտավորությամբ `
![]()
![]() Համեմատականության
Kկր հաստատունը հավասար է այնպիսի լուծույթի կարծրացման ջերմաստիճանի
իջեցմանը, որի 1000գ լուծիչում լուծված է 1 մոլ նյութ:
Համեմատականության
Kկր հաստատունը հավասար է այնպիսի լուծույթի կարծրացման ջերմաստիճանի
իջեցմանը, որի 1000գ լուծիչում լուծված է 1 մոլ նյութ:
Ջրի համար Kկր = 1.860C, բենզոլի համար` 5.120C/մոլ:
Եթե mB գրամ լուծիչում լուծված է mA գրամ նյութ, ապա (1) և (2) բանաձևերում տեղադրելով C-ի արժեքը`

![]()
կստացվի ընդհանուր տեսքով
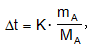
վերահաշվելով 1000գ լուծիչի համար կստացվի որ եռման ջերմաստիճանի բարձրացման դեպքում
![]()
իսկ կարծրացման ջերմաստիճանի իջեցման դեպքում`
![]()
Այս բանաձևերից ելնելով լուծույթների եռման և կարծրացման ջերմաստիճանների չափման հիման վրա կարելի է հաշվել լուծված նյութի մոլեկուլային զանգվածը (MA): Այս մեթոդները համապատասխանաբար կոչվում են էբուլիոսկոպիկ և կրիոսկոպիկ եղանակներ:

2. Օսմոտիկ Ճնշում
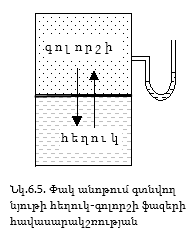
Եթե շաքարի կոնցենտրիկ լուծույթի վրա զգուշորեն անոթի պատի վրայով ավելացվի ջուր, ապա ժամանակի ընթացքում ջրի մոլեկուլները կթափանցեն շաքարի լուծույթի մեջ, իսկ շաքարի մոլեկուլները ջրի մեջ, և այդ երկկողմանի դիֆուզիայի շնորհիվ որոշ ժամանակ հետո կոնցենտրացիաները կհավասարվեն: Եթե ջուրը և լուծույթը իրարից բաժանվեն կիսաթափանցիկ թաղանթով` դրանք միջնորմներ են, որոնք բաց են թողնում միայն ջրի (լուծիչի) մոլեկուլները (կենդանական թաղանթներ, խեցիներ) ապա տեղի է ունենում միակողմանի դիֆուզիա:
Նկ.6.8 –ում գլանի մեջ լցված է շաքարի C1 կոնցենտրացիայի լուծույթ, հատակը փակված է կիսաթափանցիկ թաղանթով և իջեցվում է ջրով լի անոթի մեջ: Ջրի և լուծույթի սկզբնական մակարդակները հավասար են: Քանի որ ջրի կոնցենտրացիան շաքարի լուծույթում ավելի փոքր է, քան մաքուր ջրում, ջրի մոլեկուլները անոթից կիսաթափանցիկ թաղանթի միջով կանցնեն լուծույթի մեջ: Լուծույթում եղած ջրի մոլեկուլները ևս կարող են դուրս գալ թաղանթի միջով, սակայն դրանց թիվը փոքր կլինի լուծույթի մեջ մտնող մոլեկուլների թվից: Դրա հետևանքով գլանի մեջ լուծույթի ծավալը կմեծանա, և մակարդակը կբարձրանա:
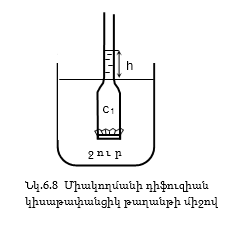
Թաղանթի վրա կառաջանա դեպի ներքև ուղղված ավելցուկային ճնշում (h), որը կմեծացնի դուրս եկող և կփոքրացնի ներս մտնող ջրի մոլեկուլների թիվը: h-ի որոշակի արժեքի դեպքում դրանք կհավասարվեն, և կհաստատվի հավասարակշռություն: Այսպիսի միակողմանի այդ դիֆուզիան կիսաթափանցիկ թաղանթի միջով կոչվում է օսմոս, իսկ առաջացած ավելցուկային ճնշումը, որը օսմոսը բերում է հավասարակշռությանը` օսմոտիկ ճնշում:
Օսմոտիկ շնշման մեծությունը կախված է լուծույթի կոնցենտրացիայից և նրա ջերմաստիճանից: Այն կախված չէ ոչ լուծված նյութի, և ոչ էլ լուծիչի բնույթից: Փորձերը ցույց են տվել (Վանթ-Հոֆֆ, 1886), որ օսմոտիկ ճնշումը արտահայտվում է
![]()
որտեղ C–ն` մոլային կոնցենտրացիան է, R-ը` ունիվերսալ գազային հաստատունը, T-ն` բացարձակ ջերմաստիճանը: Քանի որ C = v / V, իսկ v = mA / MA, ապա
![]()
Ստացված հավասարումը նման է իդեալական գազերի վիճակի հավասարմանը: Այստեղից եզրակացվել է, որ
![]() Օսմոտիկ ճնշումը հավասար է այն
ճնշմանը, որը կառաջացներ լուծված նյութը, եթե այն գտնվեր գազային վիճակում և նույն
ջերմաստիճանում գրավեր լուծույթի ծավալին հավասար ծավալ:
Օսմոտիկ ճնշումը հավասար է այն
ճնշմանը, որը կառաջացներ լուծված նյութը, եթե այն գտնվեր գազային վիճակում և նույն
ջերմաստիճանում գրավեր լուծույթի ծավալին հավասար ծավալ:
Եթե երկու լուծույթներն ունեն նույն օսմոտիկ ճնշումը, դրանք կոչվում են իզոտոնիկ լուծույթներ, ցածր օսմոտիկ ճնշում ունեցողին` հիպոտոնիկ, բարձրին` հիպերտոնիկ լուծույթներ:
Օգտվելով oսմոտիկ ճնշման բանաձևից` կարելի է չափելով օսմոտիկ ճնշումը, հաշվել լուծված նյութի մոլային (մոլեկուլային) զանգվածը կամ նրա կոնցենտրացիան:

Օսմոսի երևույթը կարևոր նշանակություն ունի բնության մեջ: Բույսերի բջջաթաղանթները կիսաթափանցիկ են, և առաջացած օսմոտիկ ճնշման շնորհիվ է, որ ջուրը բարձրանում է բույսերի ցողունների միջով ու սնուցում: Կիսաթափանցիկ են նաև կենդանական թաղանթները: Տեխնիկայում օգտագործում են հակադարձ օսմոսի երևույթը: Այդ դեպքում լուծույթի վրա ազդում են իր օսմոտիկ ճնշումից ավելի բարձր ճնշումով, որի հետևանքով կիսաթափանցիկ թաղանթի միջող արտամղվում է լուծիչը: Այս եղանակը օգտագործում են կեղտաջրերը մաքրելու համար:
Ամփոփում: Լուծույթները համասեռ համակարգեր են կազմված լուծիչից և լուծվող նյութից: Դրանց հարաբերական քանակները լուծույթում կարող են արտահայտվել որակապես (նոսր և կոնցենտրիկ լուծույթներ) և քանակապես (զանգվածային տոկոսներ, մոլյարությամբ, նորմալությամբ, մոլային բաժնով, մոլալությամբ): Նյութի լուծումը տվյալ լուծիչում որոշվում է լուծվող նյութ լուծվող նյութ, լուծիչ լուծիչ, լուծվող նյութ լուծիչ փոխազդեցության ուժերով: Պինդ նյութերի մեծ մասի լուծելիությունը ջերմաստիճանի բարձրացումից մեծանում, իսկ գազերի լուծելիությունը` հիմնականում փոքրանում է: Լուծվող նյութի ներկայությունը լուծիչում իջեցնում է լուծիչի գոլորշիների ճնշումը, կարծրացման ջերմաստիճանը և բարձրացնում եռման ջերմաստիճանը:
Լուծույթի օսմոտիկ ճնշումը այն ճնշումն է, որը պետք է ազդել լուծույթի վրա, հավասարակշռության հասցնելու լուծիչի մոլեկուլների անցումը լուծիչից լուծույթի մեջ կիսաթափանցիկ թաղանթի միջով: Այս հատկությունները կոչվում են կոլիգատիվ հատկություններ: Դրանց միջոցով կարելի է որոշել չցնդող ոչ էլեկտրոլիտների մոլեկուլային կշիռները:
Սովորելու նպատակը: Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1. Տարբերել լուծույթների բաղադրության և կոնցենտրացիաների արտահայտման զանգվածային բաժին, մոլային բաժին, մոլայնություն, նորմալություն, մոլալություն եղանակները, հաշվել լուծույթների կոնցենտրացիան այս եղանակներով և վերահաշվել մեկը մյուսին:
2. Տալ նոսր, կոնցենտրիկ, հագեցած, չհագեցած, գերհագեցած լուծույթներ որակական հասկացությունների ձևակերպումները:
3. Իմանալ լուծույթների բաղադրության և կոնցենտրացիաների արտահայտման քանակական եղանակները, դրանց հաշվումը:
4. Նկարագրել լուծման պրոցեսի մեխանիզմը:
5. Բացատրել լուծման պրոցեսում տեղի ունեցող էներգետիկ երևույթները:
6. Բացատրել անկարգավորվածության մեծացման նշանակությունը լուծման պրոցեսում:
7. Նկարագրել նյութերի լուծելիությունը տարբեր լուծիչներում` կախված նրանց մոլեկուլային կառուցվածքից և միջմոլեկուլային ուժերից:
8. Քննարկել ճնշման և ջերմաստիճանի ազդեցությունը գազերի լուծելիության վրա:
9. Բացատրել լուծույթի կոնցենտրացիայի ազդեցությունը լուծիչի գոլորշիների վրա և Ռաուլի օրենքը:
10. Բացատրել լուծույթների կոլիգատիվ հատկությունները` եռման ջերմաստիճանի բարձրացումը, կարծրացման ջերմաստիճանի իջեցումը, օսմոտիկ ճնշումը:
11. Որոշել լուծված նյութի մոլեկուլային զանգվածը` օգտվելով կոլիգատիվ հատկություններից:
Հիմնական հասկացությունները:
Լուծիչ կոչվում է այն նյութը, որն առանձին վերցրած ունի նույն ագրեգատային վիճակը, ինչ որ լուծույթը:
Զանգվածային բաժին տոկոսներով. ցույց է տալիս 100 գ լուծույթում լուծված նյութի գրամների քանակը:
Մոլային կոնցենտրացիա. ցույց է տալիս 1 լիտր լուծույթում լուծված նյութի մոլերի թիվը:
Նորմալ կոնցենտրացիա. ցույց է տալիս 1 լիտր լուծույթում լուծված նյութի համարժեքների թիվը:
Սոլվատացում. լուծված մասնիկների փոխազդեցությունն է լուծիչի մոլեկուլների հետ: Երբ լուծիչը ջուրն է, այն կոչվում է հիդրատացում:
Հագեցած լուծույթ կոչվում է այն լուծույթը, որը շարժուն հավասարակըշռության մեջ է գտնվում լուծված նյութի ավելցուկի հետ: Այն լուծույթները, որոնք պարունակում են ավելի քիչ լուծված նյութ, քան հագեցած վիճակում, կոչվում են չհագեցած: Հագեցածից ավելի շատ լուծված նյութ պարունակողները կոչվում են գերհագեցած:
Ռաուլի օրենք նոսր լուծույթի վրա լուծիչի գոլորշիների ճնշման հարաբերական իջեցումը (ΔP/P) hավասար է լուծված նյութի մոլային բաժնին`
![]()
I հետևություն օրենքից: Լուծույթը եռում է ավելի բարձր ջերմաստիճանում, քան լուծիչը: Եռման ջերմաստիճանի բարձրացումը ուղիղ համեմատական է նոսր լուծույթի կոնցենտրացիային, Δtեռ = Kէբ · Cm:
II հետևություն օրենքից: Լուծույթը կարծրանում է ավելի ցածր ջերմաստիճանում, քան լուծիչը: Կարծրացման ջերմաստիճանի իջեցումը ուղիղ համեմատական է նոսր լուծույթի կոնցենտրացիային, Δtկրծ = Kկր · Cm:
Օսմոս - միակողմանի դիֆուզիա կիսաթափանցիկ թաղանթի միջով:
Օսմոտիկ ճնշում կոչվում է այն ավելցուկային ճնշումը, որը օսմոսը բերում է հավասարակշռային վիճակի P = 1000CRT: Հավասարակշռային է այն ճնշումը, որն առաջացնում է լուծված նյութը, եթե գտնվի գազային վիճակում և գրավի լուծույթի ծավալին հավասար ծավալ:
1. М.Х.Карапетянц, С.И. Даркин // Общая и неорганическая химия. Москва, Химия,1981.
2. Ն.Ա.Գլինկա // Ընդհանուր քիմիա Երևան, Լույս, 1979:
3. М.Фриментл // Химия в действии, м. 12, Москва, Мир, 1961.
4. Խմբ. Գ.Ա.Դիմիտրևի //Քիմիայի դասընթաց, հատ.1, 2 Երևան, Լույս, 1979:
5. L.Pauling // General Chemistry, W.H. Freeman and Company San Francisco, 1972.
6. T.L.Brown, H.E.LeMay // Chemistry , Englewood Cliffs , New Gersey, 1977.
Ֆրիդրիխ Գրիգորյան
Արմեն Գրիգորյան
Լուծույթներ, լուծույթների հատկություններ
Ուսումնական ձեռնարկ
Խմբագիր Ն.Խաչատրյան