ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ
ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
Քիմիական տեխնոլոգիաներ
և բնապահպանական ճարտա-
րագիտության դեպարտամենտ
Տեսական քիմիայի սեկտոր
Ֆրիդրիխ Գրիգորյան
Արմեն Գրիգորյան
Էլեկտրոլիտների լուծույթներ
Ուսումնական ձեռնարկ
Ե Ր Ե Վ Ա Ն 2004
ՀՏԴ 541(64)
Էլեկտրոլիտների լուծույթներ
Մեթոդական ցուցումներ
Հայաստանի պետական ճարտարագիտական համալսարան: Երևան, 2003թ; 28 էջ:
Նախատեսված է քիմիա-տեխնոլոգիական և բնապահպանական ճարտարագիտության մասնագիտության ուսանողների, մագիստրանտների և ասպիրանտների համար:
Գրախոսներ՝ պրոֆեսոր Ռ.Միրզախանյան
պրոֆեսոր Հ.Մխիթարյան
Բովանդակություն
7.1.Էլեկտրոլիտներ և ոչ էլեկտրոլիտներ
7.2. Էլեկտրոլիտիկ դիսոցման տեսություն
7.4.Էլեկտրոլիտների դիսոցման վրա ազդող գործոնները
7.6. Էլեկտրոլիտների էլեկտրահաղորդականությունը
7.7. ՈՒժեղ էլեկտրոլիտների դիսոցումը
7.8. Թթուները, հիմքերը և աղերը էլեկտրոլիտիկ դիսոցման տեսանկյունից
7.9. Ջրի դիսոցումը: Ջրածնական ցուցիչ
7.11. Իոնափոխանակման ռեակցիաներ
7. ԷԼԵԿՏՐՈԼԻՏՆԵՐԻ ԼՈՒԾՈՒՅԹՆԵՐ
7.1. Էլեկտրոլիտներ և ոչ էլեկտրոլիտներ
Հայտնի է, որ շատ նյութեր (աղեր, թթուներ, հիմքեր) լուծված կամ հալված վիճակում էլեկտրահաղորդիչ են: Միաժամանակ այդ նյութերի կոլիգատիվ հատկությունները (գոլորշիների ճնշման իջեցումը, եռման ջերմաստիճանի բարձրացումը, կարծրացման ջերմաստիճանի իջեցումը, օսմոտիկ ճնշումը) շեղվում են Ռաուլի և Վանթ-Հոֆֆի օրենքներից: Այդ մեծությունները փորձնականորեն ստացվում են ավելի մեծ, քան պետք է լինեին ըստ այդ օրենքների: Ընդ որում նշված բոլոր մեծությունները տվյալ լուծույթի համար նույն թվով (i) անգամ են մեծ ստացվում: Եթե նշանակենք փորձնականորեն չափված մեծությունները համապատասխանաբար ∆P՛, ∆t՛եռմ, ∆t՛կրծ, P՛, իսկ տեսականորեն հաշվածները` առանց շտրիխի,ապա
![]()
i գործակիցը կոչվում է իզոտոնիկ գործակից և նոսր լուծույթների համար ընդհանրապես ունենում է պարզ ամբողջ թվերին մոտ արժեքներ: Լուծույթների կոլիգատիվ հատկությունները կախված են լուծված մասնիկների թվից և քանի որ այդ նյութերի համար փորձնականորեն մեծ են ստացվում, նշանակում է դրանց լուծման ժամանակ ինչ-որ պատճառով մասնիկների թիվը մեծանում է: Մյուս կողմից այդ նյութերի լուծույթները հաղորդում են էլեկտրական հոսանք: Ելնելով այս երկու փաստերից Արրենիուսը 1887 թվին ենթադրեց, որ այդ նյութերը ջրում լուծելիս նրանց մոլեկուլները տրոհվում են` դիսոցվում են` վերածվելով լիցքավորված մասնիկների` իոնների: Մասնիկների թիվը աճում է, ուստի և կոլիգատիվ հատկությունները մեծանում են, միաժամանակ լիցքավորված մասնիկների առաջացման հետևանքով լուծույթը ստանում է հաղորդականություն: Այդպիսի նյութերը կոչվեցին էլեկտրոլիտներ:
![]() Այն
նյութերը,
որոնք
լուծվելիս
կամ հալվելիս
դիսոցվում են
իոնների և այդ
պատճառով
դառնում են
էլեկտրահաղորդիչ,
կոչվում են էլեկտրոլիտներ:
Այն
նյութերը,
որոնք
լուծվելիս
կամ հալվելիս
դիսոցվում են
իոնների և այդ
պատճառով
դառնում են
էլեկտրահաղորդիչ,
կոչվում են էլեկտրոլիտներ:
Հետևաբար իզոտոնիկ գործակիցը ցույց է տալիս, թե դիսոցման հետևանքով քանի անգամ է աճում մասնիկների թիվը
![]()
որտեղ N-ը լուծված մասնիկների թիվն է, Nընդ-ը դիսոցումից հետո մասնիկների ընդհանուր թիվն է (իոններ գումարած մոլեկուլներ): Մտցնելով իզոտոնիկ գործակիցը Վանտ-Հոֆի և Ռաուլի բանաձևերի մեջ` վերջիններս դառնում են կիրառելի էլեկտրոլիտների համար:

Բնորոշ էլեկտրոլիտներ են, օրինակ, լուծելի աղերը, H2SO4-ը, HCl-ը, լուծելի հիմքերը (բացառությամբ NH4OH-ի):
Այն նյութերը, որոնք լուծվելիս կամ կամ հալվելիս չեն դիսոցվում իոնների և էլեկտրական հոսանք չեն հաղորդում, կոչվում են ոչ-էլեկտրոլիտներ: Այդպիսիք են, օրինակ, օրգանական նյութերի մեծ մասը:

7.2. Էլեկտրոլիտիկ դիսոցման տեսություն
Արրենիուսի տեսությունը հետագայում զարգացվեց և ներկայումս կարողանում է բացատրել դիսոցման պրոցեսի կարևորագույն օրինաչափությունները: Այդ տեսության հիմնական դրույթներն են.
1. Էլեկտրոլիտները ջրում կամ այլ բևեռային լուծիչներում լուծվելիս տրոհվում են դրական և բացասական լիցքավորված իոնների:
2. Էլեկտրոլիտի լուծույթով հոսանք անցկացնելիս դրական լիցքավորված իոնները շարժվում են դեպի կատոդ և կոչվում են կատիոններ (Na+,Ca+,H+ և այլն), բացասական իոնները`դեպի անոդ և կոչվում են անիոններ (Cl-, SO42- և այլն ):
3. Դիսոցումը դարձելի պրոցես է:
Լուծվող էլոկտրոլիտի կառուցվածքից կախված` դիսոցումն ընթանում է տարբեր մեխանիզմով: Էլեկտրոլիտների համար բնորոշ են իոնական բյուրեղացանցեր (օրինակ` աղերը) և բևեռային մոլեկուլներով (օրինակ` թթուները), կառուցվածքները:
Քննարկենք NaCl-ի լուծելիությունը ջրում (նկ. 7.1):

NaCl–ի բյուրեղը ջրում լուծելիս ջրի բևեռային մոլեկուլները կողմնորոշվում և հակառակ բևեռներով ձգվում են բյուրեղային ցանցի հանգույցներում գտնվող իոնների կողմից: Դրա հետևանքով իոնի ձգողության ուժը բյուրեղի հետ փոքրանում է ջրի դիէլեկտրիկ հաստատունի (ε = 81) չափով, իոնը դառնում է թույլ կապված բյուրեղի հետ և ջրի ջերմային շարժում կատարող այլ մոլեկուլների հարվածների շնորհիվ այդ իոններն անջատվում են բյուրեղից և անցնում ջրի մեջ: Ջրում լրիվ հիդրատացված Na+ և Cl- իոնները կատարում են քաոսային շարժում և կարող են, բախվելով բյուրեղին, նորից վերադառնալ նրա մեջ, ուստի պրոցեսը կլինի դարձելի և որոշ ժամանակ անց կհասնի հավասարակշռության:
![]()
Բևեռային մոլեկուլներ ունեցող նյութերի (օրինակ HCl) դիսոցման դեպքում ջրի բևեռային մոլեկուլները կողմնորոշվում և ձգվում են դեպի լուծված դիպոլ մոլեկուլների հակառակ բևեռները (նկ. 7.2):
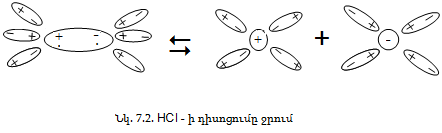
Դրա հետևանքով HCl–ի մոլեկուլում ձգողությունը բևեռների միջև թուլանում է և ջերմային շարժման հարվածների շնորհիվ մոլեկուլը տրոհվում է H+ և Cl- իոնների, որոնք լրիվ հիդրատացվում են:
![]()
որում H+ իոնը միանում է մեկ մոլեկուլ ջրի հետ, առաջացնելով H3Օ+ հիդրոքսոնիում իոն: Առաջացած իոնները ջրում կատարելով քաոսային շարժում` կարող են բախվել և նորից միանալ, հետևաբար պրոցեսը կլինի դարձելի և կհասնի հավասարակշռության:
Պարզության համար դիսոցումը ջրում գրվում է առանց հիդրատացումը նշելու`
![]()
Հավասարակշռության վիճակում, հետևաբար, ընդհանուր առմամբ, դիսոցված կլինի էլեկտրոլիտի մի մասը միայն: Դիսոցման այդ չափը որոշվում է դիսոցման աստիճանով (α):
![]() Էլեկտրոլիտի
դիսոցման
աստիճան
կոչվում
է
տվյալ
լուծույթում
դրա
դիսոցված
մոլեկուլների
(մոլերի)
թվի
հարաբերությունը
ամբողջ
լուծված
մոլեկուլների
(մոլերի)
թվին:
Էլեկտրոլիտի
դիսոցման
աստիճան
կոչվում
է
տվյալ
լուծույթում
դրա
դիսոցված
մոլեկուլների
(մոլերի)
թվի
հարաբերությունը
ամբողջ
լուծված
մոլեկուլների
(մոլերի)
թվին:

Հաճախ դիսոցման աստիճանը արտահայտում են տոկոսներով
![]()

Դիսոցման աստիճանի առավելագույն արժեքը կարող է լինել մեկ կամ 100%:
Կախված դիսոցման աստիճանի մեծությունից` էլեկտրոլիտները լինում են
1. ՈՒժեղ էլեկտրոլիտներ, որոնց դիսոցման աստիճանը α > 30 %-ից: ՈՒժեղ էլեկտրոլիտներ են բոլոր լուծելի աղերը, շատ անօրգանական թթուներ, օրինակ H2SO4, HNO3, HCl, HClO4, ալկալիական մետաղների հիդրօքսիդները և այլն:
2. Միջին ուժի էլեկտրոլիտներ, որոնց դիսոցման աստիճանը 3 < α < 30 %: Այդպիսիք են որոշ օրգանական և անօրգանական թթուներ (H3PO4, H2SO3, HCOOH, H2CrO4 և այլն):
3. Թույլ էլեկտրոլիտներ, որոնց դիսոցման աստիճանը α < 3 %-ից: Թույլ էլեկտրոլիտներ են օրգանական թթուների մեծ մասը, որոշ անօրգանական թթուներ (H2S, HCN, H2SiO3 և այլն), d-տարրերի հիդրօքսիդների մեծ մասը:
Էլեկտրոլիտիկ դիսոցումը ինքնաբերաբար ընթացող պրոցես է: Նրա համար ∆G < 0: Գիբսի էներգիայի բացասական լինելը պայմանավորված է նրանով, որ հադրատացման (սոլվատացման) պրոցեսը ջերմանջատիչ է` ∆H < 0, լուծիչի մոլեկուլների փոխազդեցության էներգիան լուծվող նյութի հետ բավարար է լուծվող նյութի մոլեկուլում կամ բյուրեղում կապը քայքայելու համար: Միաժամանակ դիսոցման հետևանքով մասնիկների թիվը մեծանում է, ուստի ∆S > 0 և ∆G = ∆H - T∆S կլինի փոքր զրոյից:
7.4. Էլեկտրոլիտների դիսոցման վրա ազդող գործոնները
Էլեկտրոլիտների դիսոցման վրա ազդող կարևոր գործոններն են.
1. Դիսոցվող նյութի կառուցվածքը ինչպես ասվեց, Էլեկտրոլիտիկ դիսոցման մեծամասամբ ենթարկվում են կովալենտ բևեռային և իոնական կառուցվածք ունեցող նյութերը: Կովալենտ ոչ բևեռային կապեր ունեցող նյութերը` պարզ գազեր, ածխաջրածիններ մեծ մասամբ ոչ Էլեկտրոլիտներ են:
2. Լուծիչի բնույթը Էլեկտրոլիտները դիսոցվում են միայն բևեռային լուծիչներում (H2O, հեղուկ NH3) և չեն դիսոցվում ոչ բևեռային լուծիչներում (C6H6 և այլն): Օրինակ, քլորաջրածնի ջրային լուծույթը էլեկտրականության հաղորդիչ է, իսկ բենզոլային լուծույթը` ոչ:Ջրի դիէլեկտրիկ թափանցելիությունը ε = 81, իսկ բենզոլինը` 2.7: Հետևաբար ջրում քլորաջրածին լուծելիս H և Cl ատոմների միջև կապը թուլանում է 81, իսկ բենզոլում` 2.7 անգամ, ուստի վերջինս բավարար չէ դիսոցման համար:
3. Ջերմաստիճանը Դիսոցումը ջերմակլանիչ պրոցես է:
![]()
Այդ պատճառով ջերմաստիճանի բարձրացումից, ըստ Լե Շատելյեի սկզբունքի, հավասարակշռությունը տեաշարժվում է ջերմության կլանման կողմը և դիսոցման աստիճանը մեծանում է:
4. Էլեկտրոլիտի կոնցենտրացիան Դիսոցման հետևանքով մասնիկների թիվը մեծանում է: Հետևաբար կոնցենտրացիան (այսինքն միավոր ծավալում լուծված մասնիկների թիվը) մեծացնելիս, ըստ Լե Շատելյեի սկզբունքի, հավասարակշռությունը տեաշարժվում է դեպի մասնիկների թվի փոքրացման, այսինքն` դիսոցման հակառակ` ասոցման կողմը, ուստի դիսոցման աստիճանը փոքրանում է:
Քանի որ էլեկտրոլիտների դիսոցումը դարձելի պրոցես է և հասնում է հավասարակշռության (բացառություն են կազմում ուժեղ էլեկտրոլիտների` օրինակ ալկալիական մետաղների հալոգենիդները) դրա համար կիրառելի են հավասարակշռության ընդհանուր օրենքները:
Ենթադրենք ունենք K Am էլեկտրոլիտը: Նրա դիսոցման
![]()
հավասարակշռության հաստատունը`
![]()
Տվյալ դեպքում հավասարակշռության հաստատունը կոչվում է դիսոցման հաստատուն: K-ն հաստատուն թիվ է թույլ էլեկտրոլիտների համար, և ի տարբերություն դիսոցման աստիճանի, կոնցենտրացիալից կախված չէ:
Ենթադրենք
KA թույլ
էլեկտրոլիտը
դիսոցվել է ըստ
![]() հավասարման:
Նրա դիսոցման
հաստատունը`
հավասարման:
Նրա դիսոցման
հաստատունը`
![]()
Ընդունենք, որ KA էլեկտրոլիտի սկզբնական կոնցենտրացիան C մոլ/լ է, դիսոցման աստիճանը`α: Հետևաբար հավասարակշռության պահին KA-ի դիսոցված քանակը 1լ լուծույթում կլինի Cα, ուստի [K+] և [A-] իոնների քանակը ևս ըստ դիսոցման հավասարման կլինի Cα` [K+] = [A-] = Cα: Չդիսոցված էլեկտրոլիտի քանակը կլինի C - Cα = C (1 - α): Տեղադրելով կոնցենտրացիաների արժեքները K-ի արտահայտութան մեջ կստանանք`
![]()
կամ
![]()
Այս հավասարումը արտահայտում է K-ի, α-ի և C-ի միջև կապը և կոչվում է Օստվալդի (1888) նոսրացման օրենք: Եթե ընդունենք, որ թույլ էլեկտրոլիտների համար α <<1 – ից, ապա հայտարարում α կարելի է հաշվի չառնել` 1-α ε1: Կստացվի K = α2C, որտեղից

Այս հավասարումից ևս երևում է, որ թույլ էլեկտրոլիտների դիսոցման հաստատունը հակադարձ համեմատականորեն է կախված կոնցենտրացիայից, այսինքն լուծույթը նոսրացնելիս դիսոցման աստիճանը մեծանում է:
Թույլ էլեկտրոլիտի դիսոցման աստիճանի կախումը իզոտոնիկ գործակցից պարզելու համար ենթադրենք, որ ընդհանուր դեպքում էլեկտրոլիտի մեկ մոլեկուլի դիսոցումից առաջանում են m թվով իոններ:
Օրինակ NaCl-ի դեպքում
![]()
CaCl2-ի դեպքում
![]()
Այդ դեպքում C մոլի դիսոցումից կառաջանան mCα մոլ իոններ, և կմնա չդիսոցված C - Cα մոլ: Մասնիկների ընդհանուր թիվը կլինի mCα + C (1- α), ուստի իզոտոնիկ գործակիցը
![]()
այստեղից
![]()
Այսպիսով չափելով էլեկտրոլիտի կոլիգատիվ հատկությունները` կարելի է հաշվել i-ն և (7.11) բանաձևով որոշել էլեկտրոլիտի դիսոցման աստիճանը:

7.6. Էլեկտրոլիտների էլեկտրահաղորդականությունը
Էլեկտրոլիտների լուծույթների էլեկտրահաղորդականությունը կախված է լուծույթի կոնցենտրացիայից: Նրանց համար բնորոշ են.
Տեսակարար էլեկտրահաղորդականությունը, որը 1 սմ2 մակերես ունեցող էլեկտրոդների միջև ամփոփված 1 սմ3 ծավալով լուծույթի էլեկտրահաղորդականությունն է: Փորձնականորեն ընդհանրապես որոշվում է ոչ թե էլեկտրահաղորդականությունը (x), այլ էլեկտրական դիմադրությունը (p):
![]()
Լուծույթի կոնցենտրացիան մեծացնելիս տեսակարար էլեկտրահաղորդականությունը ընդհանուր առմամբ մեծանում է:
Համարժեքային
էլեկտրահաղորդականությունը
1 սմ հեռավորության
վրա
գտնվող
էլեկտրոդների
միջև
ամփոփված
մեկ
համարժեք
լուծված
նյութ ![]() պարունակող
լուծույթի
էլեկտրահաղորդականությունն
է:
պարունակող
լուծույթի
էլեկտրահաղորդականությունն
է:
![]()
Ի տարբերություն տեսակարար էլեկտրահաղորդականությանը, կոնցենտրացիան փոքրացնելիս համարժեքային էլեկտրահաղորդականությունը աճում է:
7.7. ՈՒժեղ էլեկտրոլիտների դիսոցումը
Էլեկտրոլիտների դիսոցման հաստատունը բաձարձակապես անկախ է կոնցենտրացիայից իդեալական լուծույթների համար, որտեղ չկա էլեկտրաստատիկ փոխազդեցություն իոնների միջև: Այդ պատճառով բերված բանաձևերը կիրառելի են թույլ էլեկտրոլիտների նոսր լուծույթների համար, որտեղ իոնների կոնցենտրացիան փոքր է, հեռավորությունը նրանց միջև մեծ, ուստի և փոխազդեցության ուժերը` աննշան:
ՈՒժեղ
էլեկտրոլիտները
լուծույթներում
գործնականորեն
լրիվ
դիսոցված են,
իոնների կոնցենտրացիան
մեծ է, և
հետրաբար
հեռավորությունները
նրանց միջև`
փոքր: Ուրեմն
էլեկտրաստատիկ
փոխազդեցության
ուժերը
իոնների միջև
ևս մեծ են, և
այդ ուժերը
մեծանում են
կոնցենտրացիայի
մեծացումից:
Լուծույթում
յուրաքանչյուր
իոն
շրջապատված է
հակառակ
լիցքավորված
իոններով,
որոնք դրա շուրջը
առաջացնում
են “իոնական
մթնոլորտ”: Իոնների
այդպիսի
փոխազդեցությունը
իրար հետ և
լուծիչի մոլեկուլների
հետ ազդում է
դրանց
շարժման արագության
վրա
էլեկտրական
դաշտում:
Լուծույթի
էլեկտրահաղորդականությունը
չափելիս իոնների
ուղղված
շարժումը
դեպի
համապատասխան
էլեկտրոդները
դանդաղում է,
չափվում է փոքր
էլեկտրահաղորդականություն,
ուստի և դրանց
համապատասխան
դիսոցման
աստիճան, որը
փոքր է իրական
դիսոցման
աստիճանից:
Այդ պատճառով
ուժեղ
էլեկտրոլիտի
էլեկտրահաղորդականության
միջոցով որոված
դիսոցման
աստիճանը
կոչվում է
թվացող դիսոցման
աստիճան ![]()
Դրա հետևանքով էլեկտրոլիտի լուծույթի կոլիգատիվ, ինչպես նաև այն բոլոր հատկությունները, որոնք կախված են իոնների թվից դրսևորվում են այնպես, կարծես իոնների կոնցենտրացիան լուծույթում ավելի փոքր է, քան կա իրական դիսոցման հետևանքով: Իոնների այդ արդյունավետ գործող կոնցենտրացիան կոչվում է իոնների ակտիվություն:
Իոնների ակտիվությունը
![]()
որտեղ f-ը ակտիվության գործակիցն է: Այն փաստորեն բնութագրում է էլեկտրոլիտների իրական լուծույթների տարբերությունը իդեալական լուծույթներից: Անսահման նոսրացված լուծույթների համար, որտեղ փոխազդեցության ուժերը իոնների միջև բացակայում են, f = 1 և α = C:
Վերը նշված հավասարումներում իոնների կոնցենտրացիաների փոխարեն ակտիվությունները տեղադրելու դեպքում դրանք դառնում են կիրառելի ուժեղ էլեկտրոլիտների լուծույթների համար:

7.8. Թթուները, հիմքերը և աղերը էլեկտրոլիտիկ դիսոցման տեսանկյունից
![]() Էլեկտրոլիտիկ
դիսոցման
տեսանկյունից
Էլեկտրոլիտիկ
դիսոցման
տեսանկյունից
Թթուներ կոչվում են այն էլեկտրոլիտները, որոնք դիսոցվելիս որպես կատիոններ առաջացնում են միայն H+ իոններ:
Առաջացած անիոնը կոչվում է թթվային մնացորդ: Ջրածնի իոնների առավելագույն թիվը, որը կարող է առաջանալ թթվի մեկ մոլեկուլի դիսոցումից, կոչվում է թթվի հիմնայնություն: Օրինակ HCl, HNO3, CH3COOH – միահիմն թթուներ են, H2SO4, H3PO3-ը երկհիմն, H3PO4 եռհիմն:
Միահիմն թթուները բնականաբար դիսոցվում են մեկ փուլով
![]()
Բազմահիմն թթուները ենթարկվում են աստիճանական դիսոցման` հաջորդաբար պոկելով ջրածնի իոններ:
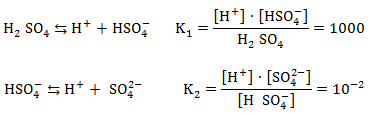
գումարային
![]()
Որպես կանոն, դիսոցման երկրորդ փուլը ընթանում է ավելի դըժվարությամբ և K2<<K1-ից, քանի որ մեծանում է թթվային մնացորդի բացասական լիցքը և ջրածնի իոնը ավելի դժվար է պոկվում, քան առաջին փուլում: Թթուների բազմափուլ դիսոցումով է պայմանավորված թթու աղերի առաջացումը:
Օրինակ H2SO4-ը առաջացնում է ինչպես չեզոք աղ Na2SO4, այնպես էլ թթու աղ` NaHSO4:
Թթուների ուժը (դիսոցման աստիճանը) կախված է բազմաթիվ գործոններից: Անթթվածնավոր թթուների (Hn+նn-) ուժը կախված է թթու առաջացնող տարրի իոնի շառավղից (r) և նրա օքսիդացման աստիճանից (n): Այն մեծանում է r-ի մեծացման և n-ի փոքրացման հետ մեկտեղ: Օրինակ, HCl, HBr, HY շարքում դիսոցման աստիճանը մեծանում է, որովհետև r-ը աճում է: HCl, H2S դեպքում դիսոցման աստիճանը նվազում է, որովհետև n-ը աճում է: Թթվածնավոր թթուների` ն+(2m+n)Om(OH)n ուժը կախված է տարրի (ն) բնույթից և n-ի ու m-ի արժեքներից: Թթուների ուժը աճում է m-ի աճման և n-ի նվազման հետ: Օրինակ,
Որպես կանոն, դիսոցման երկրորդ փուլը ընթանում է ավելի դըժվարությամբ և K2<<K1-ից, քանի որ մեծանում է թթվային մնացորդի բացասական լիցքը և ջրածնի իոնը ավելի դժվար է պոկվում, քան առաջին փուլում: Թթուների բազմափուլ դիսոցումով է պայմանավորված թթու աղերի առաջացումը:
Օրինակ H2SO4-ը առաջացնում է ինչպես չեզոք աղ Na2SO4, այնպես էլ թթու աղ` NaHSO4:
Թթուների
ուժը
(դիսոցման
աստիճանը)
կախված
է
բազմաթիվ
գործոններից:
Անթթվածնավոր
թթուների ![]() ուժը
կախված
է
թթու
առաջացնող
տարրի
իոնի
շառավղից
(r) և նրա
օքսիդացման
աստիճանից
(n): Այն մեծանում
է
r-ի մեծացման
և
n-ի փոքրացման
հետ
մեկտեղ:
Օրինակ,
HCl, HBr, HY շարքում
դիսոցման
աստիճանը
մեծանում
է,
որովհետև
r-ը աճում
է:
HCl, H2S դեպքում
դիսոցման
աստիճանը
նվազում
է,
որովհետև
n-ը աճում
է:
Թթվածնավոր
թթուների`
ուժը
կախված
է
թթու
առաջացնող
տարրի
իոնի
շառավղից
(r) և նրա
օքսիդացման
աստիճանից
(n): Այն մեծանում
է
r-ի մեծացման
և
n-ի փոքրացման
հետ
մեկտեղ:
Օրինակ,
HCl, HBr, HY շարքում
դիսոցման
աստիճանը
մեծանում
է,
որովհետև
r-ը աճում
է:
HCl, H2S դեպքում
դիսոցման
աստիճանը
նվազում
է,
որովհետև
n-ը աճում
է:
Թթվածնավոր
թթուների`![]() ուժը
կախված
է
տարրի
(Э) բնույթից
և
n-ի ու
m-ի արժեքներից:
Թթուների
ուժը
աճում
է
m-ի աճման
և
n-ի նվազման
հետ:
ուժը
կախված
է
տարրի
(Э) բնույթից
և
n-ի ու
m-ի արժեքներից:
Թթուների
ուժը
աճում
է
m-ի աճման
և
n-ի նվազման
հետ:
Օրինակ,
HOCl, H3BO3, H4SiO4, H6TeO6,
Cl(OH), B(OH)3, Si(OH)4, Te(OH)6 շարքում m = 0 և n-ը աճում է, այդ պատճառով թթուների ուժը փոքրանում է :
HNO2, H2SiO2, H5YO6
NOOH, SiO(OH)2, YOOH)5 m = 1 և դրանք միջին ուժի թթուներ են:
HNO3, H2SO4
NO2OH, SO2(OH)2 թթուների համար m = 2 և դրանք ուժեղ թթուներ են:
![]() Հիմքեր
կոչվում
են
այն
էլեկտրոլիտները,
որոնց
դիսոցումից
որպես
անիոններ
առաջանում
են
միայն
OH- հիդրօքսիլ
իոններ:
Հիմքեր
կոչվում
են
այն
էլեկտրոլիտները,
որոնց
դիսոցումից
որպես
անիոններ
առաջանում
են
միայն
OH- հիդրօքսիլ
իոններ:
Հիդրօքսիլ խմբերի առավելագույն թիվը, որը կարող է առաջանալ հիմքի մեկ մոլեկուլի դիսոցումից կոչվում է հիմքի թթվայնություն: NaOH-ը միաթթու, Ca(OH)2 –ը երկթթու հիմք է: Միաթթու հիմքերը բնականաբար դիսոցվում են մեկ փուլով
![]()
Բազմալիցք կատիոնների (բազմաթթու) hիմքերը ենթարկվում են աստիճանական դիսոցման:
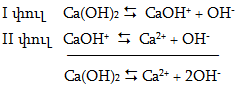
Դրանով է բացատրվում այդպիսի հիմքերի կողմից հիմնային աղերի առաջացումը` օրինակ. ZnOHCl, (CuOH)2CO3:
Որոշ հիդրօքսիդներ ջրում կարող են դիսոցվել և՛ թթվային, և՛ հիմնային բնույթով: Օրինակ
![]()
Այդպիսի հիդրօքսիդները կոչվում են ամֆոտեր հիդրօքսիդներ:
Ընդ որում` թթվային միջավայրում հավասարակշռությունը տեղաշարժվում է աջ, իսկ հիմնայինում` ձախ: Այդպիսի երկդիմի հատկության պատճառն այն է, որ հիդրօքսիդի մոլեկուլում մետաղի և թթվածնի միջև եղած կապի ամրությունը քիչ է տարբերվում ջրածնի և թթվածնի միջև եղած կապի ամրությունից:
![]() Աղեր
կոչվում
են
այն
էլեկտրոլիտները,
որոնց
դիսոցումից
առաջանում
են
մետաղի
(կամ կոմպլեքս)
կատիոններ
Աղեր
կոչվում
են
այն
էլեկտրոլիտները,
որոնց
դիսոցումից
առաջանում
են
մետաղի
(կամ կոմպլեքս)
կատիոններ ![]() և
թթվային
մնացորդի
անիոններ:
և
թթվային
մնացորդի
անիոններ:
Աղերը լինում են չեզոք Al2(SO4)3, թթու` Ca(H2PO4)2 և հիմնային` (CuOH)2CO3:
Չեզոք աղերը դիսոցվում են մեկ փուլով
![]()
Թթու և հիմնային աղերը ենթարկվում են աստիճանական դիսոցման:

7.9. Ջրի դիսոցումը: Ջրածնական ցուցիչ
Ջուրը թույլ էլեկտրոլիտ է, դիսոցվում է չնչին չափով և ունի փոքր հաղորդականություն, նրա դիսոցման աստիճանը 250C-ում 1.8 ∙ 10-16 է: Ջրի դիսոցման պարզեցված հավասարումը (առանց հիդրատացիան հաշվի առնելու)
![]()
ցույց է տալիս, որ նա ամֆոտեր էլեկտրոլիտ է և կարող է հանդես գալ և որպես թթու, և որպես հիմք:
Դիսոցման հաստատունը`
![]()
Քանի որ K = 1.8 ∙ 10-16 այսինքն` 555 միլիոն մոլեկուլներից մեկն է դիսոցվում, հետևաբար կարելի է ընդունել, որ դիսոցման հետևանքով ջրի կոնցենտրացիան գործնականորեն չի փոխվում` մնում է հաստատուն [H2O] = const: Այդ պատճառով երկու հաստատունների K∙ [H2O] արտադրյալը կարելի է նշանակել նոր հաստատունով` KH2O, և վերը բերված հավասարումը կընդունի
![]()
տեսքը: KH2O – ն կոչվում է ջրի իոնական արտադրյալ: Քանի որ 1 լ ջրի զանգվածը 1000գ է, ապա
![]()
Հետևաբար KH2O = K ∙ [H2O] = 1.8 ∙ 10-16 ∙ 55 = 10-14: Նշանակում է, որ ջրում և ջրային լուծույթներում H+ և OH- իոնների կոնցենտրացիաների արտադրյալը հաստատուն է և 250C-ում հավասար է 10-14-ի:
![]()
Քանի որ չեզոք միջավայրում [H+] = [OH-], ապա
![]()
Եթե ջրի
մեջ
ավելացնենք
թթու, H+ իոնների
կոնցենտրացիան
կմեծանա, ջրի
դիսոցման ![]() հավասարակշռությունը
ըստ Լե
Շատելյեի սկզբունքի
կտեղաշարժվի
դեպի ձախ, որի
հետևանքով OH-
իոնների
կոնցենտրացիան
կփոքրանա,
այնպես որ
արտադրյալը
մնա 10-14:
հավասարակշռությունը
ըստ Լե
Շատելյեի սկզբունքի
կտեղաշարժվի
դեպի ձախ, որի
հետևանքով OH-
իոնների
կոնցենտրացիան
կփոքրանա,
այնպես որ
արտադրյալը
մնա 10-14:
![]()
Հետևաբար [OH-]<10-7 (10-8, 10-9 և այլն):
Հետևաբար`
Չեզոք միջավայրում [H+] = [OH-] = 10-7:
Թթվային միջավայրում [H+]>10-7, [OH-]<10-7:
Հիմնային միջավայրում [H+]<10-7, [OH-]>10-7:
Եթե ջրի մեջ ավելացնենք հիմք, կմեծանա OH- իոնների կոնցենտրացիան, ուստի նույն պատճառով կնվազի H+ իոնների կոնցենտրացիան [H+]<10-7:
Քանի որ [H+] և [OH-] իոնների կոնցենտրացիաները ջրային լուծույթներում բացասական ցուցիչներով կոտորակային թվեր են և հարմար չեն օգտագործելու համար, միջավայրի թթվայնությունը կամ հիմնայնությունը արտահայտում են ոչ թե կոնցենտրացիաներով, այլ դրա տասնորդական լոգարիթմով` վերցրած հակառակ նշանով: Այդ մեծությունը ջրածնի իոնի դեպքում անվանում են ջրածնական ցուցիչ (pH)
![]()
![]() Ջրածնական
ցուցիչը
ջրածնի իոնների
կոնցենտրացիայի
տասնորդական
լոգարիթմն է`
բացասական
նշանով:
Ջրածնական
ցուցիչը
ջրածնի իոնների
կոնցենտրացիայի
տասնորդական
լոգարիթմն է`
բացասական
նշանով:
Հիդրօքսիլային ցուցիչը pOH = -lg[OH-]: Եթե լոգարիթմենք (7.16) հավասարումը բացասական նշանով կստանանք -lg[H+] - lg[OH-]=14, հետևաբար`
![]()
Չեզոք միջավայրում pH = -lg[H+] = 7: Թթվային միջավայրում, քանի որ [H+]>10-7 ապա pH<7: Հիմնային միջավայրում [H+]<10-7 ապա pH>7:

Այսպիսով`
Չեզոք միջավայրում pH = 7:
Թթվային միջավայրում pH<7:
Հիմնային միջավայրում pH >7:
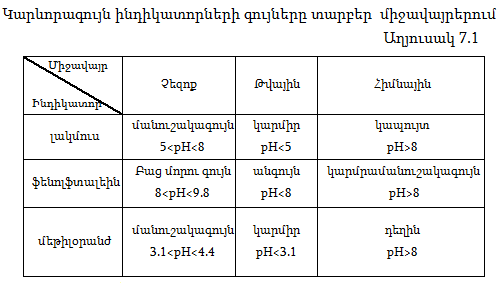
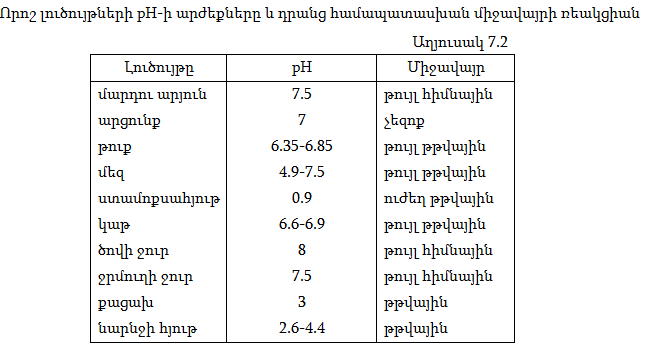
Ջրածնական ցուցիչը չափելու համար գոյություն ունեն հատուկ սարքեր` pH-մետրեր: Որակապես այն որոշվում է տվյալ միջավայրում որոշ նյութերի ինդիկատորների գույների փոփոխությամբ: Աղյուսակ 7.1-ում բերված են բնորոշ ինդիկատորների գույները` տարբեր միջավայրերում:
Կարևորագույն ինդիկատորների գույները տարբեր միջավայրերում:
Բնորոշ ինդիկատորները թույլ թթուներ կամ հիմքեր են, որոնց գույնը մոլեկուլային և իոնական վիճակներում նույնը չէ: Ենթադրենք ինդիկատորը թույլ թթու է և ջրային լուծութում մասամբ դիսոցվում է:
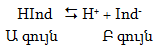
Եթե լուծույթը թթվեցնենք, այսինքն` ավելացնենք H+ իոնների կոնցենտրացիան, ապա հավասարակշռությունը կտեղաշարժվի դեպի ձախ և Բ գույնը կվերածվի Ա գույնի: Եթե ավելացնենք հիմք, OH- իոնները կփոխազդեն H+ իոնների հետ, վերջիններիս կոնցենտրացիան կփոքրանա, ուստի հավասարակշռությունը կտեղաշարժվի դեպի աջ, Ա գույնը կանհետանա, և երևան կգա Բ-ն: Միջավայրի pH-ի մեծությունը խիստ կարևոր է ինչպես բնության մեջ, այնպես էլ արտադրական գործընթացներում: Աղյուսակ 7.2-ում բերված են որոշ լուծույթների pH-ները և դրանց համապատասխան միջավայրը:
7.10. Լուծելիության արտադրյալ
Էլեկտրոլիտ պինդ նյութի (օրինակ աղի) լուծման ժամանակ պինդ նյութից լուծույթ են անցնում իոնները և հագեցած լուծո ւյթում հաստատվում է հավասարակշռություն պինդ աղի և իոնների միջև:
![]()
Այդ
պրոցեսի
հավասարակշռության
հաստատունը
արտահայտվում
է ![]() հավասարմամբ:
հավասարմամբ:
Քիչ լուծվող էլեկտրոլիտի դեպքում կարելի է ընդունել, որ դիսոցման հետևանքով պինդ աղի կոնցենտրացիան չի փոխվում, հաստատուն է և նշանակել K ∙ [KA] արտադրյալը մի նոր հաստատունով, անվանելով լուծելիության արտադրյալ (ԼԱ):
Կստացվի
![]()

Լուծելիության արտադրյալը կարելի է հաշվել` իմանալով տվյալ ռեակցիայի ∆G0-ն ∆G0 = RTlnK բանաձևից, ինչպես նաև աղի լուծելիությունը:
Ելնելով լուծելիության արտադրյալից կարելի է կանխատեսել` տվյալ աղը լուծույթում նստվածք կառաջացնի, թե` ոչ: Եթե տվյալ լուծույթում աղի իոնների կոնցենտրացիաների արտադրյալը մեծ է լուծելիության արտադրյալից [K+] ∙ [A-] > ԼԱ , ապա լուծույթը գերհագեցած է, և նրանից կանջատվի աղի նստվածք: Հակառակ դեպքում` աղը կլուծվի:
Լուծելիության արտադրյալը լավ լուծվող (ուժեղ) էլեկտրոլիտների համար հաստատուն մեծություն է, եթե իոնների կոնցենտրացիաների փոխարեն վերցնենք նրանց ակտիվությունները:
7.11. Իոնափոխանակման ռեակցիաներ
Ռեակցիաները իոնների մեջ ընթանում են մեծ արագությամբ և ըստ էլեկտրոլիտիկ դիսոցման տեսության լուծույթներում էլեկտրոլիտների միջև ընթացող ռեակցիաները փաստորեն ռեակցիաներ են իոնների միջև: Այդպիսի ռեակցիաները կոչվում են իոնափոխանակման ռեակցիաներ, իսկ դրանց իոնների տեսքով գրված հավասարումները` իոնամոլեկուլային հավասարումներ: Իոնամոլեկուլային հավասարումները կազմելու համար թույլ էլեկտրոլիտները, նստվածքները և գազային նյութերը գրվում են մոլեկուլային, իսկ ուժեղ էլեկտրոլիտները` իոնների տեսքով: Նստվածք առաջացնող նյութերի բանաձևերի կողքին դրվում է ներքև ուղղված![]() իսկ գազային նյութերի բանաձևերի կողքին` վեր ուղղված
իսկ գազային նյութերի բանաձևերի կողքին` վեր ուղղված ![]() սլաքներ:
սլաքներ:
Քննարկենք էլեկտրոլիտների միջև իոնափոխանակման ռեակցիաների բնորոշ դեպքեր, երբ ռեակցիայի հավասարակշռությունը խիստ տեղաշարժվում է դեպի վերջանյութերի առաջացման կողմը:
1. Նստվածքի առաջացումով ուղեկցվող ռեակցիաներ
Ջրային լուծույթում կալիումի սուլֆատը փոխազդում է բարիումի քլորիդի հետ` առաջացնելով բարիումի սուլֆատի նստվածք: Ռեակցիայի մոլեկուլային հավասարումը կլիլնի
![]()
Քանի, որ BaCl2–ը, K2SO4–ը և KCl-ը ուժեղ էլեկտրոլիտներ են, իոնամոլեկուլային հավասարումը կազմելիս դրանք գրվում են դիսոցված, իսկ անլուծելի BaSO4 –ը մոլեկուլային տեսքով
![]()
Այսպիսի հավասարումը կոչվում է լրիվ իոնամոլեկուլային հավասարում: Հավասարման աջ և ձախ մասերի համեմատությունից երևում է, որ K+ և Cl- իոնները ռեակցիային չեն մասնակցել, ուստի դրանք կարելի է հանել հավասարումից (կրճատել): Ստացված հավասարումը կոչվում է կրճատ իոնամոլեկուլային հավասարում`
![]()
Այսպիսով ռեակցիայի էությունն այն է, որ Ba2+
իոնները միանում են ![]() իոնների հետ` առաջացնելով BaSO4
նստվածք: Այդ պատճառով ռեակցիայի հավասարակշռությունը խիստ տեղաշարժվում է դեպի աջ
(∆G = - 60կՋ/մոլ):
իոնների հետ` առաջացնելով BaSO4
նստվածք: Այդ պատճառով ռեակցիայի հավասարակշռությունը խիստ տեղաշարժվում է դեպի աջ
(∆G = - 60կՋ/մոլ):
Կրճատ իոնամոլեկուլային հավասարումները ավելի պարզ են և ունեն ավելի ընդհանուր բնույթ: Դրանց կարող են համապատասխանել մի քանի մոլեկուլային հավասարումներ: Օրինակ BaSO4–ի առաջացման կրճատ իոնամոլեկուլային հավասարմանը կհամապատասխանեն բոլոր այն մոլեկուլային հավասարումները, որտեղ աջ մասում վերցված են Ba-ի լուծելի աղ (օր. Ba(NO3)2) և լուծելի սուլֆատ (օր. Na2SO4):
2. Գազային (ցնդող) նյութերի առաջացմամբ ընթացող ռեակցիաներ
Լուծույթում նատրիումի սուլֆիդի և աղաթթվի փոխազդեցութան արդյունքում առաջանում է գազային նյութ` ծծմբաջրածին: Մոլեկուլային հավասարումը կլինի
![]()
Լրիվ իոնամոլեկուլային հավասարումը
![]()
Na+ և Cl- իոնները ռեակցիային չեն մասնակցել, ուստի կրճատ իոնամոլեկուլային հավասարումը կլինի`
![]()
Քանի որ H+ և S2- իոնները ծախսվում են չդիսոցվող H2S-ի վրա, որը նաև հիմնականում հեռանում է լուծույթից, ուստի հավասարակշռությունը տեղաշարժվում է դեպի աջ: Քանի որ, տաքացման պայմաններում, H2S-ը լրիվ հեռանում է, հավասարակշռությունը ավելի է տեղաշարժվում դեպի աջ, ռեակցիան ընթանում է մինչև վերջ: Ռեակցիայի ∆S > 0 և ջերմաստիճանը բարձրացնելիս (∆G = ∆H - T∆S) ∆G-ն դառնում է ավելի բացասական:
3. Թույլ էլեկտրոլիտի առաջացմամբ ընթացող ռեակցիաներ
Լուծույթում աղաթթվի և նատրիումի հիդրօքսիդի փոխազդեցության արդյունքում առաջանում է թույլ էլեկտրոլիտ` ջուր: Մոլեկուլային հավասարումը կլինի
![]()
Իոնամոլեկուլային հավասարումը
![]()
Կրճատ իոնամոլեկուլային հավասարումը կլինի`
![]()
Այն ցույց է տալիս, որ այդ փոխազդեցությունը իրենից ներկայացնում է H+ և OH- իոնների չեզոքացում, և ռեակցիան ցանկացած ուժեղ թթվի և ուժեղ հիմքի միջև փոխազդեցություն է H+ և OH- իոնների միջև: Դա հաստատվում է նաև նրանով, որ անկախ ուժեղ թթվի և ուժեղ հիմքի տեսակից ռեակցիայի ջերմային էֆեկտը ցանկացած ուժեղ թթվի և ուժեղ հիմքի միջև ∆H = - 57.5կՋ/մոլ: Այդ պատճառով էլ ռեակցիաները թթուների և հիմքերի միջև կոչվում են չեզոքացման ռեակցիաներ:
![]()
![]()
![]() Այսպիսով
իոնափոխանակման
ռեակցիանեը
էլեկտրոլիտների
լուծույթներում
գործնականորեն
ընթանում են
մինչև վերջ,
եթե
առաջանում են
վատ դիսոցվող
նյութ,
նստվածք կամ
գազային
միացություն:
Այսպիսով
իոնափոխանակման
ռեակցիանեը
էլեկտրոլիտների
լուծույթներում
գործնականորեն
ընթանում են
մինչև վերջ,
եթե
առաջանում են
վատ դիսոցվող
նյութ,
նստվածք կամ
գազային
միացություն:
Որոշ գործնականորեն ոչ դարձելի ռեակցիաներ ուղեկցվում են անկայուն նութերի առաջացմամբ, որոնք քայքայվելով առաջացնում են վատ դիսոցվող կամ քիչ լուծվող նյութեր: Օրինակ

Առաջանում է թույլ էլեկտրոլիտ (H2O) և գազ (SO2) և երկու նյութերն էլ հավասարակշռությունը տեղաշարժում են աջ
![]()
Քանի որ ռեակցիայի ∆S > 0, ջերմաստճանի բարձրացումից այն ավելի է տեղաշարժվում դեպի աջ:
Եթե թույլ էլեկտրոլիտ կամ վատ լուծվող նյութ կա և՛ ելանյութերի, և՛ վերջանյութերի մեջ, ապա հավասարակշռությունը տեղաշարժվում է այն նյութի առաջացման կողմը, որի դիսոցման հաստատունը ավելի փոքր է: Օրինակ.
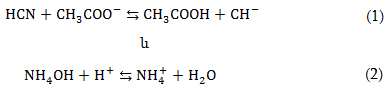
Առաջին դեպքում հավասարակշռությունը տեղաշարժվում է դեպի ձախ, որովհետև HCN-ի դիսոցման հաստատունը
![]()
շատ ավելի փոքր է, քան քացախաթթվինը
![]()
Երկրորդ դեպքում հավասարակշռությունը խիստ տեղաշարժվում է դեպի աջ, քանի որ
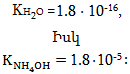
![]()
7.12. Աղերի հիդրոլիզ
Հիդրոլիզ նշանակում է քայքայում ջրով: Հիդրոլիզի ենթարկվում են շատ քիմիական միացություններ` աղեր, ածխաջրեր, սպիտակուցներ, ճարպեր և այլն:
Անօրգանական նյութերից հիմնականում հիդրոլիզի ենթարկվում են աղերը:
![]() Աղի
հիդրոլիզ
կոչվում է աղի
փոխանակման
ռեակցիան ջրի
հետ, որի
արդյունքում
առաջանում են
վատ դիսոցվող
նյութեր (կամ
վատ դիսոցվող
բարդ իոններ):
Աղի
հիդրոլիզ
կոչվում է աղի
փոխանակման
ռեակցիան ջրի
հետ, որի
արդյունքում
առաջանում են
վատ դիսոցվող
նյութեր (կամ
վատ դիսոցվող
բարդ իոններ):
Հիդրոլիզը չեզոքացման ռեակցիայի հակառակ ռեակցիան է: Քանի որ չեզոքացման ռեակցիաները թույլ թթուների և թույլ հիմքերի միջև մինչև վերջ չեն ընթանում, ապա նրանցից ստացված աղերը հիդրոլիզի ենթարվում են, ընդ որում այն չափով, ինչ չափով որ չեզոքացման ռեակցիան տեղի չի ունենում:
ՈՒժեղ թթուները և ուժեղ հիմքերը փոխազդում են մինչև վերջ, ուստի նրանցից ստացված աղերը հիդրոլիզի չեն ենթարկվում, հետևաբար հնարավոր են աղերի հիդրոլիզի երեք դեպք:
1. ՈՒժեղ թթվից և թույլ հիմքից ստացված աղի հիդրոլիզ: Ենթադրենք ջրի մեջ լուծվել է ամոնիումի քլորիդ (NH4Cl): Մինչև աղի լուծումը ջրում գոյություն ուներ
![]()
հավասարակշռությունը, ուստի և չեզոք միջավայր:
Ամոնիումի քլորիդը ուժեղ էլեկտրոլիտ է և ջրում լուծելիս գործնականորեն լրիվ դիսոցվում է
![]()
Առաջացած իոնները ջրի իոնների հետ կարող են սկզբունքորեն տալ հետևյալ փոխազդեցությունները`
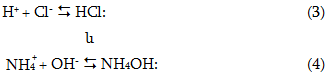
Քանի որ HCl-ը ուժեղ էլեկտրոլիտ է (3) հավասարման հավասարակշռությունը խիստ տեղաշարժվում է դեպի ձախ, և փաստորեն H+ և Cl- իոնները չեն փոխազդում: NH4OH-ը թույլ էլեկտրոլիտ է, ուստի (4) հավասարման հավասարակշռությունը, ընդհակառակը, տեղաշարժվում է դեպի աջ: Հետևաբար OH- իոնները այդ ռեակցիայի հետանքով ծախսվում են, որի հետևանքով ջրի դիսոցման (1) հավասարակշռությունը կտեղաշարժվի դեպի աջ, ջրի նոր մոլեկուլներ կդիսոցվեն, առաջացած OH- իոնները նորից կծախսվեն (4)-ի վրա, իսկ H+ իոնները կկուտակվեն: Կստեղծվի թթվային միջավայր: Եթե գումարենք (1-4) հավասարումները, իոնները աջ ու ձախ մասերում կկրճատվեն, և կստացվի հիդրոլիզի գումարային հավասարումը`
![]()
Կրճատ իոնամոլեկուլային հավասարումից երևում է, որ իսկապես ստացվել է թթվային միջավայր (pH<7)
![]()
Եթե հիդրոլիզի ենթարկվում է բազմաթթու թույլ հիմքի և ուժեղ թթվի աղ, տեղի է ունենում աստիճանական հիդրոլիզ:
Հիդրոլիզը ընթանում է փուլերով, ընդ որում` հիմնականում տեղի է ունենում առաջին փուլը: Օրինակ, CuCl2-ը առաջացել է թույլ հիմք Cu(OH)2-ից, որը երկթթու հիմք է:
![]()
Հիդրոլիզի այս տեսակը, երբ աղը կազմված է թույլ հիմքի կատիոնից և ուժեղ թթվի անիոնից, կոչվում է հիդրոլիզ ըստ կատիոնի:
Աղի մեջ եղած կատիոնները (Kn+) միանում են հիդրատացնող ջրի մոլեկուլների հետ` դոնորակցեպտորային կապով: Դոնոր է հանդիսանում ջրում պարունակվող թթվածնի ատոմը, որն ունի երկու ազատ էլեկտրոնային զույգեր, իսկ ակցեպտոր` կատիոնը, որն ունի դատարկ քվանտային բջիջներ:
Ինչքան մեծ է կատիոնի լիցքը և փոքր է շառավիղը (Cu2+, Fe3+), այնքան նրա բևեռացնող ազդեցությունը ջրի վրա մեծ է, և հիդրոլիզը ավելի խորն է ընթանում:
2. ՈՒժեղ հիմքից և թույլ թթվից ստացված աղի հիդրոլիզ: Կալիումի ցիանիդը գոյացել է ուժեղ հիմք KOH-ից և թույլ թթու HCN-ից:
Հիդրոլիզի արդյունքում կառաջանա հիմնային միջավայր (pH>7)
![]()
Այսպիսի հիդրոլիզը անվանում են հիդրոլիզ ըստ անիոնի:
Անիոնները
(An-) միանում
են
ջրի
մոլեկուլի
հետ
ջրածնական
կապով:
Եթե
անիոնի
բևեռացնող
ազդեցությունը
մեծ
է
(այդպիսիք
են
թույլ
թթուների
անիոնները`![]() և
այլն),
ապա
տեղի
է
ունենում
ջրի
մոլեկուլից
պրոտոնի
(H+) պոկում,
և
ջրածնական
կապը
վեր
ածվում
է
կովալենտի:
և
այլն),
ապա
տեղի
է
ունենում
ջրի
մոլեկուլից
պրոտոնի
(H+) պոկում,
և
ջրածնական
կապը
վեր
ածվում
է
կովալենտի:
Անիոնը առաջացնում է թթու կամ ջրածին պարունակող թթվային մնացորդ, եթե անիոնի լիցքը մեծ է մեկից (առաջանալիք թթուն բազմահիմն է): Այդ պատճառով բազմահիմն թույլ թթուներից և ուժեղ հիմքերից գոյացած աղերը ենթարկվում են աստիճանական հիդրոլիզի, ընդ որում` հիմնականում ընթանում է առաջին փուլը` առաջացնելով թթու աղ և հիմք:
![]()
Որքան մեծ է n-ը և փոքր անիոնի շառավիղը, այնքան ավելի ուժեղ է անիոնների (An-) փոխազդցությունը պրոտոնի հետ:
Թույլ հիմքից և թույլ թթվից գոյացած աղի հիդրոլիզ: Այսպիսի աղերը ենթարվում են հիդրոլիզի ինչպես ըստ կատիոնի, այնպես էլ ըստ անիոնի: Օրինակ
![]()
Կախված այն բանից, թե գոյացած թույլ հիմքից և թույլ թթվից որն է ավելի ուժեղ, միջավայրը կարող է լինել թույլ թթվային կամ թույլ հիմնային, այսինքն` միջավայրի pH-ը կլինի 7-ին մոտ:
Եթե կատիոնները և անիոնները ունեն ոչ մեծ լիցք և մեծ չափեր, դրանց բևեռացնող ազդեցությունը ջրի վրա փոքր է և գործնականում ջրի հետ չեն փոխազդում: Այդպիսիք են ալկալիական մետաղների (ուժեղ հիմքերի) կատիոնները և ուժեղ թթուների անիոնները: Այդ պատճառով ուժեղ թթվից և ուժեղ հիմքից ստացված աղերը հիդրոլիզի չեն ենթարկվում:
Հիդրոլիզը հիմնականում դարձելի պրոցես է և հասնում է հավասարակշռության: Հետևաբար քանակապես այն բնութագրվում է հիդրոլիզի աստիճանով
![]()
![]() Հիդրոլիզի
աստիճանը
աղի
հիդրոլիզի
ենթարկված
մոլեկուլների
(մոլերի)
թվի
Հիդրոլիզի
աստիճանը
աղի
հիդրոլիզի
ենթարկված
մոլեկուլների
(մոլերի)
թվի ![]() հարաբերությունն
է
ամբողջ
մոլեկուլների
(մոլերի)
թվին
(v):
հարաբերությունն
է
ամբողջ
մոլեկուլների
(մոլերի)
թվին
(v):
![]()
Հիդրոլիզի աստիճանը ընդհանուր առմամբ մեծ թիվ չէ և ուժեղ հիմքից և թույլ թթվից, ինչպես և ուճեղ թթվից և թույլ հիմքից առաջացած աղերի դեպքում սենյակի ջերմաստիճանում լինում է մինչև 1%: Ջերմաստիճանի բարձրացումից հիդրոլիզի աստիճանը մեծանում է, քանի որ հիդրոլիզը էնդոթերմ պրոցես է (∆H > 0): Միաժամանակ աստիճանական հիդրոլիզի դեպքում ջերմաստիճանի բարձրացումից մեծանում է և մյուս փուլերի հիդրոլիզի աստիճանը և հիդրոլիզը կարող է ընթանալ մինչև վերջ: Օրինակ` սենյակի ջերմաստիճանում FeCl3-ի հիդրոլիզը ընթանում է հիմնականում առաջին փուլով:
![]()
Ջերմաստիճանի բարձրացումից ընթանում են հաջորդ փուլերը ևս, և առաջանում է Fe(OH)3-ի նստվածք:
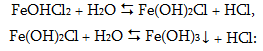
KA աղի (K–կատիոն, A-անիոն) հիդրոլիզի հավասարումը ընդհանուր տեսքով կլինի
![]()
Հավասարակշռության հաստատունը
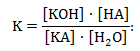
Քանի որ նոսր լուծույթներում հիդրոլիզի հետևանքով ջրի կոնցենտրացիան չի փոխվում, հաստատուն է, K[H2O] երկու հաստատունների արտադրյալը կարելի է նշանակել մի նոր հաստատունով` Kհ:
Այդ հաստատունը կոչվում է հիդրոլիզի հաստատուն: Որքան մեծ է հիդրոլիզի հաստատունը, այնքան ավելի մեծ չափով է տեղի ունենում հիդրոլիզը: Ըստ անիոնի հիդրոլիզի դեպքում (ուժեղ հիմքից և թույլ թթվից ստացված աղի հիդրոլիզ) հիմքի կոնցենտրացիան գործնականում հավասար է OH- իոնների կոնցենտրացիային [KOH] = [OH-], իսկ աղի կոնցենտրացիան` անիոնի կոնցենտրացիային [KA] = [A-], հետևաբար`

Այսինքն
![]()
Այստեղից երևում է, որ որքան Kթթու-ն (թթվի դիսոցման հաստատունը) փոքր է, այնքան Kհ-ը կլինի ավելի մեծ, այսինքն որքան թթուն թույլ է, այնքան նրա աղերը լրիվ են ենթարկվում հիդրոլիզի:
Ըստ կատիոնի հիդրոլիզի դեպքում (թույլ հիմքից և ուժեղ թթվից ստացված աղի հիդրոլիզ)
![]()
Այսինքն, որքան թույլ է հիմքը, այնքան նրա աղերը լավ են ենթարկվում հիդրոլիզի: Եթե հիդրոլիզը ընթանում է և՛ ըստ կատիոնի, և՛ ըստ անիոնի (թույլ թթվից և թույլ հիմքից), ապա
![]()
Սյդպիսի աղերը ավելի լրիվ կենթարկվեն հիդրոլիզի:
Կոնցենտրացիայից հիդրոլիզի աստիճանը կախված է հակադարձ համեմատականորեն, այսինքն, որքան նոսր է աղի լուծույթը, այնքան դրա հիդրոլիզը ավելի մեծ չափով տեղի կունենա: Դա երևում է հիդրոլիզի աստիճանի արտահայտությունից:
![]()
Լուծույթը նոսրացնելիս կոտորակի համարիչը կփոքրանա քառակուսի աստիճանով, իսկ հայտարարը` առաջին աստիճանով: Իսկ քանի որ Kh-ը կոնցենտրացիայից կախված չէ, ապա աղի նոր քանակ պետք է հիդրոլիզի ենթարկվի, որպեսզի հայտարարը էլի փոքրանա, և Kh-ը մնա հաստատուն:
Ամփոփում:
Թթուները,
հիմքերը
և աղերը
ջրում լուծելիս
նրանց մոլեկուլները
դիսոցվում
են լիցքավորված
մասնիկների`
իոնների,
այդ պատճառով
կոլիգատիվ
հատկությունները
ավելի մեծ
են ստացվում,
և լուծույթը
ձեռք է
բերում
էլեկտրահաղորդականություն:
Այդ նյութերը
կոչվում
են էլեկտրոլիտներ:
Դիսոցումը
դարձելի
պրոցես
է, հասնում
է հավասարակշռության
և բնութագրվում
է դիսոցման
աստիճանով
ու դիսոցման
հաստատունով:
Ուժեղ էլեկտրոլիտներում
հարակցական
ուժերը
իոնների
միջև մեծ
են և
իոնների
գործող
կոնցենտրացիան
կոչվում
է ակտիվություն:
Ջրային
լուծույթներում
[H+] և [OH-]
իոնների
կոնցենտրացիաների
արտադրյալը
հաստատուն
է և
կոչվում
է ջրի
իոնական
արտադրյալ` ![]()
Այդ լուծույթներում միջավայրը արտահայտվում է ջրածնական ցուցիչով (pH), որը ջրածնի իոնների կոնցենտրացիայի բացասական լոգարիթմն է` pH = -lg[H+]: Չեզոք միջավայրում pH=7, թթվային` pH<7, հիմնային` pH>7: Աղերի հիդրոլիզը դրանց փոխանակման ռեակցիան է ջրի հետ, որի դեպքում տեղի ունի H+ և OH- իոնների կոնցենտրացիայի փոփոխություն, շնորհիվ վատ դիսոցվող նյութի (իոնի) առաջացման:
Հիդրոլիզի ենթարկվում են թույլ թթվից և ուժեղ հիմքից, ուժեղ թթվից և թույլ հիմքից, թույլ թթվից և թույլ հիմքից գոյացած աղերը: Եթե թույլ թթուն բազմահիմն է կամ թույլ հիմքը բազմաթթու, տեղի է ունենում աստիճանական հիդրոլիզ:
Սովորելու նպատակը: Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1.Բացատրել դիսոցման մեխանիզմը, ձևակերպել «էլեկտրոլիտներ» հասկացությունը, իզոտոնիկ գործակցի իմաստը:
2.Ձևակերպել «դիսոցման աստիճան» հասկացությունը, որոշել ուժեղ, թույլ, միջին էլեկտրոլիտները:
3.Ձևակերպել «դիսոցման հաստատուն» հասկացությունը, դիսոցման հաստատունի, դիսոցման աստիճանի և կոնցենտրացիայի միջև կախումը (Օստվալդի նոսրացման օրենք):
4.Տարբերել լուծույթներում ուժեղ էլեկտրոլիտների վիճակը թույլ, էլեկտրոլիտներից:
5.Բնութագել թթուները, հիմքերը և աղերը էլեկտրոլիտիկ դիսոցման տեսակետից:
6.Ձևակերպել «ջրի իոնական արտադրյալ» հասկացությունը:
7.Բացատրել ինչ է ջրածնական ցուցիչը, նրա արժեքների միջակայքը թթու և հիմնային միջավայրերում:
8.Ձևակերպել «ջրի իոնական արտադրյալ» հասկացությունը, բնութագրել, որ աղերը կենթարկվեն հիդրոլիզի, գրել գործընթացների մոլեկուլային և իոնամոլեկուլային հավասարումները:
9.Ձևակերպել «հիդրոլիզի աստիճան» հասկացությունը, տալ նրա կախումը ջերմաստիճանից և կոնցենտրացիայից:
Հիմնական հասկացությունները:
1.Էլեկտրոլիտներ կոչվում են այն նյութերը, որոնց լուծույթները կամ հալույթները հաղորդում են էլեկտրական հոսանք:
2. Դիսոցման
աստիճան ![]() դիսոցված
մոլերի թվի
հարաբերությունն
է լուծված
մոլերի թվին
դիսոցված
մոլերի թվի
հարաբերությունն
է լուծված
մոլերի թվին ![]()
3. ՈՒժեղ կոչվում են այն Էլեկտրոլիտները, որոնց α>30%, միջին` 3<α<30%, թույլ` α<3%:
4. Դիսոցման
հաստատուն
հավասարակշռության
պահին
իոնների
կոնցենտրացիայի
հարաբերույթունն
է չդիսոցված
էլեկտրոլիտի
կոնցենտրացիային:
Եթե XY թույլ
էլեկտրոլիտը
դիսոցվել է ըստ
![]() հավասարման,
հավասարման,
![]()
5. Օստվալդի
նոսրացման
օրենք ![]() որտեղ
C-ն
էլեկտրոլիտի
կոնցենտրացիան
է, α-ն` դիսոցման
աստիճանը, K-ն`
դիսոցման
հաստատունը:
որտեղ
C-ն
էլեկտրոլիտի
կոնցենտրացիան
է, α-ն` դիսոցման
աստիճանը, K-ն`
դիսոցման
հաստատունը:
6. Իոների ակտիվություն (a) ուժեղ Էլեկտրոլիտների լուծույթներում իոնների գործող կոնցենտրացիան է a = f ∙ C, որտեղ f-ը ակտիվության գործակիցն է:
7. Թթուներ կոչվում են այն էլեկտրոլիտները, որոնք դիսոցվելիս որպես կատիոններ առաջացնում են միայն H+ իոններ: Հիմքեր` այն էլեկտրոլիտները, որոնց դիսոցումից որպես անիոններ առաջացնում են միայն OH- իոններ: Աղեր` այն էլեկտրոլիտները, որոնց դիսոցումից առաջանում են մետաղի կատիոններ և թթվային մնացորդի անիոններ:
8.
Լուծելիության
արտադրյալ
պինդ նյութի
լուծումից
գոյացած
իոնների
կոնցենտրացիաների
արտադրյալն է:
Եթե
![]() և
հաստատուն
մեծություն է:
և
հաստատուն
մեծություն է:
9. Իոնափաոխանակման ռեակցիաներ էլեկտրոլիտների միջև տեղի ունեն այն դեպքերում, երբ արդյունքում առաջանում է վատ դիսոցվող նյութ, նստվածք կամ գազային միացություն
10.
Ջրի
իոնական
արտադրյալը H+
և OH- իոնների
կոնցենտրացիաների
արտադրյալն է ![]()
11. Ջրածնական ցուցիչը (pH) ջրածնի իոնների կոնցենտրացիայի բացասական լոգարիթմն է` pH = -lg[H+]:
12.Աղերի հիդրոլիզը աղի փոխազդեցության ռեակցիան է ջրի հետ, որի հետևանքով տեղի ունի ջրում առաջացած H+ և OH- իոնների կոնցենտրացիայի փոփոխություն:
13.
Հիդրոլիզը
աստիճան աղի
հիդրոլիզի
ենթարկված
քանակի
հարաբերությունն
է ամբողջ
լուծված
քանակությանը![]()
Գրականություն
1. М.Х. Карапетянц, С.И.Дракин // Общая и неорганичная химия. Москва, Химия, 1981.
2. Ն.Ա.Գլնկա // Ընդհանուր քիմիա Երևան, Լույս, 1979.
3. М. Фриментл // Химия в действии, т.12, Москва, Мир, 1961.
4. խմբ.Գ.Ա.Դիմիտրևի // Քիմիայի դասընթաց, հատ. 1, 2 Երևան, Լույս, 1979/
5. L.Pauling // General Chemistry, W.H.Freeman and Company San Francisco, 1972.
6. T.L.Brown, H.H.LeMay // Chemistry, Englewood Cliffs, New Gersey,1977.