ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
(Պոլիտեխնիկ)
Քիմիական տեխնոլոգիաների
և բնապահպանության
ճարտարագիտության
դեպարտամենտ
Տեսական քիմիայի ամբիոն
ԱՐՄԵՆ ԳՐԻԳՈՐՅԱՆ
ՊԱՐԲԵՐԱԿԱՆ ՀԱՄԱԿԱՐԳԻ ՅՈԹԵՐՈՐԴ ԽՈՒՄԲԸ
Ուսումնական ձեռնարկ
ԵՐԵՎԱՆ
ՃԱՐՏԱՐԱԳԵՏ
2009
ՀՏԴ 54(07)
ԳՄԴ 24.128 ց7
Գ 888
Պարբերական համակարգի յոթերորդ խումբը:
Ուսումնական ձեռնարկ: Արմեն Գրիգորյան: Եր. ճարտարագետ, 2009 թ., 44 էջ:
Ներկայացված է Քիմիատեխնոլոգիական և բնապահպանական ճարտարագիտություն մասնագիտության ուսանողների, մագիստրանտների և դասախոսների համար:
Գրախոս՝ Ռ. Միրզախանյան
Գ. Շ. Գրիգորյան
Խմբագիր` Ն Խաչատրյան
2. ԳԼԽԱՎՈՐ ԵՆԹԱԽՈՒՄԲ: ՀԱԼՈԳԵՆՆԵՐ
2.1. ՀԱԼՈԳԵՆՆԵՐԻ ՏԱՐԱԾՎԱԾՈՒԹՅՈՒՆԸ ԲՆՈՒԹՅԱՆ ՄԵՋ
2.2. ՖԻԶԻԿԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
2.5. ՀԱԼՈԳԵՆՆԵՐԻ ՋՐԱԾՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԸ
2.5.1. ՀԱԼՈԳԵՆՆԵՐԻ ՋՐԱԾՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ՖիԶԻԿԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
2.5.2. ՀԱԼՈԳԵՆԱՋՐԱԾԻՆՆԵՐԻ ՍՏԱՑՈՒՄԸ
2.5.3. ՀԱԼՈԳԵՆԱՋՐԱԾՆԱԿԱՆ ԹԹՈՒՆԵՐԻ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
2.6. ՀԱԼՈԳԵՆՆԵՐԻ ԹԹՎԱԾՆԱՎՈՐ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԸ
2.6.1. ՀԱԼՈԳԵՆՆԵՐԻ ԹԹՎԱԾՆԱՎՈՐ ԹԹՈՒՆԵՐԻ ՍՏԱՑՈՒՄԸ ԵՎ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
2.7. ՀԱԼՈԳԵՆՆԵՐԻ ԵՎ ԴՐԱՆՑ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԿԻՐԱՌՈՒԹՅՈՒՆԸ
3. ԵՐԿՐՈՐԴԱՅԻՆ ԵՆԹԱԽՈՒՄԲ` ՄԱՆԳԱՆ, ՏԵԽՆԻՑԻՈՒՄ ԵՎ ՌԵՆԻՈՒՄ
3.1. ՏԱՐԱԾՎԱԾՈՒԹՅՈՒՆԸ ԲՆՈՒԹՅԱՆ ՄԵՋ
3.5. ՄԱՆԳԱՆԻ ԵՎ ՌԵՆԻՈՒՄԻ ԿԻՐԱՌՈՒԹՅՈՒՆՆԵՐԸ
Հիմնական հասկացությունները և միացությունները
1. ԽՄԲԻ ԸՆԴՀԱՆՈՒՐ ԲՆՈՒԹԱԳԻՐԸ
Յոթերորդ խմբի տարրերի համար ընդհանուրն այն է, որ դրանք բոլորն ունեն խմբի համարին հավասար` յոթական վալենտական էլեկտրոններ: Սակայն այդ էլեկտրոնները երկու տարբեր ձևով են բաշխված վալենտային (արտաքին և նախավերջին) շերտերում: Դա առաջացնում է քիմիական հատկությունների տարբերություն, որի պատճառով խումբը բաժանվում է երկու ենթախմբի:Խմբի մեջ մտնող տարրերից ֆտորը, քլորը, բրոմը, յոդը և աստատինը բոլոր յոթ վալենտական էլեկտրոններն էլ ունեն արտաքին շերտում երկուսը` s- և հինգը` p- ենթաշերտերում: Դրանց ընդհանուր էլեկտրոնային բանաձևը ...ns2np5 է, որտեղ n-ը այն պարբերության համարն է որում տարրը գտնվում է: Քանի որ սրանք արտաքին շերտում ունեն յոթական էլեկտրոններ, այս տարրերի ատոմները պետք է հեշտությամբ իրենց միացնեն մեկ էլեկտրոն, լրացնելով այդ շերտը, ուստի պետք է լինեն ուժեղ ոչ մետաղներ, ընդ որում, F, Cl, Br, J, At շարքում, միջուկի լիցքի աճին զուգընթաց ատոմների շառավիղների մեծացման հետևանքով տարրերի էլեկտրոն վերցնելու, այսինքն ոչ մետաղական հատկությունները աստիճանաբար պետք է թուլանան: Այս տարրերը կազմում են խմբի գլխավոր ենթախումբը:
Խմբի մեջ մտնող մնացած տարրերը` մանգանը, տեխնիցիումը և ռենիումը յոթական վալենտական էլեկտրոններից երկուսն ունեն արտաքին շերտի s-, հինգը` նախավերջին շերտի d-ենթաշերտում: Սրանց ընդհանուր էլեկտրոնային բանաձևը կլինի ...(n-1)d5ns2: Այդ պատճառով քիմիական փոխարկումների ժամանակ սրանք կարող են միայն կորցնել էլեկտրոններ, ուստի պետք է լինեն մետաղներ: Սրանք կազմում են խմբի երկրորդական ենթախումբը:
2. ԳԼԽԱՎՈՐ ԵՆԹԱԽՈՒՄԲ: ՀԱԼՈԳԵՆՆԵՐ
Գլխավոր ենթախմբի ֆտոր(F), քլոր(Cl), բրոմ(Br), յոդ(J) և աստատին(At) տարրերը կոչվում են հալոգեններ (աղածիններ), որովհետև մետաղների հետ անմիջականորեն փոխազդելով` սրանք առաջացնում են աղեր:
Հալոգեններն ունեն մեծ էլեկտրաբացասականություն, որը ֆտորից մինչև աստատին աստիճանաբար փոքրանում է: Այդ ուղղությամբ փոքրանում են նաև դրանց իոնացման և էլեկտրոնի հանդեպ խնամակցության էներգիաները: Բացառություն է կազմում միայն ֆտորը, որի էլեկտրոնի հանդեպ խնամակցության էներգիան (3.45էվ) ավելի փոքր է քան քլորինը (3.61): Պատճառն այն է, որ ֆտորի ատոմում 2p օրբիտալները ուժեղ ձգվելով միջուկի կողմից` ընկած են ավելի խորը, քան 25-ը: Վերջինիս էլեկտրոնները վանում են ֆտորի ատոմի կողմից միացվող էլեկտրոնը, էկրանանում են: Արդյունքում փոքրանում է էլեկտրոնի հանդեպ խնամակցության էներգիան, և մեծանում է իոնացման պոտենցիալը, որը ֆտորի համար 17.42, իսկ քլորի համար` 13.01Էվ է: Գումարային արդյունքում ֆտորն ունի ավելի մեծ հարաբերական էլեկտրաբացասականություն (4.0), քան քլորը` (3.0):
2.1. ՀԱԼՈԳԵՆՆԵՐԻ ՏԱՐԱԾՎԱԾՈՒԹՅՈՒՆԸ ԲՆՈՒԹՅԱՆ ՄԵՋ
Լինելով ուժեղ ոչ մետաղներ, այսինքն` ուժեղ օքսիդիչներ, հալոգենները բնության մեջ բացառապես հանդիպում են միացությունների ձևով, վերականգնված վիճակում, ցուցաբերելով –1 օքսիդացման աստիճան:
Ֆտոր միջուկի լիցքը + 9, ատոմի զանգվածը 19, ունի մեկ կայուն իզոտոպ` ![]() կազմում է երկրի կեղևի 6.25 · 10 –2
%-ը ըստ զանգվածի: Հանդիպում է ֆտորոսպար (հալասպար) CaF2, միներալի ձևով, որը մածուցիկ շլակ է (լատ. fluo-հոսել բառից, որից և ծագել է տարրի անունը): Na3AlF6-կրիոլիտ, ֆտորոպատիտ` 3Ca3(PO4)2 · CaF2 միներալների ձևով:
կազմում է երկրի կեղևի 6.25 · 10 –2
%-ը ըստ զանգվածի: Հանդիպում է ֆտորոսպար (հալասպար) CaF2, միներալի ձևով, որը մածուցիկ շլակ է (լատ. fluo-հոսել բառից, որից և ծագել է տարրի անունը): Na3AlF6-կրիոլիտ, ֆտորոպատիտ` 3Ca3(PO4)2 · CaF2 միներալների ձևով:
Քլոր միջուկի լիցքը +17, միջին իզոտոպային ատոմական զանգվածը 35.45, ունի երկու կայուն իզոտոպ` 35Cl - 75.77% և 37Cl - 24.23%: Կազմում է երկրի կեղևի 4.5 · 10 –2 %-ը: Անունը ծագել է հունարեն Chlorus-դեղնականաչավուն բառից: Ամենատարածված բնական միացությունը գալիտ միներալն է` NaCl (կերակրի աղ), որը գտնվում է պինդ քարաղի ձևով, ինչպես նաև ծովերի և օվկիանոսների ջրերում: Տարածված են նաև սիլվին` KCl, կաոնալիտ` KCl · MgCl2 · 6H2O, կաինիտ` KCl · MgSO4 · 3H2O միներալները:
Բրոմ միջուկի լիցքը +35, միջին իզոտոպային ատոմական զանգվածը` 79.9, կազմված է երկու կայուն իզոտոպներից` 79Br - 50·54% և 81Br - 49 · 46%: Անունը ծագել է լատիներեն bromos-գարշահոտ բառից: Կազմում է երկրի կեղևի 3.10-5%-ը::
Յոդ միջուկի լիցքը +53, միջին իզոտոպային ատոմական զանգվածը` 126.99, կազմված է հիմնականում մեկ կայուն իզոտոպից 127J: Անունը ծագել է դրա գույնից, jodus-մանուշակի գույն բառից: Կազմում է երկրի կեղևի 1.10-4%-ը:
Բրոմը և յոդը բնության մեջ գտնվում են կալիումի, նատրիումի և մագնեզիումի աղերի ձևով, ծովի ջրերում, յոդի միացությունները` որոշ ջրիմուռների հյուսվածքներում: Այդ ջրիմուռների մոխիրը յոդի ստացման հումքն է հանդիսանում: Յոդ պարունակում է նաև ստորերկրյա հորատաջրերում: Յոդը հանդիպում է նաև կալիումի յոդատ` KJO3 և պերյոդատ KJO4 աղերի ձևով:
2.2. ՖԻԶԻԿԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Ֆտորը (F2) բաց դեղնավուն, տհաճ սուր հոտով գազ է: Հալման ջերմաստիճանը -219 0C է, եռմանը` -189 0C: Ֆտորը և նրա միացությունների մեծ մասը խիստ թունավոր են:
Քլորը (Cl2) սուր հոտով դեղնականաչավուն գազ է, հալման ջերմաստիճանը –1010C, եռմանը` –340C, թունավոր է: Մեծ ճնշումների տակ (մոտ 6 ՄՊա) քլորը սենյակային ջերմաստիճանում հեղուկանում է: Հեղուկ վիճակում քլորն ունի դեղին գույն:
Բրոմը (Br2) կարմրագորշավուն հեղուկ է: Եռում է 59 0C, կարծրանում` –7 0C-ում: Բրոմի գոլորշիներն ունեն կարմիր գունավորում:
Յոդը սև, մետաղի փայլով բյուրեղային նյութ է: Հլավում է 1140C-ում և եռում` 183 0C-ում: Յոդը հեշտությամբ գոլորշիանում է պինդ վիճակից միանգամից անցնելով գոլորշի վիճակի: Յոդի գոլորշիները երկատոմ են (J2): Սառեցնելիս այդ գոլորշիները բյուրեղանում են: Այսպիսով, բոլոր հալոգենները ունեն սուր հոտ, առաջացնում են շնչառական ուղիների գրգռում և բորբոքում, մեծ քանակների դեպքում` ծանր թունավորում:
F2-J2 շարքում ատոմների շառավիղների մեծացման հետ մեկտեղ աճում է մոլեկուլների բևեռանալիությունը: Դրա հետևանքով ուժեղանում է միջմոլեկուլային դիսպերսիայի փոխազդեցությունը, որի արդյունքում այդ շարքում հալման և եռման ջերմաստիճաններն աճում են:
Cl2-Br2-J2 շարքում մոլեկուլներում կապի էներգիան նվազում է, ուստի դրանց դիսոցման ստանդարտ էնթալպիան փոքրանում է: Պատճառն այն է, որ արտաքին էլեկտրոնային ամպերի չափսերի մեծացման հետևանքով դրանց վերածածկման աստիճանը փոքրանում է: Վերածածկման տիրույթն ավելի ու ավելի է հեռանում միջուկներից և թույլ է ձգվում դրանց կողմից: Ֆտորը սակայն դուրս է մնում այս օրինաչափությունից: Դրա մոլեկուլում կապի ամրությունը, ուստի դիսոցման ստանդարտ էնթալպիան ավելի փոքր է: Պատճառը ֆտորի ատոմում d-օրբիտալների բացակայությունն է: Մնացած հալոգենների ատոմների վալենտային էլեկտրոնները երրորդ և ավելի բարձր շերտերում են, որոնք ունեն d-ենթաշերտեր, այդ պատճառով առաջացնում են լրացուցիչ դոնոր-ակցեպտորային կապեր P-էլեկտրոնային զույգերի և d-դատարկ օրբիտալների միջև, որի հետևանքով մոլեկուլների կայունությունը ավելի մեծ է:
Հալոգենները ջրում համեմատաբար քիչ են լուծվում: Մեկ ծավալ ջրում, սենյակային ջերմաստիճանում, լուծվում է 2.5 ծավալ քլոր: Այդ լուծույթը կոչվում է քլորաջուր: Քլորի և բրոմի ջրային լուծույթները մինչև 00C սառեցնելիս անջատվում են բյուրեղային հիդրատներ` կլատրատներ` Cl2 · 5.75 H2O և Br2 · 7.66 H2O մոտավոր բաղադրությամբ: Բրոմի լուծելիությունը ջրում 3.5, իսկ յոդինը` 0.02գ է: Ֆտորը ջրում լուծվել չի կարող, որովհետև փոխազդում է դրա հետ.
![]()
Բրոմը և յոդը ավելի լավ քան ջրում լուծվում են օրգանական լուծիչներում` դիէթիլ եթերում, բենզոլում, տոլուոլում: Դրանից օգտվում են` բրոմը և յոդը ջրային լուծույթներից առանձնացնելու համար:
2.3. ՀԱԼՈԳԵՆՆԵՐԻ ՍՏԱՑՈՒՄԸ
Միացություններում հալոգենները գտնվում են հիմնականում վերականգնված վիճակում` –1 օքսիդացման աստիճանով: Ուստի դրանց ստացումը հանգում է դրանց իոնների օքսիդացմանը մինչև չեզոք վիճակ:
Ֆտորն ունի ամենամեծ էլեկտրաբացասականություն և միացություններում գտնվում է բացառապես վերականգնված վիճակում` –1 օքսիդացման աստիճանով և F–1 իոնը օքսիդացնել հնարավոր է միայն էլեկտրոլիզի միջոցով` աղերի հալույթներից անոդային օքսիդացման եղանակով: Էլեկտրոլիզի ենթարկում են KF - HF խառնուրդը 200 0C-ում կամ KF · 2HF խառնուրդը 100 0C-ում: Կատոդը պատրաստվում է նիկելից, որը կայուն է ֆտորի նկատմամբ, իսկ անոդը` ածխից: Էլեկտրոլիզի ենթարկվում է HF-ը, իսկ KF-ը ապահովում է հալույթի բարձր էլեկտրահաղորդականությունը: HF-ը դիսոցվում է ըստ
![]()
հավասարման: Էլեկտրոդների վրա ընթանում են
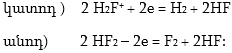
Գումարային հավասարումը
![]()
Առաջացած ջրածինը և ֆտորը իրարից բաժանելու համար կատոդային և անոդային տարածությունները իրարից անջատում են միջնապատով:
Քլորի ստացման սարքավորումները պատրաստում են պղնձից կամ նիկելից: Վերջինս առավել կայուն է ֆտորի նկատմամբ, որովհետև պատվում է նիկելի ֆտորիդի ամուր թաղանթով, որը պաշտպանում է մետաղը հետագա փոխազդեցությունից:
Քլորը լաբորատորիայում ստանում են աղաթթվից Cl– իոնը ուժեղ օքսիդիչներով օքսիդացնելով:
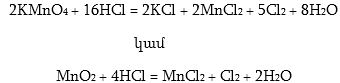
Նույն կերպ որպես օքսիդիչ աղաթթվի վրա կարելի է ազդել KClO3, PbO2:
Խիստ մաքուր քլոր ստանում են ոսկու (III) քլորիդի տաքացումից.
![]()
Արդյունաբերության մեջ քլորը ստանում են նատրիումի քլորիդի խիտ ջրային լուծույթի էլեկտրոլիզից
![]()
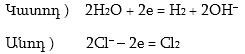
Գումարային հավասարումը.
![]()
Որպեսզի գոյացած քլորը չփոխազդի նատրիումի հիդրօքսիդի հետ, կատոդային և անոդային տարածությունները անջատում են ծակոտկեն միջնապատով (դիաֆրագմայով):
Բրոմը և յոդը լաբորատորիայում ստացվում են քլորի նման` HBr-ը և HJ-ը տարբեր օքսիդիչներով օքսիդացնելով: Արդյունաբերության մեջ ստացվում են ծովի ջրից ստացված բրոմիդներից և յոդիդներից` դրանց լուծույթների վրա քլորով ազդելով:
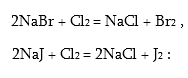
Անջատված բրոմը կլանում են երկաթի խարտվածքով, իսկ յոդը` ադսորբելով ակտիվացրած ածխի վրա:
Ենթախմբի վերջին տարրը` աստատինը բնության մեջ չի հանդիպում: Դրա իզոտոպները ստացվում են տարրեր միջուկային ռեակցիաների միջոցով, մասնավորապես ռմբակոծելով բիսմուտը α-մասնիկնեով.
![]()
2.4. ՔԻՄԻԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Խմբի ընդհանուր բնութագրում ցույց է տրվել, որ հալոգենները պետք է լինեն ուժեղ ոչ մետաղներ: Քննարկենք դրանց քիմիական հատկությունները քլորի օրինակով` նշելով մյուսների առանձնահատկությունները:
Քլորը էլեկտրոնային թաղանթների կառուցվածքն է 1s22s22p63s23p5, այսինքն`
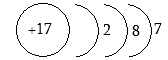
Եթե այս տարրը փոխազդի ուրիշ տարրերի հետ, ապա նրա ատոմի հետ կարող է կատարվել սկզբունքորեն երկու փոփոխություն:
Առաջին . Եթե քլորը փոխազդի իրենից փոքր էլեկտրաբացասականություն ունեցող տարրերի հետ, դրանք են` մետաղները, ջրածինը, իրենից թույլ շատ ոչ մետաղներ, ապա կվերցնի կամ դեպի իրեն կտեղաշարժի մեկ էլեկտրոն լրացնելու համար արտաքին շերտը և հանդես կբերի –1 օքսիդացման աստիճան:
Հալված մետաղական նատրիումը քլորի մթնոլորտում այրվում է շլացուցիչ բոցով` անոթի պատերի վրա առաջացնելով նատրիումի քլորիդի սպիտակ փառ.
![]()
Քլորի մեջ այրվում են նաև պղինձը, անագը, երկաթը և շատ ուրիշ մետաղներ` առաջացնելով աղեր: Ջրածնի հետ քլորը լուսավորելիս կամ տաքացնելիս փոխազդում է պայթյունով`առաջացնելով քլորաջրածին: Դա կապված է այս ռեակցիայի շղթայական մեխանիզմի հետ.
H2 + Cl2 = 2HCl:
Բրոմի փոխազդեցությունը ջրածնի հետ ընթանում է դանդաղ, իսկ յոդի հետ փոխազդում է միայն տաքացնելիս և մինչև վերջ չի ընթանում (դարձելի է): Այդ օրինաչափությունը համապատասխանում է ռեակցիայի DG0-ների փոխազդեցությանը: HCl – HBr – HJ շարքում այն համապատասխանաբար հավասար է –95, –51 և 2 կջ/մոլ-ի:
Քլորը փոխազդում է ոչ մետաղների հետ.
![]()
Այս ռեակցիաները ընթանում են մեծ ջերմության անջատումով: Պարզ նյութերից քլորը չի փոխազդում միայն թթվածնի ազոտի և ածխածնի, ինչպես նաև ազնիվ գազերի հետ:
Քլորը փոխազդում է նաև շատ բարդ նյութերի հետ: Ջրի հետ նա առաջացնում է քլորաջուր.
![]()
Փոխազդում է շատ օրգանական նյութերի հետ մտնելով ինչպես տեղակալուման, այնպես էլ միացման ռեակցիաների մեջ.
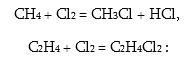
Քանի որ ֆտորի էլեկտրաբացասականությունը շատ ավելի մեծ է, իսկ մոլեկուլի դիսոցման էներգիան փոքր, ֆտորի քիմիական ակտիվությունը ավելի մեծ է: Ի տարբերություն մյուս հալոգենների, ֆտորը փոխազդում է նույնիսկ ազնիվ գազերի հետ.
![]()
ածխածնի հետ, եթե վերջինս ալմաստի ձևով է և ոսկու ու պլատինի հետ` օքսիդացնելով դրանց: Ցածր ջերմաստիճաններում էլեկտրական պարպումների ժամանակ ֆտորը փոխազդում է թթվածնի հետ` առաջացնելով թթվածնի ֆտորիդ:
2F2+O2=2F2O,
որտեղ թթվածինը ցուցաբերում է +2, իսկ ֆտորը` –1 օքսիդացման աստիճան: Մեծ քիմիական ակտիվության պատճառով ֆտորի միջավայրում այրվում են շատ բարդ նյութեր: Օրինակ ապակե բամբակը, ջուրը:
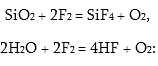
Այս ռեակցիաներում թթվածինը ստացվում է որպես այրման ռեակցիաների վերջնանյութ:
Բրոմը և յոդը քլորի համեմատությամբ քիմիապես ավելի քիչ ակտիվ են, հատկապես յոդը: Բրոմը ջրածնի հետ միանում է միայն տաքացնելիս, իսկ յոդի և ջրածնի ռեակցիան դարձելի է:
![]()
Շատ տարրերի հետ յոդն անմիջականորեն չի միանում, իսկ ջրածնի, սիլիցիումի, որոշ մետաղների հետ փոխազդում է բարձր ջերմաստիճանում:
Յոդի փոքր ակտիվությունը կապված է այն բանի հետ, որ F2–J2 շարքում օքսիդիչ հատկությունները թուլանում են: Այդ նույն պատճառով առավել օքսիդիչ հալոգենները հալոգենիդ իոններից արտամղում են մյուսներին:
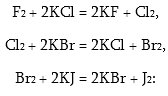
Ըստ դրա էլ ավելի թույլ հալոգենները վերականգնում են ավելի ուժեղներին իրենց թթվածնային միացություններից:
J2 +2ClO3 = 2JO3 + Cl2:
Յոդը որոշ չափով ցուցաբերում է հատկություններ, որոնք բնորոշ են մետաղներին: Օրինակ անջուր էթիլ սպիրտի միջավայրում կարող է ստացվել հեշտությամբ քայքայվող յոդի նիտրատ.
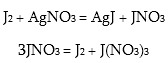
Հայտնի են մի քանի ավելի կայուն միացություններ` J2(SO4)3, JPO4, որոնք կարելի է համարել J+3-ի աղեր:
Հալոգեններն
անմիջականորեն
փոխազդում են
միմյանց հետ`
առաջացնելով
միջհալոգենային
միացություններ,
որտեղ ավելի
էլեկտրաբացասական
հալոգենն
ունի
բացասական,
իսկ մյուսը`
դրական
օքսիդացման
աստիճան:
Օրինակ ![]()
Միջհալոգենային միացությունները ենթարկվում են հիդրոլիզի` առաջացնելով թթուներ, որոնցում հալոգեններն ունեն նույն օքսիդացման աստիճանները, ինչ միջհալոգենային միացությունները`
![]()
Երկրորդ. Եթե քլորը առաջացնի միացություններ ավելի մեծ էլեկտրաբացասականություն ունեցող տարրի, օրինակ ֆտորի, թթվածնի (ոչ ուղղակի) հետ, ապա կկորցնի արտաքին շերտի յոթ էլեկտրոնները (իրենից կտեղաշարժվի) և հանդես կբերի դրական օքսիդացման աստիճան` մինչև +7 ազատ d-ենթամակարդակի առկայության շնորհիվ (նկ.1), ընդ որում հիմնականում պետք է լինեն +1 ապա +3, +5 և +7 օքսիդացման աստիճանները (նկ.1):
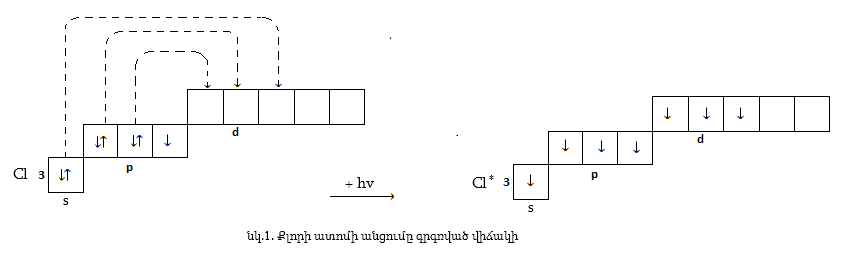
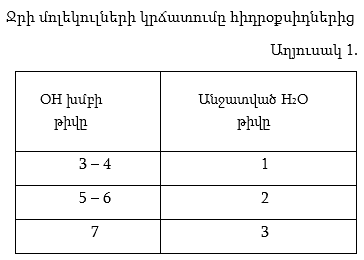
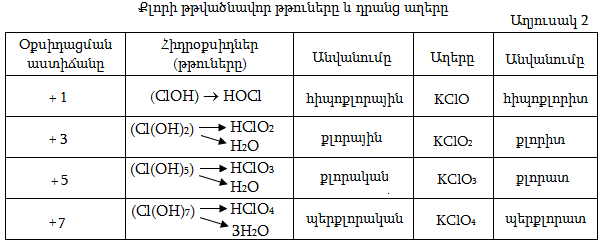
Այս օքսիդացման աստիճաններին համապատասխանող օքսիդներից Cl(III) և Cl(V) օքսիդները հայտնի չեն, սակայն թթվածնավոր թթուներում քլորը հանդես է բերում ատոմի կառուցվածքից բխող հենց այդ օքսիդացման աստիճանները: Քլորի օքսիդները` որպես ուժեղ ոչ մետաղի օքսիդներ, թթվային են, և դրանց համապատասխանող հիդրօքսիդները թթուներ են: Ինչպես հայտնի է, հիդրօքսիդները (ROH տիպի միացությունները) կարող են լինել ինչպես հիմքեր, այնպես էլ թթուներ` կախված R-տարրի տեսակից, այսինքն, թե R – O – H կապերից ո˚րն է ավելի բևեռացված և ջրային լուծույթում ո˚ր կապից կկատարվի դիսոցումը: Քանի որ քլորի դեպքում ավելի բևեռացված կլինի O – H կապը ապա սրանք կդիսոցվեն` առաջացնելով H+ իոններ, ուստի կլինեն թթուներ: Երկուսից ավելի OH խմբեր պարունակելու դեպքում հիդրօքսիդներից ջուր է անջատվում ըստ աղյուսակ 1-ում բերված օրինաչափության, հետևաբար ինչպես երևում է աղյուսակ 2-ից գոյություն կունենան HClO, HClO2, HClO3 և HClO4 թթուները, որոնցից առաջին երկու` քլորի ցածր օքսիդացման աստիճանով թթուները կունենան –ային, իսկ մյուս բարձրերը` –ական վերջավորությունները, ընդ որում առավել ցածրը հիպո– նախածանցը, առավել բարձրը` պեր– :
Ֆտորի թթվածնավոր միացությունները էնդոթերմ միացություններ են և ունեն փոքր կայունություն: Հալոգենների թթվածնավոր միացությունների ստացումն ու հատկությունները կքննարկվեն ստորև:
2.5. ՀԱԼՈԳԵՆՆԵՐԻ ՋՐԱԾՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԸ
Հալոգենաջրածինների մոլեկուլներում կա մեկական կովալենտ բևեռային կապ, որում ընդհանուր էլեկտրոնային զույգը տեղաշարժված է դեպի ավելի էլեկտրաբացասական հալոգենի ատոմի կողմը: Այդ պատճառով հալոգենաջրածինների մոլեկուլները բևեռային են մեծ դիպոլի մոմենտով:
HF, HCl, HBr, HJ շարքում հալոգենների էլեկտրաբացասականությունների փոքրացման հետևանքով ընդհանուր էլեկտրոնային զույգի տեղաշարժը փոքրանում է, ուստի և փոքրանում է կապի բևեռայնությունը: Այդ շարքում քիմիական կապի ամրությունը և ջերմության նկատմամբ կայունությունը ևս նվազում է, որը պայմանավորված է փոխազդող էլեկտրոնային ամպի վերածածկման աստիճանի փոքրացումով, որի տիրույթը հալոգենների ատոմների շառավիղների մեծացման պատճառով գտնվում է միջուկներից ավելի մեծ հեռավորության վրա: HCl–HBr–HJ շարքում եռման և հալման ջերմաստիճաններն աճում են: Այս օրինաչափությունից դուրս է մնում HF-ը, որն ունի ավելի բարձր եռման և հալման ջերմաստիճաններ, քան HCl-ը: Պատճառը ջրածնական կապերի շնորհիվ HF-ի մոլեկուլների ասոցված լինելն է: Գազային HF-ը հիմնականում կազմված է (HF)2 ասոցված մոլեկուլներից: Եվ գազային, և հեղուկ ֆազերում HCl-ի, HBr-ի, HJ-ի մոլեկուլները ասոցված չեն:
2.5.1. ՀԱԼՈԳԵՆՆԵՐԻ ՋՐԱԾՆԱԿԱՆ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ՖիԶԻԿԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Բոլոր հալոգենաջրածինները սենյակային ջերմաստիճանում անգույն, սուր հոտով թունավոր գազեր են: Առավել թունավոր է ֆտորաջրածինը, որը մաշկի հետ շփվելիս լուծում է սպիտակուցները, թափանցում հյուսվածքների խորքերը` առաջացնելով ծանր այրվածքներ: Սրանք ջրում լավ լուծվում են առաջացնելով հալոգենաջրածնական թթուներ:
HF – ֆտորաջրածին: Եռման ջերմաստիճանն է 19.50C: Կարծրանում է – 830C-ում: Խիստ թունավոր է: Վտանգավոր է նրանով, որ ունի ավելի թույլ և ոչ կտրուկ հոտ, քան HCl-ը:
HCl – քլորաջրածին: Եռում է – 85.1 0C-ում: Կարծրանում է – 114.20C-ում: Սուր հոտով թունավոր գազ է: 1 ծավալ ջրում լուծվում է 250 ծավալ HCl (սենյակային ջերմաստիճան):
HBr – բրոմաջրածին: Եռում է – 66.8 0C-ում: Կարծրանում է – 86.9 0C-ում: 1 ծավալ ջրում լուծվում է 350 ծավալ HBr (սենյակային ջերմաստիճան):
HJ – յոդաջրածին: Եռում է – 35.4 0C-ում: Կարծրանում է – 50.8 0C-ում: Ջրում լավ լուծվում է: 425 ծավալ 1 ծավալ ջրում (10 0C):
2.5.2. ՀԱԼՈԳԵՆԱՋՐԱԾԻՆՆԵՐԻ ՍՏԱՑՈՒՄԸ
Լաբորատոր եղանակով քլորաջրածինը և ֆտորաջրածինը ստացվում են իրենց աղերից` խիտ ծծմբական թթվով դուրս մղելով:
NaCl + H2SO4 = NaHSO4 + HCl,
CaF2 + H2SO4 = CaSO4 + 2HF:
Ուժեղ տաքացնելիս քլորաջրածնի դուրս մղումը կարող է ընթանալ չեզոք աղի առաջացումով.
![]()
Արդյունաբերության մեջ քլորաջրածին ստանում են NaCl-ի ջրային լուծույթի էլեկտրոլիզից ստացված ջրածնից և քլորից`սինթեզով.
![]()
Որպես կողմնակի վերջնանյութ մեծ քանակությամբ HCl ստացվում է օրգանական նյութի քլորացման հետևանքով.
![]()
որտեղ R-ը օրգանական ռադիկալն է:
Բրոմաջրածին և յոդաջրածին ստանում են բրոմի և յոդի ֆոսֆատային միացությունների հիդրոլիզից:
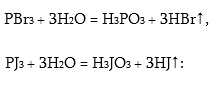
Յոդաջրածին ստանում են նաև յոդը ծծմբաջրածնով վերականգնելով.
![]()
2.5.3. ՀԱԼՈԳԵՆԱՋՐԱԾՆԱԿԱՆ ԹԹՈՒՆԵՐԻ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Ունենալով բևեռային մոլեկուլներ բավական մեծ դիպոլ մոմենտով հալոգենաջրածինները ջրում լուծելիս դիսոցվում են առաջացնելով հալոգենաջրածնական թթուներ: Թթվի ուժը HCl – HBr – HJ շարքում աճում է: Սրանք ուժեղ թթուներ են, ֆտորաջրածնական թթուն, սակայն թույլ թթու է և մի փոքր է ուժեղ քացախաթթվից: Պատճատն այն է, որ ֆտորաջրածնի ասոցված մոլեկուլները ջրում լուծելիս զգալի էներգիա է ծախսվում ջրածնական կապերը խզելու համար, ուստի HF-ի դիսոցումը պահանջում է մեծ էներգիա: Առաջացնում է ազիստրոպ խառնուրդ 38.2% պարունակության դեպքում:
Քլորաջրածնական թթուն առաջացնում է ազիոտրոպ խառնուրդ 20.1%, իսկ բրոմաջրածնականը 47.6% կոնցենտրացիայի դեպքում:
Հալոգենաջրածնական թթուներն ունեն թթուներին բնորոշ բոլոր հատկությունները: Դրանք փոխազդում են լարվածության շարքում ջրածնից առաջ կանգնած ակտիվ մետաղների հետ` դուրս մղելով ջրածին, հիմնային օքսիդների, հիմքերի և աղերի հետ:
Ֆտորաջրածնական թթվի (պլավիկյան թթու) դիսոցման դեպքում առաջացած F– իոնները միանում են չդիսոցված HF մոլեկուլների հետ` առաջացնելով HF2– իոն.
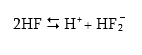
Այդ պատճառով ֆտորաջրածնական թթուն հիմքով չեզոքացնելիս նախ առաջացնում են թթու աղեր`KHF2: Պլավիկյան թթուն ունի ևս մեկ առանձնահաատկություն, այն փոխազդում է SiO2-ի հետ, ուստի լուծում է ապակին:
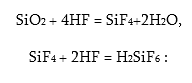
Հալոգենաջրածնական թթուները, բացի HF-ից, ունեն վերականգնիչ հատկություններ, քանի որ Cl–,Br–,J– հալոգենիդ իոնները կարող են միայն կորցնել էլեկտրոններ, ընդ որում վերականգնիչ հատկությունները այդ շարքում աճում են: Եթե քլորիդ իոնը օքսիդանում է ուժեղ օքսիդիչներով` KClO4, MnO2, ապա յոդիդ իոնը կարող է օքսիդանալ Fe3+ իոնով, մոլեկուլային թթվածնով.
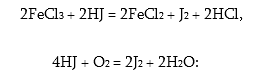
Բրոմաջրածնական թթուն թթվածնի հետ փոխազդում է դանդաղորեն, իսկ քլորաջրածնական թթուն ընդհանրապես չի փոխազդում: Հալոգենաջրածնական թթուների աղերը կոչվում են հալոգենիդներ, հալոգենիդները մեծ մասամբ լավ լուծվում են ջրում: Վատ լուծվում են Au-ի, Pb-ի, Cu-ի և Hg-ի հալոգենիդները: Ֆտորիդները ավելի վատ լուծվող են: Լուծելի են հիմնականում ալկալիական մետաղների ալյումինի, անագի ֆտորիդները և արծաթի ֆտորիդը, ի տարբերություն արծաթի մնացած հալոգենիդների:
Մետաղների ֆտորիդները փոխազդում են ոչ մետաղների ֆտորիդների հետ` առաջացնելով կոմպլեքս միացություններ:
![]()
Այդ ֆտորիդները հաճախ կոչվում են համապատասխանաբար` հիմնային և թթվային ֆտորիդներ.
2.6. ՀԱԼՈԳԵՆՆԵՐԻ ԹԹՎԱԾՆԱՎՈՐ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԸ
Արդեն ասվել է, որ հալոգենները թթվածնի հետ անմիջականորեն չեն միանում (բացառությամբ ֆտորի), և դրանց միացությունները ստացվում են անուղղակի եղանակով. պատճառը հալոգեն-թթվածին կապի փոքր էներգիան է: Այդ փոխազդեցությունը իրականացնելու համար անհրաժեշտ են շատ բարձր ջերմաստիճաններ, քանի որ դրանք ունեն Գիբսի ստանդարտ էներգիայի դրական արժեքներ (DG0>0):
Հալոգենների թթվածնավոր միացություններից առավել կայուն են թթվածնավոր թթուների աղերը և ավելի քիչ կայուն են օքսիդներն ու թթուները:
Ֆտորն առաջացնում է հիմնականում F2O, F2O2, F2O3 օքսիդներ, որոնք փոքր կայունություն ունեն: Սրանցից սենյակային ջերմաստիճանում կայուն են միայն OF2-ը: Սա բաց դեղնավուն թունավոր, խիստ ռեակցիոն ընդունակ գազ է: Ստացվում է NaOH-ի նոսր լուծույթի և ֆտորի փոխազդեցությունից`
![]()
Ֆտորի մնացած օքսիդները քայքայվում են սենյակային ջերմաստիճանից ցածր ջերմաստիճաններում: Դրանք ստացվում են թթվածնի և ֆտորի խառնուրդից` էլեկտրական պարպման ազդեցության տակ:
Քլորի թթվածնավոր օքսիդներից առավել կայուն են Cl2O, ClO2, Cl2O6(ClO3) և Cl2O7 օքսիդները:
Cl2O-ը սուր հոտով մուգ դեղին գազ է, թունավոր է և կարող է պայթել:
![]()
Սենյակային ջերմաստիճանում դանդաղ քայքայվում է առաջացնելով ClO2 և Cl2:
![]()
Ստանում են.
![]()
ռեակցիայով: Ջրում լուծելիս այն առաջացնում է հիպոքլորային թթու:
![]()
ClO2-ը քլորի (IV) օքսիդը սուր հոտով գորշ գույնի գազ է, թունավոր է և կարող է պայթել: ClO2-ի մոլեկուլում պարունակվում են կենտ թվով էլեկտրոններ, ուստի այն պարամագնիսկան է: Ստացվում է քլորական թթվի քայքայումից:
![]()
Արդյունաբերության մեջ ստանում են հետևյալ ռեակցիայով.
![]()
Փոխազդում է ջրի և ալկալիների հետ` ենթարկվելով անհամամասնական օքսիդավերականգնման:
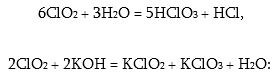
Cl2O6-ը քլորի (VI)օքսիդը սենյակային ջերմաստիճանում գորշակարմիր գույնի մածուցիկ հեղուկ է, դանդաղ քայքայվում է ClO2-ի և O2-ի: Գազ ֆազում տրոհվում է ClO3 մոլեկուլի.
![]()
Ստացվում է`
![]()
ռեակցիայով փոխազդում է ջրի և ալկալիների հետ` անհամամասնական օքսիդավերականգնման ռեակցիայով:
![]()
Cl2O7- ը քլորի (VII)օքսիդը յուղանման հեղուկ է, ավելի կայուն է, քան քլորի մյուս օքսիդները: Տաքացնելիս պայթում է միայն 120 0C-ում` առաջացնելով ClO2 և թթվածին.
![]()
Ջրի հետ տաքացնելիս առաջացնում է պերքլորական թթու.
![]()
Ստացվում է պերքլորական թթվի ջրազրկմամբ:
Բրոմի առաջացրած օքսիդների` Br2O, Br2O4, BrO3 ավելի քիչ կայուն են:
Յոդի առաջացրած օքսիդներից ` J2O4, J2O5, J2O7, առավել կայուն է յոդի (V)օքսիդը` J2O5: Սա անգույն բյուրեղային նյութ է, ստացվում է յոդաթթվի ջերմային քայքայումից.
![]()
J2O5-ը օքսիդիչ է և օգտագործվում է CO-ի քանակական որոշման համար.
J2O5+5CO=5CO2+J2:
Բրոմի կայուն թթվածնավոր թթուներն են` HBrO- հիպոբրոմային թթու, HBrO3- բրոմական թթու:
Յոդը առաջացնում է HJO- հիպոյոդային, HJO3-յոդական և պերյոդական H5JO6 թթուներ:
2.6.1. ՀԱԼՈԳԵՆՆԵՐԻ ԹԹՎԱԾՆԱՎՈՐ ԹԹՈՒՆԵՐԻ ՍՏԱՑՈՒՄԸ ԵՎ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Հալոգեններից թթվածնավոր թթուներ չի կարող առաջացնել միայն ֆտորը: Մնացած բոլորը +1 օքսիդացման աստիճանով կայուն թթվածնավոր թթուներ առաջացնում են: Դրանք են HOCl, HOBr և HOJ թթուները: Սրանք թույլ թթուներ են KHOCl=3.1·10–8, ընդ որում, այդ շարքում դրանց ուժը փոքրանում է: Ջրում լուծելիս հալոգենների մոլեկուլները (նշանակենք A2) ենթարկվում են անհամամասնական օքսիդավերականգնման ռեակցիայի:
![]()
Cl2-ից J2- ին անցնելիս այս հավասարակշռությունը տեղաշարժվում է դեպի ձախ: Քանի որ ռեակցիայի ընթացման հետևանքով առաջանում է թթվային միջավայր, ապա ալկալու ավելացումը հավասարակշռությունը կտեղաշարժի դեպի աջ, և ստացվում են գոյացող թթուների աղերը.
![]()
Օրինակ, քլորը սառն ալկալու մեջ լուծելիս առաջացնում է նատրիումի քլորիդի և նատրիումի հիպոքլորիդի խառնուրդ.
![]()
որը կոչվում է Ժավելյան ջուր:
Չոր հանգած կրի վրա քլորով ազդելիս ստացվում է սպիտակեցնող կիր (քլորակիր):
![]()
Ստացված երկու աղերը հաճախ ներկայացվում են կալցիումի քլորիդի և հիպոքլորիդի խառը աղի ձևով.
![]()
Ժավելյան ջուրը և քլորակիրն ունեն ուժեղ օքսիդացնող հատկություն և գունազրկում (սպիտակեցնում) են գունավոր նյութերը: Ժավելյան ջրում, ինչպես և խոնավ օդի դեպքում քլորակրի մեջ պարունակող հիպոքլորիդը փոխազդում է օդում պարունակվող ածխածնի (IV) օքսիդի հետ` առաջացնելով հիպոքլորային թթու.
![]()
Այն լույսի ազդեցության տակ քայքայվելով առաջացնում է ատոմական թթվածին, որը լինելով ուժեղ օքսիդիչ` գունազրկում է ներկանյութերը.
![]()
Ջուրը խլող նյութերի առկայության դեպքում հիպոքլորային թթուն կարող է քայքայվել.
![]()
իսկ լույսի ազդեցության տակ`
![]()
հավասարումների համաձայն: Անհամամասնական քայքայումը դանդաղ է ընթանում HOCl-ի և արագ` HOBr-ի և HOJ-ի դեպքում: Հաճախ ըստ հետևյալ ընդհանուր հավասարման.
![]()
Այնուհետև ընթանում է երկրորդային պրոցես.
![]()
Հիպոհալոգենային թթուները ուժեղ օքսիդիչներ են, սակայն HOCl, HOBr, HOJ շարքում օքսիդիչ հատկությունները նվազում են.
![]()
Հիպոհալոգենային թթուների աղերն ավելի կայուն են, քան թթուները: Այդ աղերը ևս ուժեղ օքսիդիչներ են
![]()
Քլորային թթու` HClO2 ազատ վիճակում անկայուն է, դրա անհիդրիդը, որը պետք է լիներ Cl2O3, հայտնի չէ: Ջրային լուծույթում միջին ուժի թթու է (K=1.1 · 10–2):
Լուծույթում արագ քայքայվում է
![]()
Ստացվում է իր աղերից` քլորիտներից.
![]()
Հալոգենական թթուներ` HAO3 առաջացնում են բոլոր երեք հալոգենները` HClO3, HBrO3 և HJO3: Սրանցից քլորական և բրոմական թթուները անկայուն են, իսկ յոդականը` կայուն: Սրանք ուժեղ թթուներ են, ընդ որում, այդ շարքում թթուների ուժը թուլանում է: HClO3-ը գործնականում լրիվ դիսոցվում է: Ստացվում են` իրենց աղերից ծծմբական թթվով դուրս մղելով.
![]()
HBrO3-ը կարելի է ստանալ նաև բրոմաջուրը քլորով օքսիդացնելով.
![]()
HJO3-ը ստանում են յոդը ազոտական թթվով օքսիդացնելով.
![]()
Այս թթուներից յոդական թթուն` HJO3-ը կայուն բյուրեղական նյութ է, տաքացնելիս քայքայվում է.
![]()
Քլորական և բրոմական թթուները (HClO3, HBrO3) գոյություն ունեն միայն լուծույթներում:
HClO3 քայքայվում է` առաջացնելով
![]()
իսկ HBrO3-ը`
![]()
Հալոգենական թթուները ինչպես և դրանց աղերը քլորատները, ուժեղ օքսիդիչներ են, և HClO3 – HBrO3 – HJO3 շարքում օքսիդիչ հատկությունները թուլանում են: Սրանց աղերը ստացվում են` հալոգենները ալկալիների տաք լուծույթի հետ փոխազդելիս.
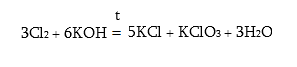
KClO3 – կալիումի քլորատը հայտնի է բերտոլետյան աղ անունով: Տաքացնելիս քլորատները քայքայվում են` կատալիզատորի (MnO2) առկայությամբ անջատելով թթվածին:
![]()
իսկ առանց կատալիզատորի ենթարկվելով անհամամասնական տրոհման`
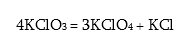
Պերհալոգենական թթուներից հայտնի են HClO4 – պերքլորական և H5JO6 – պերյոդական թթուները (ենթադրյալ J(OH)7 –ից պոկվել է մեկ մոլեկուլ ջուր): HClO4-ն ամենաուժեղ թթուներից մեկն է, կայուն է ազատ վիճակում: Դրա լուծույթը սառեցնելիս առաջացնում է բյուրեղահիդրատ ` HClO4 · H2O:
Կալիումի պերքլորատը ` KClO4 ստացվում է KClO3 –ը առանց կատալիզատորի տաքացնելիս.
![]()
Լուծույթում պերքլորատները չեն ցուցաբերում օքսիդիչ հատկություններ, սակայն չոր վիճակում ջերմաստիճանը բարձրացնելիս` դրանք ուժեղ օքսիդիչներ են:
H5JO6–ը թույլ հինգահիմն թթու է (K1 = 5 · 10–4): Խոնավածուծ բյուրեղային նյութ է, ջրում լուծվում է: Այս նյութերը ստացվում են իրենց աղերից ծծմբական թթվով դուրս մղելով.
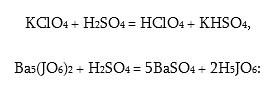
H5JO6–ի աղերը` պերյոդատները, նույնպես ստացվում են յոդատների օքսիդացումից էլեկտրաքիմիական եղանակով կամ քլոր ազդելով:
Հալոգեններն առաջացնում են միացություններ իրար հետ: Հայտնի են BrCl, JCl3, BrF5, JF7 միացությունները: Սրանք ստացվում են անմիջական սինթեզով. օքսիդիչներ են հատկապես ֆտոր պարունակող միացությունները:
2.7. ՀԱԼՈԳԵՆՆԵՐԻ ԵՎ ԴՐԱՆՑ ՄԻԱՑՈՒԹՅՈՒՆՆԵՐԻ ԿԻՐԱՌՈՒԹՅՈՒՆԸ
Հալոգեններից ամենալայն կիրառությունը ունի քլորը և դրա միացությունները: Քլորը մեծ քանակով օգտագործվում է շատ անօրգանական նյութերի աղաթթվի, քլորակրի, ժավելյան ջրի, բազմաթիվ քլորօրգանական նյութերի` մոնոմերների, պոլիմերների, թունաքիմիկատների ստացման համար: Քլորը կիրառվում է նաև գործվածքների, բջջանյութի սպիտակեցման, խմելու ջրի մանրէազերծման, գունավոր մետալուրգիայում հանքերի քլորացման համար: Քլորի միացություններից կարևոր են աղաթթուն, քլորակիրը: Քլորի բնական կարևորագույն միացությունը` NaCl-ը, կիրառվում է քլորի, HCl-ի և NaOH-ի ստացման համար օճառի արտադրության մեջ` որպես սննդի համեմունք և սննդամթերքները պահպանելու միջոց:
KCl-ը կիրառվում է գյուղատնտեսության մեջ որպես պարարտանյութ, CaCl2 · 6H2O-ը կիրառվում է սառեցնող խառնուրդներ պատրաստելու, իսկ անջուր CaCl2-ը` որպես խոնավածուծ նյութ. KClO3-ը` լուցկու արտադրության մեջ, պերքլորատները` պայթուցիկ խառնուրդներ պատրաստելու համար:
Ֆտորն օգտագործվում է օրգանական նյութերի, սառեցնեղ ագենտների (ֆրեոններ), ֆտորոպլաստների (տեֆլոն) ստացման համար, որը տետրաֆտորէթիլենի պոլիմերացման արդյունքն է: Այն բնութագրվում է ոչ մեծ խտությամբ, խոնավություն չի անցկացնում, ունի մեծ ջերմային կայունություն, բարձր էլեկտրամեկուսիչ հատկություններ: Տեֆլոնի վրա չեն ազդում հիմքերը և թթուները, նույնիսկ արքայաջուրը:
F2, OF2, ClF2, BrF5 հալոգենիդները և ֆտորի այլ միացություններ կիրառվում են որպես ռեակտիվ վառելանյութի օքսիդիչներ: HF-ը օգտագործվում է ապակու խածատման մետաղական ձուլվածքներից` ավազի հեռացման, UF4 ստանալու համար, որից հետագայում ստանում են մետաղական ուրան և UF6:
Կրիոլիտը` Na3AlF6-ը կիրառվում է ալյումինի ստացման համար:
Բրոմի և յոդի միացություններն օգտագործվում են դեղանյութերի, ներկանյութերի, արծաթի բրոմիդի ստացման համար, որը կիրառվում է լուսանկարչության մեջ: Արծաթի և կապարի յոդիդներն օգտագործվում են կարկտի դեմ պայքարող արկերի պատրաստման համար:
3. ԵՐԿՐՈՐԴԱՅԻՆ ԵՆԹԱԽՈՒՄԲ` ՄԱՆԳԱՆ, ՏԵԽՆԻՑԻՈՒՄ ԵՎ ՌԵՆԻՈՒՄ
Այս ենթախմբի տարրերից առավել մեծ տարածվածություն և գործնական նշանակություն ունի մանգանը: Ռենիումը հազվագյուտ տարր է, իսկ տեխնեցիումը` երկրի կեղևում չի հանդիպում և առաջին տարրն է որ ստացվել է արհեստականորեն (այստեղից էլ ծագել է նրա անունը), ուստի մենք կուսումնասիրենք մանգանի հատկությունները, առանձին նշելով ռենիումի առանձնահատկությունները:
3.1. ՏԱՐԱԾՎԱԾՈՒԹՅՈՒՆԸ ԲՆՈՒԹՅԱՆ ՄԵՋ
Մանգանը կազմում է երկրի կեղևի 9 · 10–2%-ը: Բնության մեջ հանդիպում է պիրոլուզիտ MnO2, հաուսմանիտ Mn3O4 և բրաունիտ` Mn2O3 միներալների ձևով:
Ռենիումը կազմում է երկրի կեղևի 10–7 %-ը, այն ինքնուրույն միներալներ չի առաջացնում, խառնուրդների ձևով պարունակվում է տարբեր մետաղների հանքերում, մասնավորապես մոլդենիտներում ` MoS2:
Մանգանը ստացվում է կարոթերմիկ կամ մետաղաթերմիկ եղանակներով` իր օքսիդները բարձր ջերմաստիճաններում սիլիցիումով կամ ալյումինումով վերականգնելով
![]()
Քանի որ մանգանը հիմնականում կիրառվում է որպես հավելանյութ տարբեր տեսակի պողպատներում, ապա որպես ստացման հումք վերցնում են պիրոլուզիտի և երկաթի օքսիդների խառնուրդ: Ստացվում է մանգանի և երկաթի համաձուլվածք` ֆերոմանգան: Մանգանի ոչ մեծ քանակներ ստանում են ալյումինաթերմիկ եղանակով.
![]()
Մաքուր մանգան ստանալու համար օգտագործում են էլեկտրոլիտիկ մեթոդը` էլեկտրոլիզի ենթարկելով MnSO4-ի ջրային լուծույթը:
Տեխնիցիում ![]() իզոտոպը ուրանի ռադիոակտիվ տրոհման արգասիքներից է: Այն ստացվում է միջուկային ռեակցիաներում օգտագործված ուրանից: Վերջինս լուծում են ազոտական թթվում և մշակում ծծմբաջրածնով: Արդյունքում առաջանում է տեխնիցիումի սուլֆիդի` Te2S7 նստվածք:
իզոտոպը ուրանի ռադիոակտիվ տրոհման արգասիքներից է: Այն ստացվում է միջուկային ռեակցիաներում օգտագործված ուրանից: Վերջինս լուծում են ազոտական թթվում և մշակում ծծմբաջրածնով: Արդյունքում առաջանում է տեխնիցիումի սուլֆիդի` Te2S7 նստվածք:
Ռենիումը ստանում են մոլիբդենային հանքերի թափոնների վերամշակումից: Դրանցում ռենիումի պարունակությունը լինում է շատ փոքր, ուստի նախ ստանում են խտանյութ, ապա ջրածնով վերականգնում խտանյութում պարունակվող կալիումի պերռենատը.
![]()
3.3. ՖԻԶԻԿԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
Մանգանը սպիտակ արծաթավուն, պինդ, օդում կայուն, ծանր մետաղ է: Խտությունը 7.44 գ/սմ3, tհալMn=12.44 0C: Մանգանը ունի չորս բյուրեղային ձևափոխություններ, որոնցից ցածր ջերմաստիճաններում կայուն α-Mn-ը դյուրաբեկ է:
Տեխնիցիումը
ռադիոակտիվ
է: դրա ![]() իզոտոպը
ենթարկվում
է β-տրոհման,
2 · 105 տարի
կիսաքայքայման
ժամանակով
իզոտոպը
ենթարկվում
է β-տրոհման,
2 · 105 տարի
կիսաքայքայման
ժամանակով
Ռենիումը սպիտակ արծաթավուն, ծանր, դժվարահալ մետաղ է: Խտությունը 21 գ/սմ3: Իր դժվարահալությամբ ռենիումը զիջում է միայն վոլֆրամին` tհալRe = 31.80 0C:
3.4. ՔԻՄԻԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ
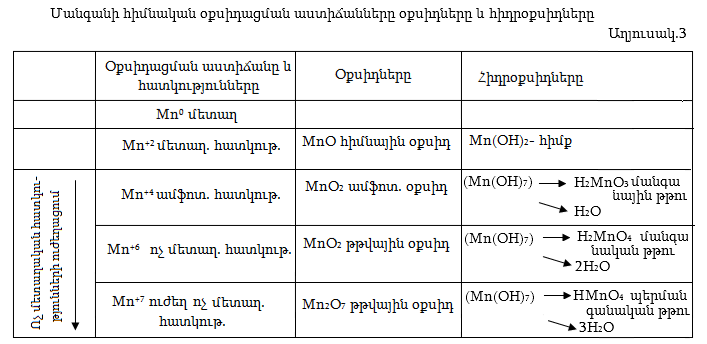
Ինչպես ցույց տրվեց խմբի ընդհանուր բնութագրում, Mn-ը, Te-ը և Re-ը պետք է լինեն մետաղներ: Մանգանը ակտիվ մետաղ է, օդում պատվում է օքսիդի բարակ շերտով, որը դրան պաշտպանում է հետագա օքսիդացումից: Սենյակային ջերմաստիճանում ջրի հետ գործնականում չի փոխազդում, սակայն տաքացնելիս ռեակցիան արագանում է: Մանգանի էլեկտրոնային բանաձևն է 1s22s22p63s23p64s23d5: Այն կարող է կորցնել վալենտային յոթ էլեկտրոնները` հանդես բերելով մինչև +7 օքսիդացման աստիճան: Քննարկենք դրանցից առավել բնութագրականները: Թթուների հետ փոխազդելիս մանգանը կորցնում է արտաքին շերտի 2 էլեկտրոնները և ցուցաբերում է +2 օքսիդացման աստիճան:
![]()
Երկվալենտ վիճակում (...3d54s0) մանգանը դեռևս կարող է կորցնել 5 էլեկտրոն, հետևաբար պետք է ունենա մետաղական հատկություններ, ուստի համապատասխան օքսիդը, որի բանաձևը պետք է լինի MnO, պետք է ներկայացնի հիմնային օքսիդ, իսկ դրան համապատասխանող հիդրօքսիդը` Mn(OH)2-ը, որպես հիմնային օքսիդի հիդրօքսիդ` պետք է լինի հիմք:
![]()
Քանի որ մանգանը ծանր մետաղ է, MnO-ն և Mn(OH)2-ը ջրում չպետք է լուծվեն, ուստի Mn(OH)2-ը պետք է ստացվի անուղղակի եղանակով.
MnCl2 + 2NaOH = Mn(OH)2$ + 2NaCl
Պինդ վիճակում մանգանի (II) աղերը վարդագույն են, իսկ դրանց լուծույթները` գրեթե անգույն: MnO-ն կանաչ գույնի փոշի է:
Երկվալենտ մանգանի հիդրօքսիդը օդում թթվածնով արագ օքսիդանում է` անցնելով քառավալենտ վիճակի:
Քառավալենտ վիճակի անցնելիս մանգանը կորցնում է նախավերջին շերտի d– ենթաշերտի հինգ վալենտային էլեկտրոններից ևս երկուսը (...3d34s0): Հետևաբար մանգանը այս վիճակում կարող է կորցնել ևս երեք էլեկտրոն (մետաղական հատկություններ), բայց և կարող է վերցնել կորցրած վերջին երկու էլեկտրոնները (ոչ մետաղական հատկություններ), ուստի քառավալենտ մանգանը պետք է լինի երդիմի (ամֆոտեր) համապատասխան օքսիդը` MnO2-ը պետք է լինի ամֆոտեր օքսիդ, իսկ համապատասխան հիդրօքսիդը Mn(OH)4` ամֆոտեր հիդրօքսիդ:
![]()
Քանի որ քառավալենտ վիճակում մանգանը դեռևս ունի մետաղական հատկություններ, ապա որպես ծանր մետաղի օքսիդ և հիդրօքսիդ MnO2-ը և Mn(OH)4-ը ջրում չպետք է լուծվեն: Անցումը երկվալենտից քառավալենտ վիճակի կարող է իրականանալ օդի` թթվածնով Mn(OH)2-ի օքսիդացումով: Վերջինիս սպիտակ նստվածքն արագ գորշանում է.
![]()
MnO2-ը մուգ գորշավուն պինդ նյութ է, այն մանգանի ամենակայուն միացությանն է: Դրա և¢ թթվային, և¢ հիմնային հատկությունները թույլ են արտահայտված: MnO2-ը թթվային միջավայրում ուժեղ օքսիդիչ է, կիրառվում է աղաթթվից քլոր ստանալիս (տես էջ 8), գալվանական էլեմենտներ պատրաստելիս:
Մանգանի եռավալենտ և հինգվալենտ միացությունները ջրային լուծույթներում ընդհանուր առմամբ անկայուն են և չունեն մեծ գործնական նշանակություն:
Քառավալենտ մանգանի հետագա օքսիդացման դեպքում այն անցնում է վեցվալենտ վիճակի (...3d14s0): Այս դեպքում մանգանը իր յոթ վալենտական էլեկտրոններից կորցրել է վեցը` արտաքին շերտի երկու և նախավերջին շերտի d-ենթաշերտի էլեկտրոններից չորսը:
Հետևաբար, մանգանի էլկետրոնը վերցնելու, այսինքն` ոչ մետաղական հատկությունները քառավալենտի համեմատ պետք է ուժեղանան` Mn+6-ը պետք է ունենա ոչ մետաղական հատկություն:
Համապատասխան օքսիդը, որը պետք է լիներ MnO3, որպես ոչ մետաղի օքսիդ պետք է լիներ (այն ազատ չի ստացվել) թթվային օքսիդ, իսկ հիդրօքսիդը, որի բանաձևը որպես հիդրօքսիդ պետք է լիներ Mn(OH)6 իրենից պետք է ներկայացնի թթու և ըստ հիդրօքսիդների ջրազրկման կանոնի պետք է անջատի երկու մոլեկուլ ջուր.
![]()
և ունենա H2MnO4 բանաձևը: Ըստ թթուների անվանակարգման պետք է կոչվի մանգանական թթու, իսկ աղերը` K2MnO4 մանգանատներ:
Այսպիսով`
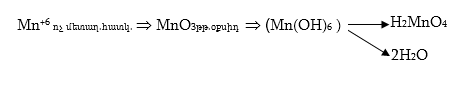
Մանգանական թթուն անկայուն թթու է և լուծույթում հեշտությամբ ենթարկում է անհամամասնական քայքայման:
Անցումը քառավալենտ վիճակից վեցվալենտի կարելի է իրականացնել ուժեղ օքսիդիչների ազդեցությամբ:
![]()
Միջավայրում
ավելացվում է
ալկալի
որովհետև Mn+6O2 օքսիդանալով
պետք է
վերածվեր MnO3
թթվային
օքսիդի, որը
հիմքի
ներկայությամբ
վերածվում է
համապատասխան
թթվի H2MnO4
աղի` K2MnO4-ի: ![]() իոնն
ունի կանաչ
գույն: Ուստի և¢
մանգանական
թթուն, և¢
մանգանատներն
ունեն այդ
գույնը:
իոնն
ունի կանաչ
գույն: Ուստի և¢
մանգանական
թթուն, և¢
մանգանատներն
ունեն այդ
գույնը:
Վեցվալենտ մանգանի միացությունները լուծույթներում կայուն չեն և ենթարկվում են ինքնաօքսիդացման-ինքնավերականգման` վերածվելով քառավալենտ և յոթավալենտ մանգանի միացությունների:
Վեցվալենտից յոթվալենտ վիճակի անցնելիս մանգանը կորցնում է իր վերջին վալենտական 3d1 էլեկտրոնը: Այս դեպքում մանգանը կարող է միայն վերցնել էլեկտրոններ, ուստի կունենա ուժեղ ոչ մետաղական հատկություններ: Համապատասխան օքսիդը` Mn2O7, պետք է լինի թթվային օքսիդ, իսկ դրան համապատասխան հիդրօքսիդը` թթու: Այն պետք է ունենա Mn(OH)7 բանաձևը, բայց կորցնելով երեք մոլեկուլ ջուր կառաջացնի HMnO4 բանաձևով թթու` պերմանգանական թթու:
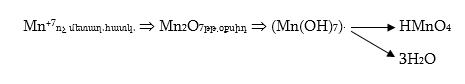
Պերմանգանական թթուն ազատ վիճակում չի ստացվել և հայտնի է միայն լուծույթներում: Այն ուժեղ թթու է և նոսր լուծույթներում գործնականում լրիվ դիսոցվում է:
Անցումը վեցվալենտից յոթվալենտի կարող է իրականանալ մանգանատի օքսիդացումով.
![]()
ինչպես նաև նշված անհամամասնական քայքայումով:
![]()
![]() պերմանգանատ
իոնը
կարմրամանուշակագույն
է, ուստի այս
ռեակցիաներում
կանաչ լուծույթը
փոխվում է
կարմրամանուշակագույնի:
պերմանգանատ
իոնը
կարմրամանուշակագույն
է, ուստի այս
ռեակցիաներում
կանաչ լուծույթը
փոխվում է
կարմրամանուշակագույնի:
Կալիումի պերմանգանատը` KMnO4 պերմանգանական թթվի ամենալայն կիրառվող աղն է: Այն առաջացնում է մուգ մանուշակագույն բյուրեղներ. որոնք ջրում լուծվում են:
Արդյունաբերության մեջ կալիումի պերմանգանատը ստացվում է մանգանատի էլեկտրոլիտիկ օքսիդացումից.
![]()
Այսպիսով,
օքսիդացման
աստիճանի
մեծացման հետ
մեկտեղ
մանգանի
էլեկտրոն
վերցնելու
հատկությունը
ուժեղանում է,
ուստի
օքսիդիչ
հատկությունները
պետք է
մեծանան: Այդ
պատճառով
մանգանի
յոթվալենտ
միացությունները,
օրինակ
պերմանգանատները
ուժեղ
օքսիդիչներ
են: Դրանց
օքսիդիչ հատկությունների
դրսևորման չափը
(թե քանի
էլեկտրոն
կվերցնի Mn+7-ը) կախված
է միջավայրի
բնույթից:
Ամենամեծ օքսիդիչ
ակտիվություն
Mn+7 հանդես է
բերում
թթվային
միջավայրում,
ուր վերցնելով
առավելագույն
թվով հինգ
էլեկտրոն,
վերականգնվում
է մինչև Mn+2
(քանի որ Mn+2-ը
օքսիդիչ չէ),
միջին
ակտիվություն
չեզոք և թույլ
հիմնային
միջավայրերում,
ուր
վերցնելով
երեք
էլեկտրոն
վերականգնվում
է մինչև Mn+4 և
ամենափոքր ակտիվությունը
ուժեղ
հիմնային
միջավայրում,
ուր վերցնում
է միայն մեկ
էլեկտրոն և վերածվում
Mn+6: Դա
բացատրվում է
նրանով, որ
թթվային
միջավայրում H+
իոնները
խցկվում են ![]() անիոնի
մեջ,
թուլացնելով
կապը մանգանի
և թթվածնի
իոնների
միջև և դրանով
հեշտացնում
են Mn+7-ի էլեկտրոն
վերցնելը:
Չեզոք
միջավայրում
անիոնի
մեջ,
թուլացնելով
կապը մանգանի
և թթվածնի
իոնների
միջև և դրանով
հեշտացնում
են Mn+7-ի էլեկտրոն
վերցնելը:
Չեզոք
միջավայրում ![]() իոնի
խարխլումը
ավելի թույլ է
որովհետև ջրի բևեռային
մոլեկուլների
բևեռացնող
ազդեցությունը
ավելի փոքր է,
քան H+-ինը:
Ուժեղ
հիմնային
միջավայրում
OH–
իոնները,
ընդհակառակը,
ավելի
ամրացնում են
Mn–O կապերը,
ուստի
մանգանը
վերցնում է
նվազագույն
թվով` մեկ
էլեկտրոն:
Հետևաբար
թթվային միջավայրում
վերցնելով
հինգ
էլեկտրոն
պետք է վերածվի
Mn+2-ի, այսինքն`
MnO-ի, որը թթվի
ներկայությամբ
պետք է
վերածվի աղի:
իոնի
խարխլումը
ավելի թույլ է
որովհետև ջրի բևեռային
մոլեկուլների
բևեռացնող
ազդեցությունը
ավելի փոքր է,
քան H+-ինը:
Ուժեղ
հիմնային
միջավայրում
OH–
իոնները,
ընդհակառակը,
ավելի
ամրացնում են
Mn–O կապերը,
ուստի
մանգանը
վերցնում է
նվազագույն
թվով` մեկ
էլեկտրոն:
Հետևաբար
թթվային միջավայրում
վերցնելով
հինգ
էլեկտրոն
պետք է վերածվի
Mn+2-ի, այսինքն`
MnO-ի, որը թթվի
ներկայությամբ
պետք է
վերածվի աղի:
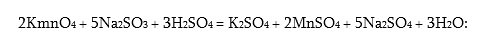
Չեզոք միջավայրում Mn+7-ը, վերցնելով երեք էլեկտրոն, վերածվում է Mn+4-ի և մնում է MnO2-ի ձևով:
![]()
իսկ ուժեղ հիմնային միջավայրում վերցնելով մեկ էլեկտրոն` վեր է ածվում Mn+6-ի: Այդ դեպքում պետք է առաջանար MnO3, սակայն քանի որ վերջինս թթվային օքսիդ է, հիմքի հետ առաջացնում է համապատասխան թթվի աղը` մանգանատ:
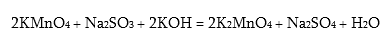
Այսպիսով` օքսիդացման աստիճանի մեծացման հետ մեկտեղ մանգանի հատկությունները փոխվում են մետաղականից մինչև բնորոշ ոչ մետաղականի (աղյուսակ 3): Դրա հետևանքով համապատասխան օքսիդների և հիդրօքսիդների հատկությունները փոխվում են հիմնայինից` թթվայինի: Միաժամանակ օքսիդիչ հատկությունները ուժեղանում են:
Չոր պերմանգանատը տաքացնելիս քայքայվում է` անջատելով թթվածին.
![]()
Մանգանի բարձրագույն օքսիդը` Mn2O7 գորշականաչավուն յուղանման հեղուկ է: Այն պայթում է թույլ հարվածի կամ տաքացման դեպքում, քայքայվելով Mn2O5-ի O2-ի: Mn2O7-ը ուժեղ օքսիդիչ է:
Te2O7 և Re2O7 օքսիդները ստացվում են փոշի մետաղները թթվածնի ներկայությամբ տաքացնելով: Ի տարբերություն Mn2O7-ի սրանք թույլ օքսիդիչներ են: Re2O7–ը խոնավածուծ է և խոնավություն կլանելիս վեր է ածվում HReO4-ի:
Պերմանգանական թթուն ուժեղ թթու է, կայուն է միայն լուծույթներում: Դրան համապատասխան անհիդրիդը` Mn2O7-ը գորշ յուղանման հեղուկ է, տաքացնելիս քայքայվում է` առաջացնելով MnO2 և թթվածին:
Քանի որ թթվային միջավայրում որպես օքսիդիչ հանդես գալիս պերմանգանատը կարմրամանուշակագույն լուծույթը գունազրկվում է, այն օգտագործվում է քանակական անալիզում վերականգնիչների տիտրման համար: Տիտրման վերջին կետը նշվում է կալիումի պերմանգանատի կարմրամանուշակագույն երանգի անհետացմամբ, այսինքն այս դեպքում տիտրող նյութը ինքը հանդիսանում է ինդիկատոր: Եռավալենտ և հինգավալենտ վիճակները մանգանի համար բնորոշ չեն, թեև այն առաջացնում է Mn2O3 և Mn3O4 (MnO · Mn2O3) օքսիդներ:
Պերտեխնեցիումական թթուն` HTeO4 մուգ կարմիր բյուրեղային նյութ է: Ստացվում է Te2O7-ի և ջրի փոխազդեցությունից.
![]()
Ռենիումի միացություններից ամենակայունը ռենիումի (VII) օքսիդն է պերռենիումական թթվի (HRO4) անհիդրիդը: Վերջինս ստացվում է Re2O7-ը ջրում լուծելիս կամ ռենիումը ազոտական թթվի հետ փոխազդելիս: Ազատ պերռենական թթուն լուծույթից անջատել չի հաջողվում, քանի որ ջուրը հեռացնելիս լուծույթից նստում է Re2O7: Դրա աղերը` պերռենատները, անգույն են և մեծ մասամբ լավ լուծվում են ջրում: Տաքացնելիս ալկալիական մետաղների պերռենատները, ի տարբերություն պերմանգանատների, հալվում են առանց քայքայվելու: Յուրահատկություն է որ պերռենիումական թթվի լուծույթի վրա H2S ազդելիս առաջանում է ռենիումի սուլֆիդ` Re2S7.
![]()
3.5. ՄԱՆԳԱՆԻ ԵՎ ՌԵՆԻՈՒՄԻ ԿԻՐԱՌՈՒԹՅՈՒՆՆԵՐԸ
Այս
ենթախմբի
տարրերից
առավել մեծ
նշանակություն
ունի մանգանը:
Մեծ
քանակներով
այն օգտագործվում
է պողպատներ
ստանալու
համար,
որովհետև
բարձրացնում
է վերջիններիս
որակը: Քանի
որ մանգանը
ավելի լավ է
փոխազդում
ծծմբի հետ քան
երկաթը ![]() հալված
պողպատի մեջ
մանգան
ավելացնելիս,
պողպատում
եղած ծծումբը
կապվում է MnS-ի ձևով,
որն անցնում է
շլակի մեջ:
Դրանից բարձրանում
է պողպատի
որակը: Մինչև 15%
մանգան պարունակող
պողպատն ունի
բարձր
կարծրություն
և ամրություն:
Պղնձի` ալյումինի
հետ
առաջացրած
մանգանի համաձուլվածքը
(12%Mn) ունի
էլեկտրադիմադրության
ցածր
ջերմաստիճանային
գործակից և
օգտագործվում
է դիմադրության
պահեստատուփեր
պատրաստելու
համար:
Մանգանի և
ալյումինի
առաջացրած Հեյսլերի
համաձուլվածքից
պատրաստում
են ուժեղ
հաստատուն
մագնիսներ:
Մանգանի (IV)
օքսիդը
լայնորեն
օգտագործվում
է որպես օքսիդիչ
(ապաբևեռացնող)
հոսանքի
քիմիական աղբյուրներում:
Կալիումի
պերմանգանատը
օգտագործվում
է որպես օքսիդիչ
շատ
օրգանական
սինթեզներում,
անալիտիկ
քիմիայում
(պերմանգանատոմեյրիա)
և բժշկության
մեջ: Մանգանի
միացությունները
մտնում են շատ
կատալիզատորների,
այդ թվում
ներկերի «չորացման»
արագացուցիչների
բաղադրության
մեջ:
հալված
պողպատի մեջ
մանգան
ավելացնելիս,
պողպատում
եղած ծծումբը
կապվում է MnS-ի ձևով,
որն անցնում է
շլակի մեջ:
Դրանից բարձրանում
է պողպատի
որակը: Մինչև 15%
մանգան պարունակող
պողպատն ունի
բարձր
կարծրություն
և ամրություն:
Պղնձի` ալյումինի
հետ
առաջացրած
մանգանի համաձուլվածքը
(12%Mn) ունի
էլեկտրադիմադրության
ցածր
ջերմաստիճանային
գործակից և
օգտագործվում
է դիմադրության
պահեստատուփեր
պատրաստելու
համար:
Մանգանի և
ալյումինի
առաջացրած Հեյսլերի
համաձուլվածքից
պատրաստում
են ուժեղ
հաստատուն
մագնիսներ:
Մանգանի (IV)
օքսիդը
լայնորեն
օգտագործվում
է որպես օքսիդիչ
(ապաբևեռացնող)
հոսանքի
քիմիական աղբյուրներում:
Կալիումի
պերմանգանատը
օգտագործվում
է որպես օքսիդիչ
շատ
օրգանական
սինթեզներում,
անալիտիկ
քիմիայում
(պերմանգանատոմեյրիա)
և բժշկության
մեջ: Մանգանի
միացությունները
մտնում են շատ
կատալիզատորների,
այդ թվում
ներկերի «չորացման»
արագացուցիչների
բաղադրության
մեջ:
Ռենիումը բացառիկ հատկություններ ունեցող մետաղ է` դժվարահալ է, մեծ մեխանիկական ամրություն ունի, բայց թանկ է: Դրա համաձուլվածքները վոլֆրամի և մոլիբդենի հետ կիրառվում են էլեկտրալամպերի և էլեկտրավակուումային սարքերի մեջ, ունեն ավելի մեծ ծառայության ժամկետ, քան վոլֆրամը: Ռենիումի և վոլֆրամի համաձուլվածքներից պատրաստում են ջերմազույգեր, որոնցով կարելի է չափել 00C-ից մինչև 25000C Ռենիումի միացությունները կատալիզատորներ են ամոնիակի և մեթանի օքսիդացման, էթիլենի հիդրման ռեակցիաների համար:
Ամփոփում
Պարբերական համակարգի յոթներորդ խմբի տարրերը ունեն յոթական վալենտական էլեկտրոններ: Ֆտորի, քլորի, բրոմի և յոդի ատոմներում այդ էլեկտրոնները գտնվում են արտաքին շերտում` երկուսը s- և հինգը p- ենթաշերտերում (...ns2np5), ուստի այդ տարրերը հեշտությամբ վերցնում են մեկ էլեկտրոն լրացնելով արտաքին շերտը և հանդիսանում են ուժեղ ոչ մետաղներ: Ոչ մետաղական հատկությունները F®J շարքում աստիճանաբար թուլանում են: Հալոգենները բնության մեջ տարածված են աղերի ձևով: Ազատ վիճակում ֆտորը և քլորը սուր հոտով թունավոր գազեր են, բրոմը հեղուկ է. իսկ յոդը` բյուրեղական պինդ նյութ: Ֆտորն արդյունաբերության մեջ ստացվում է իր աղերի հալույթներից, քլորը` աղերի ջրային լուծույթի էլեկտրոլիզով, իսկ բրոմը և յոդն իրենց աղերից` քլորով արտամղելով:
Ջրածնի, իրենցից թույլ ոչ մետաղների և մետաղների հետ հետ փոխազդելիս հալոգեններնն առաջացնում են միացությունները, որոնցում հանդես են բերում –1 օքսիդացման աստիճան: Ջրածնական միացությունները` HF, HCl, HBr և HJ, որոնք ստացվում են անմիջական սինթեզով կամ աղերից խիտ ծծմբական թթվով դուրս մղելով, ջրում լուծվում են առաջացնելով թթուներ, որոնց ուժը այդ շարքում մեծանում է: Այս թթուներից HF-ն ունի առանձնահատկություն: Այն փոխազդում է SiO2-ի հետ, ուստի լուծում է ապակին: Հալոգենաջրածնական թթուները ունեն վերականգնիչ հատկություններ: Մետաղների հետ հալոգենները հեշտությամբ փոխազդում են առաջացնելով աղերի, որտեղից էլ ծագել է դրանց «հալոգեններ» (աղածիններ) անունը: Հալոգեններից ամենաակտիվը` ֆտորը փոխազդում է ջրի հետ օքսիդացնելով O2–-ը: Քլորը, բրոմը և յոդը թթվածնի հետ ուղղակիորեն չեն միանում: Ալկալիների հետ փոխազդեցության հետևանքով ստացված թթվածնավոր միացություններում հալոգենները հանդես են բերում մինչև +7 օքսիդացման աստիճան, առաջացնում են թթվային օքսիդներ և դրանց համապատասխանող թթվածնավոր թթուներ, որոնցում հանդես են բերում+1, +3, +5 և +7 օքսիդացման աստիճաններ: Քլորն առաջացնում է HClO, HClO2, HClO3 և HClO4 թթուները: Օքսիդացման աստիճանի մեծացման հետ մեկտեղ այդ շարքում թթուների ուժը մեծանում է և պերքլորական թթուն` HClO4-ը ամենաուժեղ թթուն է, իսկ հիպոքլորային թթուն` HClO-ն դրանցից ամենաուժեղ օքսիդիչը, շնորհիվ այն բանի, որ հեշտությամբ քայքայվում է առաջացնելով ատոմար թթվածին: Cl–Br–J շարքում նույն օքսիդացման աստիճանով թթվածնավոր թթուներում թթուների ուժը թուլանում է: Խմբի մեջ մտնող մյուս տարրերը` Mn, Te, Re-ը յոթ վալենտական էլեկտրոններից երկուսը ունեն արտաքին շերտում, հինգը` նախավերջին d-ենթաշերտում (...(n-1)d5ns2), ուստի սրանք կարող են միայն կորցնել էլեկտրոններ և մետաղներ են:
Տարածված են օքսիդների ձևով, տեխնեցիումը ստացված է արհեստականորեն: Մանգանը և ռենիումը ստացվում են մետաղոթերմիկ կամ կարբոթերմիկ եղանակներով, սպիտակ, արծաթավուն փայլով ծանր մետաղներ են, ռենիումը դժվարահալ է (3180 0C): Մանգանը հանդես է բերում մինչև +7 օքսիդացման աստիճան, ընդ որում վերջինիս մեծացման հետ մեկտեղ հատկությունները փոխվում են մետաղականից ամֆոտերի, ապա ոչ մետաղականի, իսկ համապատասխան օքսիդների և հիդրօքսիդների հատկությունները հիմնայինից` թթվայինի: Mn0-ն և Mn2+-ը ունեն մետաղական ուստի MnO-ն և Mn(OH)2 հիմնային հատկություններ, Mn4+-ը ուստի և MnO2-ը, Mn(OH)4-ը ամֆոտեր, իսկ Mn6+-ը և Mn7+-ը ոչ մետաղական ուստի և դրանց համապատասխանող օքսիդներն ու հիդրօքսիդները` MnO3, Mn2O7,
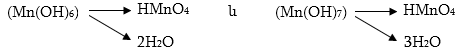
թթվային հատկություններ: Օքսիդացման աստիճանի մեծացման հետ մեկտեղ աճում են օքսիդիչ հատկությունները և պերմանգանական թթուն (HMnO4) ու դրա աղերը (KMnO4) ուժեղ օքսիդիչներ են: Ընդ որում վերջինիս օքսիդիչ հատկությունների ուժգնությունը կախված է միջավայրից և ամենից ուժեղ դրսևորվում է թթվային միջավայրում: Թթվային միջավայրում յոթվալենտ մանգանը վերականգնվում է մինչև երկվալենտ, չեզոքում` քառավալենտ, իսկ հիմնայինում` վեցվալենտ վիճակ:
Սովորելու նպատակը
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1. Տալ յոթներորդ խմբի ընդհանուր բնութագիրը: Ելնելով խմբի մեջ մտնող տարրերի ատոմների էլեկտրոնային թաղանթների կառուցվածքից, պատճառաբանել խումբը ենթախմբի բաժանելը, հալոգենների ոչ մետաղներ և մանգանի ենթախմբի տարրերի մետաղներ լինելը:
2. Ելնելով հալոգենների ատոմների էլեկտրոնային թաղանթների կառուցվածքից արտածել դրանց քիմիական հատկություններն, այն բաժանելով երկու հիմնական մասերի.
ա) երբ փոխազդում են իրենցից փոքր էլեկտրաբացասականություն ունեցող տարրերի հետ (ջրածին, մետաղներ),
բ) երբ առաջացնում են իրենցից մեծ էլեկտրաբացասականություն ունեցող թթվածնի պարունակությամբ միացություններ:
3. Համեմատել հալոգենների դրանց ջրածնական թթվածնավոր միացությունների հատկությունները F–Cl–Br–J շարքում, բացատրել ֆտորի և դրա միացությունների առանձնահատկությունները:
4. Ելնելով մանգանի ենթախմբի տարրերի ատոմների էլեկտրոնային թաղանթների կառուցվածքից արտածել այդ մետաղի հատկությունները, դրանց միացությունների բանաձևերն ու հատկությունները, պատճառաբանել օքսիդացման աստիճանի մեծացման հետ մեկտեղ այդ հատկությունների փոփոխման օրինաչափությունը:
Հիմնական հասկացությունները և միացությունները
«Հալոգեն» նշանակում է աղածին: Ֆտորը` (F2) դեղնավուն, տհաճ հոտով գազ է, քլորը`(Cl2)-դեղնականաչավուն գազ է, բրոմը` (Br2) կարմրագորշավուն հեղուկ է, յոդը` սև մետաղական փայլով պինդ նյութ է: Հալոգենները ակտիվ ոչ մետաղներ են, միացություններում ցուցաբերում են –1 ինչպես նաև դրական (բացառությամբ ֆտորի) մինչև +7 օքսիդացման աստիճաններ: Ջրածնական միացությունները HF, HCl, HBr և HJ անգույն, սուր հոտով գազեր են: Սրանց ջրային լուծույթները ուժեղ թթուներ են, որոնց ուժը այդ շարքում մեծանում է HCl` քլորաջրածին, ջրային լուծույթը` աղաթթու, աղերը` քլորիդներ: HF` ֆտորաջրածին, ջրային լուծույթը` քլորաջրածնական (պլավիկյան) թթու, աղերը` ֆտորիդներ: Թույլ թթու է, լուծում է SiO2-ը:
Չեզոք և +2 օքսիդացման աստիճանում մանգանը ցուցաբերում է մետաղական հատկություններ, օքսիդը`MnO և հիդրօքսիդը` Mn(OH)2` հիմնային հատկություններ: Քառավալենտ վիճակում (+4) մանգանը երկդիմի հատկություններ ունի, օքսիդը` MnO2 և հիդրօքսիդը` Mn(OH)4` ամֆոտեր են: Մանգանը վեց- և յոթ վալենտ վիճակում ունի ոչ մետաղական հատկություններ, համապատասխան օքսիդները թթվային են , հիդրօքսիդները` թթուներ (MnO3 և H2MnO4, Mn2O7 և HMnO4): H2MnO4- մանգանական թթու, անկայուն է աղերը` մանգանատներ (K2MnO4): HMnO4-պերմանգանական թթու, աղերը` պերմանգանատներ (KMnO4): Պերմանգանատները ուժեղ օքսիդիչներ և ախտահանիչներ են: Տաքացնելիս քայքայվում են: Պերռենատները տաքացնելիս չեն քայքայվում: