ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ
ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ
ՀԱՅԱՍՏԱՆԻՆ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
(ՊՈԼԻՏԵԽՆԻԿ)
Քիմիական տեխնոլոգիաների և
բնապահպանական
ճարտարագիտության ֆակուլտետ
Ընդհանուր քիմիայի և քիմիական
Պրոցեսների ամբիոն
Աարմեն Շահենի Գրիգորյան
ՊԱՐԲԵՐԱԿԱՆ ՀԱՄԱԿԱՐԳԻ ՎԵՑԵՐՈՐԴ
ԽՈՒՄԲԸ
ՈՒսումնական ձեռնարկ
ԵՐԵՎԱՆ
ՃԱՐՏԱՐԱԳԵՏ
2011
ՀՏԴ 54 (07)
ԳՄԴ 24.126 ց 7
Գ 888
Հրատարակվում է Հայաստանի պետական
ճարտարագիտական համալսարանի
22.01.2011թ. գիտական խորհրդի նիստում
Հաստատված 2011թ. հրատարակչական
պլանի համաձայն
Գրիգորյան Ա.
Գ 888 Պարբերական համակարգի վեցերորդ խումբը: Ուսումնական ձեռնարկ / Արմեն Շահենի Գրիգորյան; ՀՊՃՀ.- Եր. Ճարտարագետ, 2011.- 40էջ
Ձեռնարկում շարադրված է Vl խմբի տարրերի ընդհանուր բնութագիրը, նյութերի ֆիզիկական հատկությունները, ստացման լաբորատոր և արդյունաբերական եղանակները, կիրառությունները: Ելնելով տարրերի ատոմի կառուցվածքից` արտածման մեթոդով դուրս են բերված դրանց հիմնական միացությունների բանձևերն ու քիմիական հատկությունները: Բերված է համառոտ ամփոփում, սովորելու նպատակը և հիմնական հասկացությունները:
Ներկայացված է Քիմիատեխնոլոգիական և բնապահպանական ճարտարագիտություն մասնագիտության ուսանողների, մագիստրոսների և դասախոսների համար:
ՀՏԴ 54 (07)
ԳՄԴ 24.126 ց 7
ISBN 978-9939-55-616-1
© ՃԱՐՏԱՐԱԳԵՏ 2011
© Գրիգորյան Ա. 2011
ԲՈՎԱՆԴԱԿՈՒԹՅՈՒՆ
2.2.1.Տարածվածությունը բնության մեջ
2.2.2. ֆիզիկական հատկությունները
2.2.4. ԹԹվածնի քիմիական հատկությունները
2.2.5. Թթվածմի կիրառությունները
2.3.1. Տարածվածությունը բնության մեջ
2.3.3. Ֆիզիկական հատկությունները
2.3.4. Ծծմբի քիմիական հատկությունները
2.3.6. Ծծմբի թթվածնավոր միացությունները
2.3.7. Ծծմբի թթվածնավոր թթուները
2.3.8. Ծծմբի և դրա միացությունների կիրառությունը
2.4. Սելեն, տելուր և պոլլոնիում
2.4.1. Տարածվածությունը բնության մեջ
2.4.2. Ֆիզիկական հատկությունները
2.4.4. Քիմիկան հատկությունները
3.2.1. Տարածվածությունը բնության մեջ
3.2.2. Ֆիզիկական հատկությունները
3.2.4. Քիմիկան հատկությունները
3.3.1. Տարածվածությունը բնության մեջ
3.3.2. Ֆիզիկական հատկությունները
3.3.4. Քիմիական հատկությունները
6. Հիմնական հասկացությունները և միացությունները
1. Խմբի ընդհանուր բնութագիրը
Վեցերորդ խմբի տարրերի համար ընդհանուրն այն է, որ դրանք բոլորն էլ ունեն խմբի համարին հավասար` վեցական վալենտական էլելկտրոններ: Սակայն այդ էլեկտրոնները երկու տարբեր ձևով են բաշխված վալենտային (արտաքին և նախավերջին) շերտերում: Դա առաջացնում է քիմիական հատկությունների տարբերություն, որի պատճառով խումբը բաժանվում է երկու ենթախմբի:
Խմբի մեջ մտնող տարրերից թթվածինը, ծծումբը, սելենը, տելուրը և պոլլոնիումը բոլոր վեցական վալենտական էլեկտրոններն ունեն արտաքին շերտում, երկու`s- և չորս` P- ենթաշերտերեում:
Դրանց ընդհանուր էլեկտրոնային բանաձևը ns2nP4 է, որտեղ n-ը այն պարբերության համարն է որում տարրը գտնվում է: Քանի որ սրանք արտաքին շերտում ունեն վեցական էլեկտրոններ, այս տարրերի ատոմները պետք է հեշտությամբ իրենց միացնեն երկու էլեկտրոն, լրացնելով այդ շերտը, ուստի պետք է լինեն ուժեղ ոչ մետաղներ, իհարկե ավելի թույլ քան յոթերորոդ խմբի համապատասխան տարրերը (հալոգենները): Միջուկի լիցքի աճին զուգընթաց O, S, Se, Te, Po շարքում ատոմների շառավիղների մեծացման հետևանքով տարրերի էլեկտրոն միացնելու` այսինքն ոչ մետաղական հատկությունները պետք է թուլանան: Այս տարրերը կամում են խմբի գլխավոր ենթախումբը:
Խմբի մեջ
մտնող մնացած տարրերը`
քրոմը, մոլիբդենը
և վոլֆրամը վեցական
վալենտակլան էլեկտրոններից
մեկը կամ երկուսն
ունեն արտաքին
շերտի s-, չորսը կամ
հինգը նախավերջին
շերտի d-ենթաշերտում:
Սրանց ընդհանուր
էլեկտրոնային
բանաձևը պետք է
լիներ
(n-1)d4ns2, սակայն
էլեկտրոնի գլորման
երևույթի պատճառով
քրոմի, և մոլիբդենի
վեցական վալենտական
էլեկտրոններից
մեկը արտաքին ![]() ենթաշերտում
է, հինգը` նախավերջին
d ենթշերտում: Քանի
որ արտաքին շերտում
մեկ կամ երկու
էլեկտրոններ են,
քիմիական փոխարկումների
ժամանակ այս տարրերը
կարող են միայն
կորցնել էլեկտրոններ,
ուստի պետք է լինեն
մետաղներ: Սրանք
կամում են խմբի
երկրորոդական
ենթախումը: s
ենթաշերտում
է, հինգը` նախավերջին
d ենթշերտում: Քանի
որ արտաքին շերտում
մեկ կամ երկու
էլեկտրոններ են,
քիմիական փոխարկումների
ժամանակ այս տարրերը
կարող են միայն
կորցնել էլեկտրոններ,
ուստի պետք է լինեն
մետաղներ: Սրանք
կամում են խմբի
երկրորոդական
ենթախումը: s
2. Գլխավոր ենթախումբ
2.1. Պատմական ակնարկ
Թթվածինը հայտնաբերել է Շելյենը (1772) և Պրիստլին 1774թ-ին: Տարրը «Թթվածին» կոչել է Լաուազեն, քանի որ այն մտնում էր շատ թթուների բաղադրությաքն մեջ:
Ծծումբը հայտնի է մարդկությանը հին դարերից, քանի որ բնության մեջ կա ազատ վիճակում: Որպես քիմիական տարր և պարզ նյութ այն հաստատվել է Լաուաենի կողմից 1789թ. և մտցվել ոչ մետաղական նյութերի ցանկում: 1822թ. Միտչերլիխը հայտնաբերել է ծծմբի ալոտրոպիան:
Տեյուրը հայտնաբերել է Ֆ. Մյուլլերը 1782թ-ին: Անվանումը ստացել է լատիներեն tellus-հող բառից:
Պոլլոնիումը առաջին տարրն է, որը հայտնաբերվել է ռադիոակտիվ հատկության շնորհիվ, 1898 թ-ին Պ.Կյուրիի և Մ.Սկլադովսկայայի կողմից: Անվանվել է վերջինիս հայրենիքի` Լեհաստանի անունով:
2.2. Թթվածին
Քիմիական նշանը`O , միջուկի լիցքը`8, միջին իզոտոպային ատոմական զանգվածը`15,9994: Կազմված երեք կայուն իզոտոպներից` 16O(99,76%), 17O(0,04%) և 18O(0,20%):
2.2.1. Տարածվածությունը բնության մեջ
Թթվածինը ամենատարածված տարրն է, դրա պարունակությունը երկրի կեղևում 47% է: Ազատ վիճակում գտնվում է մթնոլորտում. կազմելով դրա 23%-ը ըստ զանգվածի և 21%-ը` ըստ ծավալի: Կապված վիճակում մտնում է ջրի մեջ, բամաթիվ օքսիդների, միներալների բաղադրության մեջ` առաջացնելով ամենամեծ թվով` 1364 միներալներ`սիլիկստներ, կվարց, երկաթի, ալյումինի օքսիդներ, կարբոնատներ, սուլֆատներ և այլն: Բացի O2-ից, մթնոլորտի վերին շերտերում մոտ 25 կմ բարձրության վրա պարունակվում է օզոն`O3: Օզոնային այդ շերտը կլանում է արեգակի ուլտրամանուշակագույն ճառագայթները, որոնց երկարատև ազդեցությունը մահացու է կենդանի օրգանիզմների համար:
2.2.2. ֆիզիկական հատկությունները
Թթվածինը` O2
անգույն, անհոտ
գազ է, որը -182,9 0C-ում
նորմալ ճնշման
տակ վեր է ածվում
թույլ կապտավուն
հեղուկի, կարծրանում
է -218,70C -ում, առաջացնելով
կապույտ բյուրեղներ:
Թթվածինը ջրում
վատ է լուծվում:
Նորմալ պայմաններում
1մ3 ջրում լուծվում
է 0.049 մ3 թթվածին:
O2-ն ունի պարամագնիսական
հատկություններ,
քանի որ ունի երկու
չզույգված էլեկտրոններ`
խարխլող ![]() օրբիտալների
վրա:
օրբիտալների
վրա:
Օզոնը սուր հոտով կապույտ գազ է: Եռում է -1100C-ում և կածրանում է -1930C -ում: Հեղուկ օզոնն ունի մուգ կապույտ գույն,իսկ կարծրը` սև գույն: Օզոնը թունավոր է և պայթուցիկ հատկապես հեղուկ և պինդ վիճակում:
2.2.3. Ստացումը
Թթվածնի ստացման երեք մեթոդ կա` ա) ֆիզիկական` օդի բաժանումով, բ) էլեկտրաքիմիական`ջրի էլեկտրոլիզով, գ) քիմիական` թթվածնավոր բարդ նյութերի քայքայումից: Լաբորատորիայում թթվածին ստանում են KOH-ի ջրային լուծույթի էլեկտրոլիզի միջոցով`
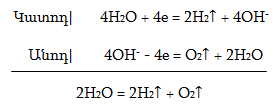
Ինչպես նաև այնպիսի թթվածնավոր միացությունների քայքայումից, որոնք պարունակում են ուժեղ օքսիդիչներ`Hg2+, Cl+5, Mn+7, N+5 և այլն:
2HgO = 2Hg + O2
2KNO3 = 2KNO2 + O2,
2KClO3 = 2KCl + 3O2,
2KMnO4 = K2MnO4 + MnO2 + O2:
Ադյունաբերության մեջ թթվածինը հիմանականում ստանում են հեղուկ օդից: Քանի որ թթվածնի և ազոտի եռման ջերմաստիճանները տարբեր են` համապատասխանաբար -183 և 1960C, հեղուկ օդը թորելիս գազային ազոտը հեռանում է, իսկ հեղուկ թթվածինը` մնում: Երբեմն արդյունաբերության մեջ թթվածին ստանում են նաև KOH-ի ջրային լուծույթի էլեկտրոլիզից, երբ կան նաև ջրածնի ստացման անհրաժեշտություն:
Օզոնը ստացվում է թթվածնի միջոցով էլեկտրական կայծեր բաց թողնելիս` օզոնատոր կոչվող սարքի միջոցով: Տեղի է ունենում ջերմակլանիչ ռեակցիան:
![]()
Քանի որ ռեակցիայի
հետևանքով համակարգի
էնտրոպիան նույնպես
փոքրանում է, ապա
այս ռեակցիան ![]() և ինքնաբերաբար
ընթանալ չի կարող
և պահանջում է
էներգիայի մեծ
ծախս: Հետևաբար
հակառակ ռեակցիան`
օզոնի տրոհումը,
պետք է ընթանա
ինքնաբերաբար,
և օզոնը անկայուն
նյութ է:
և ինքնաբերաբար
ընթանալ չի կարող
և պահանջում է
էներգիայի մեծ
ծախս: Հետևաբար
հակառակ ռեակցիան`
օզոնի տրոհումը,
պետք է ընթանա
ինքնաբերաբար,
և օզոնը անկայուն
նյութ է:
2.2.4. ԹԹվածնի քիմիական հատկությունները
Թթվածնի էլեկտրոնային բանաձևն է 1s22s22P4: Ինչպես նշվեց վերը, արտաքին շերտում ունենալով վեց էլեկտրոն, թթվածինը փոխազդում է իրենից փոքր էլեկտրաբացասականություն ունեցող տարրերի հետ, իսկ դրանք բոլորն են բացի ֆտորից, հեշտությամբ վերցնում է կամ դեպի իրեն է տեղաշարշում ևս երկու էլեկտրոն` հանդես բերելով հիմնականում -2 օքսիդացման աստիճան: Թթվածինը միացություններ է առաջացնում բոլոր տարրերի հետ, բացի հելիումից, նեոնից և արգոնից: Հալոգենների, ոսկու և պլատինի հետ թթվածինը անմիջականորեն չի փոխազդում և այդ տարրերի հետ թթվածնի միացությունները ստացվում են անուղղակի եղանակով: Տարրերի հետ թթվածնի առաձացրած միացությունները լինում են չորս տեսակի` օքսիդներ, որոնք պարունակում են O2-, պերօքսիդներ, որոնք պարունակում են O-1, (-O-O- խմբեր Na2O2, BaO2), գերպերօքսիդներ, որոնք պարունակում են և O2- NaO2, KO2 և օզոնիդներ, որոնք պարունակում են O-3, (KO3,RbO3): Գերպերօքսիդներ և օզոնիդներ թթվածին առաջացնում է առավել ակտիվ ալկալիական մետաղների հետ: Ջրածնբի հետ սովորական ջերմաստիճաններում թթվածինը շատ դանդաղ է փոխազդում, սակայն 5500C-ից բարձր այդ ռեակցիան ընթանում է պայթունով`
2H2 + O2 = 2H2O
բացի ջրից, թթվածինը ջրածնի հետ առաջացնում է ևս մեկ միացություն` ջրածնի պերօքսիդ` H2O2 : Սա մացուծիկ հեղուկ է, որը հեշտությամբ քայքայվում է`
2H2O2 = 2H2O + O2
Մացուծիկությունը հետևանք է մոլեկուլների միջև բազմաթիվ ջրածնական կապերի առկայության: Քանի որ H2O2-ում թթվածինն ունի միջին -1 օքսիօդացման աստիճան, այն հանդես է բերում օքսիդացման վերականգնման երկվություն: H2O2-ը լավ օքսիդիչ է`
2KJ + H2O2 + H2SO4 = J2 + K2SO4 + 2H2O:
Բայց ուժեղ օքսիդիչների ազդեցության դեպքում հանդես է գալիս որպես վերականգնիչ`
2KMnO4 + 5H2O2 + 3H2SO4 = 5O2 + K2SO4 + 2MnSO4 + 8H2O:
Ծծմբի, ածխածնի, ազոտի, ֆոսֆորի հետ սովորական ջերմաստիճաններում շատ դանդաղ է փոխադում, սակայն տաքանալիս յուրաքանչյուր տարրի համար բնորոշ բոցավառման ջերմաստիճանում տեղի է ունենում այրում: Աոտի հետ ռեակցիան շնորհիվ N2 մոլեկուլի մեծ ամրության ջերմակլանիչ է և նկատելի է դառնում միայն 12000C-ից բարձր ջերմաստիճաններում կամ էլեկտրական պարպուման ժամանակ`
N2 + O2 = 2NO
Մետաղների հետ թթվածնի փոխադեցության ժամանակ կարևոր նշանակություն ունի ջրի ներկայությունը: Օրինակ, նույնիսկ այնպիսի ակտիվ մետաղը, ինչպիսին կալիումն է, լրիվ խոնավազրկված թթվածնի հետ չի փոխազդում, իսկ խոնավության ամենաչնչին քանակի ներկայության դեպքում սովորական ջերմաստիճանում թթվածնի մեջ բոցավառվում է:
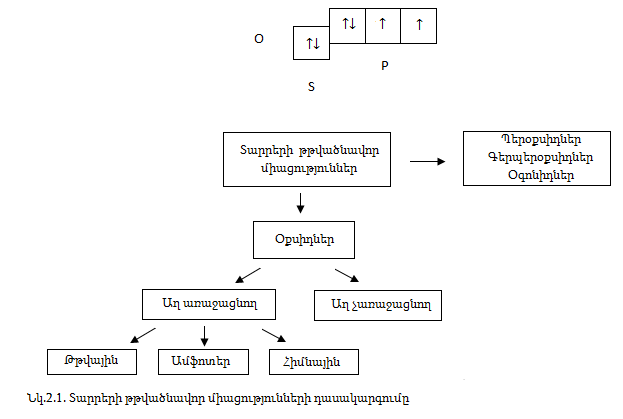
Թթվածնի առաջացրած օքսիդները բաժանվում են հիմնային օքսիդների, որոնց համապատասխան հիդրօքսիդները հիմքեր են (Na2O, K2O), թթվային օքսիդների, որոնց համապատասխան հիդրօքսիդները թթուներ են (SO3, P2O5) և ամֆոտեր օքսիդների, որոնց համապատասխան հիդրօքսիդներն ամֆոտեր բնույթ ունեն (ZnO,Al2O3): Հիմնային օքսիդներ են մետաղների օքսիդները m (անցումային մետաղների դեպքում դրանց ցածր օքսիդացման աստիճանի օքսիդները): Թթվային օքսիդներ են ոչ մետաղների բարձր օքսիդացման աստիճանի օքսիդները, իսկ ամֆոտեր` երկդիմի տարրերի օքսիդները: Այս երեք տեսակի օքսիդները միասին կոչվում են աղ առաջացնող օքսիդներ, քանի որ հիմնային օքսիդները` թթուների և թթվային օքսիդների, թթվային օքսիդները` հիմքերի և հիմնային օքսիդների, ինչպես նաև թթվային և հիմնային օքսիդներն իրար հետ առաջացնում են աղեր:
CaO + H2SO4 = CaSO4 + H2O
CO2 + 2NaOH = Na2CO3 + H2O
BaO + SiO2 = BaSiO3
Ոչ այնքան ուժեղ ոչ մետաղական ցածր վալենտականության օքսիդները կոչվում են աղ չառաջացնող (SiO, N2O, NO), քանի որ չեն փոխազդում հիմքերի և հիմնային օքսիդների հետ և աղեր չեն առաջացնում (նկ.2.1):
Օզոնը ցուցաբերում է ավելի ուժեղ օքսիդիչ հատկություններ, քան սովորական թթվածինը, օրինակ արծաթըը թթվածնով չի օքսիդանում նույնիսկ ուժեղ տաքացնելիս, իսկ օզոնի հետ փոխազդում է: Պատճառն կայանում է նրանում, որ օզոնի հեշտությամբ քայքայվում է` առաջացնելով խիստ ռեայկցիոն ընդունակ ատոմար թթվածին`
2Ag + O3 = Ag2O + O2:
Օզոնը ցածր օքսիդները վերածում է բարձր օքսիդների, իսկ մետաղների սուլֆիդները` սուլֆատների:
Ֆտորի հետ կազմած միացություններում թթվածինը հանդես է բերում +2 օքսիդացման աստիճան` F2O: Ավելի բարձր դրական օքսիդացման աստիճաններ թթվածինը չի ցուցաբերում, քանի որ դրա արտաքին էլեկտրոնային շերտը չունի d ենթաշերտ, ուստի 2P էլեկտրոնային զույգը չի կարող գրգռվել:
2.2.5. Թթվածմի կիրառությունները
Թթվածնի արդյունաբերական կիրառնման հիմնական բնագավառը սև մետալուրգիան է, որտեղ թթվածնով հարստացված օդով ինտեսիվացնում են պողպատի ստացումը թուջից: Ացետիլինի, բնական գազի հետ թթվածինը կիրառվում է մետաղները կտրելու, զոդելու, դժվարահալ նյութերը հալեցնելու համար: Հեղուկ թթվածնինն օգտագործվում է հրթիռային տեխնիկայում:
Քիմիական արդյունաբերության մեջ թթվածինը կիրառում են`արհեստական հեղուկ վառելանյութերի, ազոտական և ծծմբական թթուների, մեթանոլի, մետաղների պերօքսիդների ստացման համար:
Թթվածինն առանձնահատուկ դեր ունի բնության մեջ: Թթվածնի միջոցով է իրականանում շնչառությունը, փտման և նեխման պրոցեսները, որոնք ապահովում են բնության մեջ եղած նյութերի շրջապտույտը:
2.3. Ծծումբ
Քիմիական նշանը` S (sulfur), միջուկի լիցքը`16, միջին իզոտոպային ատոմական զանգվածը` 32,06: Բնական ծծումբը կազմված է չորս կայուն իզոտոպներից`32S(95.02%), 33S(0.75%), 34S(4.21%) և 36S(0.02%):
2.3.1. Տարածվածությունը բնության մեջ
Ծծումբի
պարունակությունը
երկրի կեղևում
կազմում է ![]()
Այն հանդիպում
է մեծ քանակությամբ
ազատ վիճակում:
Բնության մեջ հայտնի
է ծծմբի մոտ 250 միներալ:
Բնական կարևորագույն
միացություններն
են տարբեր մետաղների
առաջացրած սուլֆիդները`ZnS
(ցինկախաբուկ), Cu2S (պղնձի փայլ), PbS (կապարի փայլ), FeS2 (պիրիտ), ![]() , (միրաբիլիտ),
, (միրաբիլիտ),
![]() (գիպս):
Կենսոլորտում
տեղի ունի ծծմբի
շրջապտույտ: Երկրաբանական
անցյալում ծծմբի
աղբյուր են հանդիսացել
հրաբախային ժայթքումները,
որոնք պարունակում
են SO2 և H2S:
(գիպս):
Կենսոլորտում
տեղի ունի ծծմբի
շրջապտույտ: Երկրաբանական
անցյալում ծծմբի
աղբյուր են հանդիսացել
հրաբախային ժայթքումները,
որոնք պարունակում
են SO2 և H2S:
2.3.2. Ծծմբի ստացումը
Բնության մեջ ազատ ծծմբի մեծ քանակների առկայության պատճառով, ծծմբի ստացումը հանգում է դրա անջատմանը դատարկ ապարից: Դրա համար ապարի մեջ ճնշման տակ մղում են տաք ջուր, և հալված ծծումբը դուրս է գալիս: Ծծումբ ստանում են նաև H2S, SO2 գաերից: Դրանք գոյանում են սուլֆիդների այրումից (SO2) և պարունկավում են բնական գաերում (H2S): Ծծումբը ստացվում է նաև երկաթի կոլչեդանից`FeS2: Առանց օդի մուտքի տաքացնելիս այն քայքայվում է`
FeS2 = FeS + S
Ծծումբ ստանում են նաև ածխի կոքսացման և գազացման ժամանակ ստացվող գազերից:
2.3.3. Ֆիզիկական հատկությունները
Ծծումբն առաջացնում է մի քանի ալոտրոպ ձևափոխություն:
Սենյակային
ջերմաստիճանում
կայուն ![]() կամ ռոմբիկ
ծծումբը, որը դեղին
գույն բյուրեղային
նյութ է, խտությունը`
2.07 գ/սմ3 և tհալ =
119,30C, կայուն
է 95,60C և
հալման ջերմաստիճանի
միջև ընկած միջակայքում:
Ծծումբի այդ երկու
ձևն էլ կամված
են S8 ցիկլիկ մոլեկուլներից:
Հալելիս ծծումբը
վերածվում է դյուրաշարժ
դեղին հեղուկի,
որը 1600C -ից
բարձր գոլորշիանում
է, իսկ 1900C-ից
բարձր վեր է ածվում
մուգ գորշավուն
մածուցիկ հեղուկի:
Մինչև 3500C տաքացնելիս
նորից դառնում
է դեղնավուն հոսուն:
Պատճառն այն է
որ1600C -ից բարձր
ծծմբի օղակավոր
S8 մոլեկուլները
սկսում են խզվել,
և գոյացած շղթաները
միանում են իրար:
Դա հանգեցնում
է մացուծիկության
մեծացմանը: Հետագա
տաքացումը բերում
է գոյացած երկար
շղթաների խզմանը,
և մածուցիկությունը
նորից ընկնում
է : Եթե հալված է
մինչև 250-3000C տաքացրած
ծծումբը բարակ
շիթով լցվի սառը
ջրի մեջ, այն վերածվում
է գորշադեղնավուն
առաձգական զանգվածի`
պլաստիկ ծծումբի:
Պլաստիկ ծծումբը
կարճ ժամանակում
կարծրանում է`վերածվելով
ռոմբիկ ծծմբի:
Եռման ջերմաստիճանից
բարձր ջերմաստիճանում
ծծումբի S8 մոլեկուլները
տրոհվում են` առաջացնելով
S6, S4, S2 մոլեկուլներ,
իսկ մոտ 15000C-ում`
առանձին ատոմներ:
Ծծումբը ջրում
գործնականում
չի լուծվում, լավ
լուծվում է ծծմբաածխածինում, ֆենոլում,
բենզոլում և դիքլորէթանում:
կամ ռոմբիկ
ծծումբը, որը դեղին
գույն բյուրեղային
նյութ է, խտությունը`
2.07 գ/սմ3 և tհալ =
119,30C, կայուն
է 95,60C և
հալման ջերմաստիճանի
միջև ընկած միջակայքում:
Ծծումբի այդ երկու
ձևն էլ կամված
են S8 ցիկլիկ մոլեկուլներից:
Հալելիս ծծումբը
վերածվում է դյուրաշարժ
դեղին հեղուկի,
որը 1600C -ից
բարձր գոլորշիանում
է, իսկ 1900C-ից
բարձր վեր է ածվում
մուգ գորշավուն
մածուցիկ հեղուկի:
Մինչև 3500C տաքացնելիս
նորից դառնում
է դեղնավուն հոսուն:
Պատճառն այն է
որ1600C -ից բարձր
ծծմբի օղակավոր
S8 մոլեկուլները
սկսում են խզվել,
և գոյացած շղթաները
միանում են իրար:
Դա հանգեցնում
է մացուծիկության
մեծացմանը: Հետագա
տաքացումը բերում
է գոյացած երկար
շղթաների խզմանը,
և մածուցիկությունը
նորից ընկնում
է : Եթե հալված է
մինչև 250-3000C տաքացրած
ծծումբը բարակ
շիթով լցվի սառը
ջրի մեջ, այն վերածվում
է գորշադեղնավուն
առաձգական զանգվածի`
պլաստիկ ծծումբի:
Պլաստիկ ծծումբը
կարճ ժամանակում
կարծրանում է`վերածվելով
ռոմբիկ ծծմբի:
Եռման ջերմաստիճանից
բարձր ջերմաստիճանում
ծծումբի S8 մոլեկուլները
տրոհվում են` առաջացնելով
S6, S4, S2 մոլեկուլներ,
իսկ մոտ 15000C-ում`
առանձին ատոմներ:
Ծծումբը ջրում
գործնականում
չի լուծվում, լավ
լուծվում է ծծմբաածխածինում, ֆենոլում,
բենզոլում և դիքլորէթանում:
2.3.4. Ծծմբի քիմիական հատկությունները
Ծծմբի էլեկտրական բանաձևն է` 1s22s22P63s23P4: Այլ տարրերի հետ փոխազդելիս այս ատոմի արտաքին էլեկտրոնային թաղանթի հետ կարող է կատարվել երկու տեսակի փոփոխություն.
1. Եթե ծծումբը փոխազդի իրենից փոքր էլեկտրաբացասականություն ունեցող տարրերի` օրինակ` ջրածնի, մետղների, իրենից թույլ ոչ մետաղների հետ, ապա կվերցնի կամ դեպի իրեն կտեաշարժի երկու էլեկտրոն լրացնելու արտաքին էլեկտրոնային շերտը (օկտետը) և հանդես կբերի -2 օքսիդացման աստիճան: Հետևաբար ջրածնի հետ ծծումբը պետք է առաջացնի H2S միացություն` ծծմբաջրածին:
H2 + S = H2S
Ռեակցիան ընթանում է բարձր ջերմաստիճանում, նույն կերպ մետաղների հետ ծծումբն առաջացնում է աղեր` սուլֆիդներ.
Fe + S = FeS:
2. Եթե ծծումբը փոխազդի իրենի մեծ էլեկտրաբացասականություն ունեցող տարրի , օրինակ` թթվածնի, հալոգենների հետ, ապա կկորցնի արտաքին շերտի էլեկտրոնները և կարող է հանդես բերել մինչև +6 օքսիդացման աստճիան, քանի ո,ր ի տարբերություն թթվածնի, երրորդ շերտն ունի d ենթաշերտ:
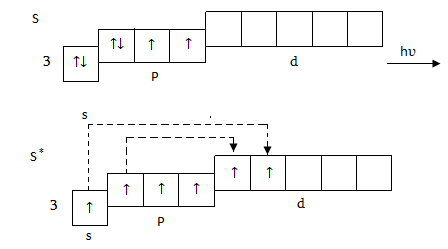
Այդ պատճառով ծծումբը պետք է հանդես բերի +2, +4, +6.. օքսիդացման աստիճաններ, սակայն +2 օքսիդացման աստիճանը ծծմբի համար բնորոշ չէ, և թթվածնի հետ այն առաջացնում է երկու օքսիդներ` SO2(+4), SO3(+6), որոնք ուժեղ ոչ մետաղի օքսիդներ թթվային բնույթ ունեն և ջրի հետ փոխադելիս առաջացնում են թթուներ`
S + O2 = SO2
SO2 + H2O = H2SO3 - ծծմբային թթու
SO3 + H2O = H2SO4 - ծծմբական թթու
Ծծումբը քիմիապես ակտիվ տարր է և տաքացնելիս փոխազդում է համարյա բոլոր քիմիական տարրերի հետ, բացառությամբ N2-ի, l2-ի, Au-ի, Pt-ի և իներտ գազերի:
Հայտնի են ծծումբի շատ մացություններ հալոգենների հետ: Դրանք ստացվում են ծծմբի և հալոգենների անմիջական փոխազդեցությամբ: Ծծմբի հալոգենիդներից առավել կարևոր են ծծմբի հեքսաֆտորիդը` SF6 տետրաքլորիդը`SCl4 և դիքլորիդը`SCl2: Ծծմբի հեքսաքլորիդն ունի մեծ քիմիական կայունություն և սենյակի ջերմաստիճանում չի փոխազդում ոչ թթուների , ոչ հիմքերի և ոչ էլ ջրի հետ: Մյուս հալոգենիդները ջրի ազդեցության տակ ենթարկվում են հիդրոլիզի`
![]()
2.3.5. Ծծմբաջրածին
Ջրածնի հետ ծծումբն առաջացնում է մի շարք միացություններ H2Sx ընդհանուր բանաձևով, որոնցից կարևորը և կայունը ծծմբաջրածինն է`H2S:
1. Ստացումը. Ծծմբաջրածինը լաբորիատորիայում ստացվում է սուլֆիդներից, աղաթթվով դուրս մղելով`
FeS + 2HCl = FeCl2 + H2S:
Այդպիսի ծծմբաջրածինը պարունակում է խառնուրդներ (AsH3, SiH4), ի հետևանք երկաթի սուլֆիդի մեջ պարունակվող արսենի, սիլիցիումի միացությունների: Մաքուր H2S ստանում են Al2S3-ի հիդրոլիզից`
![]()
Տաքացնելիս (150-2000C) ծծումբն ուղղակիորեն փոխազդում է ջրածնի հետ` առաջացնելով ծծմբաջրածին`
H2 + S = H2S:
2. Ֆիզիկական հատկությունները: Ծծմբաջրածինը անդուր ,նեխած ձվի հոտով գազ է: Այն -600C -ում հեղուկանում է մ, իսկ -860C-ում` կարծրանում: Ջրում լավ լուծվում է: 200C-ում մեկ ծավալ ջրում լուծվում է 2.5 ծավալ ծծմբաջրածին: H2S-ը շատ թունավոր է:
3. Քիմիական հատկությունները: Ծծմբաջրածնի ջրային լուծույթը` ծծմբաջրածնական թթուն, թույլ երկհիմն թթու է: Դիսոցվում է երկու փուլով`
![]()
Դրա աղերը կոչվում են սուլֆիդներ, որոնց մի մասն ունենում է ցայտուն գունավորումնեը: Հիդրոսուլֆիդներ ծծմբաջրածնական թթուն առաջացնում է միայն ալկալիական և հողալկալիական մետաղների հետ: Ջրում լուծելի են միայն ալկալիական և հողալկալիական մետաղների սուլֆիդները: Որպես թույլ թթվի աղեր` սուլֆիդները ենթարկվում են հիդրոլիզի, ընդ որում, եթե սուլֆիդում տարրն ունի բարձր օքսօիդացման աստիճան (օրինակ Al2S3, Cr2S3) հիդրոլիզն ընթանում է մինչև վերջ և դարձելի չէ: Ջրում չլուծվող սուլֆիդների մի ամասը (FeS, ZnS) լուծվում է ոչ օքսիդիչ թթուներում, իսկ CuS-ը, PbS-ը, HgS-ը` ոչ: Այդ ռեակցիաների աջ մասում թույլ էլեկտրոլիտ H2S-ն է, իսկ ձախ մասում` նստվածք սուլֆիդը` MeS: Կախված նրանից, թե դրանցից որի լուծելիության արտադրյալն է ավելի մեծ, հավասարակշռությունը տեղաշարժվում է դեպի աջ (նստվածքը լուծվում է)`
BaS(բ) + 2HCl(լ) = BaCl2(լ) + H2S(գ) (տեղի ունի)
կամ դեպի ձախ (նստվածքը լուծվում է)`
HgS(բ) + 2HCl(լ) = HgCl2(լ) + H2S(գ) (տեղի չունի)
Ոչ օքսիդիչ թթուներում չլուծվող սուլֆիդները լուծվում են օքսիդիչ հատկություններ ունեցող թթուներում`
CuS + 10HNO3 = Cu(NO3)2 + H2SO4 + 8NO2 + 4H2O:
Ծծմբի S-S- կապեր առաջացնելու հատկության շնորհիվ գոյություն ունեն բազմասուլֆիդներ: Եթե նատրիումի սուլֆիդի լուծույթը թափահարենք ծծմբի հետ, վերջինս լուծվում է, և լուծույթը գոլորշիացնելուց հետո մնում են բամասուլֆիդային միացություններ`
Na2S + 2S = Na2S3:
Բազմասուլֆիդներում ծծմբի ատոմների քանակը 2-ից մինչև 8 է, առավել հաճած` 2, որոնք կարելի է դիտարկել որպես ջրածնի դիսուլֆիդի` H2S2 -ի աղեր: Սրանցից բնության մեջ առավել հաճախ հանդիպում է երկաթի դիսուլֆիդը` FeS2(պիրիտ):
Օքսիդացման-վերականգման տեսակետից H2S-ը ուժեղ վերականգնիչ է: Օդում այն այրվում է`
2H2S + 3O2 = 2SO2 + 2H2O:
Ջրային լուծույթում դանդաղ օքսիդանում է ջրում լուծված թթվածնով առաջացնելով ծծումբ`
2H2S + O2 = 2H2O + S:
Ծծմբաջրածինը փոխադում է նաև շատ այլ օքսիդիչների հետ` վերականգնվելով ոչ միայն մինչև ազատ ծծումբ`
5H2S + 2KMnO4 + 3H2SO4 = 5S + K2SO4 + 2MnSO4 + 8H2O
այլ նույնիսկ մինչև S+6
3H2S + 4HClO3 = 3H2SO4 + 4HCl:
Բնական սուլֆիդները կիռառվում են մետալուրգիայում` մետաղների ստացման համար, ծծմբական թթվի արտադրության մեջ, ալկալիական և հողալկալիական մետաղների սուլֆիդները`թեթև արդյունաբերության մեջ:
2.3.6. Ծծմբի թթվածնավոր միացությունները
Ծծմբի հիմնանակ օքսիդներն են SO2-ը և SO3-ը:
SO2-ը ծծմբի (lV) օքսիդը բնորոշ սուր հոտով, անգույն թունավոր գազ է: Հեշտությամբ խտանում է -10,50C-ում` վերածվելով անգույն հեղուկի, իսկ -750C-ում բյուրեղանում է: Ջրում լավ լուծվում է`1լ ջրում` 30լ:
Լաբորատորիայոևւմ SO2-ը ստանում են նատրիում սուլֆիտից`
![]()
Արդյունաբերության մեջ SO2-ը ստանում են ծծմբի այրումից`
S + O2 = SO2
և պիրիտի թրծումից`
4FeS2 + 11O2 = 2Fe2O3 + 8SO2:
SO2- թթվայի օքսիդ է: Ջրում լուծելիս առաջանում է համապատասխան ծծմբային թթու, այդ պատճառով հաճախ անվանվում է ծծմբայիին անհիդրիդ`
![]()
Այն փոխազդում է հիմքերի հետ` առաջացնելով ծծմբային թթվի աղեր` սուլֆիտներ`
SO2 + 2NaOH = Na2SO3 + H2O:
Քանի որ SO2-ում ծծումբն ունի միջին +4 օքսիդացման աստիճան, այն հանդես է բերում օքսիդա-վերականգման երկվություն: Ուժեղ օքսիդիչների հետ այն փոխադում է որպես վերագկանգնիչ` անցնելով +6 օքսիդացման աստիճանի`
SO2 + Cl2 = SO2Cl2
այստեղ ստացվում է քլորային աուլֆուրիլ, որը սուր հոտով անգույն հեղուկ է:
Վերականգնիչների հետ SO2-ը փոխազդում է որպես օքսիդիչ`
SO2 + 2H2S = 3S + 2H2O:
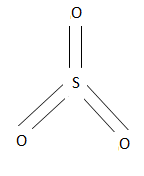
SO3-ը ծծմբի (Vl) օքսիդը ցնդող հեղուկ է, եռում է 44,70C-ում, բյուրեղանում է 16,80C-ում` առաջացնելով մի քանի բյուրեղային ձևեր: Գազային վիճակում գտնվող SO3-ի մոլեկուլն ունի եռանկյունաձև կառուցվածք, քանի որ դրամում ծծումբն ունի sp2 հիբրիդացում`
Ծծմբի ազատ 3d օրբիտալների և թթվածնի 2p գրգռված էլեկտրոնային զույգերի հաշվին SO3-ը կարող է առաջացնել լրացուցիչ կովալենտ կապեր: Այն հեշտությամբ փոխադում է HCl-իհետ առաջացնելով քլորսուլֆոնային թթու`
SO3 + HCl = HSO3Cl:
SO3-ը արդյունաբերության մեջ, ինչպես և լաբորատորիայումն ստացվում է SO2-ի կատալիտիկ օքսիդացումից`
2SO2 + O2 = 2SO3:
Որպես կատալիզատոր օգտագործվում է վանադիումի (V) օքսիդը արդյունաբերության մեջ, և պլատինը` լաբորատորիայում: Լաբարատորիայում SO3 ստանում են նաև երկաթի (lll) սուլֆատի` Fe2(SO4)3 քայքայումից կամ կոնցենտրիկ ծծմբական թթվի վրա P2O5 ավելացնելով:
Ծծմբի (Vl) օքսիդը ծծմբական թթվի անհիդրիդն է և ջրի հետ փոխազդելիս առաջացնում է ծծմբական թթու`
SO3 + H2O = H2SO4
6000C-ից բարձր տաքացնելիս SO3-ը քայքայվում է SO\2-ի և թթվածնի`
2SO3 = 2SO2 + O2:
2.3.7. Ծծմբի թթվածնավոր թթուները
Ծծումբն առաջացնում է բազմաթիվ թթվածնավոր թթուներ, որոնց մի մասում ծծումբը ցուցաբերում է +4`
H2SO3 - ծծմբային թթու
H2S2O4 - դիթիոնային թթու
H2S2O3 - թիոծծմբական թթու
H2SnO6 - պոլիթիոնային թթուների շարք
Իսկ մյուներում`+6 օքսիդացման աստիճաններ
H2SO4 - ծծմբական թթու
H2S2O7 - պիրոծծմբական թթու
H2SO5 - պերօքսիծծմբական թթու
H2S2O8 - պերօքսիերկծծմբական թթու
Սրանցից առավել կարևոր են ծծմբային և ծծմբական թթուները:
1. Ծծմբային թթուն` H2SO3-ը թույլ և անկայուն թթու է: Հայտնի է միայն ջրային լուծույթի ձևով: Դիսոցվում է երկու փուլով`
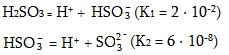
Առաջացրած միջին աղերը կոչվում են սուլֆիտներ, իսկ թթու աղերը հիդրոսուլֆիտներ: Սրանք ևս SO2-ի նման ունեն օքսիդավերականգման երկվություն` առավել ընդգրկված վերականգնիչ հատկություններով: Ակտիվ մետաղների սուլֆիտները տաքացնելիս ենթարկվում են ինքնաօքսիդացման-ինքնավերականգման, առաջացնելով սուլֆիդներ և սուլֆատներ`
4Na2SO3 = Na2S + 3Na2SO4:
Սուլֆիտների հայտնաբերումը հենց հենվում է դրանց վերականգնիչ հատկոււթյունների վրա` բրոմով օքսիդացվում են մինչև սուլֆատների (SO2-3 իոնի հայտնաբերման որակական ռեակցիան) և բրոմի դեղին գույնն անհետանում է:
Na2SO3 + Br2 + H2O = Na2SO4 + 2HBr,
Դիթիոնային թթուն` H2S2O4 անկայուն թթու է: Դրա աղերը` դիթիոնատները, ստացվում են սուլֆիտները թթվային միջավայրում ցինկով վերականգնելով`
2NaHSO3 + Zn + H2SO4 = Na2S2O4 +ZnSO4 + 2H2O:
Թիոծծմբական թթուն` H2S2O3, բավականին ուժեղ թթու է, սակայն անկայուն է և սենյակի ջերմաստիճանում քայքայվում է SO2-ի, ջրի և ծծմբի: Դրա աղերը ստացվում են սուլֆիտների լուծույթները ծծմբի հետ տաքացնելիս`
Na2SO3 + S = Na2S2O3
Նատրիումի թիոսուլֆատի լուծույթի վրա ծծմբական թթու ավելացնելիս` թիոծծմբական թթվի փոխարեն առաջանում են նշված նյութերը`
![]()
Այս թթվին տալիս են -ական վերջավորությունը, որովհետև դրա մեջ մտնող ծծմբի ատոմներից մեկը վեցավալենտ է`
Պոլիթիոնային թթուներում գոյություն ունեն S-S- շղթաներ`
2. Ծծմբական
թթուն` H2SO4 -ը,
անգույն անհոտ,
մածուցիկ հեղուկ
է, հալման ջերմաստիճանն
է 100C, եռմանը` 3400C:
Ջրում լավ լուծվում
է` առաջացնելով
հիդրատներ ![]() և անջատվում
է մեծ քանակությամբ
ջերմություն: Ծծմբական
թթուն խոնավածուծ
է, չորացնում է
խոնավ գազերը,
ջուրը պոկում է
նույնիսկ օրգանական
նյութերից:
և անջատվում
է մեծ քանակությամբ
ջերմություն: Ծծմբական
թթուն խոնավածուծ
է, չորացնում է
խոնավ գազերը,
ջուրը պոկում է
նույնիսկ օրգանական
նյութերից:
Արդյունաբերության մեջ ծծմբական թթուն ստանում են ծծմբից կամ երկաթի կոլչեդանից: Վերջիններս օքսիդացնում են մինչև SO2`
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
կամ
S + O2 = SO2
Վերջին դեպքում ստացվող SO2-ը մաքուր է լինում փոշուց և այլ գազերից: Այնուհետև SO2-ը օքսիդացնում են SO3-ի: Այժմ առավել հաճախ կիրառվում է այդ օքսիդացման կոնտակտային մեթոդը: Այդ դեպքում որպես կատալիզատոր կիրառվում է վանադիումի (V) օքսիդը V2O5: Կատալիզատորի վրա տեղի է ունենում օքսիդացման ռեակցիան`
2SO2 + O2 = 2SO3:
Առաջացած ծծմբի (Vl) օքսիդը բաց է թողնվում 96-98%-անոց ծծմբական թթվի միջցով, որը հանգելով վերածվում է օլեումի` SO3-ի լուծույթի H2SO3-ի մեջ: Վերջինս այնուհետև նոսրացվում է ջրով`
SO3 + H2O = H2 SO4
SO2-ի օքսիդացման նիտրոզային մեթոդի դեպքում որպես կատալիզատոր օգտագործվում է NO2-ը:
SO2 + NO2 + H2O = H2SO4 + NO:
Ստացված ազոտի օքսիդը հեշտությամբ փոխաղդում է թթվածնի հետ` նորից վերածվելով NO2-ի:
Ծծմբական թթուն ուժեղ թթու է: Դիսոցվում է երկու փուլով առաջացնելով հիդրսուլֆատ`HSO-4 և սուլֆատ`SO42--իոններ`
H2SO4 = H+ + HSO-4,
HSO-4 = H+ + SO2-4:
Առաջին փուլը
գործնականում
տեղի է ունենում
լրիվ, իսկ երկրորդ
փուլի հավասարակշռության
հաստատունը` ![]() Ջրի
հետ ծծմբական թթուն
առաջացնում է մի
շարք հիդրատներ,
որոնցից ամենից
կայունը
Ջրի
հետ ծծմբական թթուն
առաջացնում է մի
շարք հիդրատներ,
որոնցից ամենից
կայունը ![]() Հիդրատների
առաջացումով է
պայմանավորված
ծծմբական թթվի
խոնավածուծ հատկությունը:
Ածխաջրերը, օրինակ,
ծծմբական թթվի
ազդեցության տակ
կորցնելով ջուրը,
ածխանում են:
Հիդրատների
առաջացումով է
պայմանավորված
ծծմբական թթվի
խոնավածուծ հատկությունը:
Ածխաջրերը, օրինակ,
ծծմբական թթվի
ազդեցության տակ
կորցնելով ջուրը,
ածխանում են:
Ծծմբական
թթուն ունի թթուների
բնորոշ բոլոր հատկությունները
և փոխազդելով մետաղնների
, հիմնային օքսիդներ,
հիմքերի և աղերի
հետ` առաջացնում
է սուլֆատներ:
Ակտիվ մետաղները
առաացնում են նաև
հիդրոսուլֆատներ,
որոնք պարունակում
են HSO-4 իոններ:
Վատ լուծվող սուլֆատները
ջրից անջատվում
են առանց բյուրեղաջրի
![]() Երկաթի
պղնձի, ցինկի սուլֆատները
պարունակում են
բյուրեղաջուր`
Երկաթի
պղնձի, ցինկի սուլֆատները
պարունակում են
բյուրեղաջուր`![]() և կոչվում
են արջասպներ:
և կոչվում
են արջասպներ:
϶+[϶3+(SO4)2] կրկնակի աղերը, որոնցում ϶+-ը լինում է ալկալիական մետաղների, իսկ ϶+-ը` Al3+, Cr3+, Fe3+, և այլ իոններ, կոչվում են շիբեր: Կոնցենտրիկ ծծմբական թթուն ուժեղ օքսիդիչ է: Այդ պատճառով ծծմբական թթուն մետաղների հետփոխաղդում է տարբեր կերպ` կախված կոնցենտրացիայից: Նոսր ծծմբական թթուն ակտիվ մետաղների օքսիդացնում է իր ջրածնի իոնով, այդ պատճառով փոխազդում է միայն ակտիվ մետաղների հետ , և դուրս է մղվում ջրածին`
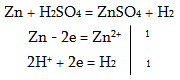
իսկ կոնցենտրիկ ծծմբական թթվում օքսիդիչ է S+6-ը: Այդ պատճառով կոնցենտրիկ ծծմբական թթվուն փոխազդում է և ակտիվ, և պասիվ մետաղների հետ, և ջրածին դուրս չի մղվում`
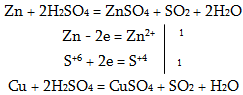
Ոսկին և պլատինը կայուն են ծծմբական թթվի նկատմամբ բոլոր կոնցենտրացիաներում և ջերմաստիճաններում:
Կոնցենտրիկ ծծմբական թթուն կարող է օքսիդացնել նաև շատ ոչ մետաղներ`
C + 2H2SO4 = CO2 + 2SO2 + 2H2O:
Սենյակային ջերմաստիճանում կոնցենտրիկ ծծմբական թթուն պասիվացնում է երկաթը, այլումինը, քրոմը: Այդ պատճառով այն հնարավոր է տեղափոխել երկաթյա ցիստեռներով:
Ծծմբական թթվի բարձր եռման ջերմաստիճանը հնարավորություն է տալիս դուրս մղել հեշտ ցնդող թթուներն իրենց աղերից`
![]()
Ծծմբական թթվի աղերի` սուլֆատների մեծ մասը ջրում լավ լուծվում է: Վատ լուծվող են CaSO4-ը, SrSO4-ը, BaSO4-ը, ընդ որում, լուծելիությունն այդ շարքում նվազում է: Կապարի սուլֆատը` PbSO4 գործնականում անլուծելի է:
Տաքացնելիս սուլֆատները քայքայվում են մետաղի օքսիդի և SO3-ի: Բարձր ջերմաստիճաններում (մեծ 6000C-ից) SO3-ը ևս քայքայվում է SO2-ի և O2-ի: Սուլֆատների ջերմային կայունությունն աճում է մետաղի ակտիվության մեծացմանը զուգընթաց: Ալկալիական մետաղների սուլֆատները չեն քայքայվում նույնիսկ 10000C-ում, իսկ CuSO4-ը քայքայվում է 6500C -ում:
3. Պիրոծծմբական թթուն` H2S2O7-ը ստացվում է ծծմբական թթվի և SO3-ի փոխազդեցությունից`
H2SO4 + SO3 = H2S2O7:
Դրա աղերը` պիրոսուլֆատները, առաջանում են հիդրոսուլֆատների քայքայումից`
2NaHSO4 = Na2S2O7 + H2O:
Ավելի ուժեղ տաքացման դեպքում/ հալման ջերմաստիճանից բարձր/ պիրոսուլֆատները քայքայվում են սուլֆատների և SO3-ի`
Na2S2O7 = Na2SO4 + SO3:
4. Պերօքսոծծմբական թթուն` H2SO5 և պերօքսոերկծծմբական թթուն` H2S2O3 պերօքսիդային կապեր պարունակով թթուներ են և ունեն հետևյալ կառուցվածքը`
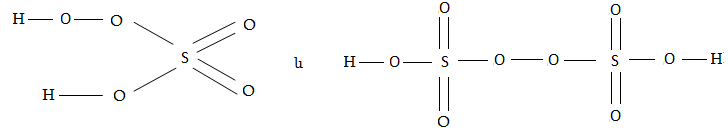
Պերօքսիերկծծմբական թթուն ստացվում է ծծմբական թթվի էլեկտրաքիմիական օքսիդացումով, իսկ պերօքսոծծմբական թթուն` H2S2O8-ի վրա ջրածնի պերօքսիդով ազդելով`
H2S2O8 + H2O2 = 2H2SO5:
Այս երկու թթուներն էլ բյուրեղային նյութեր են, հեշտությամբ քայքայվում են ծծմբական թթվի և թթվածնի:
2.3.8. Ծծմբի և դրա միացությունների կիրառությունը
Ազատ ծծումբը կիրառվում է ծծմբական թթվի ստացման, կաուչուկների վուլկանացման, բույսերի որոշ վնասատուների ոչնչացման համար, օրգանական սինթեզում, լուցկու արտադրության մեջ:
Ծծմբական թթուն քիմիական արդյունաբերության մեջ կարևորագույն արտադրանքներից մեկն է: Այն կիրառվում է ֆոսֆատային պարարտանյությերի ստացման, նավթամթերքների մաքրման, մի շարք ուրիշ թթուների ստացման, ներկերի պատրաստման համար, պայթուցիկ նյութերի արտադրության մեջ:
Ծծմբական
թթվի աղերից կալցիումի
և նատրիումի հիդրոսուլֆատներն
օգտագործվում
են ցելյուլյոզայի
արտադրության
մեջ, վերջինս մաքրելու
համար, նատրիումի
սուլֆատը` ապակի
ստանալու համար,
Na2S2O3-ը որպես
ֆիքսաժ լուսանկարչական
տեխնիկայում, կիսաջուր
գիպսը`![]() շինարարության
մեջ:
շինարարության
մեջ:
Պղնձարջասպը`
![]() օգտագործվում
է մետաղների էլեկտրոլիտային
պղնձապատման ,
ներկանյութերի
պատրաստման, բույսերի
համար վնասակար
մանրէները ոչնչացնելու
համար:
օգտագործվում
է մետաղների էլեկտրոլիտային
պղնձապատման ,
ներկանյութերի
պատրաստման, բույսերի
համար վնասակար
մանրէները ոչնչացնելու
համար:
2.4. Սելեն, տելուր և պոլլոնիում
2.4.1. Տարածվածությունը բնության մեջ
Սելենը կազմում
է երկրի կեղևի
![]() Սելենի
միացությունները
խառնուրդների
ձևով պարունակվում
են ծծմբի առաջացրած
միացություններում:
Պոլլոնիումը ուրանի
ռադիոակտիվ քայքայման
արգասիք է և քիչ
քանակներով կա
ուրան պարունակող
միներալներում:
Սելենի
միացությունները
խառնուրդների
ձևով պարունակվում
են ծծմբի առաջացրած
միացություններում:
Պոլլոնիումը ուրանի
ռադիոակտիվ քայքայման
արգասիք է և քիչ
քանակներով կա
ուրան պարունակող
միներալներում:
2.4.2. Ֆիզիկական հատկությունները
Սելենը ծծմբի նման առաջացնում է մի քանի ալոտրոպ ձևափոխություններ: Առավել կայուն է մոխրագույն սելենը (tհալ = 2190C, tեռ = 6850C), որը բյուրեղային նյութ է: Ավելի քիչ կայուն են կարմիր սելենը և սև ապակենման սելենը: Սրանք ամորֆ նյութեր են: Մոխրագույն և ապակենման սելենները կիսահաղորդիչներ են: Տելուրն առաջացնում է հիմնականում երկու ալոտրոպ ձևափոխություն` ամորֆ մուգ գոլորշավուն և բյուրեղային` արծաթափայլ սպիտակ (tհալ = 449,50C, tեռ = 9900C), որը կիսահաղորդիչն է:
2.4.3. Ստացումը
Սելենը և տելուրը ստացվում են պղնձի և նիկելի էլկտրոլիտիկ մաքրման թափոններից, SO2-ի մաքրման թափոններից, ծծմբական թթվի արտադրություններում: Դրանցում պարունակվող սելենը և տելուրը վերափոխվում են Se+4, Te+4, վիճակի և այնուհետև վերականգնում SO2-ի միջոցով:
2.4.4. Քիմիկան հատկությունները
Se -Te - Po շարքում ոչ մետաղական հատկությունները թուլանում են, մետաղական հատկությունները` ուժեղանում : Ծծմբի նման ջրածնի հետ դրանք առաջացնում են H2Se և H2Te միացությունները: Սրանք անդուր հոտով խիստ թունավոր գազեր են: H2Se-ը ստացվում է անջատման սինթեզով`
![]()
Լաբորատորիայում այդ գազերը ստացվում են և ալյումինիումի սելենիդի` Al2Se3 և տելուրիդի`Al2Te3 հիդրոլիզից`
![]()
Այս գազերի ջրային լուծույթները թթուներ են: Թթուների ուժը H2S H2Se H2Te շարքում աճում է: H2Se -ի համար հայտնի են նաև թթու աղեր, իսկ H2Te ` միայն միջին աղեր: Ծծմբաջրածնի նման սրանք վերականգնիչներ են, ընդ որում, H2S H2Se H2Te շարքում վերականգնիչ հատկություններն ուժեղանում են: Ջրային լուծույթներում դրանք արագ օքսիդանում են օդի թթվածնով`
2H2Se + O2 = 2Se + 2H2O
Թթվածնի հետ տաքացնելիս սելենը և տելուրը փոխազդում են` առաջացնելով երկօքսիդներ` SeO2, TeO2: SO2 SeO2 -TeO2 - PoO2 շարքում, բնականաբար, օքսիդների թթվային բնույթը թուլանում է, և TeO2 -ը արդեն ամֆոտեր է: Ջրի հետ փոխազդելիս դրանք առաջացնում են սելենային` H2SeO3 և տելուրային` H2TeO3 թթուներ: H2SO3 H2SeO3 - H2TeO3 արքում թթուների ուժը փոքրնում է: Տելուրային թթուն ամֆոտեր բնույթ ունի: Սրանց աղերից սելենիդները ստացվում են` H2SeO3 ի լուծույթը ալկալիներով չեզոքացնելով, իսկ տելուրիդները` լուծելով TeO2 ը ալկալիների լուծույթի մեջ`
TeO2 + 2NaOH = Na2TeO3 + H2O:
Սելենական` H2SeO4 և տելուրական H6TeO6 (վեցվալենտ տելուրի համապատասխան լուծույթից բյուրեղանալիս հիդրօքսիդը ջուր չի անջատում) թթուները ստացվում են` սելենի և տելուրի +4 օքսիդացման աստիճան ունեցող միացությունները կամ չեզոք սելենը և տելուրը ուժեղ օքսիդիչներով օքսիդացնելով`
H2SeO3 + H2O2 = H2SeO4 + H2O,
Te + HClO4 + 3H2O = H6TeO6 + HCl:
Այս թթուները բյուրեղային նյութեր են: Տելուրական թթուն ջրում ունի սահմանափակ լուծելիություն: Ուժեղ օքսիդիչներ են, ընդ որում, H2SO4 - H2SeO4 - H2TeO4 շարքում օքսիդիչ հատկությունները թուլանում են:
Սելենի (Vl) օքսիդը` SeO3 բյուրեղային նյութ է, ագաորեն կլանում է ջուրը, առաջացնելով H2SeO4, իսկ դեղին TeO3-ը ջրում քիչ է լուծվում:
Հալոգենների հետ սելենը և տելուրը ուղղակիորեն փոխազդում են և հատկություններով նման են ծծմբի հալոգենիդներին:
3. Երկրորդական ենթախումբ
3.1. Պատմական ակնարկ
Քրոմը հայտնաբերվել է 1797 թվականին Լ.Վոլկլենի կողմից կրոկոիտ միներալի մեջ (կապարի բնական քրոմատ`PbCrO4): Անունը ստացել է հունական chrom-գույն, ներկ բառից ,իր միացությունների տարատեսակ գունավորումների պատճառով:
Մոլիբդենը հայտնաբերվել է շվեդացի քիմիկոս Կ. Շելեն 1778 թվականին` մոլիբդենատից ազոտական թթվով դուրս մղելով մոլիբդենաթթու: 1782 թ.-ին շվեդացի Պ. Հելմը առաջին անգամ ստացավ մետաղական մոլիբդեն` վերականգնելով մոլիբդենի (Vl) օքսիդը ածխածնով: Մինչև 18-րդ դարի վերջը մոլիբդենի հիմնական միներալը` մոլիբդենիտը չէին տարբերում գրաֆիտից և կապարի փայլից, քանի որ արտաքին տեսքով շատ նման են: Այստեղից էլ ծագել է տարրի անունը հունարեն molybdos կապար բառից:
Վոլֆրամը հայտնաբերվել է և անջատվել WO3-ի ձևով դարձյալ շվեդացի քիմիկոս Կ. Շելեի կողմից 1781 թցականին: 1783 թ. իսպանացի քիմիկոսներ Էլյուար եղբայրները երականգնեցին WO3-ը ածխածնով և ստացան մետաղն ազատ վիճակում: Վոլֆրամիտ միներալը հայտնի էր դեռ 16-րդ դարում և անվանվում էր «գայլի փրփուր» (գերմ.wolf-գայլ, rahm փրփուր):
3.2. Քրոմ
Քիմիակն նշանը` Cr, միջուկի լիցքը` 24, միջին իզոտոպային ատոմական զանգվածը` 51.996: Բնական կայուն իզոտոպներն են`50Cr(4,31%), 52Cr(87,86%), 53Cr(9,55%) և 54Cr(2,38%) :
3.2.1. Տարածվածությունը բնության մեջ
Քրոմի
պարունակությունը
երկրի կեղևում
կազմում է ![]() Բնության
մեջ գոյություն
ունի միայն միացությունների
ձևով: Հիմնական
միացությունը
քրոմային երկաթաքարն
է`
Բնության
մեջ գոյություն
ունի միայն միացությունների
ձևով: Հիմնական
միացությունը
քրոմային երկաթաքարն
է` ![]()
Քրոմը ուլտրահիմնային ապարների հիմնական բաղադրիչն է:
3.2.2. Ֆիզիկական հատկությունները
Քրոմը ծանր (p = 7,19 գ/սմ3), դժվարահալ (tհալ = 18750C), կարծր, փայլուն, սպիտակ մետաղ է:
3.2.3. Ստացումը
Քանի որ քրոմը հիմնականում օգտագործում են լեգրիացված պողպատներ ստանալու համար, քրոմային երկաթաքարը վերականգնում են վերածվելով ֆերոքրոմի`
![]()
Մաքուր քրոմ ստանում են`վերականգնելով Cr2O3-ից ալյումինոթերմիկ եղանակով`
Cr2O3 + 2Al = Al2O3 + 2Cr,
իսկ Cr2O3 ստանում են քրոմային երկաթաքարից, նախ` մշակելով սոդայով թթվածնի ներկայությամբ, այստեղ ստացվում է նատրիումի քրոմատ, վերջինիս ծծմբական թթվով վերածում են դիքրոմատի, այնուհետև վերականգնում ածխածնով`
Na2Cr2O7 + 2C = Cr2O3 + Na2CO3 + CO:
Քրոմ ստանում են նաև CrO3-ի և ծծմբական թթվի խառնուրդի էլեկտրոլիզից: Այդ պրոցեցն օգտագործում են տարբեր իրերի քրոմապատման համար:
3.2.4. Քիմիկան հատկությունները
Քրոմի էլեկտրոնային բանաձևն է` 1s22s22p63s23p63d54s1: Վեց վալենտային էլեկտրոններից մեկը արտաքին շերտում է, իսկ մյուսը հինգը` նախավերջինում: Այդ պատճառով քիմիական փոխարկումների ժամանակ քրոմը կարող է միայն կորցնել էլեկտրոններ և մետաղ: Ակտիվության շարքում քրոմը գտնվում է ջրածնից առաջ, սակայն սենյակային ջերմաստիճանում քրոմը պակաս ակտիվ է, քանի որ դրա մակերեսին առաջանում է բարակ, բայց շատ ամուր օքսիդային թաղանթ: Քրոմը լուծվում է աղաթթվի և ազոտական թթվի մեջ անցնելով երկվալենտ վիճակի`
Cr + 2HCl = CrCl2 + H2,
կորցնելով արտաքին շերտի և նախավերջին շերտի d ենթաշերտից մեկական էլեկտրոն: Առաջացած Cr+2-ը ևս կունենա մետաղական հատկություններ, քանի որ այն նույնպես միայն կարող է կորցնել d ենթաշերտում մնացած չորս էլեկտրոնները, ուստի համապատասխան օքսիդը` CrO պետք է լինի հիմնական օքսիդ և հիդրօքսիդը` Cr(OH)2 ` հիմք:
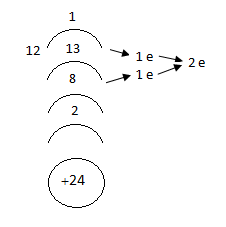
![]()
Որպես ծանր մետաղի օքսիդ և և հիդրօքսիդ սրանք ջրում չպետք է լուծվեն, ուստի` Cr(OH)2 - ը ,որը դեղին նստվածք է, պետք է ստացվի անուղղակի եղանակով`
![]()
Քրոմի երկվալենտ միացություններն անկայուն են և հիշողությամբ օքսիդանում են: Այդ պատճառով CrSO4-ի լուծույթը նոսր ծծմբական թթվում օգտագործվում է թթվածին կլանելու համար`
![]()
Գործընթացի
![]() և հեշտությամբ
է ընթանում: Cr2+
-ի առավել կայուն
միացություններից
է քրոմի (ll) ացետատի
բյուրեղահիդրատը`
և հեշտությամբ
է ընթանում: Cr2+
-ի առավել կայուն
միացություններից
է քրոմի (ll) ացետատի
բյուրեղահիդրատը`
![]()
Եռավալենտ վիճակի անցնլիս քրոմը, կորցնում է ևս մեկ էլեկտրոն 3 d ենթաշերտից:
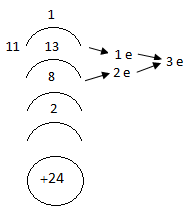
Եռավալենտ վիճակում քրոմը իր վեց վալենտային էլեկտրոններից երեքը կորցրել է, ուստի կարող է կորցնել ևս երեք վալենտային էլեկտրոն (մետաղական հատկություն), բայց և վերցնել կորցրած էլեկտրոններից վերջինը (ոչ մետաղական հատկություն): Այդ պատճառով եռավալենտ քրոմը ցուցաբերում է ամֆոտեր հատկություններ: Համապատասխան օքսիդը` Cr2O3 ամֆոտեր օքսիդ է, իսկ հիդրօքսիդը ` Cr(OH)3 ամֆոտեր հիդրօքսիդ:
![]()
Որպես ծանր մետաղի օքսիդ և հիդրօքսիդ Cr2O3 -ը և Cr(OH)3 -ը ջրում չեն լուծվում, և Cr(OH)3 ը ստացվում է անուղղակի եղնակով`
![]()
Քրոմի (lll) օքսիդը դժվարահալ կանաչ գույնի նյութ է, կոմպակտ վիճակում չի լուծվում նոսր թթուներւմ և ալկալիների լուծույթներում, սակայն բարձր մանրածվածության վիճակում լուծվում է ուժեղ թթուներում և ալկալիաների լուծույթներում`
Cr2O3 + 6NaOH + 3H2O = 2Na3[Cr(OH)6],
Cr2O3 + 3H2SO4 + 9H2O = [Cr(H2O)6]2(SO4)3:
Ամֆոտեր Cr(OH)3 -ը որպես թթու կունենա HCrO2 բանաձևը`(կկորցնի մեկ մոլեկուլ ջուր) և կկոչվի քրոմային թթու, որի աղերը կկոչվեն քրոմատներ:
Cr2O3-ը ալկալիական մետաղների օքսիդների հետ միահալելիս առաջացնում է քրոմային թթվի աղեր`
Cr2O3 + 2NaOH = 2NaCrO2 +H2O:
Cr(OH)3-ը HF-ի և Hl-ի հետ փոխազդելիս առաջացնում է CrF3 և Crl3 հալոգեններ: Քրոմի (lll) քլորիդը և բրոմիդը ստացվում են պարզ նյութերց` բարձր ջերմաստիճանային սինթեզով: Եռավալենտ քրոմը` Cr+3 նման է ալյումինումին, որը պայմանավորված է դրանց իոնների շառավիղների մոտավորապես հավասար լինելով: Դա արտահայտվում է այդ տարրերի Э2O3 օքսիդների նմանությամբ` կարծրությամբ, ամֆոտերությամբ, Э(OH)3-ի ամֆոտերությամբ, Э2S3 -ի և Э2(CO3)3-ի լավ հիդրոլիզվելու հատկությամբ:
Քրոմ (lll)-ը հետագա օքսիդացման ենթարկվելիս անցնում է քրոմ(Vl)-ի, կորցնելով մնացած երեք վալենտական էլեկտրոնները:
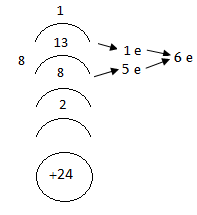
Այդ վիճակում քրոմը, կարող է միայն վերցնել էլեկտրոններ, ուստի ցուցաբերում է բնորոշ ոչ մետաղական հատկություններ, հետևաբար համապատասխան օքսիդը`CrO3 և հիդրօքսիդը, որը պետք է ունենար Cr(OH)6 բանաձևը, պետք է ունենան թթվային բնույթ, ուստի հիդրօքսիդը, համաձայն հիդրօքսիդների ջրազրկման կանոնի, պետք է կորցնի 2 մոլեկուլ ջուր և վերծվի H2CrO4 քրոմական թթվի:
![]()
Անցումը Cr(lll)-ից Cr(Vl)-ի կարելի է իրականացնել ուժեղ օքսիդիչներով հիմնային միջավայրում օքսիդացնելով`
2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O:
Այդ ռեակցիան իրականանալիս քրոմիտի կանաչ լուծույթը վերածվում է քրոմատի դեղին գույնի լուծույթի: Հիմնային միջավայրն այս դեպքում անհրաժեշտ է գոյանալիք թթվային բնույթ ունեցող քրոմի (Vl) օքսիդը աղի (քրոմատի) վրածելու համար: Քրոմատներ կարելի է ստանալ նաև քրոմի (lll) օքսիդը ալկալու հետ որևէ օքսիդիչի առկայությամբ միահալելով`
Cr2O3 + 4KOH + KClO3 = 2K2CrO4 + KCl + 2H2O:
Քրոմատների լուծույթնները թթվացնլու դեպքում լուծույթի դեղին գույնը փոխվում է նարնջագույնի: CrO42- -քրոմատ իոնները թթվային միջավայրում փոխազդելով H+ իոնների հետ առաջանում են դիքրոմատ իոն` Cr2O72-: Այդ ռեակցիան դարձելի է և արտահայտվում է հետևյալ հավասրմամբ`
2CrO42- + 2H+ = Cr2O72- + H2O:
Cr2O72 -իոնը դիքրոմական թթվի` H2Cr2O7 ի թթվային մնացորդն է: Այս թթվի աղերը կոչվում են դիքրոմատներ
![]()
2K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
Քանի որ քրոմատներում և դիքրոմատներում քրոմն ունի առավելագույն` +6 օքսիդացման աստիճան, սրանք ուժեղ օքսիդիչներ են և կիրառվում են զանազան նյութերի օքսիդացման համար`
K2Cr2O7 + 14HCl = 2CrCl3 + 3Cl2 + KCl + H2O:
Դիքրոմատներից առավել կարևոր են կալիումի` K2Cr2O7 և նատրիումի` Na2Cr2O7 · 2H2O դիքրոմաները: Սրանք նարնջագույն բյուրեղներ են և հայտնի են քրոմպիկ անունով: Քրոմի (Vl) օքսիդը ստացվում է քրոմատների և դիքրոմատների վրա կոնցենտրիկ ծծմբական թթվով ազդելով`
K2Cr2O7 + H2SO4 = K2SO4 + 2CrO3 + H2O:
CrO3-ը վառ կարմիր բյուրեղային նյութ է, որը հեշտությամբ լուծվում է ջրում` առաջացնելով քրոմական թթուներ: Դիքրոմատների նման` CrO3-ը ևս ուժեղ օքսիդիչ է: Այն հեշտությամբ օքսիդացնում է սպիրտը` վերածելով ալդեհիդի`
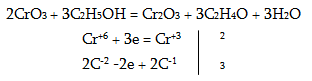
Բացի կայուն H2CrO4 և H2Cr2O7 թթուներից CrO3 -ին համապատասխանում են H2CrnO3n+1 բանաձևով այլ թթուներ ևս, որտեղ n-ը լինում է մինչև 4(H2Cr3O10 և H2Cr4O13):
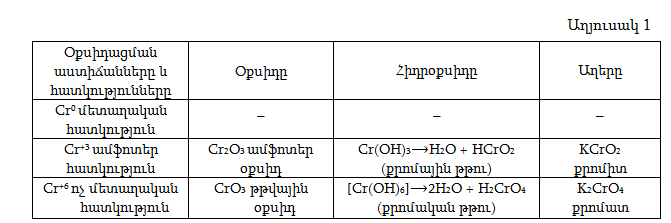
Այսպիսով, օքսիդացման աստիճանի մեծացման հետ մեկտեղ, քրոմի հատկությունները փոխվում են մետաղականից մինչև ոչ մետաղական, իսկ օքսիդների և հիդրօքսիդների հատկությունները` հիմնայինից թթվային (աղ.1):
Օքսիդավրականգման տեսակետից , օքսիդացման աստիճանի մեծացմա հետ մեկտեղ միացությունների օքսիդիչ հատկություններն ուժեղանում են:
Քրոմը, տարբեր օքսիդացման աստիճաններում, հեշտությամբ առաջացնում է կոմպլեքս միացություններ` [Cr(NH3)2]Cl2, K[CrF4]: Քրոմի բոլոր աղերը թունավոր են:
3.2.5. Կիրառությունը
Քրոմը պողպատին տալիս է լիգերացնող հատկություն: Պողպատի մեջ13%-ի ներմուծումը պողպատը դարձնում է չժանգոտվող: Քրոմը մտնում է բազմաթիվ ջերմակայուն համաձուլվածքների բաղադրության մեջ: Նիքրոմ համաձուլվածքը (80% Ni, 20% Cr) օգտագործվում է տաքացնող սարքերում: Քրոմը օգտագործվում է տարբեր իիրերի քրոմապատման համար:
3.3. Մոլիբդեն և վոլֆրամ
Մոլիբդենի քիմիական նշանն է` Mo, միջուկի լիցքը` 42, միջին իզոտոպային ատոմական զանգվածը` 95,94:
Վոլֆրամի քիմիական նշանն է`W , միջուկի լիցքը` 74, միջին իզոտոպային ատոմական զանգվածը` 183,85:
3.3.1. Տարածվածությունը բնության մեջ
Կազմում
են երկրի կեղևի
համապատասխանաբար
![]() և հանդիպում
են բացառապես միացությունների
ձևով: Մոլիբդենի
հիմնական բնական
միացությունը
մոլիբդենի փայլն
է`MoS2, իսկ վոլֆրամինը`
Շելիտը (CaWo4) և վոլֆրամատը`(Fe,
Mn)Wo4:
և հանդիպում
են բացառապես միացությունների
ձևով: Մոլիբդենի
հիմնական բնական
միացությունը
մոլիբդենի փայլն
է`MoS2, իսկ վոլֆրամինը`
Շելիտը (CaWo4) և վոլֆրամատը`(Fe,
Mn)Wo4:
3.3.2. Ֆիզիկական հատկությունները
Մոլիբդենը և վոլֆրամը սպիտակ արծաթավուն, ծանր, դժվարահալ մետաղներ են: pMo = 10,2գ/սմ3, tհալ = 26200C , իսկ pW =19,3 գ/սմ3 , tհալ 33950C: Վոլֆրամը բոլոր մետաղներից ամենադժվարահալն է:
Մոլիբդենը ստանում են հանքի խտանյութի թրծումից`
2MoS2 +7O2 = 2MoO3 + 4SO2:
Ստացված MoO3-ից մետաղը վերականգնում են տարբր վերականգնիչներով (Al, Mn, Zn, H2):
Վոլֆրամը ստանում են վոլֆրամատից: Այն միահալում են սոդայի և SiO2-ի հետ` ստանալով Na2WO4, այնուհետև մշակում աղաթթվով: Ստացված H2WO4-ը շիկացնում են` վերածելկով WO3-ի`
CaWO4 + Na2CO3 + SiO2 = Na2WO4 + CaSiO3 + CO2,
NaWO4 + 2HCl = H2WO4 + 2NaCl,
H2WO4 = WO3 + H2O:
Ստացված WO3-ը վերականգնում են ջրածնով, և ստացված մետաղի փոշին մասնակի հալման միջոցով վերածում են կոմպակտ մետաղի:
3.3.4. Քիմիական հատկությունները
Մոլիբդենը և վոլֆրամը քրոմի նման առաջացնում են կայուն միացություններ +3 և +6 օքսիդացման աստիճաններում, իսկ մոլիբդենը նաև +4 դեպքում: Բարձր ջերմաստիճաններում այս մետաղները փոխազդում են թթվածնի հետ` առաջացնելով MoO3 և WO3 օքսիդներ: Սրանք CrO3-ի նման ուժեղ օքսիդիչներ չեն և ջրում ավելի վատ են լուծվում: Աղաթթուն և նոսր ծծմբական թթուն սենյակային ջերմաստիճանում չեն ազդում մոլիբդենի վրա, այն տաքացնելիս լուծվում է ազոտական թթվում և խիտ ծծմբական թթվում: Վոլֆրամը կայուն է թթուների նկատմամաբ, չի լուծվում նույնիսկ արքայական ջրի մեջ, բայց լուծվում է ազոտական և ֆտորաջրածնական թթուների խառնուրդի մեջ: Դրանց համապատասխանում են մոլիբդենական (H2MoO4) և վոլֆրամական (H2WO4) թթուները: Դրանց վրա հիմքեր ավելացնելիս, կամ MoO3-ը (WO3) հիմքերի հետ միահալելիս առաջանում են մոլիբդեններ (վոլֆրամատներ)`
MoO3 + 2NaOH = Na2MoO4 + H2O,
WO3 + 2NaOH = Na2WO4 + H2O:
Մոլիբդենի (lV) օքսիդը` MoO3 ստացվում է մոլիբդենը ջրային գոլորշիներով օքսիդացնելով 8000C -ում, ինչպես նաև MoO3-ը վերականգնելով ջրածնով: Տաքացնելիս MoO3-ը ենթարկվում է անհամամասնական քայքայման`
3MoO2 = 2MoO3 + Mo:
3.3.5. Կիրառությունները
Արդյունահանվող մոլիբդենի և վոլֆրամի մեծ մասը (80%) ծախսվում է պողպատի հատուկ տեսակների արտադրության վրա: Մոլիբդենից պատրաստում են լաբորատոր ամանեղեն, էլեկտրոնային և շիկացած լամպերի մասեր: Հատիչ գործիքային պողպատները պարունակում են մինչև 20% վոլֆրամ: Որպես ամենադժվարահալ մետաղ, վոլֆրամը մտնում է ջերմամուր համաձուլվածքների բաղադրության մեջ: Վոլֆրամը կիրառվում է էլեկտրական լամպերի արտադրդության մեջ` շիկացած թելիկներ պատրաստելու համար: Այն 2200-25000C-ում ապահովում է բարձր լուսավորություն: Վոլֆրամի կարբիտ`WC ունի բարձր ալմաստին մոտ կարծրություն, դժվարահալ է, մաշակայուն է և կիրառվում է հորատող գործիքների աշխատով մասերի պատրաստման համար:
4. Ամփոփում
Պարբերական համակարգի վեցերորդ խմբի տարրերն ունեն վեցական վալենտական էլեկտրոն: ԹԹվածնի, ծծմբի, սելենի, տելուրի և պոլլոնիումի ատոմներում այդ էլեկտրոնները գտնվում են արտաքին շերտում (ns2np4), ուստի այդ տարրերը հեշտությամբ վերցնում են երկուական էլեկտրոն և հանդիսանում են ոչ մետաղներ: Ոչ մետաղական հատկությունները O Te շարքում թուլանում են : Բնության մեջ տարածված են միացություննների ձևեով, թթվածինը և ծծումբը նաև` ազատ վիճակում: Ազատ վիճակում թթվածինը անհոտ, անգույն գազ է, մնացածները պինդ բյուրեղային նյութեր են: Ջրածնի, իրենցից թույլ ոչ մետաղների հետ փոխազդելիս, այս տարրերը առաջացնում են միացություններ, որոնցում ունեն -2 օքսիդացման աստիճան`H2O, H2S, H2Se, H2Te: Բացառությամբ ջրի, սրանք սուր հոտավ թունավոր գազեր են, ջրում լուծվելիս առաջացնում են թթուներ, որոնց ուժը H2S H2Te շարքում մեծանում է: Սրանք լավ վերականգնիչներ են: Իրենցից մեծ էլեկտրաբացասականություն ունեցող տարրերի հետ փոխազդելիս ցուցաբերում են մինչև +6 օքսիդացման աստիճան, բացառությամբ թթվածնի, որը ցուցաբերում է միայն +2 օքսիդացման աստիճան (F2O): Հիմնականում առաջանում են +4 և +6 օքսիդացման աստիճան ունեցող թթվածնավոր միացություններ`(lV) օքսիդնր (SO2, SeO2, TeO2), որոնց համապատասխանում են H2SO2, H2SeO2, H2TeO2 թույլ թթուները: Տելուրային թթուն ամֆոտեր բնույթ ունի: Վեցվալենտ օքսիդներին` SO3, SeO3, TeO3 , համապատասխանում են H2SO4, H2SeO4, H2TeO4 (H6TeO6) թթուները:
Ծծմբային թթուն` H2SO3 թույլ անկայուն թթու է , ունի օքսիդավերականգման երկտվություն:
Ծծմբական թթուն` H2SO4 ուժեղ թթու է, նաև ուժեղ օքսիդիչ է կոնցենտրիկ վիճակում: Ստացվում է ծծմբից կամ երկաթի կոլչեդանից հետևյալ սխեմայով`
![]()
Խմբի մեջ մտնող մյուս տարրերը `Cr, Mo, W-ը վեց վալենտային էլեկտրոններից մեկը կամ երկուսը ունեն արտաքին s-ենթաշերտում, իսկ հինգը կամ չորսը` նախավերջին d ենթաշերտում, ուստի սրանք մետաղներ են: Ցածր օքսիդացման աստիճանում (+2) սրանց օքսիդներն ու հիդրոօքսիդները հիմնային բնույթ ունեն, (օրինակ CrO, Cr(OH)2, միջին օքսիդացման աստիճանում (+3) ամֆոտեր (օրինակ Cr2O3 ,Cr(OH)3), իսկ բարձ օքսիդացման աստիճանում` թթվային բնույթ: Քրոմական (H2CrO4) և դիքրոմական (H2Cr2O7) թթուները և դրանց աղերը ուժեղ օքսիդիչներ են:
5. Սովորելու նպատակը
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք`
1)Տալ տվյալ վեցերորդ խմբի ընդհանուր բնութագիրը: Ելնելով խմբի մեջ մտնող տարրերի ատոմների էլեկտրոնային թաղանթների կառուցվածքից` պատճառաբանել խումբը ենթախմբերի բաժանելը, թթվածնի ենթախմբի տարրերի ոչ մետաղներ և քրոմի ենթախմբի տարրերի լինելը:
2) Ելնելով թթվածնի ենթախմբի տարրերի ատոմների էլեկտրոնային թաղանթների կառուցվածքից` արտածել դրանց քիմիական հատկությունները` այն բաժանելով երկու հիմնական տեսակների`
ա) երբ փոխազդում են իրենցից փոխր էլեկտրաբացասականություն ունեցող տարրերի (ջրածին, մետաղներ) հետ:
բ) երբ առաջացնում են միացություններ, իրենցից մեծ էլեկտրաբացասականություն ունեցող տարրերի (թթվածին, հալոգեններ) հետ:
3)Համեմատել S - Se Te շարքում սրանց ջրածնական և թթվածնավոր միացությունների հատկությունները:
4) Ելնելով քրոմի ենթախմբի տարրերի ատոմների էլեկտրոնային թաղանթնրի կառուցվածքից, արտածել այդ մետաղների հատկությունները, դրանց միացությունների բանաձևերն ու հատկությունները, պատճառաբանել օքսիդացման աստիճանի մեծացման հետ մեկտեղ այդ հատկությունների փոփոխման օրինաչափությունները:
6. Հիմնական հասկացությունները և միացությունները
Թթվածինը (O2) անգույն գազ է, ծծումբը (S) դեղին, պինդ բյուրեղային նյութ է, Se-ը սև գույնի պինդ բյուրեղային նյութ է ,Te-ը մետաղանման մուգ գորշավուն նյութ է: Սրանք ակտիվ ոչ մետաղներ են, միացությունները ցուոցաբերում են -2-ից մինչև +6 օքսիդացման աստիճաններ, բացառությամբ թթվածնի` (-2-ից +2): Ջրածնային միացությունները սուր հոտով թունավոր գազեր են (H2S, H2Se, H2Te ), ջրային լուծույթում թույլ թույներ են, լավ վերականգնիչներ:
Մետաղների հետ առաջացնում են սուլֆիդներ, համապատասխան միներլները կոչվում են փայլեր (CuS, ZnS, MoS), թթվածնի հետ առաջացնում են (lV) և (Vl) օքսիդներ`SO2, SeO2, TeO2 թթվային օքսիդներ, որոնց համապատասխանում են H2SO3, H2SeO3, H2TeO3 -ային վերջավորությամբ թթուները, և SO3, SeO3, TeO3 թթվային օքսիդները, որոնց համապատասխանում են H2SO4, H2SeO4, H2TeO4 (H6TeO6)-ական վերջավորությամբ թթուները:
Ծծմբային
թթուն (H2SO3 ) թույլ
թթու է ծծմբական
թթուն (H2SO4) ուժեղ
թթու է և կոնցենտրիկ
վիճակում օքսիդիչ
է: Աղերը կոչվում
են սուլֆատներ:
![]() գլաուբերյան
աղ, կիրառվում
է ապակու արտադրության
մեջ, K2SO4 - կալիումի
սուլֆատ, առաջացնում
է կրկնակի աղեր,
շիբեր: MgSO4- մագնեզիումի
սուլֆատ, պարունակվում
է ծովի ջրում, լուծույթից
բյուրեղանում
է
գլաուբերյան
աղ, կիրառվում
է ապակու արտադրության
մեջ, K2SO4 - կալիումի
սուլֆատ, առաջացնում
է կրկնակի աղեր,
շիբեր: MgSO4- մագնեզիումի
սուլֆատ, պարունակվում
է ծովի ջրում, լուծույթից
բյուրեղանում
է ![]() բյուրեղահիդրատի
ձևով: CaSO4-կալիցիումի
սուլֆատ, բնության
մեջ պարունակվում
է
բյուրեղահիդրատի
ձևով: CaSO4-կալիցիումի
սուլֆատ, բնության
մեջ պարունակվում
է ![]() գիպս միներալի
ձևով, ջրազրկված
գիպս միներալի
ձևով, ջրազրկված
![]() տեսակը շինարարական
նյութ է: Արջասպներ`
տեսակը շինարարական
նյութ է: Արջասպներ`![]() պղնձաջրասպ,
պղնձաջրասպ,
![]() - երկաթի արջասպ:
Շիբեր`
- երկաթի արջասպ:
Շիբեր` ![]() - ալյումինակալիումական
շիբ և
- ալյումինակալիումական
շիբ և ![]() -քրոմոկալիումական
շիբ: Չեզոք
և +2 օքսիդացման
աստիճաններում
քրոմը, մոլիբդենը
և վոլֆրամը ցուցաբերում
են մետաղական հատկություններ
(CrO - հիմն. օքսիդ,
Cr(OH)2 անլուծելի
հիմք), եռավալենտ
վիճակում (+3) քրոմը
ամֆոտեր բնույթ
ունի (Cr2O3-ամֆոտեր
օքսիդ, Cr(OH)3 ամֆոտեր
հիդրօքսիդ/: Վեց
վալենտ վիճակում
(+6) քրոմը ոչ մետաղական
հատկություններ
ունի (CrO3-թթվային
օքսիդ, H2CrO4 կամ
H2Cr2O7-թթուներ):
Քրոմի վեցվալենտ
թթուները և դրանց
աղերը (քրոմատներ`K2CrO4,
դիքրոմատներ`K2Cr2O7)
ուժեղ օքսիդիչներ
են: Մոլիբդենը
և վոլֆրամը դժվարահալ
մետաղներ են, ավելի
կայուն են թթուների
նկատմամբ, քան
քրոմը:
-քրոմոկալիումական
շիբ: Չեզոք
և +2 օքսիդացման
աստիճաններում
քրոմը, մոլիբդենը
և վոլֆրամը ցուցաբերում
են մետաղական հատկություններ
(CrO - հիմն. օքսիդ,
Cr(OH)2 անլուծելի
հիմք), եռավալենտ
վիճակում (+3) քրոմը
ամֆոտեր բնույթ
ունի (Cr2O3-ամֆոտեր
օքսիդ, Cr(OH)3 ամֆոտեր
հիդրօքսիդ/: Վեց
վալենտ վիճակում
(+6) քրոմը ոչ մետաղական
հատկություններ
ունի (CrO3-թթվային
օքսիդ, H2CrO4 կամ
H2Cr2O7-թթուներ):
Քրոմի վեցվալենտ
թթուները և դրանց
աղերը (քրոմատներ`K2CrO4,
դիքրոմատներ`K2Cr2O7)
ուժեղ օքսիդիչներ
են: Մոլիբդենը
և վոլֆրամը դժվարահալ
մետաղներ են, ավելի
կայուն են թթուների
նկատմամբ, քան
քրոմը:
Արմեն Շահենի Գրիգորյան
ՊԱՐԲԵՐԱԿԱՆ ՀԱՄԱԿԱՐԳԻ Vl ԽՈՒՄԲԸ
ՈՒսումնական ձեռնարկ
Григорян Армен Шагенович
Шестая группа периодической системы
Учебное пособие
Խմբագիր` Ն.Ա. Խաչատրյան
Ստորագրված է տպագրության`30.05.2011
Հայաստանի Պետական
Ճարտարագիտական
Համալսարանի տպարան
Երևան ,Տերյան 105 Հեռ`.52-03-56
Типопграфия Гоцударственного Инженерного
Унивеиситета Армении
Ерреван. Ул. Теряна 105 Тел.52-03-56
