ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ
ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐԱՈՒԹՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
(ՊՈԼԻՏԵԽՆԻԿ)
Քիմաիական տեխնեոլոգիաների և
բնապահպանական
Ճարտարագիտության ֆակուլտետ
Ընդհանուր քիմաիայի և
քիմիական պրոցեսների ամբիոն
Ա.Շ. Գրիգորյան
ՊԱՐԲԵՐԱԿԱՆ ՀԱՄԱԿԱՐԳԻ ՀԻՆԳԵՐՈՐԴ ԽՈՒՄԲԸ
Ուսումնական ձեռնարկ
ԵՐԵՎԱՆ
ՃԱՐՏԱՐԱԳԵՏ
2014
ՀՏԴ 546.85(07)
ԳՄԴ 24.125 ց7
Գ 888
Հրատարակված է հայաստանի պետական
Ճարտարագիտական համալսարանի
14.01.2014թ. գիտական խորհրդի նիստում
հաստատված 2014թ. հրատարակչական
պլանի համաձայն
Գրախոսներ` Գ. Վարդերեսյան
Օ. Աճեմյան
Գրիգորյան Ա.Շ.
Գ 888 Պարբերական համակարգի հինգերորդ խումբը:Ուսումնական ձեռնարկ /Ա.Շ.Գրիգորյան: ՀՊՃՀ.-Եր.: Ճարտարագետ, 2014-48 էջ:
Ձեռնարկում շարադրված է V խմբի տարրերի ընդհանուր բնութագիրը,նյութերի ֆիզիկական հատկությունները, ստացման լաբորատոր և արդյունաբերական եղանակները, կիրառությունները: Ելնելով տարրերի ատոմների կառուցվածքից արտածման մեթոդով շարադրված են դրանց հիմնական միացությունների բանաձևերն ու քիմիական հատկությունները: Բերված են համառոտ ամփոփում, սովորելու նպատակը և հիմնական հասկացությունները: Ներկայացված է քիմիատեխնոլոգիական և բնապահպանական ճարտարագիտության մասնագիտությունների ուսանողների, մագիստրոսների և դասախոսների համար:
ՀՏԴ 546.85 (07)
ԳՄԴ 24.125 ց7
ISBN 978-9939-72-125-5
© ՃԱՐՏԱՐԱԳԵՏ 2014
© Գրիգորյան Ա.Շ. 2014
Բովանդակություն
2.2.1. Տարածվածությունը բնության մեջ
2.2.2. Ֆիզիկական հատկությունները
2.2.4. Ազոտի քիմիական հատկությունները
2.2.5. Ազոտի և դրա միացությունների կիրառությունը
2.3.1 Տարածվածությունը բնության մեջ
2.3.2. Ֆիզիկական հատկությունները
2.3.3. Քիմիական հատկությունները
2.3.4. Ֆոսֆորի կիրառությունը, հանքային պարարտանյութեր
2.4.1. Տարածվածությունը բնության մեջ
2.4.3. Ֆիզիկական հատկությունները
2.4.4. Քիմիական հատկությունները
3.2. Տարածվածությունը բնության մեջ
3.4. Ֆիզիկական հատկությունները
Հիմնական հասկացությունները և միացությունները
1. Խմբի ընդհանուր բնութագիրը
Հինգերորդ խմբի տարրերի համար ընդհանուրն այն է, որ դրանք բոլորն ունեն խմբի համարին հավասար`հինգական վալենտական էլեկտրոններ: Սակայն այդ էլեկտրոնները երկու տարբեր ձևով են բաշխված վալենտային (արտաքին և նախավերջին) շերտերում: Դա առաջացնում է քիմիական հատկությունների տարբերություն, որի պատճառով խումբը բաժանվում է երկու ենթախմբի:
Խմբի մեջ մտնող տարրերից ազոտը, ֆոսֆորը, արսենը, անտիմոնը և բիսմուտը հնգական վալենտական էլեկտրոններ ունեն արտաքին շերտում, երկուսը`S- և երեքը P-ենթաշերտում: Դրանց ընդհանուր էլեկտրոնային բանաձևը…ns2np3 է, որտեղ n–ն այն պարբերության համարն է, որում տարրը գտնվում է: Քանի որ սրանք արտաքին շերտում ունեն հնգական էլեկտրոններ, այս տարրի ատոմները պետք է միացնեն երեք էլեկտրոն, լրացնելու այդ շերտը, ուստի պետք է լինեն բնորոշ ոչ մետաղներ, իհարկե ավելի թույլ քան յոթերորդ և վեցերորոդ խմբերի համապատասխան տարրերը (հալոգենները և խալկոգենները): Միջուկի լիցքի աճմանը զուգընթաց N, P, As, Sb, Bi շարքում ատոմների շառավիղների մեծացման հետևանքով տարրերի էլեկտրոն միացնելու, այսինքն ոչ մետաղական հատկությունները պետք է թուլանան, և ի հայտ գան մետաղական հատկություններ: Այդպիսի հատկություններ դրսևորում են արդեն արսենը և անտիմոնը, իսկ բիսմուտի մետաղական հատկությունները գերազանցում են ոչ մետաղականնին:
Խմբի մեջ մտնող մնացած տարրերը`վանադիումը, նիոբիումը և տանտալը հնգական վալենտական էլեկտրոններից երկուսն ունեն արտաքին շերտի s-, երեքը նախավերջի շերտի d-ենթաշերտում:Սրանց ընդհանուր էլեկտրոնային բանաձևն է …(n-1)d3 ns2: Քանի որ արտաքին շերտում երկու էլեկտրոն է, քիմիական փոխակերպումների ժամանակ այս տարրերը կարող են միայն կորցնել էլեկտրոններ, ուստի պետք է լինեն մետաղներ: Սրանք ակզմում են խմբի երկրորդական ենթախումբը:
2 Գլխավոր ենթախումբ
2.1. Պատմական ակնարկ
Ազոտը հայտնաբերել է Ռեզերֆորդը 1772թ անվանել «անկյանք»՝լատիներեն azoos բառից, քանի որ այդ գազը չի պահպանում շնչառությունը:
Ֆոսֆորը հայտնաբերելէ գերմանացի Խ. Բրանդը և անվանել «լուսակիր» լատիներեն posphoros բառից, քանի որ այն մթության մեջ լուսարձակում է:
Արսենը «Arsenikon» անունը հանդիպում է դեռ Արիստետելի աշխատություններում և ծագել է հունարեն arsen-ուժեղ բառից, քանի որ արսենի միացություններն ուժեղ ազդեցություններ են թողնում օրգանիզմի վրա: Ազատ վիճակում ստացումը վերագրվում է թագավոր Ալբերտ Մեծին (1250թ) 1789թ.-ին Լավազեն այն մտցրեց քիմիակա տարրերի ցանկի մեջ:
Անտիսիմոնը օգտագործվել է հին աշխարհում դեռևս մեռ թվարկությունից երեք հազար տարի առաջ: Անտիմիոնի և մյուս միացությունների ստացումը առաջինը նկարագրել է գերմանացի ալքիմիկոս Վ.Վալենտինը 1604թ:
Բիսմուտը հայտնի է եղել դեռ 15-16-րդ դարերում, սակայն երկար ժամանակ համարվել կապարի կամ անագի տարատեսակ: Որպես ինքնուրույն մետաղ ճանաչվել է 18 –րդ դարի կեսերից : Անվան ծագումը հատնի չէ:
2.2 Ազոտ
Քիմիական նշանը՝ N(Nitrogenium), միջուկի լիցքը՝ 7, միջին իզոտոպային զանգվածը՝ 14.0067, կազմված է երկու կայուն իզոտոպներից՝ 14N(99.653%) 15N(0.365%):
2.2.1 Տարածվածությունը բնության մեջ
Ազոտը կազմում է երկրի կեղևի 0.04%-ը, որի հիմնական մասը գտնվում է մթնոլորտում կազմելով օդի 78.03%-ը, ըստ ծավալի կամ 75.6%-ը՝ ըստ զանգվածի:
2.2.2 Ֆիզիկական հատկությունները
Ազոտը հոտ չունեցող անգույն գազ է, հեղուկացման ջերմաստիՃանը -190oC է, իսկ կարծրացմանը՝ -201oC: Ջրում ազոտի լուծելիությունը ավելի փոքր է, քան թթվածինը և կազմում է 23.3գ 1մ3 ջրում: Ավելի լավ քան ջրում, ազոտը լուծվում է որոշ ածխաջրածիններում:
Արդյունաբերության մեջ ազոտը ստանում են հեղուկ օդի գոլոշիացումով (ռեկտիֆիկացիա): Քանի որ թթվածնի և ազոտի եռման ջերմաստիճաննեռը տարբեր են -183 և -190oC համապատասխանաբար, գոլոշացնելիս ստացվում է գազային ազոտ և հեղուկ թթվածին:
Լաբորատորիայում ընդանրապես օգտագործում են արդյունաբերական եղանակով ստացված ազոտ, լցված բարձր ճնշման բալոններում, կամ հեղուկ ազոտ լցված Դյուարի անոթներում: Ազոտի փոքր քանակներ հարմար է ստանալ NH4Cl և NaNO2 խառնուրդի տաքացումից:
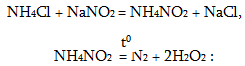
Ազոտ ստացվում է նաև նատրիումի ազիդի (NaN3),ամոնիումի դիքրոմատի ((NH4)22Gr2O7) քայքայումից, պղնձի օքսիդն ամոնիակով վերականգնելիս:
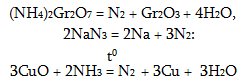
2.2.4. Ազոտի քիմիական հատկությությունները
Ազոտի էլեկտրոնային բանաձևն է 1s2 s22p3: Ազոտի մոլեկուլում ատոմները միացած են N≡N եռակի կապով: Այդ պատճատով այս մոլեկուլի դիսոցման էնեգիան շատ մեծ է (948 ԿՋ/մոլ), և ազոտը քիմիապես քիչ ակտիվ է:
Ազոտի քիմիական հատկությունները կարելի է բաժանել երկու հակադիր մեծ խմբերի:
Առաջին: Երբ ազոտը փոխազդում է իրենից փոքր էլեկտրաբացասականություն ունեցող տարրերի` օրինակ ջրածնի, ակտիվ մետաղների հետ, վերցնում կամ դեպի իրեն է տեղաշարժում երեք էլեկտրոն լրացնելով առաջին շերտը և հանդես է բերում -3 օքսիդացման աստիճան, հետևաբար ջրածնի հետ փոխազդելիս պետք է առաջացնի NH3 բանաձևով միացություն` ամոնիակ:
Ամոնիակը սուր հոտով անգույն գազ է, tեռ. = -330C և tհալ. = -780C : Հեղուկ վիճակում NH3 մոլեկուլներն ասոցացվում են ջրածնային կապերի շնորհիվ: Հեղուկ ամոնիակի մեջ լուծվում են շատ ակտիվ մետաղներ, որոնք աստիճանաբար փոխազդում են ամոնիակի հետ`առաջացնելով ամիդներ:
2Na + 2NH3 = 2NaNH2 + H2
Այստեղ ամոնիակը կարծես հանդես է բերում թթվային հատկություններ, սակայն դրանք շատ ավելի թույլ են արտահայտված, քան Vl և Vll խմբերի ոչ մետաղների ջրածնական միացություններում (H2S, HF):
Մետաղաամոնիակային լուծույթները մետաղների նման լավ հաղորդիչներ են, քանի որ դրանցում մետաղների ատոմները տրոհվում են մետաղի իոնի և էլեկտրոնի, որոնք սոլվատացվում են NH3 մոլեկուլներով: Այս լուծույթներն ուժեղ վերականգնիչներ են:
Ամոնիակը ջրում լավ լուծվում է: Սենյակի ջերմաստիճանում մեկ ծավալ ջուրը լուծում է 700 ծավալ ամոնիակ, որը համապատասխանում է 25% պարունակության: Լուծույթում այն փոխքզդում է ջրի հետ առաջացնելով ամոնիումի հիդրօքսիդ` NH4 OH, որը թույլ հիմք է:
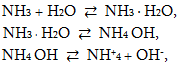
Սրանցից
երկրորդ ռեակցիան
քիչ չափով է ընթանում,
լուծույթում հիմնականում
պարունակում է
![]() այդ
պատճառով, չնայած
NH4OH-ը շատ լավ է դիսոցվում,
այն պայմանականորեն
համարվում է թույլ
հիմք:
այդ
պատճառով, չնայած
NH4OH-ը շատ լավ է դիսոցվում,
այն պայմանականորեն
համարվում է թույլ
հիմք:
Քանի որ NH3-ում ազոտի օքսիդացման աստիճանը ամենացածրն է`-3, այն ունի բնորոշ վերականգնիչ հատկություններ: Ամոնիակը թթվածնի մեջ այրվում է`առաջացնելով ազոտ և ջուր:
![]()
Պլատին կատալիզատորի ներկայությամբ
NH3 + H+ = NH+4:
Այստեղ ամոնիակը պրոտոնների ակցեպտոր է, ուստի հիմք է: Ջրի հետ փոխազդելիս ամոնիակն առաջացնում է ոչ միայն հիդրատ այլ նաև ամոնիումի իոն:
![]()
Թթուների հետ փոխազդելիս ամոնիակը չեզոքացնում է դրանց ամոնիակն օքսիդանում է մինչև NO և կիրռվում է ազոտական թթվի ստացման համար:
4NH3 + 5O2 = 4NO2 + 6H2O:
Ամոնիական օքսիդանում է նաև քլորով.
2NH3 + 3CI2 =N2+ 6HCI:
Ամոնիակի մոլեկուլում ազոտն ունի մեկ սեփական էլեկտրոնային զույգ, որով մտնում է դոնոր-ակցեպտորային կապի մեջ:
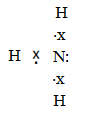
(այստեղ ջրածնի էլեկտրնները պայմանականորեն ցույց են տրված աստղիկով), առաջացնելով չորրորդ կովալենտ կապը: Սրանով է բացատրվում NH3-ի միացման ռեակցիաների մեջ մտնելու հատկությունը: Ջրի, թթուների հետ փոխազդելիս NH3-ը միանում է ջրածնի իոնի հետ` առաջացնելով ամոնիումի իոն:
NH3 + H+ = NH4+:
Այստեղ ամոնիակը պրոտոնների ակցեպտոր է, ուստի հիմք է: Ջրի հետ փոխազդելիս ամոնիակն առաջացնում է ոչ միայն հիդրատ այլ նաև ամոնիումի իոն:
![]()
Թթուների հետ փոխազդելիս ամոնիակը չեզոքացնում է դրանց՝ առաջացնելով ամոնիումի աղեր:
NH3 + HCI = NH4CI:
Ամոնիումի աղերի հիմնականում անգույն են լավ լուծվում են ջրում, իրենց հատկություններով նման են ալկալիական մետաղների աղերին, սակայն, քանի որ NH4OH-ը թույլ հիմք է, այդ աղերը ջրային լուծույթներում հիդրոլիզացվում են:
![]()
Ամոնիումի աղերը տաքացնելիս քայքայվում են: Այն աղերը, որոնցում անիոնը օքսիդիչ չէ, տրոհվում են դարձելիորեն:
![]()
Օքսիդիչ անիոն պարունակող աղերի քայքայման ժամանակ ընթանում է ներմոլեկույալին օքսիդավերականգման ռակցիա, որում ամոնիում իոնը օքսիդանում է:
![]()
NH3-ի էլեկտրոնադոնոր հատկություններն արտահայտվում են նաև նրանով, որ այն որպես լիգանդ մտնում է շատ կոմպլեքս միացությունների բաղադրության մեջ: Եթե d-տարրի աղերի լուծույթներին ավելացվի ավելցուկով ամոնիակ, առաջանում են դրանց ամոնիակային կոմպլեքսները: Կոմպլեքսագոյացումն ընդհանրապես ուղեկցվում է լուծույթի գույնի փոփոխմամբ:
NiSO4 + 6NH3 = [Ni(NH3)6]SO4 ,
Pd(NO3)2 + 4NH3 = [Pd(NH3)4](NO3)2 :
Լաբորատորիայում ամոնիակն ստանում են ամոնիումի քլորիդի և կալցիումի հիդրոքսիդի խառնուրդի տաքացումից`
2NH4CI + Ca(OH)2 = CaCI2 + 2NH3 + 2H2O:
Կալցիումի հիդրօքսիդը կապում է առաջացած HCI-ը, և գազ ֆազում մնում են միայն ամոնիակ և ջրի գոլորշիներ, որը չորացնում են` անցկացնելով նատրոնակիր (կրի և NaOH-ի խառնուրդ) միջով:
Արդյունաբերության մեջ ամոնիակ ստանում են` ազոտից և ջրածնից սինթեզելով:
![]()
Ռեակցիան էկզոթերմիկ է և ընթանում է ծավալի կրճատումով, ուստի հավասարակշռությունը դեպի աջ տեղաշարժելու համար հարմար է բարձրացնել ճնշումը և իջեցնել ջերմաստիճանը: Առանց կատալիզատորի այդ ռեակցիան ընթանում է շատ դանդաղ: Որպես կատալիզատոր օգտագործվում են երկաթ` ակտիվացված ալյումինով: Ռեակցիան տարվում է մինչև 300 կգ/սմ2 ճնշման տակ (մոտ 100 մթ) և 500 0C-ում: Համեմատաբար բարձր ջերմաստիճան վերցվում է այն պատճառով, որ ցածր ջերմաստիճաններում, չնայած հավասարակշռությունն ավելի է տեղաշարժվում դեպի աջ, բայց փոքրանում է արագությունը: 500 0C-ում ստացվում է առավելագույն ելք:
Ամոնիակի մոլեկուլում մեկ ջրածինը OH խմբով փոխարինելիս ստացվում է NH2OH-հիդրօքսիլամին ածանցյալը: Այն ստացվում է ազոտական թթվի էլեկտրաքիմիական վերականգնումով:
![]()
Հիդրոքսիլամինը բյուրեղային նյութ է tհալ. = -330C, թունավոր է, լավ վերականգնիչ է: Օքսիդիչ ազդելիս անջատվում է N2 կամ N2O:
![]()
Ամոնիակի նման հիդրօքսիլամինը փոխազդում է թթուների հետ` առաջանալով հիդրօքսիլամոնիումի աղեր:
NH2OH + HCI = [NH3OH]CI
Որոնց մեծ մասը ջրում լուծվում է:
Բացի NH3-ից հայտնի են ազոտի այլ ջրածնական միացություններ. hիդրազին` N2H4 և ազոտաջրածնական թթու NH3:
Հիդրազինը ստացվում է` ամոնիակը նատրիումի հիպոքլորիդի ջրային լուծույթում օքսիդանելով
2NH3 +NaOCI =N2H4 + NaCI+ H2O:
Հիդրազինը ամոնիակի հոտով հեղուկ է, tեռ. = 1140C, թունավոր է և պայթուցիկ, լավ վերականգնիչ է: Ազոտի երկու ատոմներում ունեցած չբաժանված էլեկտրոնային զույգերի առկայությության շնորհիվ հիդրազինը կարողանում է իրեն միացնել ջրածնի իոններ (դոնոր-ակցեպտորային կապով) առաջացնելով հիդրազոնիում միացություններ` ջրի հետ N2H5OH, աղաթթվի հետ N2H5-CI և այլն: Հիդրազոնիում աղերի մեծ մասը ջրում լուծելի են:
Իր կայունությամբ հիդրազինը բավականին զիջում ամոնիակին, քանի որ N-N կապը այնքան էլ ամուր չէ:
Հիդրազինն այրվում է օդում
![]()
Լուծույթներում հիդրազինն օքսիդանում է մինչև N2, իսկ վերականգնվում է մինչև NH3 միայն ուժեղ վերականգնիչների ազդեցության տակ:
N2H4 +Zn +4HCI =2NH4CI + ZnCI2:
Ազոտաջրածնական թթունստացվում է ծծմբական թթվի և նատրիումի ազիդի փոխազդեցությունից, իսկ վերջինս ստացվում է
2NaNH2 +N2O = NaN3 + NaOH + NH3
ռեակցիայով: HN3-ը սուր հոտով հեղուկ է, tեռ.=370C, tհալ.=-800C, հեշտությամբ պայթում է : Սրա աղերը` ազիդները (Pd(N3)2) պայթուցիկ են: HN3-ը թույլ թթու է:
Մետաղներից սենյակային ջերմաստիճանում ազոտը փոխազդում է միայն լիթիումի հետ: Տաքացնելիս այն փոխազդում է նաև կալցիումի, մագնիզիումի, տիտանի հետ` առաջացնելով նիտրադներ:
3Ca + N2 = Ca3N2
Ակտիվ մետաղների նիտրիդները ջրում հիդրոլիզվում են առաջացնելով ամոնիակ և մետաղի հիդրօքսիդ`
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3:
Սենյակային ջերմաստիճանում հիդրոլիզի ենթարկվում են միայն ակտիվ մետաղների նիտրիդները,որովհետև դրանցում կապը մոտ է իոնականին: Կան այնպիսի նիտրիդներ (BH, Si2, N4), որոնցում կապը մոտ է կովալենտին, ուստի սրանք կայուն են ջրի նկատմամբ: d- և f-տարրերին առաջացնում են նիտրիդներ, որոնք նման են կարբիդներին: Սրանք ունեն մետաղների նման մեծ հաղորդականություն, կարծր են և քիմիապես իներտ:
Երկրորդ: Իրենից մեծ էլեկտրաբացասականություն ունեցող տարրի հետ կազմված միացություններում օրինակ` թթվածնի հետ, ազոտը հանդես է բերում դրական օքսիդացման աստիճաններ, մինչև +5, ընդ որում, քանի որ ազոտի վալենտային էլեկտրոնները գտնվում են երկրորդ շերտում, որը չունի d-ենթաշերտ 2s էլեկտրոնային զույգը չի կարող անցնել գրգռված վիճակի (երրորդ շերտ անցնելու դեպքում էներգիայի ծախսը կլինի ավելի մեծ, քան առաջացած կենտ էլեկտրոնների կապ առաջացնելու հետևանքով էներգիա կանջատվի), ուտի ազոտը հանդես է բերում +1, +2, +3 և +5 օքսիդացման աստիճաններ և լինում է առավելագույնը քառավալենտ (lV): Ըստ դրա էլ ազոտն առաջացնում է N2O, NO, N2O3, NO2(N2O4) և N2O5 օքսիդները:
Ազոտի (l) օքսիդը` N2O թույլ հոտով քաղցրավուն համով անգույն գազ է, ջրում վատ է լուծվում: N2O-ի փոքր քանակի ներշնչումն առաջացնում է ցավի զգացողության բթացում, իսկ մեծ քանակները գրգռիչ ազդեցություն են թողնում նյարդային համակարգի վրա, որի պատճառով N2O-ն անվանում են «զվարճացնող գազ»: Սենյակային ջերմաստիճանում այն կայուն է, իսկ բարձր ջերմաստիճաններում քայքայվում է ազոտի և թթվածնի: N2O-ի մոլեկուլն ունի հետևյալ կառուցվածքը`
![]()
որտեղ սլաքով ցույց է տրված դոնոր-ակցեպտորային եղանակով առաջացած կապը: N2O-ն աղ չառաջացնող օքսիդ է, այն չի փոխազդում ոչ ջրի, ոչ թթուների և ոչ էլ հիմքերի հետ:
N2O-ն ստացվում է ամոնիումի նիտրատի քայքայումից
NH4NO3 = N2O + 2H2O:
Տաքացնելիս N2O-ն քայքայվում է N2-ի և O2-ի: Թթվածնից բացի սա միակ գազն է, որի մեջ ծխացող մարխը բոցավառվում է:
Ազոտի (ll) օքսիդը` NO-անգույն գազ է, հեղուկանում է -1520C-ում և պնդանում -1640C-ում: Ջրում վատ է լուծվում, ցածր և ջերմաստիճաններում չի քայքայվում, 1000C-ում նկատելիորեն քայքայվում է, իսկ ավելի բարձր ջերմաստիճաններում դարձյալ կայուն է: NO-ն ևս աղ առաջացնող օքսիդ է: Ցածր ջերմաստիճաններում այն հեշտությամբ փոխազդում է թթվածնի, հալոգենների հետ
2NO + O2 = 2NO2,
2NO + CI2 = 2NOCI:
Առաջացած նիտրոզիլ քլորիդը հեշտությամբ անջատվում է քլորի ատոմ և օգտագործվում է քլորացման համար: Այս ռեակցիաներում NO-ն հանդես է գալիս որպս վերականգնիչ, սակայն այն ունի օքսիդավերականգման երկվություն և կարող է տաքանալիս օքսիդացնել ածխածնին, ֆոսֆորին, խխմբին, ջրածնին շատ մետաղների` վերախվելով ազոտի
2NO + 2H2 = N2 + 2H2O:
Որոշ մետաղների հետ NO-ն առաջացնում, է կոմպլեքս միացություններ: Երկաթի սուլֆատի հետ առաջացրած կոմպլեքս միացությունը NO-ի հայտնաբերման որակական ռեակցիա է,
![]()
որովհետև առաջանում է գորշ գույնի լուծույթ: Տաքացնելիս ընթանում է հակառակ ռեակցիան, և գույնն անհետանում է: Սպունգային երկաթի հետ NO-ն առաջացնում է երկաթի տետրանիտրիլ` Fe(NO)4 :
NO-ն այն քիչ թվով մոլեկուլներից է, որը պարունակում է կենտ թվով էլեկտրոններ: Խարխլող օրբիտայում չզույգված էլեկտրոն պարունակելը պայմանավորվում է NO-ի դիմեր սոդա առաջացնելու հատկությունը ON - NO: Այս դիմերը առանձնապես կայուն չէ: Հեղուկ NO-ն պարունակում է մոտ 25% N2O2, իսկ պինդը լրիվ կազմված է դրանից:
NO-ի դիմերացումը կարևոր նշանակություն ունի ազոտական թթվի արտադրության մեջ կարևոր
2NO + O2 = 2NO2:
ռեակցիայի արագ ընթացման համար: Թթվածինը փոխազդում է ոչ թե NO այլ N2O2 մոլեկուլի հետ: Դիմերի բացակայության դեպքում
NO + O2 = NO2 + O
ռեակցիան ընթանում է չնչին արագությամբ, քանի որ երկու մոլեկուլ NO-ի և մեկ մոլեկուլ O2-ի եռակի բախումը քիչ հնարավոր է:
Լաբորատորիայում NO-ն ստացվում է պղինձ և 30%-անոց ազոտական թթվի փոխազդեցությունից
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4HO2
Արդյունաբերության մեջ մեծ քանակով NO ստանում են ամոնիակի կատալիզային օքսիդացումից պլատին կատալիզատորի ներկայությամբ
4NH3 + 5O2 = 4NO+ 6H2O:
NO ստացվում է նաև բարձր ջերմաստիճաններում (3000-40000C) ազոտի և թթվածնի փոխազդեցությունից, ուստի այն
N2 + O2 = 2NO
Ստացվում է մթնոլորտում, կայծակի ժամանակ: Որոշ քանակով NO առաջանում է ավտոմեքենաների շարժիչների գլաններում պայթման ժամանակ, որը CO-ի հետ միասին արտանետված գազերը դարձնում են թունավոր:
Ազոտի (lll) օքսիդը` N2O3 մուգ կապույտ հեղուկ է -1020C-ում կարծրանում է: Այն անկայուն մեխություն: N2O3-ի մոլեկուլն ունի հետևյալ կառուցվածքը`
![]()
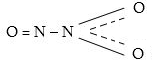
![]()
![]() Ստացվում
է
Ստացվում
է ![]() ռեակցիայով,
նույնիսկ սենյակի
ջերմաստիճանում
ընթանում է նաև
հակառակ ռեակցիան,
ուստի հեղուկ N2O3-ի
մեջ պարունակվում
են նաև NO2 և NO:
ռեակցիայով,
նույնիսկ սենյակի
ջերմաստիճանում
ընթանում է նաև
հակառակ ռեակցիան,
ուստի հեղուկ N2O3-ի
մեջ պարունակվում
են նաև NO2 և NO:
N2O3-ը թթվային օքսիդ է, այն ջրում լուծվում է` առաջացնելով աղոտային թթու: Ջրի հետ այն պետք է առաջացներ համապատասխան N(OH)3 հիդրօքսիդը, սակայն ըստ հիդրօքսիդ-ների ջրազրկման կանոնի այն կորցնում է մեկ երկու մոլեկուլ ջուր`առաջացնելով HNO2
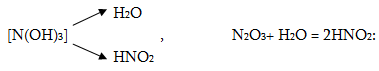
Ազոտի (lV) օքսիդը` ունի գորշ գույն, բնորոշ հոտով թունավոր գազ է: 210C-ից ցածր ջերմաստիճանում այն վերածվում է դեղին հեղուկի, իսկ -11.20C-ում վեր է ածվում անգույն բյուրեղային նյութի: Տաքացնելիս գազային NO2-ի գույնը, ընդհակառակը, մգանում է և 11.20C-ում սևանում: Պատճառը NO2 մոլեկուլների դիմերի առաջացնելու հատկությունն է, NO2 մոլեկուլները մուգ են, իսկ N2O4-ը`անգույն:
![]()
1400C-ում N2O4 մոլեկուլները լրիվ դիսոցվում են: Ջերմաստիճանի բարձրացումից, ըստ Լև Շատելյեի, հավասարակշռությունը շարժվում է դեպի ձախ և 1400C-ում միայն NO2 մոլեկուլներն են, սառեցնելիս`դեպի աջ և պինդ վիճակում միայն N2O4:
NO2-ի մոլեկուլն ունի հետևյալ կառուցվածքը`
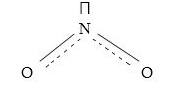
Ազոտը պարունակում է մեկ կենտ էլեկտրոն, որի պատճառով NO2 մոլեկուլները դիմերացվում են` առաջացնելով N2O4:
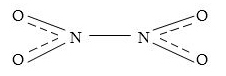
NO2-ը թթվային օքսիդ է, այն փոխազդում է ջրի հետ` առաջացնելով երկու թթուներ` ազոտային և ազոտական
2NO2 + H2O=HNO3 +HNO2:
Ազոտի (lV) օքսիդն օոքսիդիչ է: NO2-ի մթնոլորտում շատ նյութեր այրվում են նրանից խլելով թթվածին`
SO2 + NO2 = SO3 + NO
NO2-ն ստացվում է հիմնականում NO-ի օքսիդացումից ցածր ջերմաստիճաններում, քանի որ բարձր ջերմաստիճաններում այն քայքայվում է: Այդ պատճառով, օրինակ երբ ազոտը և թթվածինը 30000C-ում փոխազդում են, ստացվում է NO, իսկ երբ գազը սառեցնում են, սենյակային ջերմաստիճանում, այն իսկույն փոխազդում է թթվածնի հետ` առաջացնելով NO2
2NO+ O2=2NO2:
Ազոտի (V) օքսիդը` N2O5 (ազոտական անհիդրիդ), սպիտակ բյուրեղային նյութ է: Այն արդեն 320C-ում քայքայվում է NO2-ի և O2-ի: Մոլեկուլի կառուցվածքն է
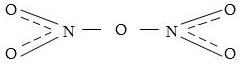
Ջրի մեջ լավ լուծվում է` առաջացնելով ազոտական թթու: Ջրի հետ փոխազդելիս այն պետք է առաջացներ համապատասխան հիդօքսիդը,որը պետք է լիներ N(OH)5, սակայն ըստ հիդրօքսիդների ջրազրկման կանոնի այն կորցնում է երկու մոլեկուլ ջուր առաջացնելովN(OH)3
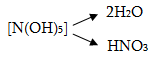
Ուստի կարելի է գրել
N2O5 + H2O = 2HNO3
N2O5-ն ուժեղ օքսիդիչ է, քանի որ սրամում ազոտն ունի առավելագույն +5 օքսիդացման աստիճան: N2O5-ն ստացվում է ֆոսֆորական անհիդրիդով ազոտական թթուն դեհիդրատացնելով
2HNO3 + P2O5 = N2O5 + 2HPO3
կամ N2O3-ը օքսիդացնելով օզոնով
N2O3 + 2O3 = N2O5 +2O2
Ազոտն առաջացնում է երկու թթվածնավոր թթուներ` ազոտային և ազոտական:
Ազոտային թթու`HNO2 հայտնի է միայն նոսր ջրային լուծույթներում, ինչպես նաև գազային ֆազում հետևյալ հավասարակշռային խառնուրդում: Մոլեկուլային կառուցվածքն է`
![]()
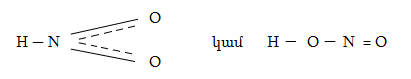
Այս երկու
տաուտոմիկ ձևերից
առաջինն ավելի
կայուն է, որովհետև
առաջին (ցիս HNO2)
ձևի համար ![]() իսկ երկրորդի
համար
իսկ երկրորդի
համար ![]()
![]() Թթվային
դիսոցման հետ մեկտեղ
ուժեղ թթվային
լուծույթներում
որոշ չափով տեղի
է ունենում դիսոցում`
առաջացնելով
OH- և NO+2 իոներ,
որը խոսում է որոշակի
հիմնային հատկությունների
մասին, մասնավորապես
ծծմբական թթվի
հետ այն առաջացնում
է նիտրոզիլի հիդրոսուլֆատ`
NOHSO4:
Թթվային
դիսոցման հետ մեկտեղ
ուժեղ թթվային
լուծույթներում
որոշ չափով տեղի
է ունենում դիսոցում`
առաջացնելով
OH- և NO+2 իոներ,
որը խոսում է որոշակի
հիմնային հատկությունների
մասին, մասնավորապես
ծծմբական թթվի
հետ այն առաջացնում
է նիտրոզիլի հիդրոսուլֆատ`
NOHSO4:
Քանի որ ազոտային թթվում ազոտն ունի միջին +3 օքսիդացման աստիճան, HNO2-ը և դրա աղերը` նիտրիտները, ցուցաբերում են օքսիդավերականգման երկվություն, վերականգվելով մինչև +2(NO), կամ օքսիդացնելով մինչև +5(HNO2)
2HNO2 + 2KJ + H2SO4 = 2NO + J2 + K2SO4 + 2H2O
5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O
Նույն պատճառով HNO2-ը ենթարկվում է անհամամասնական քայքայման (ինքնաօքսիդացման –ինքնավերականգնում)
![]()
Ազոտային թթվի աղերը` նիտրատները սատացվում են իրենց անհիդրիդի (N2O3) և հիմքերի փոխազդեցությունից,
N2O3 +2NaOH = 2NaNO2 + H2O
Ինչպես նաև նիտրատների վերականգնումից:
Արդյունաբերության մեջ նիտրատներն ստացվում են ազոտային թթվի ստացման`վերը նշված եղանակով, ջրի փոխարեն օգտագործելով ալկալու լուծույթ:
NO2 + NO + 2NaOH = 2NaNO2 + H2O
Նիտրատներն ավելի կայուն են, քան HNO2-ը: Լուծույթներում նիտրատներն աստիճանաբար օքսիդանում են` վերածվելով նիտրատների:
Ազոտական թթուն (HNO3) անգույն հեղուկ է, tհալ.= - 410C, tեռ. = 840C: Օդում ծխում է որովհետև դրա գոլորշիներն օդի խոնավության հետ առաջացնում են մառախուղի կաթիլներ: Կոնցենտրիկ աղոտական թթուն ունի գոշ գույն, քանի որ լույսի ազդեցության տակ քայքայվում է
4HNO3 = 4NO2 + 2H2O + O2
Ջրի հետ ազոտական թթուն առաջացնում է ազեոտրոպ խառնուրդ, որը պարունակում է 68.4% HNO3 և եռում է 121.90C-ում: (Ազոտրոպ կոչվում են այն խառնուրդները, որոնց վրա գոլորշիների բաղադրությունն այնպիսին է , ինչպիսին հեղուկինը, ուստի սրանք թորումով հնարավոր չէ բաժանել, բաղադրել մասերի):
Ազոտական թթվում ազոտը քառավալենտ է: Ազոտի հինգ վալենտային էլեկտոններից մեկն անցնում է թթվածնին և ազոտին մնում է չորս վալենտային էլեկտրոն, որոնք առաջացնում են չորս կապեր: Քանի որ միայն ազոտի հետ կապված թթվածնի ատոմները միատեսակ են, ապա էլեկտրոնի անցման հավանականությունը դրանցից յուրաքանչյուրին ևս նույնն է, այդ պատճառով չորրորդ կապը պատկերացվում է ապակենտրոնացված և հավասարաչափ պատկանում է թթվածնի երկու ատոմների էլ:
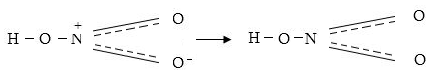
Ազոտական թթուն ուժեղ թթու է, նոսր լուծույթներում այն գործնականորեն լրիվ դիսոցված է H+ և HNO¯3 իոնների:
HNO3-ի աղերը` նիտրատներն ստացվում են թթվի և մետաղների, օքսիդների, հիդրօքսիդների և շատ աղերի հետ փոխազդելիս, և բոլորը ջրում լավ լուծվում են:
Ազոտական թթուն ուժեղ օքսիդիչ է: Այն օքսիդացնում է ոչ միայն համարյա բոլոր մետաղներին (բացառապես ոսկու, պլատինի, ռադիումի և իրիդիումի), այլ նաև շատ ոչ մետաղների (S, P, C) փոխարկելով դրանց համապատասխան թթուների (ածխածնի դեպքում` CO2): Որոշ մետաղների (Fe, Gr, Al) խիստ ազոտական թպասիվացնում է դրանց մակերեսը առաջացնելով պաշտպանիչ օքսիդային շերտ:
Հանդես գալով որպես օքսիդիչ ազոտական թթվում N+5-ը կարող է վերականգնվել տարբեր չափով ընդհուպ մինչև N- 3: Թե ինչքան խորը կվերականգնվի N+5-ը կախված է HNO3-ի կոնցենտրացիայից, վերականգնիչի բնույթից և ջերմաստիճանից: Որքան նոսր է ազոտական թթուն, այնքան ավելի ուժեղ են դրա օքսիդիչ հատկությունները: Նշանակում է առավել ուժեղ կդրսևորվեն HNO3-ի օքսիդիչ հատկությունները, եթե այն լինի նոսր, իսկ վերականգնիչ մետաղը` ակտիվ: Այդ դեպքում N+5-ը կվերցնի առավելագույն թվով` 8 էլեկտրոն և կվերածվի N-3-ի:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O:
Եթե թթուն լինի կոնցենտրիկ, իսկ մետաղը` պասիվ, այդ դեպքում N+5-ը կվերցնի նվազագույն թվով` մեկ էլեկտրոն, և կվերածվի N+4-ը:
Cu + 4HNO3 = 2Cu(NO3)2 + NO2 + 2H2O
Մնացած դեպքերում N+5-ը վերցնում է միջին թվով էլեկտրոններ, և հնարավոր է ազոտի տարբեր օքսիդների (հիմնական NO) առաջացում, կախված նրանից, թե որքան նոսր կամ խիտ է թթուն, և թե ինչ ակտիվություն ունի մետաղը: Օրինակ պղնձի հետ փոխազդեիս նոսր ազոտական թթուն առաջացնում է NO, իսկ ավելի ակտիվ մագնեզիումի հետ` N2O

Ոչ մետաղների խիտ թթվով օքսիդացման դեպքում ռեակցիան ընթանում է այնպես, ինչպես պասիվ մետաղների հետ, առաջացնում է NO2,
S + 3HNO3 + H2O = H2 SO4 + 3HNO2,
Իսկ նոսր թթվի դեպքում` NO:
Քանի որ մետաղների հետ փոխազդելիս մետաղից էլեկտրոններ վերցնում է N+5-ը և ոչ թե H+ -ը, ապա մետաղները որպես կանոն ազոտական թթվից ջրածին դուրս չեն մղում:
Ազոտական թթվի և ազոտաթթվի 1:3 հարաբերությամբ խառնուրդը կոչվում է արքայաջուր, որն արդեն լուծում է, ինչպես ոսկին, այնպես էլ պլատինի խմբի մետաղները: Արքայաջրի ազդեցությունը բացատրվում է նրանով, որ ազոտական թթուն օքսիդացնում է F ազոտաթթվին` առաջացնելով նիտրոզիլքլորիդ:
HNO3 + 3HCI = CI2 + 2H2O +NOCI:
Նիտրոլի քլորիդը քայքայվում է` առաջացնելով ատոմար քլոր, որն ուժեղ օքսիդիչ է և օքսիդացնում է նշված պասիվ մետաղներին:
Au + HNO3 + 3HCI =AuCI3 + NO + 2H2O:
Ազոտական թթուն փոխազդում է շատ օրգանական նյութերի հետ նրանցում փոխարինելով ջրածնի ատոմները NO2 խմբերով: Օրգանական քիմիայում այդ կարևորագույն պրոցեսը կոչվում է նիտրացում:
Ազոտական թթվի աղերը` նիտրատները, ուժեղ օքսիդիչներ են: Սրանք կարող են օքսիդացնել ակտիվ մետաղները` հիմնային լուծույթներում վերականգնվելով մինչև NH3
3KNO3 + 8AI +5KOH +18H2O =3NH3 +8K[AI(OH)4]
Նիտրատները տաքացնելիս քայքայվում են` ենթարկվելով ներմոլեկուլային օքսիդավերականգնման:
Առավել ակտիվ մետաղների նիտրատները (լարվածության շարքում մինչև Mg ընկածները,բացառությամբ լիթիումի) քայքայվում են նիտրատների ևթվածնի:
2KNO3 = 2KNO2 + O2:
Միջին ակտիվության մետաղների նիտրատները (մագնեզիումից մինչև պղինձ ներառյալ) քայքայվում են մետաղի օքսիդի, NO2-ի թթվածնի:
2Cu(NO3)2 = 2CuO + 4NO2 + O2:
Առավել պասիվ մետաղների նիտրատները քայքայվում են մետաղի, NO2-ի և թվածնի:
2AgNO3 = 2Ag + 2NO2 + O2:
Այլ կերպ է քայքայվում ամոնիումի նիտրատը` NH4NO3:
Ցածր ջերմաստիճանում այն քայքայվում է N2O-ի և ջրի (տես N2O-ի ստացումը), բարձր ջերմաստիճաններում, քանի որ N2O-ը կայուն չէ, առաջանում է N2, O2 և H2O:
![]()
Այս ռեակցիան խիստ էկզոտերմիկ է , ուստի NH4NO3-ի դետոնացիան առաջացնում է պայթուն:
Լաբորատորիայում ազոտական թթուն ստանում են նիտրատներից` դուրս մղելով ծծմբալան թթվով
KNO3 + H2SO4=KHSO4+HNO3:
Արդյունաբերության մեջ ազոտական թթուն ստանում են մեծ քանակով ամոնիակի օքսիդացումից: Ամոնիակի կատալիտիկ օքսիդացումից ստացված NO-ն (տես NH3-ի քիմիական հատկությունները) օքսիդացնում են մինչև NO2 և վերջինիս խառնուրդը օդի ավելցուկի հետ կլանում են ջրով
4NO2 + 2H2O + O2 = 4HNO3:
Ազոտի միացությունները հալոգենների հետ անկայուն են, բացառությամբ NF3-ի և քայքայվում են պայթյունով:
2.2.5. Ազոտի և դրա միացությունների կիրառությունը
Արդյունաբերության մեջ ստացված ազոտի հիմնական մասը օգտագործվում է ամոնիակի ստացման համար, որի մեծ մասն էլ իր հերթին օգտագործվում է ազոտական թթվի ստացման համար: Ազոտն ամենից էժան քիմիապես իներտ գազն է և օգտագործվում է այնպիսի օրգանական և անօրգանական սինթեզներում, որտեղ պահանջվում է թթվածնի բացակայություն: Հեղուկ ազոտն օգտագործվում է ցածր ջերմաստիճանային պայմաններ ստեղծելու համար:
Ազոտը բնության մեջ կատարում է շրջապտույտ: Մթնոլորտում կատարվող էլեկտրական պարպումների ժամանակ առաջանում են մեծ քանակությամբ ազոտի օքսիդներ, որոնք ջրի հետ առաջացնում են ազոտական թթու: Վերջինս հողում փոխակերպվում է նիտրատնրի և յուրացվում է բույսերի կողմից: Կան նաև բակտեերիաներ (ազոտամանրէներ), որոնք ընդունակ են յուրացնել մթնոլորտային ազոտը: Բույսերի փտման, օրգանական նյութերի այրման ժամանաակ, ինչպես նաև ազոտազերծող մանրէների ազդեցության տակ կապված ազոտը նորից անցնում է մթնոլորտ ազատ ազոտի ձևով:
Ազոտի կարևորագույն միացություններից է ամոնիակը: Այն ոչ բարձր ճնշումների տակ հեղուկանում է, քանի որ հեղուկ ամոնիակի գոլորշացման ժամանակ կլանվում է մեծ քանակությամբ ջերմություն, այն օգտագործում են զանազան սառնարանային համակարգերում: Ամոնիակից ստանում են ազոտական թթու, ինչպես նաև ազոտ պարունակող այլ նյութեր, զանազան աղեր, միզանյութ, կապտաթթու, սոդա ամոնիակային եղանակով:
Ազոտական թթվի կիրառության կարևորագույն բնագավառներն են ազոտական ինչպես նաև համակցված պարարտանյութերի, պայթուցիկ նյութերի, օրգանական ներկերի արտադրությունները: Օրգանական սինթեզում լայնորեն կիրառվում է կոնցենտրիկ ազոտական և ծծմբական թթուների խառնուրդը`«նիտրացնող խառնուրդ»: Ազոտական թթուն օգտագործվում է, որպես ռեակտիվ վառելիքի օքսիդիչ: Մետալուրգիայում ազոտական թթուն օգտագործում են մետաղների խածատման և լուծման, ինչպես նաև ոսկին և արծաթն իրարից բաժանելու համար: Ազոտական թթվի աղերից` նիտրատներից առավել կարևոր նշանաակություն ունեն կալիումի, ամոնիումի և կալցիումի նիտրատները, որոնց կոչում են սելիտրաներ: KNO3-ը և Ca(NO3)2-ը և NH4NO3-ն օգտագործում են որպես պարարտանյութեր, ընդ որում առաջինում նաև պարունակվում է բույսերի համար անհրաժեշտ կալիում, իսկ վերջինում մեծ է տոկոսային պարունակությունը: NH4NO3-ը նաև այրվող նյութերի հետ աառաջացնում է պայթուցիկ խառնուրդներ, որոնք կիրառվում են պայթեցման աշխատանքների ժամանակ:
2.3 Ֆոսֆոր
Քիմիական նշանը`P (Phosphorus), միջուկի լիցքը` 15, միջին իզոտոպային զանգվածը` 30.97, կազմված է մեկ կայուն 31:P իզոտոպից: Արհեստականորեն ստացվել են ևս վեց ռադիոակտիվ իզոտոպներ 28-ից 34 ատոմական զանգվածներով:
2.3.1. Տարածվածությունը բնության մեջ
Ֆոսֆորը
բավականին տարածված
տարր է, պարունակությունը
երկրի վրա կազմում
է 10-2%: Ազատ վիճակում
երկրի կեղևում
չի հանդիպում:
Ֆոսֆորի հիմնական
բնական միացություններն
են կալցիումի օրթոֆոսֆատը`
Ca3(PO4)2, որը ֆոսֆորիտ
կոչվող միներալի
ձևով հանքավայրեր
է առաջացնում,
և ապատիտները`![]() որտեղ
X-ը լինում է f, CI կամ
OH:
որտեղ
X-ը լինում է f, CI կամ
OH:
Ֆոսֆորը մտնում է նաև սպիտակուցների բաղադրության մեջ, մեծ քանակությամբ պարունակվում է ողնաշարավոր կենդնիների ոսկորներում`
![]() միացությունների
ձևով:
միացությունների
ձևով:
Ֆոսֆորը մտնում է նուկլեինաթթուների բաղադրության մեջ, որոնք մասնակցում են կենդանի բջջի ժառանգական հատկությունների փոխանցմանը:
2.3.2. Ֆիզիկական հատկությունները
Հայտնի են ֆոսֆորի 11 ալոտրոպ ձևափոխություններ,որոնցից առավել կայուն և ուսումնասիրված են սպիտակ, կարմիր և սև ֆոսֆորները:
Ֆոսֆորի գոլորշիները կազմված են P4 մոլեկուլներից,որոնք 8000C–ից բարձր քայքայվում են P2 մոլեկուլների: Արագ սառեցնելիս ֆոսֆորի գոլորշիները վերածվում են սպիտակֆոսֆորի: Սա սպիտակ ,թույլ դեղնավուն երանգով պինդ նյութ է: Արտաքին տեսքով նման է մոմի: Հալման ջերմաստիճանը 440C է, եռմանը` 2800C: Ցնդող լինելու պատճառով սպիտակ ֆոսֆորն ունի բնորոշ հոտ:Օդում սպիտակ ֆոսֆորն օքսիդանում է, ռեակցիան ընթանում է լույսի անջատումով, որը մթության մեջ երևում է:Այստեղ է գոյացել է ֆոսֆորի «լուսակիր» անվանումը:
Սպիտակ ֆոսֆորը հրդեհավտանգ և խիստ թունավոր է: Այն հեշտությամբ բոցավառվում է սովորական շփումից:Արյումն ուղեկցվում է ցայտումներով, որոնք մաշկի վրա առաջացնում են ծանր այրվածքներ:Սպիտակ ֆոսֆորով հնարավոր է թունավորել նաև մաշկի միջոցով, քանի որ այն լուծվում է կենդանի հյուսվածքների մեջ:
Սպիտակ ֆոսֆորն ունի մոլեկուլային բյուրեղացանց` կազմված P4 մոլեկուլներից: Այդպիսի կառուցվածքը պայմանավորվում էսպիտակ ֆոսֆորի դյուրահալությունը,բարձր ցնդողականությունը, և մեծ լուծելիությունը ոչ բևեռային լուծիչներում` հատկապես CS2-ում:
Կարմիր ֆոսֆորը գորշ կարմիր մանր բյուրեղներից կազմված քիչ ցնդող նյութ է: Թունավոր չէ, չի լուծվում ոչ բևեռային լուծիչներում: Դա ֆոսֆորի օգտագործելի ձևափոխությունն է: Կարմիր ֆոսֆորն ստանում են սպիտակ ֆոսֆորից առանց օդի մուտքի 280-3000C-ում ու երկարատև տաքացնելով:
Մինչև 4230C տաքացնելիս կարմիր ֆոսֆորը ցնդում է և առաջացած գոլորշիների սառեցումից գոյանում է սպիտակ ֆոսֆոր:
Կարմիր ֆոսֆորը համարյա թունավոր չէ և ավելի քիչ հրդեհավտանգ է քան սպիտակը: Օքսիդիչների հետ այն առաջանում է պայթուցիկ նյութեր:
Սև ֆոսֆորը ֆոսֆորի առավել կայուն ձևափոխությունն է: Այն ստացվում է սպիտակ ֆոսֆորից մեծ ճնշման տակ (1.2գպա) բարձր ջերմաստիճանում տաքացնելով
(∼2000C): Ճնշումը մինչև մթնոլորտային իջեցնելիս այն վերածվում է սպիտակ ֆոսֆորի:
Տեսքով այն նման է գրաֆիտի, շոշափելիս յուղային էթվում, հեշտությամբ բաժանվում է թեփուկների: Սև ֆոսֆորը կիսահաղորդիչ է: Սենյակային ջերմաստիճանում ոչ մի լուծիչի մեջ չի լուծվում,թունավոր չէ, քիմիապես քիչ ակտիվ է, բոցավառվում է միայն 4900C-ում:
2.3.3. Քիմիական հատկությունները
Ֆոսֆորի էլեկտրոնային թաղանթների կառուցվածքն է 1s22s22p6 3s23p3 կամ
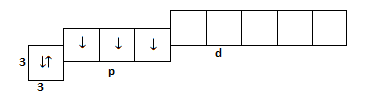
Այսինքն`
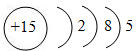
Եթե այս տարրը փոխազդի ուրիշի տարրերի հետ, ապա դրա ստոմի հետ կարող է կատարվել սկզբունքորեն երկու փոփոխություն:
Առաջին: Եթե ֆոսֆորը փոխազդի իրենից փոքր էլեկտրաբացասականություն ունեցող տարերի հետ` ջրածին, մետաղներ, ապա կվերցնի կամ դեպի իրեն կտեղաշորժի երեք էլեկտրոն լրացնելու ատոմի շերտը, ուստի հանդես կբերի -3 օքսիդացման աստիճան: Այդ պատճառով այն պետք է առաջացնի PH3 բանաձևով ջրածնական միացություն ֆոսֆորաջրածին (ֆոսֆին) կամ Ca3P2 – կալցիումի ֆոսֆիդ: Սակայն ջրածնի հետ ֆոսֆորն ուղղակիորոն չի միանում և ֆոսֆիտն ստացվում է կալցիումի ֆոսֆիդի հիդրոլիզով
Ca3P2 + 6H2O = 2PH3+3Ca(HO)2:
Ֆոսֆինը տհաճ նեխած ձկան հոտով գազ է, tեռ.=-880C, tհալ.=-1530C: Ի տարբերություն NH3-ի, ջրում վատ է լուծվում և չի փոխազդում, խիստ թունավոր է:
Ֆոսֆինի հիմնային հատկություններն անոնիակի համեմատ ավելի թույլ են արտահայտված: Ուժեղ թթուների հետ այն առաջացնում է ֆոսֆոնիումի աղեր, որոնք ամոնիումի աղերի համեմատ ավելի անկայուն են: Այդ աղերում կատիոն է ֆոսֆոնիում իոնը` PH-4: Ջրի մեջ լուծվելիս լրիվ քայքայվում են վերածվելով ֆոսֆինի և համապատասխան թթվի:
PH4Cl = PH3 + HCl:
Ֆոսֆինը բնականաբար ուժեղ վերականգնիչ է, քանի որ ֆոսֆորն այստեղ ունի ցածրագույն`-3 օքսիդացման աաստիճանը և հեշտությամբ կարող է կորցնել էլեկտրոններ:
Օդում այն 1000C-ից բարձր օքսիդանում է` առաջացնելով P2H5 Որը գոյացած ջրի հետ ի վերջո առաջացնում է ֆոսֆորական թթու
2PH3 + 4O2 = P2H5 + H2O:
Ֆոսֆորի մյուս ջրածնական միացությունները` դիսֆոսֆինը P2H4 (հիդրազինի նմանակը) հեղուկ է tեռ. = 630C, tհալ.=- 990C: Ստացվում է ֆոսֆիդների հիդրոլիզից PH3-ի ստացման ժամանակ, որպես երկրորդական արդյունք:
Երկրորդ:
Երբ
ֆոսֆորը փոխազդում
է իրենից մեծ էլեկտրաբացասականություն
ունեցող տարրերի
հետ` թթվածին, հալոգեններ,
այդ դեպքում կորցնում
է արտաքին շերտի
հինգ էլեկտրոնները
կամ տեղաշարժվում
դեպի այդ տարրերը
և հանդես է բերում
մինչև +5 օքսիդացման
աստիճան: Սակայն
ի տարբերություն
ազոտի, ֆոսֆորը
վալենտային շերտում
ունի ազատ d-օրբիտալներ
և այդ պատճառով
բավականին տարբերվում
է ազոտից: Դատարկ
d-օրբիտալների
շնորհիվ ֆոսֆորն
առաջացնում է դոնոր-ակցեպտորային
![]() էլեկտրոնային
զույգերի դոնոր
հանդիսացող տարրերի,
հատկապես թթվածնի
հետ: Այդ պատճառով
ազոտից ֆոսֆորին
անցնելիս ատոմի
տրամագծի մեծացման
հետևանքով Э-H կապի
ամրությունը թուլանում
է, իսկ Э-О կապի ամրությունն
ուժեղանում է:
Դոնոր-ակցեպտորային
կապերի առաջացումով
է բացատրվում ֆոսֆորի
բուռն փոխազդեցությունը
թթվածնի հետ և
ֆոսֆորի թթվածնավոր
միացությունների
բազմատեսակությունն
ու կայունությունը:
Ըստ էլեկտրոնային
կառուցվացքի ֆոսֆորը
պետք է հանդես
բերի +3 և +5 օքսիդացման
աստիճաններ և առաջացնի
երկու օքսիդ` P2O3
և P2O5, սակայն
վերը նշված պատճառով
առաջանում է P4O6
և P4O10 օքսիդներ:
էլեկտրոնային
զույգերի դոնոր
հանդիսացող տարրերի,
հատկապես թթվածնի
հետ: Այդ պատճառով
ազոտից ֆոսֆորին
անցնելիս ատոմի
տրամագծի մեծացման
հետևանքով Э-H կապի
ամրությունը թուլանում
է, իսկ Э-О կապի ամրությունն
ուժեղանում է:
Դոնոր-ակցեպտորային
կապերի առաջացումով
է բացատրվում ֆոսֆորի
բուռն փոխազդեցությունը
թթվածնի հետ և
ֆոսֆորի թթվածնավոր
միացությունների
բազմատեսակությունն
ու կայունությունը:
Ըստ էլեկտրոնային
կառուցվացքի ֆոսֆորը
պետք է հանդես
բերի +3 և +5 օքսիդացման
աստիճաններ և առաջացնի
երկու օքսիդ` P2O3
և P2O5, սակայն
վերը նշված պատճառով
առաջանում է P4O6
և P4O10 օքսիդներ:
Ֆոսֆորային անհիդրիդը` P4O6(P2O3), առաջանում է սպիտակ ֆոսֆոր դանդաղ օքսիդացումից, թթվածնի անբավարարության պայմաններում, իսկ ֆոսֆորական անհիդրիդը` P4O10(P2O5), օդի (թթվածնի) ավելցուկի դեպքում: P4O10 ստացվում է նաև ֆոսֆորի այլ տեսակներն օդի ավելցուկում տաքացնելիս: P4O6-ը սպիտակ, բյուրեղային, դյուրահալ նյութ է հալման ջերմաստիճանն է 240C, եռմանը` 1750C: Տաքացնելիս այն քայքայվում է:
![]()
Որտեղ n-ը լինում է 2-ից 6:
Ֆոսֆորային անհիդրիդը դանդաղ միանում է սառը ջրի հետ` առաջացնելով ֆոսֆորային թթու` H3PO3: Այն բյուրեղային նյութ է, tհալ.= 74 0C: Միջին ուժի թթու է, որի աղերը` ֆոսֆորիտները, ջրում քիչ լուծելի են: Ֆոսֆորի (lll) օքսիդը, ինչպես և ֆոսֆորային թթուն ուժեղ վերականգնիչներ են:
Օրթոֆոսֆորային թթուն ստացվում է P4O6-ի սառը ջրի հետ փոխազդեցությունից
P4O6 + 6H2O = 4H3PO3
Ինչպես նաև PCl3-ի հիդրոլիզից
![]()
Հայտնի են նաև պիրոֆոսֆատային` H4P2O5 և մետաֆոսֆորային` HPO2 թթուները:
Ֆոսֆորային թթուների աղերի` ֆոսֆիտների մեծ մասը ջրում չեն լուծվում: Տաքացնելիս H3PO3-ը ենթարկվում է անհամամասնական տրոհման
4H3PO3 = 3H3PO4 + PH3:
Ֆոսֆորական անհիդրիդը սպիտակ փոշի է, ուժեղ հիգրոսկոպիկ է: Սրա ջուր կանելու հատկությունը գերազանցում է բոլոր հայտնի հիգրոսկոպիկ նյութերին:
Ֆոսֆորի
(V) օքսիդին համապատասխանում
են մի քանի թթուներ:
Դրանց ընդհանուր
բանաձևն է`![]() և լինում
են երկու տեսակի
օրթոֆոսֆորական
և պոլիֆոսֆորական
թթուներ:
և լինում
են երկու տեսակի
օրթոֆոսֆորական
և պոլիֆոսֆորական
թթուներ:
Օրթոֆոսֆորական թթուն` H3PO4 (հաճախ անվանում են պարզապես ֆոսֆորական թթու), պինդ նյութ է, tհալ.=420C: Ընդհանրապես օգտագործվում է H3PO4-ի 80%-անոց լուծույթը, որը մածուցիկ հեղուկ է: Օրթոֆոսֆորական թթուն միջին ուժի թթու է: Այն ստացվում է ֆոսֆորիտից:
Ca3(PO4)2 +3H2SO4 = 3CaSO4 + 2H3PO4
Կամ P2O5-ի և ջրի փոխազդոցությունից:
Լաբորատոիայում ֆոսֆորական թթուն ստացվում է ազոտական թթվով ֆոսֆորի օքսօդացումից:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
H3PO4-ը եռհիմն թթու է և առաջացնում է միատեղակալված (դիհիդրո-), երկտեղակալված (հիդրո-) և եռտեղակալված ֆոսֆորատներ:
KH2PO4, Ca(H2PO4)2 - միատեղակալված կամ դիհիդրոֆոսֆատներ:
K2HPO4, CaHPO4 - երկտեղակալված կամ հիդրոֆոսֆատներ,
K3PO4, Ca3(PO4)2 - եռտեղակալված կամ ֆոսֆատներ:
Միատեղակալված (առաջնայաին) ֆոսֆատներն ընդհանուր առմամբ լավ լուծվում են ջրում, գրեթե բոլոր երկտեղակալված (երկրորդային) և եռտեղակալված (երրորդական) ֆոսֆատները քիչ լուծելի են:
Պոլիֆոսֆոտական թթուներից բյուրեղային վիճակում անջատվել է դիֆոսֆորական (կամ պիրոֆոսֆատական) թթուն` H4P2O7-ը: Այն առաջացնում է 610C-ում հալվածանգույն բյուրեղներ և ունի կառուցվածքը: Ջրում լրիվ լուծվում է ևավելի ուժեղ թթու է քան H3PO4-ը:

Աղերը հիմնականում լինում են երկու տեսակի, թթու աղեր Me2H2P2O7 և չեզոք աղեր Me4P2O7 և կոչվում են համապատասխանաբար` դիհիդրոդիֆոսֆորատներ և դիֆոսֆորատներ: Սրանցից թթու աղերը ջրում լավ են լուծվում, իսկ չեզոքները քիչ լուծելի են:
Պոլիմետաֆոսֆորական թթուներն ունեն ընդհանուր (HPO3)n բանաձևը, որտեղ n-ը 3-ից մինչև 8 է: Այդպիսիք մի քանիսն են, բայց դրանց պայմանականորեն անվանում են «մետաֆոսֆորական թթուներ» և գրում են HPO3 բանաևով:
Ջրային լուծույթում սրանք դանդաղ միանում են ջրի հետ`առաջացներով H3PO4:
Հակառակ պրոցեսն ընթանում է օրթոֆոսֆորական թթու ջրազրկվելիս:
![]()
Ֆոսֆորի այս թթուները կարելի է տարբերել իրարից AgNO3-ի հետփոխազդեցության ռեակցիայով: Ag3PO4-ը դեղին, իսկ Ag4P2O7 և AgPO3-ը սպիտակ նստվածքներ են: Բացի դրանից, H3PO4-ը և H4P2O7-ը չեն մակարդում ձվի սպիտակուցը, իսկ HPO3-ը` մակարդում է:
Մետաֆոսֆորական թթուները թունավոր են:
Ֆոսֆորը շատ բուռն փոխազդում է հալոգենների հետ, ընդ որում հալոգենի պակասի դեպքում առաջանում է PCl3, իսկ ավելցուկի դեպքում PCl5: Սրանք անհակադարձելիորեն հիդրոլիզվում են առաջացնելով համապատասխան թթուներ`
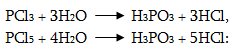
երկրորդ ռեակցիան ընթանում է երկու փուլով: Առաջինը`
![]()
Առաջանում է ֆոսֆորի օքսիքլորիդից` POCl3: Ֆոսֆորի հալոգենների և POCl3-ի հիդրոլիզն անհակացուցելի է:
2.3.4. Ֆոսֆոր կիրառությունները, հանքային պարարտանյութեր
Ֆոսֆոր մեծ քանակությամբ օգտագործվում է P2O5-ի և H3PO4-ի ստացման համար, լուցկու արտադրության մեջ, մետալուրգիայում` ֆոսֆորային թուջեր, բրոնզներ ստանալու համար: Այն օգտագործվում է նաև որոշ կիսահաղորդիչների`GaP, ZnP ստացման համար: Ֆոսֆորի այրման հետևանքով առաջանում է սպիտակ ծուխ, ուստի ֆոսֆորն օգտագործվում են ծխածածկույթ առաջացնող ռազմամթերքի պատրաստման համար:
Ֆոսֆորի միացությունների մեծ մասը ծախսվում է ֆոսֆորական պարարտանյութերի համար: Որպես պարարտանյութ օգտագործվում են մանրացված ֆոսֆորը`Ca3(PO4)2, որը կոչվում է «ֆոսֆորային ալյուր», սակայն վերջինս փոքր լուծելիություն ունի ջրում և օգտագործվում է թթու հողերի համար: Ավելի հեշտ յուրացվող պարարտանյութեր ստանալու համար կալցիումի ֆոսֆատը վերածում են թթու աղերի:
«Սուպերֆոսֆատ»պարարտանյութը ստանում են` ֆոսֆատը ծծմբական թթվով մշակելով
![]()
Սուպերֆոսֆատը ֆոսֆորի մեծ պարունակություն չունի,քանի որ պարունակում է նաև CaSO4:
«Կրկնակի սուպերֆոսֆատ»ստացվում է կալցիումի ֆոսֆատը ֆոսֆորական թթվով մշակելիս և ֆոսֆորի ավելի մեծ պարունակություն ունի:
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
«Պրեցիպիտատ»-ը ստացվում է կալցիումի հիդրօքսիդի և ֆոսֆորական թթվի փոխազդեցությունից
![]()
Այս պարունակությունները կոչվում են «պարզ հանքային պարարտանյութեր,քանի որ պարունակում են բույսին անհրաժեշտ միայն մեկ տարր (P): «Բարդ հանքային պարարտանյութերը»պարունակում են, ֆոսֆատից բացի, բույսին անհրաժեշտ այլ տարրեր:
«Ամորֆը» ստացվում է ֆոսֆորական թթվի և ամոնիակի փոխազդեցությունից և կախված ելանյութերի քանակական հարաբերությունից, առաջանում է մոնոամոնիումի ֆոսֆատ` NH4H2PO4, կամ դիամոնիումի ֆոսֆոտ` (NH4)2HPO4: Օգտագործվում է նաև «նիտրոֆոսկ» պարարտանյութը, որը պարունակում է ազոտ, ֆոսֆոր և կալիում և ստացվում է (NH4)2HPO4.-ը , NH4NO3 և KCl-ը միհալելով:
Ալկալիական մետաղների ֆոսֆատները, պոլիֆոսֆատները և պերօքսիֆոսֆատները մտնում են լվացող նյութերի բաղադրության մեջ: Պոլիֆոսֆատներն օգտագործում են ջրի կոշտությունը փոքրացնելու համար: Դրանք Ca2+ և Mg2+ իոնների հետ առաջացնում են կոմպլեքս միացություններ և խանգարում են կաթսայաքարի առաջացմանը:
Ֆոսֆորի քլորիդներն օգտագործվում են ֆոսֆորօրգանական նյութեր սինթեզելու համար, որոնք ունեն կենսաբանական ակտիվություն և օգտագործվում են որպես դեղանյութեր:
2.4.Արսեն, անտիմոն, բիսմութ
2.4.1. Տարածվածությունը բնության մեջ
Երկրի
կեղևում արսենի
պարունակությունը
կազմում է ![]()
Արսենի հիմնական միներալն արսենի կոլչեդանն է FeAsS: Դրանից բացի առաջացնում է ռեալգար`As4 S4 և աուրիպիգմենտ` As2S3 միներալները:
Անտիմոնի պարունակությունը
կազմում է ![]() Անտիմոնը
հիմնականում հանդիպում
է անտիմոնիտի
(անտիմոնափայլի)
`Sb6S3
ձևով:
Անտիմոնը
հիմնականում հանդիպում
է անտիմոնիտի
(անտիմոնափայլի)
`Sb6S3
ձևով:
Բիսմուտը
կազմում
է երկրի կեղևի
![]() և հանդիպում
է Բիսմուտիտի
(բիսմուտ փայլ)`
Bi2S3, ինչպես
նաև բիսմուտ օխրա`
Bi2O3, միներալի
ձևով: Անտիմոնը
և բիսմուտը հանդիպում
են նաև ազատ վիճակում:
և հանդիպում
է Բիսմուտիտի
(բիսմուտ փայլ)`
Bi2S3, ինչպես
նաև բիսմուտ օխրա`
Bi2O3, միներալի
ձևով: Անտիմոնը
և բիսմուտը հանդիպում
են նաև ազատ վիճակում:
2.4.2.Ստացումը
Արսենն ստացվում է արսենի կոլչեդանի ջերմային քայքայումով
![]()
Կամ As2O3, վերականգնումով, որը ստացվում է արսենի ծծմբային միացությունների թրծումից:
![]()
Անտիմոնն ստացվում է` իր սուլֆիտները երկաթի հետ միահալելով
Sb2S3 + 3Fe = 2Sb + 3FeS
կամ սուլֆիդների օքսիդացումից ստացված օքսիդն ածխածնելով վերականգնելով`
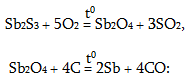
Բիսմուտն ստացվում է նույն կերպ
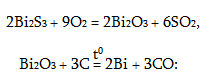
Բիսմուտի մեծ մասն ստացվում է կապարի և պղնձի թափոնների վերամշակումից:
2.4.3. Ֆիզիկական հատկությունները
Ազատ արսենն առաջացնում է մի քանի ազոտրոպ ձևափոխություններ: Առավելապես կայուն մետաղական արսենը, որը մոխրապողպատագույն դյուրաբեկ բյուրեղային նյութ է, հեշտությամբ փշրվում է սանդի մեջ վերածվելով փոշու: Մետաղական (կամ մոխրագույն) արսենի խտությունը 5.72 գ/սմ3է, տաքացնելիս սուբլիմացվում է, ունի մետաղներին բնորոշ էլեկտրահաղորդականություն:
Անտիմոնն ազատ վիճակում առաջացմում է մետաղական փայլ ունեցող սպիտակ-արծաթավուն բյուրեղներ, 6.68 գ/սմ3 խտությամբ: Անտիմոնը ևս փխրուն է, սակայն ջերմություն և էլեկտրական հոսանք վատ է հաղորդում:
Բիսմութը փայլուն, սպիտակ-արծաթավուն, թույլ վարդագույն երանգով մետաղ է, 9.8գ/սմ3 խտությամբ, ավելի քիչ փխրուն, քան անտիմոնը: Բիսմութը պատկանում է այն քիչ թվով մետաղների թվին, որոնց խտությունը հեղուկ վիճակում ավելի մեծ է, քան պինդ վիճակում:
Արսենի և անտիմոնի գոլորշիներում կան As4 և Sb4 մոլեկուլներ, իսկ բիսմութի գոլորշիների համար բնորոշ են Bi2 մոլեկուլները:
2.4.4. Քիմիական հատկությունները
Այս տարրերիարտաքին էլեկտրոնային շերտերի կառուցվածքը հիմնական վիճակում As…3d104s24p3, Sb…4d105s25p3 և Bi…4f145d106s26p3 է: Միջուկի լիցքի աճին զուգընթաց այս տարրերի մոտ կայունանում է ցածրագույն (+3) օքսիդացման աստիճանը, որը պայմանավորված է քիմիական կապի մեջ միայն P էլեկտրոնների ընդգրկումով: Դա պայմանավորված է նրանով, որ աճում է էներգիաների տարբերությունը S և P վիճակների միջև: Այդ պատճառով արսենի համար հավասարապես բնութագրական են +3 և +5 օքսիդացման աստիճանը, անտիմոնի մոտ առավել հաճախ հանդիպում է +3 օքսիդացման աստիճանը, իսկ բիսմութն ունի հիմնական +3 օքսիդացման աստիճանով միացություններ: Bi+5 պարունակող միացությունները շատ քիչ են և լինելով ուժեղ օքսիդիչներ` հեշտությամբ վերածվում են Bi+3-ի:
Իրենցից փոքր էլեկտրաբացասականություն ունեցող տարրերի, մասնավորապես ջրածնի հետ կազմված միացություններում այս տարրերը ցուցաբերում են -3 օքսիդացման աստիճան:
Ջրածնի հետ AS-ը, Sb-ը, Bi-ը չեն փոխազդում: Սրանց ջրածնական միացությունները` Արսենը` AsH3, ապա նաև As2O3, ստիրինը` SbH3 և բիսմուտինը`BiH3 ստացվում են այդ տարրերի մետաղների հետ կազմված միացությունների վրա թթուներով ազդելիս
Ca3As2 + 6HCl = 2AsH3 + 3CaCl2:
AsH3-ը և SbH3-ն անդուր հոտով, խիստ թունավոր գազեր են, հեշտությամբ քայքայվում են: Ջրում վատ են լուծվում, ի տարբերություն NH3-ի և PH3-ի, թթուների հետ աղերը չեն առաջացնում, լավ վերականգնիչներ են: BiH3-ը նույնպես գազ է, սակայն ավելի անկայուն քան SbH3-ը:
Տաքացնելիս
As-ը, Sb-ը և Bi-ը փոխազդում
են թթվածնի հետ`
առաջացնելով
Э2O3 բանաձևով
օքսիդներ: Այդ
օքսիդիչները բյուրեղային
նյութեր են: Բարձր
ջերմաստիճանում
(4000C) թթվածնի ավելցուկի
պայմաններում
անտիմոնն առաջացնում
է Sb2Օ4 օքսիդը,
որն ավելի բարձր`10000C-ում
քայքայվում է Sb2Օ3-ի
և թթվածնի: Արսենային
անհիդրիդը`As2O3-ը,
սպիտակ գույնի
պինդ նյութ է, ջրում
մասամբ է լուծվում,
առաջացնելով արսենային
թթու` H3AsO3, որը
հայտնի է միայն
լուծույթում: Ջուրը
գոլորշիանալիս
այն քայքայվում
է` առաջացնելով
նախ մետաարսենային
թթու`HAsO2,ապա նաև
As2O3, որի բյուրեղացումը
լուծույթից ուղեկցվում
է լյումինիսցենցիայով:
Sb2O3-ը և Bi2O3-ը
ջրում չեն լուծվում,
և դրանց համապատասխան
հիդրօքսիդները`Sb(OH)3-ը
և Bi(OH)3-ն ստացվում
են համապատասխան
աղերից, ալկալիով
դուրս մղելով Անտիմոնի
(lll) հիդրօքսիդը որոշակի
բաղադրություն
չունի և դրա բանաձևն
է ![]() սակայն պայմանականորեն
գրվում է Sb(OH)3: Այդ
հիդրոքսիդն ամֆոտեր
է
սակայն պայմանականորեն
գրվում է Sb(OH)3: Այդ
հիդրոքսիդն ամֆոտեր
է
Sb(OH)3 + 3HCl = SbCi3 + 3H2O,
Sb(OH)3 + 3NaOH = Na3[Sb(OH)6]
Հալույթում ընթանալիս`
Sb(OH)3 + NaOH = Na3SbO2 + 2H2O
Bi(OH)3-ի համար բնորոշ են հիմնային հատկությունները:
Այս տարրերի հինգվալենտ` Э2O5 օքսիդների կայունությունը փոքրանում է As-ից Bi-ի անցնելիս: Bi2O5ը հեշտությամբ քայքայվում է Bi2O3-ի և O2-ի:
Արսենական անհիդրիդը`As2O5-ն ապակենման նյութ է, ստացվոում է արսենական թթվի` H3AsO4-ի ջրազրկումից 1200C-ում, իսկ վերջինս ստացվում է`As2O3-ի վրա ուժեղ օքսիդիչներ ազդելով:
3As2O3 + 4HNO3 + 7H2O = 6H3AsO4 + 4NO,
Մինչև 5000C տաքացնելիս As2O5-ը քայքայվում է
As2O5 = As2O3 + O2:
As2O5-ն ուժեղ հիգրոսկոպիկ է, ջրի հետ փոխազդելիս առաջանում է արսենիական թթու` H3AsO4:
Ի տարբերություն
H3A3O3-ի H3A3O4-ը
կայուն է, լուծույթից
բյուրեղանում
է ![]() ձևով: Սա միջին
ուժի թթու է: Անտիմոնը
ազոտական թթվով
օքսիդացնելիս
անջատվում է
ձևով: Սա միջին
ուժի թթու է: Անտիմոնը
ազոտական թթվով
օքսիդացնելիս
անջատվում է ![]() նստվածքը
(H3SbO4): Br+5 ստանալու
համար օգտագործվում
են ավելի ուժեղ
օքսիդիչներ
նստվածքը
(H3SbO4): Br+5 ստանալու
համար օգտագործվում
են ավելի ուժեղ
օքսիդիչներ
Bi(OH)3+Cl2 + 3NaOH =NaBrO3 + 2NaCl+ 3H2O:
Թթվային միջավայրում Sb2O5-ն ուժեղ օքսիդիչ է
Sb2O5 +10HCl = 2SbCl3 + 2Cl2 + 5H2O:
Bi2O5 օքսիդիչն ունի կարմրամոխրագույն գույն, ստացվում է
B2O3 + 2O3 = B2O5 + 2O2:
Այս օքսիդը շատ անկայուն է և քայքայվում է B2O3-ի և O2-ի արդեն 1000C -ում:
As-ը, Sb-ը և
Bi-ը հեշտությամբ
փոխազդում են հալոգենների
հետ: Անտիմոնի
փոշին ակնթարթորեն
այրվում է քլորի
մեջ, քանի որ այդ
ռեակցիան ունի
մեծ ջերմային էֆեկտ
![]() Ծծմբի հետ
այս տարրերը փոխազդում
են` առաջացնելով
հիմնականում
Э2S3 և Э2S5 nբաղադրությամբ
սուլֆիդներ: Ընդ
որում, Sb-ի և Bi -ի համար
բնորոշ են Э2S3
սուլֆիդները:
Ծծմբի հետ
այս տարրերը փոխազդում
են` առաջացնելով
հիմնականում
Э2S3 և Э2S5 nբաղադրությամբ
սուլֆիդներ: Ընդ
որում, Sb-ի և Bi -ի համար
բնորոշ են Э2S3
սուլֆիդները:
2.4.5.Կիրառությունները
Ասենը կիրառվում է որպես հավելանյութ որոշ համաձուլվածքներում Արսենի միացություններն օգտագործվում են գյուղատնտեսական վնասատուների դեմ պայքարելու համար: Արսենի և անտիմոնի շատ միացություններ`GaAs, InSb օգտագործվում են կիսահաղորդչային տեխնիկայում:
Անտիմոնի որոշ համաձուլվածքներ օգտագործվում են տպագրական տեխնիկայում:
Բիսմութը մտնում է շատ դյուրահալ համաձուլվածքների բաղադրության մեջ:
3.1. Պատմական ակնարկ
Վանադիումը հայտնաբերվել է Մ. Դելրիսի 1801թ. Մեքսիկայի կապարի հանքում, իսկ 1830թ.-ի Շվեդացի Ն. Սեֆստիյմը երկաթի հանքում և անվանել է վանադիում ի պատիվ գեղեցկության թագուհի Վանադիսի:
Նիոբիումը հայտնաբերել է 1801թ. Անգլիացի Չ. Հարձերի կողմից և անվանվել է «կոլումբիտ»: 1844թ. գերմանացի Հ. Ռոզեն հայտնաբերվեց նոր տարրը, անվանեց «նիորիում»: Հունական դիցաբանության հերոս Տանտալի աղջկա Նիոբոմի անունով` դրանով նշելով տարրի նմանությունը Տանտալին: Հետագայում պարզվեց, որ դա նույն կոլումբիումն է:
Պրոտակտինիումը հայտնագործվել է 1913թ. Գերմանացիներ O.Գեորինգի և Կ. Ֆայանսի կողմից: Ռադիոակտիվ այս տարրերից է ստացվում է ակտինիումը, որտեղից էլ ծագել անունը (հուն. Protos-առաջին):
Տանտալը հայտնաբերվել է շվեդ Ա. Էքսբերգը 1802թ. և անվանել ի պատիվ հունական դիցաբանության հերոս Տանտալի:
3.2. Տարածվածությունը բնության մեջ
Վանադիումի,
նիոբիումի, տանտալի
և պրոտակտինիումի
պարունակությունը
երկրի կեղևում
համապատասխանաբար
![]() Սրանք ցրված
տարրեր են և պարունակում
են որպես խառնուրդներ
երկաթի, տիտանի,
կապարի հանքերում:
Այս մետաղները
պարունակող կարևորագույն
մետաղներն են պատրոնիտը`
VS2-2,5 վանդանիտը`
Սրանք ցրված
տարրեր են և պարունակում
են որպես խառնուրդներ
երկաթի, տիտանի,
կապարի հանքերում:
Այս մետաղները
պարունակող կարևորագույն
մետաղներն են պատրոնիտը`
VS2-2,5 վանդանիտը`
![]() կոլումբիտը`
Fe(NbO3)2 և տանտալիտը`
Fe(TaO3)2.:
կոլումբիտը`
Fe(NbO3)2 և տանտալիտը`
Fe(TaO3)2.:
3.3.Ստացումը
Վանադիումը հիմնականում ստացվում է վանադիում պարունակող երկաթահանքի վերամշակումից: Դոմենյան պրոցեսում վանադիումն անցնում է թուջի մեջ, որից պաղպատ ստանալիս այն անցնում է շլակների մեջ FeVO4 միացության ձևով: Վերջինից ստանում են V2O5, որից վանադիումը վերականգնում են ալյումինաթերմիկ եղանակով:
Մետաղական նիոբիումն ստանում են NbC և Nb2U5, խառնուրդը ցածր ճնշման տակ 17000C տաքացնելով, որպեսզի հեռանա առաջացած CO-ն: Մետաղական տանտալն ստանում են K2TaF7-ի հալույթի էլեկտրոլիզից` դրա մեջ ավելացնելով Ta2O5:
3.4. Ֆիզիկական հատկությունները
Վանադիումիկարգային համարն է 23, միջին իզոտոպային զանգվածը` 50,94, կազմված երկու իզոտոպներից` 51V(99,75%) և 50V(0,25%):
Նատրիումի կարգային համարն 41, ատոմական զանգվածը` 92.91, ունի երկու իզիտոպ` 93Nb:
Տանտալի կարգային համարն է 73, միջին իզոտոպային զանգվածը 180.95, ունի երկու իզոտոպ` 181Ta(99,98%) և 180Ta(0,12%):
Վանադիումը, նիոբիումը և տանտալը սպիտակ արծաթափայլ մետաղներ են: Մակերեսի օքսիդացման դեպքում ձեռք են բերում մուգ երանգ: Այս մետաղների խտությունները համապատասխանաբար 5.96, 8.57 և 16.6 գ/սմ3 է, իսկ հալման ջերմաստիճանները` 1900, 2500 և 30000C: Նիոբիումը և տանտալը դժվարահալ մետաղներ են: Սրանք կարծր են, ոչ փխրուն, լավ ենթարկվում են մեխանիկական մշակման:
Այս մետաղների արտաքին էլեկտրոնային թաղանթներն ունեն հետևյալ կառուցվածքը` V…3d34s2, Nb…4d45s1, Ta…4f145d36s2: Այս տարրերը հանդես են բերում O-ից մինչև +5 բոլոր օքսիդացման աստիճանները, ընդ որում, օքսիդացման աստիճանի մեծացման հետ ուժեղանում են օքսիդների թթվային հատկությունները: Այսպես,VO-ն հիմնային օքսիդ է, որին համապատասխանում է V(OH2) հիմքը, V2O3-ն ամֆոտեր օքսիդ է [V(OH)3], VO2-ը ևս ունի հիմնային հատկություններ, իսկ V2O5-ը թթվային օքսիդ է և հանդիսանում է մետավանադական թթվի` HVO3 անհիդրիդը:
Սենյակային ջերմաստիճաններում այս մետաղների վրա օդը, ջուրը և շատ քիմիակաան ռեագենտներ չեն ազդում: Տաքացնելիս փոխազդում են թթվածնի և հալոգենների հետ: Բարձր ջերմաստիճաններում և փոշի վիճակում այս մետաղները փոխաղդում են ջրի հետ` դուրս մղելով ջրածին: Սենյակային ջերմաստիճաններում վանադիումը փոխազդում է HF-ի հետ և կոնցենտրիկ HNO3-ի հետ: Նիոբիումը և տանտալն ավելի պասիվ են: HF-ի հետ սրանք փոխազդում են ավելի դանդաղ, բայց լուծվում են HF և HNO3 խառնուրդում
3Nb + 5HNO3 + 21HF = 3H2NbF7 + 5NO + 10H2O:
Այս տարրերի միացություններից առավել կայուն են +5 օքսիդացման ջերմաստիճանով միացությունները: Ցածր օքսիդացման աստիճանով (+1, +2, +3, +4) միացությունները հեշտությամբ օքսիդանում են +5-ի, ընդ որում այդ տենդենցը V-Nb-Ta շարքում ուժեղանում է:
Այս տարրերի երկվալենտ միացությունները քիչ են և դրանցից առավել կայուն են V+2-ները: Վանադիումի(lll) օքսիդը ստանում են V2O5-ը ջրածնով վերականգնելով 17000C-ում: NbO-ն և TaO-ն վերականգնելով Nb2O5-ը և Ta2O5-ն ածխածնով 11000C-ում: Հալոգենիդներից առավել ուսումնասիրված է VCl2-ը: Սա ոուժեղ վերականգնիչ է նույնիսկ օքսիդանում է ջրով:
![]()
Այս տարրերի +3 օքսիդացման աստիճանով միացություններն ավելի շատ են հայտնի, մասնավորապես V+3-ը, որոնք հեշտությամբ օքսիդանում են:
Վանադիումի (lll) օքսիդը` V2O3-ն, ստացվում է V2O5-ի բարձր ջերմաստիճանային վերականգնումով ջրածնով: Ջրում գործնականորեն չի լուծվում և համապատասխան հիդրօքսիդը` V(OH)3, ստացվում է V+3-ի աղերի և ալկալինների փոխազդեցությունից:
VCl3 +3NaOH =3NaCl+V(OH)3:
Հայտնի են բազմաթիվ միացություններ, որոնցում վանադիումն ունի +4 օքսիդացման աստիճան: Վանադիումի (lV) օքսիդը` VO2 ստացվում է` վերականգնելով V2O5-ը թրթնջկաթթվով, NbO-ն Nb2O5-ի վերականգնումով ջրածնով, իսկ TaO2-ը Ta2O5-ի վերականգնումով ածխածնով: Այս օքսիդները ջրում չեն լուծվում: VO2-ն ունի ամֆոտեր բնույթ և արագ լուծվում է ինչպես թթուներում, այնպես էլ ալկալիներում:
VO2 + 2HCl + 4H2O = [VO(H2O)5]Cl2:
4VO2 + 2KOH = K2V4O9 = H2O
Ստացված աղը` K2V4O9-ը, տետրավանադիումական թթվի` H2V4O9 աղն է:
Այս տարրեր բարձրագույն օքսիդները`V2O5, Nb2O5, Ta2O5 ստացվում են մետաղները կամ դրանց նիտրիդները, կարբիդները թթվածնի մեջ շիկացնելով: V2O5-ը նարնջագույն նյութ է, հեշտությամբ լուծվում է ալկալիններում առաջացնելով տարբեր վանադատներ:
V2O5 + 6KOH = 2K3VO4 + 3H2O
Nb2O5-ը և Ta2O5-ը ջրում չեն լուծվում, իսկ ալկալինների հետ փոխազդում են հալույթներում: Հալույթների հետ այս մեաղնեերն առաջացնում են պենտահալոգենիտներ` VF5, Nb2Cl5, TaCl5, որոնք դյուրահալ, հեշտ ցնդող մետաղներ են:
3.6. Կիրառությունները
Վանադիումի քանակության մոտ 95%-ն օգտագործվում է մետալուրգիական արդյունաբերության մեջ: Վանադիումի փոքր քանակությունները պողպատին տալիս են առանձգականություն և մեծ դիմադրողականություն հարվածների նկատմամաբ: Պողպատի վրա վանադիումը թողնում է լեգիրացնող ազդեցություն:
Նատիումի և տանտալի համաձուլվածքները ջերմամուր են և կոռոզիակայուն, օգտագործվում են կտրող և կոռոզիակայուն պողպատների ստացման համար: Նիոբիումն օգտագործվում է ռադիոտեխնիկայում` ռենտգեն և ռադիոլակացիոն սարքավորումների պատրաստման համար: Տանտալը կիրառվում է քիմիական արդյունաբերության մեջ, մասնավորապես որպես փոխարինիչ ոսկու, արծաթի և պլատինի, թթուների նկատմամբ կայուն սարքավորունմերի պատրաստման դեպքում: Տանտալը չի փոխազդում մարդու օրգանիզմի կենդանի հյուսվածքների հետ, ուստի այն կիրառվում են կոտրվածքների ոսկորներն իրար ամրացնելու համար: Տանտալի և նատրիումի (90%Ta և 10%Nb) համաձուլվածքն օգտագործվում են ռեակտիվ և տիեզերական տեխնիկայում, քանի որ այն կարելի է շահագործել մինչև 23000C-ում: Վանադիումի (V) օքսիդը կիրառվում է որպես կատալիզատոր ծծմբական թթվի ստացման ժամանակ:
Ամփոփում
Պարբերական համակարգի հինգերորդ խմբի տարրերն ունեն հնգական վալենտական էլեմենտներ: Ազոտի, ֆոսֆորի, արսենի, անտիմոնի և բիսմութի ատոմներում այդ էլեկտրոնները գտնվում են արտաքին շերտում` երկուսը s և երեքը` p ենթաշերտերում (….ns2np3): Ուստի այդ տարրերը վերցնում են կամ դեպի իրենց են տեղաշարժում երեք էլեկտրոն լրացնելով արտաքին շերտը և ոչ մետաղներ են, ընդ որում, (N→Bi) շարքում այդ հատկությունները թուլանում են, և բիսմութը հանդես է բերում մետաղական հատկություններ: Բնության մեջ ազոտը տարածված է նաև աղատ վիճակում, իսկ մյուսները` միացությունների մեջ: Ազատ վիճակում ազոտը գազ է , իսկ մյուսները պինդ նյութեր: Ազոտն ստացվում է օդից, իսկ մյուսները` միացություններից վերականգնելով:
Ջրածնի
և իրենից փոքր
էլեկտրաբացասականություն
ունեցող տարրերի
հետ միանալիս այս
տարրերն առաջացնում
են միացություններ,
որոնցում հանդես
են բերում -3 օքսիդացման
աստիճան: ![]() շարժում
այդ միացությունների
կայունությունը
փոքրանում է:
շարժում
այդ միացությունների
կայունությունը
փոքրանում է:
Ամոնիակը (NH3) կարևոր նյութ է` օգտագործվում է հիմնականում ազոտական թթու ստանալու համար:
Թթվածնի հետ փոխազդելիս առաջացնում են օքսիդներ: Ազոտը +1-ից մինչև +5 օքսիդացման աստիճանով, որոնցից N2O-ն և NO-ն աղ առաջացնող, իսկ մյուսները (N2O3, NO2 և N2O5) թթվային օքսիդներ են: Հանդես են բերում +1-ից մինչև +4 օքսիդացման աստիճանով միացություններ, որոնցից առավել բնորոշ են +3 և +5 օքսիդացման աստիճանները:
Ազոտն առաջացնում է երկու թթվածնավոր թթուներ` ազոտային (HNO2) և ազոտական `(HNO3):
Մնացած տարրերը հիմնականում առաջացնում են +3 և +5 օքսիդացման աստիճանով օքսիդներ են: Ֆոսֆորի (V) օքսիդը` P2O5 հիգրոսկոպիկ նյութ է և առաջացնում է մի քանի ֆոսֆորական թթուներ` HPO3-մետա, H4P2O7-պիրո և H3PO4-օրթոֆոսֆորական թթուներ: Ֆոսֆորական թթվի աղերը պարարտանյութեր են` Ca3(PO4)2-ֆոսֆորական այլուր,
![]() -հասարակ
սուպերֆոսֆատ,
Ca(H2PO4)2-կրկնակի
սուպերֆոսֆատ,
պրոցիպտատ`
-հասարակ
սուպերֆոսֆատ,
Ca(H2PO4)2-կրկնակի
սուպերֆոսֆատ,
պրոցիպտատ` ![]() ամոֆոսներ`
NH4H2PO4 և (NH4) 2HPO4:
ամոֆոսներ`
NH4H2PO4 և (NH4) 2HPO4:
Վանադիումը, նատրիումը և տանտալը մետաղներ են, քանի որ հինգ վալենտական էլեկտրոններից երկուսն արտաքին շերտում են(նիրբիումի ատոմում` մեկը), իսկ երեքը` նախավերջին d-ենթաշերտում (Nb- համար` չորսը): Սրանք դժվարահալ մետաղներ են: Հանդես են բերում +1–ից մինչև +4 օքսիդացման աստիճաններով միացություններ, որոնց առավել բնորոշ են+3 և+5 օքսիդացման աստիճանները: Ցածր օքսիդացման աստիճանի օքսիդներն ունեն հիմնային բնույթ և հիդրօքսիդները հիմքեր են, միջին օքսիդացման աստիճանի օքսիդներն ու հիդրօքսիդներն ամֆոտեր են, իսկ բարձր օքսիդացման աստիճանի օքսիդները թթվային են:
Վանադիումի թթուներն են HVO4-մետավանադական, H2V4O9-տետրավանադիումական և H3VO4-օրթովանանդական թթուները: Այս մետաղները հիմնականում կիրառվում են կոռոզիակային կայուն, առանձգական պողպատների ստացման համար:
Սովորելու նպատակը
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1 . Տալ հինգերորդ խմբի ընդհանուր բնութագիրը` ելնելով խմբի մեջ մտնող տարրերի ատոմների էլեկտրոնային թաղանթների կառուցվածքից, պատճառաբանել խումբը, ենթախմբերի բաժանելը, ազոտի ենթախմբի տարրերի ոչ մետաղական և վանադիումի ենթախմբի տարրերի մետաղական հատկություններ ունենալը:
2. Ելնելով ազոտի ենթախմբի տարրերի էլեկտրոնային թաղանթների կառուցվածքից` արտածել դրանց քիմիական հատկությունները, այն բաժանելով երկու հիմնական մասերի.
ա) երբ փոխազդում են իրենցից փոքր էլեկտրաբացասականություն ունեցող տարրերի( ջրածին, մետաղներ) հետ,
բ) երբ փոխարինում են իրենցից մեծ էլեկտրաբացականություն ունեցող տարրերի (թթվածին, հալոգեններ) հետ:
3. Համեմատել
տարրերի հատկությունները
![]() շարքում,
բացատրել հատկությունների
փոփոխման պառճառները,
առաջացրած միացությունների
կայունությունն
ու բնույթը:
շարքում,
բացատրել հատկությունների
փոփոխման պառճառները,
առաջացրած միացությունների
կայունությունն
ու բնույթը:
4. Ելնելով վանադիումի ենթախմբի տարրերի ատոմների էլեկտրոնային թաղանթների կառուցվածքից` արտածել այդ տարրերի հատկությունները և V-Ta շարքում դրանց փոփոխման օրինաչափությունները:
Հիմնական հասկացությունները և միացությունները
Ազոտն անգույն, անհոտ գազ է: Ֆոսֆորը պինդ նյութ է, ունի երեք ազոտրոպ ձևափոխություններ` սպիտակ կարմիր և սև: Արսենը, անտիմոնը և բիսմութը պինդ նյութեր են:NH3-ը` ամոնիակը, գազ է ունի հիմնային բնույթ, ջրում լուծվում է, առաջացնելով ամոնիումի հիդրօքսիդ` NH4OH: Ազոտային թթուն` HNO2-թույլ թթու է: HNO2-ազոտական թթուն ուժեղ թթու է, աղերը` KNO3, Ca(NO3)2 կոչվում են նիտրատներ:
Օրթոֆոսֆորական
թթուն` H3PO4 աղերը
պարարտանյութեր
են` ![]() -հասարակ
սուպերֆոսֆատ,
Ca(H2PO4)2-կրկնակի
սուպերֆոսֆատ:
-հասարակ
սուպերֆոսֆատ,
Ca(H2PO4)2-կրկնակի
սուպերֆոսֆատ:
Արսենի կարևորագույն ազոտրոպ ձևափոխությունը մետաղական արսենն է: Արսենը, անտիմոնը և բասմութը փխրուն պինդ բյուրեղային նյութեր են: Կարևորագույն օքսիդացման աստիճաններն են -3, +3, և +5: Ջրածնական միացությունները` AsH3, SbH3, և BrH3, անդուր հոտով թունավոր գազեր են: H3AsO4-արսենական թթուն բյուրեղային նյութ է, աղերը` (K3AsO4) կոչվում են արսենիտներ:
Վանադիումը, նիոբիումը և տանտալը մետաղներ են:
HVO3-մետավանադական թթու, աղերը` KVO2 կալիումի մետավանադատ, H2V4O9-տետրավանդական թթու, աղերը`K2V4O9-կալիումի տետրավանդատ:
H3VO4-օրթովանադական թթու, աղերը` օրթովանդատներ (K3VO4-կալիումի տետրավանդատ): V, Nb, Ta կիրառվում են հատուկ, կոռոզիա կայուն պողպատների ստացման համար:
Արմեն Շահենի Գրիգորյան
ՊԱՐԲԵՐԱԿԱՆ ՀԱՄԱԿԱՐԳԻ ՀԻՆԳԵՐՈՐԴ ԽՈՒՄԲ
Ուսումնական ձեռնարկ
Խմբագիր` Ն.Ա. Խաչատրյան
