ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ
ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
(ՊՈԼԻՏԵԽՆԻԿ)
Քիմիական տեխնոլոգիաների և
բնապահպանական
ճարտարագիտության
դեպարտամենտ
Տեսական քիմիայի սեկտոր
Ֆրիդրիխ Գրիգորյան
Արմեն Գրիգորյան
ՔԻՄԻԱԿԱՆ ԿԱՊ ԵՎ ՄՈԼԵԿՈՒԼԻ ԿԱՌՈՒՑՎԱԾՔԸ
ուսումնական ձեռնարկ
ԵՐԵՎԱՆ 2007
Ֆ.Գրիգորյան, Ա.Գրիգորյան:
Քիմիական կապ և մոլեկուլի կառուցվածք: Ուսումնական ձեռնարկ: Եր., Հայաստանի պետական ճարտարագիտական համալսարան, 2007.-59 էջ:
Ներկայացված է Քիմիատեխնոլոգիական և բնապահպանական ճարտարագիտություն մասնագիտության ուսանողների մագիստրանտների և ասպիրանտների համար:
Գրախոսներ՝ Հ.Մխիթարյան
Ռ.Միրզախանյան
Խմբագիր՝ Ն.Խաչատրյան
Բովանդակություն
1.1. ՄՈԼԵԿՈՒԼՆԵՐ, ԻՈՆՆԵՐ, ԱԶԱՏ ՌԱԴԻԿԱԼՆԵՐ
3.4. ԲԵՎԵՌԱՑՄԱՆ ԱԶԴԵՑՈՒԹՅՈՒՆԸ ՆՅՈՒԹԻ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԻ ՎՐԱ
4. ՔԻՄԻԱԿՆ ԿԱՊԻ ՔՎԱՆՏԱՄԵԽԱՆԻԿԱԿԱՆ ՏԵՍՈՒԹՅՈՒՆ
4.1. ՇՐՅՈԴԻՆԳԵՐԻ ՀԱՎԱՍԱՐՄԱՆ ԼՈՒԾՈՒՄԸ ԱԼԻՔԱՅԻՆ ՖՈՒՆԿՑԻԱՅԻ ՄՈՏԱՎՈՐ ԱՐՏԱՀԱՅՏՈՒԹՅՈՒՆՆԵՐԻ ՕԳՏԱԳՈՐԾՄԱՄԲ
4.2. ՋՐԱԾՆԻ ՄՈԼԵԿՈՒԼԻ ՔՎԱՆՏԱՄԵԽԱՆԻԿԱԿԱՆ ՆԿԱՐԱԳՐՈՒԹՅՈՒՆԸ ԸՍՏ ՀԵՅՏԼԵՐ-ԼՈՆԴՈՆԻ
4.4. ԿՈՎԱԼԵՆՏ ԿԱՊԻ ՈՒՂՂՎԱԾՈՒԹՅՈՒՆԸ
4.5. ՄԻԱԿԻ, ԿՐԿՆԱԿԻ, ԵՌԱԿԻ ԿԱՊԵՐ
4.6. ԷԼԵԿՏՐՈՆԱՅԻՆ ԱՄՊԵՐԻ ՀԻԲՐԻԴԱՑՈՒՄ (ԽԱՉԱՍԵՐՈՒՄ)
4.7. ՄՈԼԵԿՈՒԼԻ ԴԻՊՈԼԱՅԻՆ ՄՈՄԵՆՏԸ
4.8. ՄՈԼԵԿՈՒԼԱՅԻՆ ՕՐԲԻՏԱԼՆԵՐԻ ՄԵԹՈԴԸ
4.9. ՈՐՈՇ ՄՈԼԵԿՈՒԼՆԵՐԻ ՄՈԼԵԿՈՒԼԱՅԻՆ ՕՐԲԻՏԱԼՆԵՐԸ
1.1. ՄՈԼԵԿՈՒԼՆԵՐ, ԻՈՆՆԵՐ, ԱԶԱՏ ՌԱԴԻԿԱԼՆԵՐ
Բացի ազնիվ գազերի մի մասից, բոլոր ատոմները սովորական պայմաններում անկայուն են, միանում են իրար և կազմում երեք տեսակի մասնիկներ՝ մոլեկուլներ, իոններ և ազատ ռադիկալներ:
Մոլեկուլը նյութի փոքրագույն էլեկտրաչեզոք մասնիկն է, որն ունի նյութի բաղադրությունը, նույն քիմիական հատկությունները և ինքնուրույն գոյություն ունի: Տարբերվում են միատոն, երկատոմ, եռատոմ և ընդհանրապես՝ բազմատոմ մոլեկուլներ: Սովորական պայմաններում միատոմ մոլեկուլներից են կազմված ազնիվ գազերը, իսկ բարձրամոլեկուլային միացությունների մոլեկուլները՝ ընդհակառակը, պարունակում են հազարավոր ատոմներ:
Իոնը լիցքավորված մասնիկն է, որն ատոմ կամ քիմիապես միացած ատոմների խումբ է, որն ունի էլեկտրոնների ավելցուկ (անիոն), կամ պակասորդ (կատիոն): Նյութի մեջ դրական իոնները գոյություն ունեն բացասական իոնների հետ միասին:
Ազատ ռադիկալները,
ատոմներ կամ ատոմների
խումբ են, որոնք
ունեն չզույգված
էլեկտրոններ, այսինքն՝
չհագեցած վալենտականություն:
Օրինակ՝ ![]() Ազատ
ռադիկալները անկայուն
մասնիկներ են,
սովորական պայմաններում
ունեն փոքր կյանքի
տևողություն, մեծ
ռեակցիոն ունակություն
և փոխազդում են
միմյանց հետ՝ առաջացնելով
իներտ մասնիկներ:
Ազատ
ռադիկալները անկայուն
մասնիկներ են,
սովորական պայմաններում
ունեն փոքր կյանքի
տևողություն, մեծ
ռեակցիոն ունակություն
և փոխազդում են
միմյանց հետ՝ առաջացնելով
իներտ մասնիկներ:
Ատոմներից իոնների ազատ ռադիկալների, մոլեկուլների առաջացումը ուղեկցում է էներգիայի անջատումով, այսինքն՝ համակարգի էներգիան նվազում է: Առաջանում է էներգետիկ վիճակ՝ ելային ատոմների էներգիայից ավելի փոքր լրիվ էներգիայով:
2. ՔԻՄԻԱԿԱՆ ԿԱՊԻ ԲՆՈՒԹԱԳՐԵՐԸ
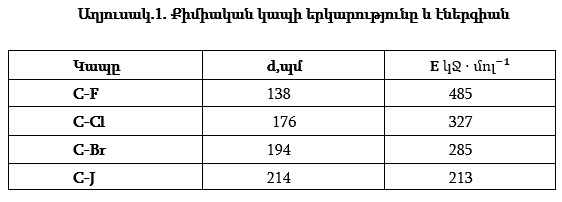
Կապի երկարությունը: Կապի d երկարություն կոչվում է կապն առաջացնող երկու ատոմների միջուկների միջև եղած հեռավորությունը: Օրինակ՝ H2, N2, O2 մոլեկուլներում կապի երկարություններում համապատասխանաբար կազմում են 74, 110, 121պմ ( 1պմ = 10-12մ ): Կապի երկարությունը կախված է ատոմների շառավիղներից և կապի բազմակիությունից: Ջրածնի մոլեկուլում կապի երկարությունը փոքր է, որովհետև ատոմի չափերը փոքր են: Ազոտի և թթվածնի ատոմների շառավիղները մոտ են իրար, սակայն ազոտի մոլեկուլում կապի երկարությունը փոքր է, որովհետև կապը եռակի է, իսկ թթվածնի մոլեկուլում՝ կրկնակի: Այսպիսով միակի կապից երկակի և եռակի կապի անցնելիս կապի երկարությունը փոքրանում է:
![]()
Կապի էներգիա:
Էներգիայի
այն քանակը, որը
պետք է ծախսել
տվյալ կապը խզելու
համար, կոչվում
է կապի էներգիա:
Կապի խզման էներգիան
միշտ դրական է
(կլանվում է էներգիա),
կապի առաջացման
էներգիան՝ բացասական
(անջատվում է էներգիա),
և բացարձակ արժեքով
հավասար է խզման
էներգիային: Միակի
կապից եռակի կապի
անցնելիս, կապի
էներգիան աճում
է ![]()
Սակայն էներգիան մեծանում է բազմակիությանը ոչ համեմատական: Կապի էներգիան փոքրանում էկապի երկարությունը մեծանալիս:
Կապի ուղղվածություն: Կապի ուղղվածությամբ որոշվում է մոլեկուլի տարածական կառուցվածքը: Քննարկենք դա H2O, CO2 մոլեկուլների օրինակով:
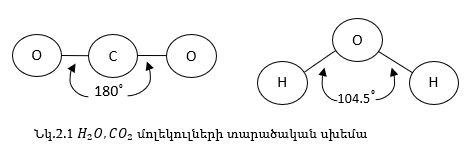
Նկ.2.1-ից երևում է, որ CO2-ը ունի գծային, իսկ HO2-ն անկյունային կառուցվածք: Հետագայում մենք կբացատրենք այդ տարբերությունը: Կապերի միջև կազմած անկյունները կոչվում են վալենտական անկյուններ:
Հագենալիություն: Հագենալիություն ասելով հասկանում ենք որորշակի, սահմանափակ թվով կապեր առաջացնելու ընդունակությունը: Օրինակ՝ ջրածինը առաջացնում է մեկ, ածխածինը՝ չորս կապեր: Մոլեկուլի կապերի հագենալիության հետևանքով մոլեկուլն ունի որոշակի բաղադրություն. H2, CH4, HCI:
Կապի բազմակիություն:Կապերը լինում են միակ՝ H - H կրկնակի O = O և եռակի N ≡ N Կապի բազմակիությունը մեծանալիս կապի երկարությունը նվազում է, իսկ էներգիան՝ աճում:
3. ՄՈԼԵԿՈՒԼԻ ԿԱՌՈՒՑՎԱԾՔԻ ՄԻՆՉՔՎԱՆՏԱՄԵԽԱՆԻԿԱԿԱՆ
ՏԵՍՈՒԹՅՈՒՆԸ: ԿՈՎԱԼԵՆՏ ԿԱՊԻ ԼՅՈՒԻՍԻ ԵՎ ԿՈՄԵԼԻ ՏԵՍՈՒԹՅՈՒՆԸ
Մեր խնդիրն է պարզել հետևյալ 3 հարցերը.
· Ինչու՞ են ատոմները միանում իրար:
· Ինչու՞ են ատոմները միանում որոշակի հարաբերությամբ:
· Ինչու՞ մոլեկուլը որոշակի տարածական կառուցվածք ունի:
3.1. ԿՈՎԱԼԵՆՏ ԿԱՊ
Ատոմների էլեկտրոնային կառուցվածքի հիման վրա ստեղծված քիմիական կապի առաջին տեսությունը Ջ.Լյուիսի կովալենտ կապի տեսությունն է: Ըստ Լյուիսի քիմիական կապ առաջանում է շնորհիվ նրա, որ փոխազդող ատոմների չզույգված էլեկտրոններից գոյանում է երկուսի համար ընդհանուր էլեկտրոնային զույգ,կովալենտ (կամ ատոմական) կապի առաջացումը նկարագրելու համար վալենտական էլեկտրոնները նշվում են քիմիական նշանների կողքին կետերի ձևով: Օրինակ. ջրածնի, քլորի մոլեկուլների առաջացումը նկարագրվում է հետևլավ կերպ.
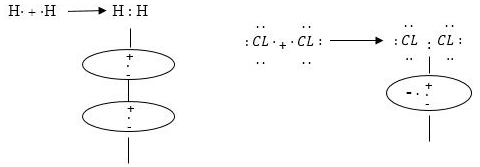
Քանի որ փոխազդող ատոմների էլեկտրաբացասականությունները հավասար են, գոյացած ընդհանուր էլեկտրոնային զույգը հավասարապես պատկանում է երկուսին էլ, այսինքն՝ սիմետրիկ է պտտվում երկու միջուկների շուրջը: Դրա հետևանքով առաջացած H2 և Cl2 մոլեկուլներում դրական և բացասական լիցքերի ծանրության կենտրոնները գտնվում են մեջտեղում և համընկնում են: Հետևաբար, այդպիսի կովալենտ կապը կոչվում է ոչ բևեռային: Ե՛վ ջրածինը, և՛ քլորը ձեռք են բերում պարբերական համակարգում իրենց մոտիկ ազնիվ գազերի՝ համապատասխանաբար He-ի և Ne-ի էլեկտրոնային կառուցվածք, եթե փոխենք ջրածնի ատոմներից մեկը քլորով, ապա, քանի որ քլորն ունի ավելի մեծ էլեկտրաբացասականություն, գոյացած ընդհանուր էլեկտրոնային զույգը կտեղաշարժվի դեպի քլորը:
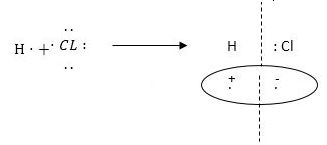
Դրա հետևանքով առաջացած մոլեկուլում դրական և բացասական լիցքեր իծանրության կենտրոնները չեն համընկնի: Բացասական լիցքերի ծանրության կենտրոնը կտեղաշարժվի դեպի քլորը, և մոլեկուլում կլինեն երկու բևեռներ: Այդպիսի կովալենտ կապը կոչվում է բևեռային:
Արդյունքում ջրածնիատոմը ձեռք կբերի դրական, իսկ քլորիատոմը՝բացասական լիցքի ավելցուկ: Այդ լիցքերը կոչվում են մոլեկուլում ատոմների էֆեկտիվ լիցքեր: Ջրածնի և քլորի էֆեկտիվ լիցքերը քլորաջրածնի մոլեկուլում հավասար են էլեկտրոնիլիցքի 0.17 մասին:
Ընդունված է յուրաքանչյուր ընդհանուր էլեկտրոնային զույգը (յուրաքանչյուր կապը) նշել մեկ գծիկով՝
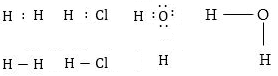
Դրական և
բացասական լիցքերի
ծանրության կենտրոնների
միջև եղած հեռավորությունը
(l) կոչվում է դիպոլի
երկարություն:
Կապի բևեռացվածությունը
որոշվում է ոչ
միայն դիպոլի երկարությամբ,
այլ նաև տեղաշարժված
լիցքի (q) մեծությամբ,
այսինքն՝ նրանց
արտադրյալով և
կոչվում է դիպոլի
մոմենտ՝ ![]()
Եթե կապում
էլեկտրոնը լրիվ
տեղաշարժված է
միատոմից մյուսը,
ապա ![]() Դիպոլի
երկարությունը
10-10 մ կարգի մեծություն
է, ուստի դիպոլի
մոմենտի առավելագույն
արժեքը կլինի՝
Դիպոլի
երկարությունը
10-10 մ կարգի մեծություն
է, ուստի դիպոլի
մոմենտի առավելագույն
արժեքը կլինի՝
![]()
Ընդունված
է
![]() համարել
միավոր և անվանել
մեկ Դեբայ: Հետևաբար
դիպոլի մոմենտի
առավելագույն
արժեքը կլինի՝
համարել
միավոր և անվանել
մեկ Դեբայ: Հետևաբար
դիպոլի մոմենտի
առավելագույն
արժեքը կլինի՝
![]() դեբայ:
դեբայ:
Ոչ բևեռային
կապի դեպքում,
քանի որ l = 0, ապա q = 0:
Կապը կոչվում է
բևեռային, եթե
դիպոլի մոմենտը
զրոյից մինչև չորս
դեբայ է՝ ![]()
Օրինակ 3.1.1.
H2Se-ի դիպոլի մոմենտը հավասար է 0.24 դեբայի: Հաշվել այդ մոլեկուլի դիպոլի երկարությունը:
Լուծում. Մոլեկուլի դիպոլի մոմենտը արտահայտված Կլ · մ-ով կլինի՝
![]()
![]()
3.2. ԻՈՆԱԿԱՆ ԿԱՊ
Իոնական կապի առաջացման գաղափարն առաջինը տվել է Վ.Կոսելը 1916 թ-ին: Ըստ նրա, երբ ատոմները փոխազդում են, նրանցից մեկը կորցնում է էլեկտրոն, մյուսը՝ վերցնում, այնպես որ արտաքին շերտերը նմանվեն պարբերական համակարգում մոտ գտնվող իներտ գազի ատոմին: Առաջացած դրական և բացասական լիցքավորված իոնները ձգում են իրար և միանում: Քննարկենք այդ կապի առաջացումը NaCl-ի օրինակով: Նատրիումի և քլորի ատոմներն ունեն խիստ տարբեր էլեկտրաբացասականություններ: Նատրիումի համար այն հավասար է 1.01-ի, իսկ քլորի համար՝ Na-1s22s2 2p63s1, և Cl-1s22s22p63s23p5 դրանք ունեն մեկական կենտ էլեկտրոններ: Այս դեպքում ևս կարելի է ընդունել, որ նատրիումի և քլորի կենտ էլեկտրոններից կարող է առաջանալ ընդհանուր էլեկտրոնային զույգ, սակայն խիստ տարբերէլեկտրաբացասականությունների պատճառով այդ զույգն այնքան խիստ կտեղաշարժվի դեպի քլորը, որ փաստորեն կպատկանի միայն քլորին: Այսինքն՝ նատրիումը կորցնում է այդ մեկ էլեկտրոնը, իսկ քլորը վերցնում՝

Նատրիումը
վեր է ածվում դրական
իոնի Na0– e = Na+, իսկ
քլորը՝ բացասականի
Cl0 – e = Cl-: Նատրիումի
էլեկտրոնային
թաղանթը վերածվում
է իներտ գազ նեոնի՝
1s22s22p6 , իսկ քլորինը՝
իներտ գազ արգոնի,
1s22s22p63s23p6 կայուն
էլեկտրոնային
թաղանթների:Գոյացած
Na+ և Cl-իոնների
միջև առաջանում
են էլեկտրաստատիկ
ձգողական ուժեր,
որի արդյունքում
առաջանում է NaCl միացությունը:
Այդպիսի կապը կոչվում
է իոնական կամ
էլեկտրավալենտ
կապ: Այն կապերն,
որոնց դիպոլի մոմենտը
մեծ է չորս դեբայից՝
![]() համարվում
են իոնական:
համարվում
են իոնական:
Իոնների միջոցով առաջացած կապը, էլեկտրաստատիկ ձգողական ուժերի շնորհիվ, կոչվում է իոնական կապ: Միացությունները, որոնք առաջացել են իոնների ձգողականության շնորհիվ, կոչվում է իոնական միացություններ:
Այսպիսով, իոնական միացություններ առաջացնում են այն ատոմները, որոնց էլեկտրաբացասականությունները խիստ տարբերվում են, օրինակ I և II խմբի գլխավոր ենթախմբի մետաղները VI և VII խմբի գլխավոր ենթախմբի տարրերի հետ:
NaCl միացությունն ունի բյուրեղային կառուցվածք: Բյուրեղային ցանցի հանգույցներում դասավորված են Na+ և Cl-իոնները:
Ի տարբերություն կովալենտ կապի, իոնական կապն ուղղվածություն չունի: Դա բացատրվում է նրանով, որ իոների էլեկտրական դաշտն ունի գնդաձև սիմետրիա, այսինքն՝ հեռավորությամբ նվազում է բոլոր ուղղություններով նույն օրենքով:
Այդ պատճառով իոնների միջև փոխազդեցությամբ իրականացնում է նույն ձևով՝ անկախ ուղղությունից: Երկու հակաիոնները, որոնք ձգում են իրար, պահպանում են էլեկտրաստատիկ փոխազդեցության հատկությունն այլ իոնների հետ: Դրանում է կայանում ևս մեկ տարբերություն իոնական և կովալենտ կապերի միջև, իոննական կապը չունի հագեցվածություն: Ուղվածության և հագեցվածության բացակայությունը իոնական կապի դեպքում պայմանավորում է իոնական մոլեկուլների հակումը ասոցման, այսինքն՝ իրար հետ միանալուն:
Օրինակ 3.1.2
Դասավորենք Be-Cl, Na-Cl, Mg-Cl, Sn-Cl կապերը իոնացվածության աստիճանի աճման կարգով:
Լուծում. Քիմիական կապն այնքան ավելի բևեռացված կլինի, որքան փոխազդող տարրերի էլետրաբասականությունների տարբերությունը մեծ է: Քանի որ բերված օրինակում երկրորդ տարը քլորն է, ապա բևեռացվածությունը կորոշվի առաջին տարրի էլեկտրաբացասականությամբ: Այն կապը կլինի ավելի բևեռացված, որտեղ առաջին տարրի էլեկտրաբացասականությունն ավելի փոքր է: Հետևաբար հերթականությունը կլինի. 1) Na-Cl (Na-ի E=0.9), 2)Mg-Cl(1.2), 3)Be-Cl(1.5), 4)Sn-Cl(1.7):
3.3. ԻՈՆՆԵՐԻ ԲԵՎԵՌԱՑՈՒՄ
Նշենք, որ նույնիսկ ալկալիական մետաղների հալոգենիդներում, որոնք առաջացել են ատոմներից և խիստ տարբերվում են էլեկտրաբացասականությամբ, գոյություն չունի իդեալական իոնական կապ: Այստեղ կապն ունի մասնակաի կովալենտ բնույթ, այսինքն՝ դրական և բացասական լիցքերը լրիվ չեն բաժանված, էլեկտրոնի լրիվ անցում չկա մի ատոմից մյուսը: Օրինակ NaCl-ի բյուրեղում քլորի ատոմի էֆեկտիվ լիցքը հավասար է էլեկտրոնի լիցքի 0.94 մասին, նույնչափ, բայց դրական լիցք ունի նատրիումի ատոմը:
Իոնական միացություններում, իոններում լիցքերի ոչ լրիվ բաժանումը, պայմանավորված է իոնների փոխադարձ բևեռացմամբ, այսինքն՝ փոխադարձ ազդեցությումբ, որը բերում է իոնների էլեկտրոնային թաղանթների դեֆորմացիային: Բևեռացման պատճառը էլեկտրական դաշտի ազդեցություն է, որը տեղաշարժվում է:
Յուրաքանչյուր իոն, որն էլեկտրական լիցքի կրող է, էլեկտրական դաշտի աղբյուր է: Այդ պատճառով, հակառակ լիցքերով լիցքավորված իոնները փոխազդելով բևեռացնում են իրար: Բևեռացման ժամանակ ամենաշատ տեղաշարժվում են արտաքին թաղանթի էլեկտրոնները: Առաջին մոտեցմամբ կարելի է ընդունել, որ դեֆորմացիայի են ենթարկվում միայն արտաքին էլեկտրոնային թաղանթները: Սակայն միևնույն էլեկտրական դաշտի ազդեցությամբ տարբեր իոններ տարբեր չափով են դեֆորմացվում: Այլ կերպ ասած,տարբեր իոնների բևեռացումը միատեսակ չէ, որքան արտաքին թաղանթի էլեկտրոնները թույլ են կապված միջուկի հետ, այնքան իոնը հեշտ է բևեռանում, այնքան ուժեղ է դեֆորմացվում էլեկտրական դաշտում:
Նույն լիցքն ունեցող իոնների դեպքում, որոնք ունեն արտաքին էլեկտրոնային թաղանթի նմանատիպ կառուցվածք, բևեռացումը աճում է իոնի չափերի մեծացման հետ, քանի որ արտաքին էլեկտրոններն ավելի հեռու են միջուկից, էկրանացվում են ավելի մեծ թվով էլեկտրոնային թաղանթներով և արդյունքում թույլ են կապված միջուկի հետ: Այսպես, ալկալիական մետաղների բևեռացնելու հատկությունը աճում է հետևյալ շարքում. Li+<Na+<K+=<PB+<Cs+
Նույն կերպ հալոգենների իոնների բևեռացվելիությունը փոփոխվում է հետևյալ հաջորդականությամբ. F- < Cl- < Br- < J-
Ատոմների վերածումը դրական իոնների միշտ հագեցնում է չափերի փոքրացման (Աղյուսակ 1):
Կատիոնի ավելցուկային դրական լիցքը դժվարացնում է արտաքին թաղանթի էլեկտրոնների դեֆորմացիան: Ընդհակառակը, բացասական լիցքավորված իոնները միշտ ունեն ավելի մեծ չափեր, քան չեզոք ատոմները: Այդ պատճառով անիոնների բևեռացումը, որպես կանոն, զգալի մեծ է կատիոնների բևեռացումից:
Եթե տվյալ տարրը առաջացնում է տարբեր լիցքեր ունեցող կատիոններ, ապա իոնի բևեռացվելիությունը կլինի այնքան ավելի փոքր, որքան մեծ է նրա լիցքը, քանի որ վերջինիս մեծացումը բերում է իոնի շառավղի փոքրացմանը և միջուկի հետ էլեկտրոնների կապի միացմանը:

Ազնիվ գազի ատոմների կոնֆիգուրացիա ունեցող իզոէլեկտրոն իոնների շարքում բևեռացվելիությունը աճում է դրական լիցքի փոքրացման հետ, օրինակ՝ Mg2+ - Na+ - Ne0–F- - O2- (Աղյուսակ 1) :
Իոնի բևեռացնող հատկությունը, այսինքն՝ այլ իոնների վրա դեֆորմացնող ազդեցությունը նույնպես կախված է իոնի տեսակից,լիցքից և չափերից, այն այնքան ավելի զգալի է, որքան մեծ է լիցքը, փոքր է վշառավիղը, և որքան կայուն է իոնի էլեկտրոնային թաղանթը: Ամենաուժեղ բևեռացնող ազդեցություն ունեն այն իոնները, որոնք թույլ են բևեռանում:
Այսպես, ալկալիական մետաղների կատիոնների շարքում, բևեռացնող ընդունակությունը հակառակ է բևեռացնելիությանը՝ li+>Na+>K+>Pb+>Cs+
Ինչպես արդեն նշվել է, անիոնների չափերը, որպես կանոն, ավելի մեծ կատիոնների չափերից: Դրա հետևանքով, անիոնները ավելի թույլ բևեռացնող ընդունակություն ունեն, քան կատիոնները:
Այսպիսով, անիոնները կատիոնների համեմատ բնորոշվում են ուժեղ բևեռացնելիությամբ և թույլ բևեռացող հատկությամբ: Այդ պատճառով հակառակ լիցքեր ունեցող իոնների փոխազդեցության ժամանակ բևեռացման են ենթարկվում հիմնականում բացասական իոնները, դրական իոնների բևեռացումը մեծ մասամբ կարելի է անտեսել, այսինքն՝ ընդունել, որի բևեռացումը ընթանում է միակողմանի:
3.4. ԲԵՎԵՌԱՑՄԱՆ ԱԶԴԵՑՈՒԹՅՈՒՆԸ ՆՅՈՒԹԻ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԻ ՎՐԱ
Իոնների բևեռացումը, այսինքն՝ էլեկտրոնների այս կամ այն չափով տեղաշարժ, շատ մեծ նշանակություն ունի, քանի որ այն հանգեցնում է միջատոմային հեռավորության կրճատման, փոքրացնում է դիպոլի մոմենտը և իոնական կապը դարձնում է կովալենտ: Բևեռացումը և բևեռացնող հատկությունը բացատրում է տարբեր նյութերի բազմաթիվ առանձնահատկություններ:
Օրինակ՝ բևեռացման էֆեկտով է բացատրվում, թե ինչու AgCl-ը ավելի վատ է լուծվում ջրում, քան NaCl-ը և KCl-ը: Ag+-ի շառավիղը մոտ է և իոնների շառավղին, սակայն իոնը, որն ունի արտաքին թաղանթում 18 էլեկտրոն, ունի զգալիորեն մեծ բևեռացվելիություն, քանNa+ ևK+իոնները: Այդ պատճառով AgCl-ում միջուկների միջև եղած հեռավորությունը փոքր է, կապի խզման էներգիան մեծ է, քան NaCl և KCl մոլեկուլներում: BaCl2-ը ուժեղ էլեկտրոլիտ է ջրային լուծույթում գործնականորեն լրիվ դիսոցված է իոնների, իսկ սնդիկի քլորիդը՝ HgCl2 համարյա չի դիսոցվում և չի լուծվում ջրում: Դա նույնպես բացատրվում է Hg2+ իոնի մեծ բևեռացնելիությամբ, որի ատոմի արտաքին էլեկտրոնային շերտում կա 18 էլեկտրոն:
Էլեկտրոնային թաղանթի դեֆորմացումը ազդում է նաև նյութի օպտիկական հատկությունների վրա: Նյութի գույնը պայմանավորված է տեսանելի լույսի որոշ ալիքների կլանումով և գրգռված վիճակի անցումով: Որքան մեծ է բևեռացվելիությունը, այնքան քիչ էներգիա է համապատասխանում էլեկտրոնային անցմանը: Եթե բևեռացվելիությունը փոքր է, ապա գրգռումը պահանջում է մեծ էներգիա, որոնք համապատասխանում են ուլտրամանուշակագույն ճառագայթները: Իսկ եթե իոնը հեշտ բևեռացող է, ապա գրգռումը պահանջում է փոքր էներգիա ունեցող քվանտներ, որոնց համապատասխանում է տեսանելի լույսի սպեկտրը: Այդ դեպքում նյութը գունավորված է:
Այսպիսով, այն նյութերի կողքին, որոնց գույնը պայմանավորված է նրանց մեջ պարունակող իոններով, գոյություն ունեն նաև գունավոր նյութեր, որոնք առաջացել են անգույն իոններից, որոնց գույնը պայմանավորված է իոնների փոխազդեցությամբ: Որքան մեծ է միացության մեջ իոններից մեկի բևեռացվելիությունը և մյուսի բևեռացնող ընդունակությունը, այնքան հավանական է գույնի ի հայտ գալը: Օրինակ PbJ2 -ը գունավորված է, CaJ2 -ը անգույն է, քանի որ կապար իոնն ունի մեծ բևեռացնող ազդեցություն:
4. ՔԻՄԻԱԿԱՆ ԿԱՊԻ ՔՎԱՆՏԱՄԵԽԱՆԻԿԱԿԱՆ ՏԵՍՈՒԹՅՈՒՆ
Ատոմների միջև կապի առաջացման ֆիզիկական պատճառները պարզվեցին միայն այն բանից հետո, երբ հայտնի դարձան միկրոմարմինների շարժման օրինաչափությունները, ստեղծվեց քվանտային մեխանիկան: Մենք արդենգիտենք, որ կայուն մոլեկուլ կարող է առաջանալ, եթե փոխազդող ատոմների համակարգի պոտենցիալ էներգիան նվազի: Էլեկտրոնների վիճակը ատոմում նկարագրելու համար անհրաժեշտ է կազմել Շրյոդինգերի հավասարումը՝ համապատասխան էլեկտրոնների և միջուկների համար և գտնել նրա այն լուծումը, որը համապատասխանում է նվազագույն էներգիային: Բայց, ինչպես արդեն նշել ենք, բազմաէլեկտրոն համակարգերի համար Շրյոդինգերի հավասարումը լուծել չի հաջողվել: Այդ պատճառով մոլեկուլի կառուցվածքի քվանտամեխանիկական նկարագրությունը կատարվում է Շրյոդինգերի հավասարման մոտավոր լուծման եղանակով:
Առաջին անգամ նման մոտավոր հաշվարկ կատարել են Վ.Հեյտլերը և Ֆ.Լոնդոնը, 1927թ-ի ջրածնի մոլեկուլի համար: Այդ աշխատանքը հիմք է դրել քվանտային մեխանիկայի կիրառմանը քիմիական խնդիրների լուծման համար: Այսպես, զարգացել է գիտության նոր ճյուղ՝ քվանտայինքիմիան: Քննարկենք քվանտամեխանիկական հաշվարկների սկզբունքները:
4.1. ՇՐՅՈԴԻՆԳԵՐԻ ՀԱՎԱՍԱՐՄԱՆ ԼՈՒԾՈՒՄԸ ԱԼԻՔԱՅԻՆ ՖՈՒՆԿՑԻԱՅԻ
ՄՈՏԱՎՈՐ ԱՐՏԱՀԱՅՏՈՒԹՅՈՒՆՆԵՐԻ ՕԳՏԱԳՈՐԾՄԱՄԲ
Շրյոդինգերի հավասարումն ունի հետևյալ տեսքը
![]()
Բազմապատկելով (4.1) հավասարման երկու մասերը Ψ-ով և տանելով E-ն ձախ կողմը՝ կստանանք՝
![]()
Այս հավասարման օգնությամբ կարելի է հաշվել համակարգի E էներգիան, եթե հայտնի է Ψ ալիքային ֆունկցիան: Սակայն ինչպես վերը նշեցինք, Ψ-ալիքային ֆունկցիայի ճշգրիտ արժեքը կարելի է որոշել միայն մեկ էլեկտրոնային համակարգերի համար: Այդ պատճառով E հաշվելու համար (4.2) հավասարման համարիչը և հայտարարը ինտեգրում են ըստ ամբողջ տարածության և (4.3) հավասարման լուծման ժամանակ այն օգտագործում են Ψ ֆունկցիայի մոտավոր արտահայտությունը:
![]()
որտեղ՝ dv-ն տարրական ծավալն է
(4.3) արտահայտությունը կարելի է համարել քվանտային քիմիայի հիմնական հավասարումը:
Ψ ֆունկցիայի մոտավոր արժեքը որոշում են վարացիոն մեթոդով, ըստ որի իրական մեծությանը ամենամոտը Ψ այն արժեքն է, որը (4.3) հավասարման միջոցավ տալիս է E-ի ամենափոքր արժեքը; Այս դեպքում Ψ-ն ներկայացվում է գումարի տեսքով:
![]()
որտեղ φ-ն կոորդինատից կախված ֆունկցիա է, C-ն ՝ գործակից:
Ψ-ի արտահայտությունը ընտրում են դիտարկվող համակարգի մասին որևէ դատողության հիման վրա: Օրինակ, ստորև բերված մոլեկուլային օրբիտալների մեթոդում որպես Ψվերցնում են ազատ ատոմի համար էլեկտրոնների ալիքային ֆունկցիան: C գործակիցները պետք է համապատասխանեն E-ի փոքրագույն արժեքին, այսինքն՝ պետք է իրականացվի հետևյալ արտահայտությունը, որը դրված է վարիացիոն մեթոդի հիմքում:
![]()
Այսպիսով գտնում են C գործակցի արժեքը, որը գալիս է (4.4) հավասարմամբ տրված Ψֆունկցիայի լավագույն (իրական արժեքին ամենամոտ) արտահայտությունից:
4.2. ՋՐԱԾՆԻ ՄՈԼԵԿՈՒԼԻ ՔՎԱՆՏԱՄԵԽԱՆԻԿԱԿԱՆ ՆԿԱՐԱԳՐՈՒԹՅՈՒՆԸ ԸՍՏ ՀԵՅՏԼԵՐ-ԼՈՆԴՈՆԻ
Քննարկենք
ջրածնի մոլեկուլի
էներեգիայի (E) կախումը
ատոմների միջև
եղած r հեռավորությունից:
Եթե չգրգռված ջրածնի
ատոմները գտնվում
են իրարից անվերջ
հեռու, ապա նրանք
միմյանց հետ չեն
փոխազդում և էներգիան
0 է: Ատոմների միջև
եղած հեռավորության
փոքրացումից, եթե
ատոմներն ընդունակ
են մոլեկուլ առաջացնելու,
փոխազդում են իրար
հետ, գործում են
ձգողական ուժերը,
և էներգիան նվազում
է: Այդ նվազումը
շարունակում է
մինչև որոշ
![]() հեռավորությունը:
r-ի հետագա նվազումից
էներգիան սկսում
է աճել, որը պայմանավորված
է վանողական ուժերով,
որոնք համեմատաբար
մեծ են ատոմների
փոքր հեռավորության
դեպքում: Այսպիսով,
էներգիայի կախումը
r-ից
գրաֆիկորեն արտահայտվում
է կորով, որն ունի
մինիմում (նկ. 4.1, կոր
1): Եթե ատոմները
ընդունակ չեն մոլեկուլ
առաջացնել, ապա
r-ի
բոլոր արժեքների
դեպքում տեղի ունի
էլեկտրոնային
թաղանթների և միջուկների
վանում: Այս դեպքում
համակարգի էներգիան
r-ի
փոքրացման հետ
անընդհատ աճում
է (նկ.
4.1, կոր 2):
հեռավորությունը:
r-ի հետագա նվազումից
էներգիան սկսում
է աճել, որը պայմանավորված
է վանողական ուժերով,
որոնք համեմատաբար
մեծ են ատոմների
փոքր հեռավորության
դեպքում: Այսպիսով,
էներգիայի կախումը
r-ից
գրաֆիկորեն արտահայտվում
է կորով, որն ունի
մինիմում (նկ. 4.1, կոր
1): Եթե ատոմները
ընդունակ չեն մոլեկուլ
առաջացնել, ապա
r-ի
բոլոր արժեքների
դեպքում տեղի ունի
էլեկտրոնային
թաղանթների և միջուկների
վանում: Այս դեպքում
համակարգի էներգիան
r-ի
փոքրացման հետ
անընդհատ աճում
է (նկ.
4.1, կոր 2):
Այսպիսով,
չգռգրված վիճակում
մոլեկուլն ունի
նվազագույն էներգիա:
Միջուկները կատարում
են տատանումներ
հավասարակշռային
![]() վիճակի
նկատմամբ:
վիճակի
նկատմամբ:
Ջրածնի մոլեկուլում կա երկու էլեկտրոն, որոնք շարժվում են երկու միջուկների դաշտում: Այդ չորս մասնիկների միջև գոյություն ունի վեց փոխազդեցություն:
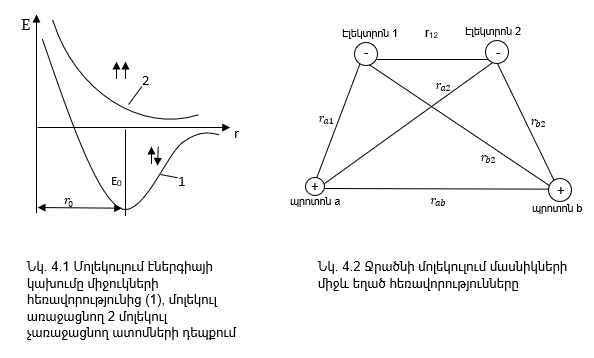
Եթե մասնիկների միջև եղած հեռավորությունը նշենք ինչպես նշված է (նկ. 4.2)-ում, ապա ջրածնի մոլեկուլի պոտենցիալ էներգիան կլինի վեց փոխազդեցությունների գումարը:
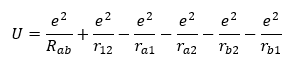
Ալիքային ֆունկցիայի կառուցման համար Հեյտլերը և Լոնդոնը որպես հիմք վերցրել են ջրածնի ատոմի էլեկտրոնի ալիքային ֆունկցիան, որը գտնվում է նորմալ 1s վիճակում: Այդ ալիքային ֆունկցիան որոշվում է հետևյալ արտահայտությամբ
![]()
որտեղ՝ r-ը էլեկտրոնի հեռավորություն է միջուկից,
![]() Բորի
առաջին օրբիտայի
շառավիղը:
Բորի
առաջին օրբիտայի
շառավիղը:
Ակնհայտ է, եթե ատոմները գտնվում են իրարից մեծ հեռավորության վրա, ապա էլեկտրոնների շարժումը զգալի փոփոխության չի ենթարկվի և մոլեկուլի ալիքային ֆունկցիան կարելի է արտահայտել երկու ատոմների ալիքային ֆունկցիաների արտադրյալով.
![]()
(4.7) հավասարման
տեսքով ալիքային
ֆունկցիայի որոշումը
պայմանավորված
է նրանով, որ
![]() ցույց
է տալիս տարրական
ծավալում էլեկտրոնի
գտնվելու հավանականությունը,
իսկ համապատասխան
ծավալում էլեկտրոնների
միաժամանակյա
գտնվելը որոշվում
է հավանականությունների
արտադրյալով (համաձայն
հավանականությունների
տեսության օրենքի,
երկու անկախ իրադարձությունների
միաժամանակյա
իրականացումը
հավասար է նրանց
հավանականությունների
արտադրյալին):
(4.6) հավասարման մեջ
մտնող 2-ը
ցույց
է տալիս տարրական
ծավալում էլեկտրոնի
գտնվելու հավանականությունը,
իսկ համապատասխան
ծավալում էլեկտրոնների
միաժամանակյա
գտնվելը որոշվում
է հավանականությունների
արտադրյալով (համաձայն
հավանականությունների
տեսության օրենքի,
երկու անկախ իրադարձությունների
միաժամանակյա
իրականացումը
հավասար է նրանց
հավանականությունների
արտադրյալին):
(4.6) հավասարման մեջ
մտնող 2-ը ![]() համար
հավասար է
համար
հավասար է ![]() ,
իսկ
,
իսկ ![]() համար
համար
![]() Քանի
որ էլեկտրոնները
բացարձակապես
անտարբերելի են,
ապա կարելի է ընդունել,
որ 1 էլեկտրոնը
շարժվում է b-ի մոտակայքում,
իսկ 2 էլեկտրոնը՝
a-ի:
Այս դեպքում (4.7)հավասարման
նման կարելի է
գրել.
Քանի
որ էլեկտրոնները
բացարձակապես
անտարբերելի են,
ապա կարելի է ընդունել,
որ 1 էլեկտրոնը
շարժվում է b-ի մոտակայքում,
իսկ 2 էլեկտրոնը՝
a-ի:
Այս դեպքում (4.7)հավասարման
նման կարելի է
գրել.
![]()
Էլեկտրոնների անտարբերելիության պատճառով (4.6), (4.7) արտահայտությունները համարժեք են, բայց երկուսն էլ մոլեկուլի իրական ալիքային ֆունկցիայի անհաջող մոտեցումներն են, քանի որ էլեկտրոնի շարժումը մոլեկուլում տարբերվում է, էլեկտրոնի շարժումից ազատ ատոմում:
Հեյտլերը և Լոնդոնը առաջարկել են, որ ջրածնի մոլեկուլի իրական ալիքային ֆունկցիայի լավագույն մոտավորությունը այն արտահայտությունը կլինի, որը հաշվի է առնում էլեկտրոնների շարժման նկարագրությունը երկու հավասարումներում: Նրանց կողմից առաջարկվել է ջրածնի մոլեկուլի էլեկտրոնների ալիքային ֆունկցիա, որը (4.7), (4.8) հավասարումերի գծային կոմբինացիան է:
![]()
(4.9) հավասարման օգնությամբ հաշվել են էլեկտրոնների էներգիան միջուկների միջև տարբեր Rab հեռավորությունների համար:
Վարիացիոն
մեթոդի կիրառումը
տալիս է հետևյալ
արդյունքը՝ մի
դեպքում C1=
C2,
մյուս դեպքում
C1=
- C2:
Այսպիսով, հնարավոր
է ալիքային ֆունկցիայի
երկարժեք![]() (S
և A նշանները նշանակում
են սիմետրիկ և
անտիսիմետրիկ):
(S
և A նշանները նշանակում
են սիմետրիկ և
անտիսիմետրիկ):
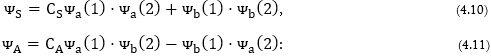
(4.10) հավասարումը
ցույց է տալիս,
որ եթե փոխենք
միջուկների կամ
էլեկտրոնների
տեղը, այսինքն՝
փոփոխեն (1) և (2) ինդեքսների
կամ a-ի և b-ի տեղերը,
ապա ![]() ալիքային
ֆունկցիան մնում
է նույնը: Այդ պատճառով
այն կոչվում է
սիմետրիկ ֆունկցիա
միջուկների կամ
էլեկտրոնների
նկատմամբ: Ընդհակառակը,
նման փոփոխություն
կատարելիս փոխվում
է
ալիքային
ֆունկցիան մնում
է նույնը: Այդ պատճառով
այն կոչվում է
սիմետրիկ ֆունկցիա
միջուկների կամ
էլեկտրոնների
նկատմամբ: Ընդհակառակը,
նման փոփոխություն
կատարելիս փոխվում
է ![]() ֆունկցիայի
նշանը, և այդ պատճառով
կոչվում է անտիսիմետրիկ:
Որպեսզի հասկանանք
սիմետրիկ և անտիսիմետրիկ
ֆունկցիաների
ֆիզիկական իմաստը,
հիշենք Պաուլիի
սկզբունքը: Ըստ
այդ սկզբունքի
ատոմային կամ մոլեկուլային
համակարգում չի
կարող լինել երկու
էլեկտրոն նույն
չորս քվանտային
թվերով: Քվանտային
թվերը որոշում
են ալիքային ֆունկցիայի
տեսքը: Այսպիսով
միևնույն համակարգում
Պաուլիի սկզբունքի
համաձայն չի կարող
լինել երկու էլեկտրոն
նույն վիճակում,
քանի որ սիմետրիկ
ֆունկցիան չի փոխվում
էլեկտրոններ վերադասելուց
հետո, կարող է թվալ,
թե այդ էլեկտրոնները
գտնվում են միևնույն
վիճակում, որը
հակասում է Պաուլիի
սկզբունքին: Սակայն
Շրյոդինգերի հավասարման
լուծումից ստացված
ջրածնի ատոմի ալիօքային
ֆունկցիան (4.1) հաշվի
չի առնում էլեկտրոնի
սպինը: Որպեսզի
մոլեկուլում սիմետրիկ
Ψ
ֆունկցիայով
նկարագրվող էլեկտրոնները
տարբերվեն իրարից
վիճակակով, դրանք
պետք է ունենան
տարբեր սպինային
քվանտային թվեր,
այսինքն՝ այդ էլեկտրոնները
պետք է ունենան
հակառակ ուղղվածև
հակազուգահեռ
սպիներ: Ընդհակառակը՝
անտիսիմետրիկ
ֆունկցիան համապատասխանում
է այնպիսի վիճակ,
երբ էլեկտրոններն
ունեն նույն ուղղությամբ
ուղղված կամ զուգահեռ
սպիներ: Հեյտլերի
և Լոնդոնի հաշվարկը
քիմիական կապին
վեց քանակական
բացատրություն,
քվանտային մեխանիկայի
հիման վրա: Այն
ցույց տվեց, որ
եթե ջրածնի ատոմների
էլեկտրոններն
ունեն հակառակ
ուղղված սպիներ,
ապա, ատոմները
իրար մոտենալիս,
տեղի է ունենում
էներգիայի զգալի
նվազում՝ առաջանում
է քիմիական կապ:
Քիմիական կապի
առաջացումը պայմանավորված
է նրանով, որ եթե
էլեկտրոններն
ունեն հակազուգահեռ
սպիներ, հնարավոր
է դառնում էլեկտրոնների
շարժումը երկու
միջուկների մոտ:
Դա բերում է էլեկտրոնային
ամպի զգալի խտություն
երկու ատոմների
միջև ընկած տարածությունում,
դեպի որը ձգվում
են դրական լիցքավորված
միջուկները: Ձգումը
փոքրացնում է էլեկտրոնների
պոտենցիալ էներգիան,
հետևաբար նաև համակարգի
պոտենցիալ էներգիան՝
առաջանում է քիմիական
կապ: Հետևաբար
քիմիական կապի
առաջացումը բացատրվում
է էլեկտրոնների
պոտենցիալ էներգիայի
նվազումով՝ պայմանավորված
միջուկների միջև
եղած տարածությունում
էլեկտրոնային
ամպի խտության
մեծացմամբ:
ֆունկցիայի
նշանը, և այդ պատճառով
կոչվում է անտիսիմետրիկ:
Որպեսզի հասկանանք
սիմետրիկ և անտիսիմետրիկ
ֆունկցիաների
ֆիզիկական իմաստը,
հիշենք Պաուլիի
սկզբունքը: Ըստ
այդ սկզբունքի
ատոմային կամ մոլեկուլային
համակարգում չի
կարող լինել երկու
էլեկտրոն նույն
չորս քվանտային
թվերով: Քվանտային
թվերը որոշում
են ալիքային ֆունկցիայի
տեսքը: Այսպիսով
միևնույն համակարգում
Պաուլիի սկզբունքի
համաձայն չի կարող
լինել երկու էլեկտրոն
նույն վիճակում,
քանի որ սիմետրիկ
ֆունկցիան չի փոխվում
էլեկտրոններ վերադասելուց
հետո, կարող է թվալ,
թե այդ էլեկտրոնները
գտնվում են միևնույն
վիճակում, որը
հակասում է Պաուլիի
սկզբունքին: Սակայն
Շրյոդինգերի հավասարման
լուծումից ստացված
ջրածնի ատոմի ալիօքային
ֆունկցիան (4.1) հաշվի
չի առնում էլեկտրոնի
սպինը: Որպեսզի
մոլեկուլում սիմետրիկ
Ψ
ֆունկցիայով
նկարագրվող էլեկտրոնները
տարբերվեն իրարից
վիճակակով, դրանք
պետք է ունենան
տարբեր սպինային
քվանտային թվեր,
այսինքն՝ այդ էլեկտրոնները
պետք է ունենան
հակառակ ուղղվածև
հակազուգահեռ
սպիներ: Ընդհակառակը՝
անտիսիմետրիկ
ֆունկցիան համապատասխանում
է այնպիսի վիճակ,
երբ էլեկտրոններն
ունեն նույն ուղղությամբ
ուղղված կամ զուգահեռ
սպիներ: Հեյտլերի
և Լոնդոնի հաշվարկը
քիմիական կապին
վեց քանակական
բացատրություն,
քվանտային մեխանիկայի
հիման վրա: Այն
ցույց տվեց, որ
եթե ջրածնի ատոմների
էլեկտրոններն
ունեն հակառակ
ուղղված սպիներ,
ապա, ատոմները
իրար մոտենալիս,
տեղի է ունենում
էներգիայի զգալի
նվազում՝ առաջանում
է քիմիական կապ:
Քիմիական կապի
առաջացումը պայմանավորված
է նրանով, որ եթե
էլեկտրոններն
ունեն հակազուգահեռ
սպիներ, հնարավոր
է դառնում էլեկտրոնների
շարժումը երկու
միջուկների մոտ:
Դա բերում է էլեկտրոնային
ամպի զգալի խտություն
երկու ատոմների
միջև ընկած տարածությունում,
դեպի որը ձգվում
են դրական լիցքավորված
միջուկները: Ձգումը
փոքրացնում է էլեկտրոնների
պոտենցիալ էներգիան,
հետևաբար նաև համակարգի
պոտենցիալ էներգիան՝
առաջանում է քիմիական
կապ: Հետևաբար
քիմիական կապի
առաջացումը բացատրվում
է էլեկտրոնների
պոտենցիալ էներգիայի
նվազումով՝ պայմանավորված
միջուկների միջև
եղած տարածությունում
էլեկտրոնային
ամպի խտության
մեծացմամբ:

Նկ. 4.3-ում ցույց
է տրված էլեկտրոնային
ամպերի խտության
բաշխումը համակարգում,
կազմված երկու
միջուկից և երկու
էլեկտրոններից,
քանի որ էլեկտրոնների
հակառակ սպիների
դեպքում ալիքային
ֆունկցիաները
գումարվում են,
ապա միջուկների
միջև էլեկտրոնային
ամպի խտությունը
մեծանում է, այդ
դեպքում ասում
են, որ էլեկտրոնային
ամպերը փոխծածկվում
են: Այն չի կարելի
դիտել որպես ատոմների
էլեկտրոնային
ամպերի պարզ գումար:
![]() մեծությամբ
որոշվող էլեկտրոնային
խտությունը միջուկների
միջև կլինի ավելի
մեծ, քան առանձին
մեկուսացված ատոմների
խտությունների
գումարը միջուկից,
նույն հեռավորության
վրա: Քիմիական
կապի առաջացման
ժամանակ էլեկտրոնային
ամպերը կարծես
թե ձգվում են դեմ
հանդիման:
մեծությամբ
որոշվող էլեկտրոնային
խտությունը միջուկների
միջև կլինի ավելի
մեծ, քան առանձին
մեկուսացված ատոմների
խտությունների
գումարը միջուկից,
նույն հեռավորության
վրա: Քիմիական
կապի առաջացման
ժամանակ էլեկտրոնային
ամպերը կարծես
թե ձգվում են դեմ
հանդիման:
Ընդհակառակը՝ զուգահեռ սպիներով էլեկտրոնների դեպքում, ատոմների միջև ամպի խտությունը նվազում է մինչև զրո՝ էլեկտրոնները վանվում են միջուկների միջև եղած տարածությունից, և քիմիակն կապ չի առաջանում:
Հեյտլերը և Լոնդոնը կատարել են նաև քվանտամեխանիկական հաշվարկ, ջրածնի մոլեկուլի և ջրածնի երրորդ ատոմի փոխազդեցության էներգիայի: Հաշվարկը ցույց է տվել, որ երրորդ ատոմը չի ձգվում, այսինքն՝ H3 մոլեկուլ գոյություն չունի: Այսպես տրվել է կովալենտ կապի կարևորագույն հատկության՝ հագենալիության տեսական հիմնավորումը:
4.3. ՎԱԼԵՆՏԱԿԱՆ ԿԱՊԵՐԻ ՄԵԹՈԴԸ
Ջրածնի մոլեկուլի համար ստացված արդյունքն ընդհանրացվել է բոլոր մոլեկուլների համար և ստեղծվել վալենտական կապերի մեթոդը, ըստ որի քիմիական կապն առաջանում է այն դեպքում, երբ փոխազդում են երկու ատոմներ, որոնք ունեն չզույգված էլեկտրոններ: Եթե ատոմն ունի n հատ չզույգված էլեկտրոններ, ապա կարող է առաջացնել n հատ քիմիական կապ այլ ատոմների հետ, որոնք ունեն մեկական չզույգված էլեկտրոն:
Ըստ Հեյտլերի և Լոնդոնի, տարրի վալենտականությունը հավասար է ատոմի չզույգված էլեկտրոնների թվին հիմնական կամ գրգռված վիճակում: Օրինակ, ածխածնի ատոմը հիմնական վիճակում ունի երկու չզույգված էլեկտրոն, և նրա վալենտականությունը հավասար է երկուսի: Մինչդեռ հայտնի է, որ ածխածինը հիմնականում ցուցաբերում է չորսին հավասար վալենտականություն (CH4 , CO2): Պարզվում է, որ դա հնարավոր է: Եթե ծախսվի որոշ էներգիա 2s էլեկտրոններից մեկը կանցնի 2p վիճակին, որի հետևանքով ատոմի կանցնի գրգռված վիճակի:
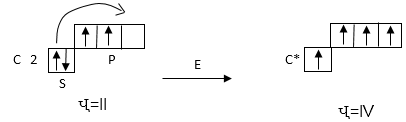
Այսպիսով, ածխածնի ատոմը արտաքին էլեկտրոնային շերտում կլինի չորս չզույգված էլեկտրոն, հետևաբար այն կարող է առաջացնել չորս կովալենտ կապ: Կապ առաջանալիս անջատվում է ավելի շատ էներգիա, քան կլանվել է գրգռված վիճակի անցնելիս:
Անհրաժեշտ է նշել, որ էլեկտրոնի անցումը մի մակարդակից մյուսը (օրինակ՝ n=3-ից n=4) գործնականորեն անհնարին է, որովհետև գրգռման համր ծախսված էներգիան չի կոմպենսացվում կովալենտ կապի առաջացման ժամանակ անջատված էներգիայով: Այդ պատճառով թթվածնի ատոմը կարող է առաջացնել ոչ ավելի քան երկու կովալենտ կապ, իսկ ֆտորի ատոմը՝ միայն մեկ, որովհետև երկրորդ մակարդակում այն չունի դատարկ d օրբիտալ: Իսկապես թթվածնի համար բնորոշ է երկու վալենտականությունը, ֆտորի համար՝ մեկը:
Երրորդ և հաջորդ պարբերության տարրերի ատոմները արտաքին էլեկտրոնային թաղանթում ունեն d-ենթամակարդակ, որի վրա կարող են անցնել գրգռման ժամանակ արտաքին թաղանթի s և p էլեկտրոնները: Այդ պատճառով նրանք կարող են ցուցաբերել լրացուցիչ վալենտականություններ: Քլորի ատոմը արտաքին թաղանթում ունի մեկ չզույգված էլեկտրոն, որոշ էներգիայի ծախսումով այն կարող է անցնել գրգռված վիճակի (Cl*), որը բնորոշվում է երեք, հինգ, յոթ չզույգված էլեկտրոնով: Ուստի ցուցաբերում է մեկ, երեք, հինգ, յոթ վալենտականություն:
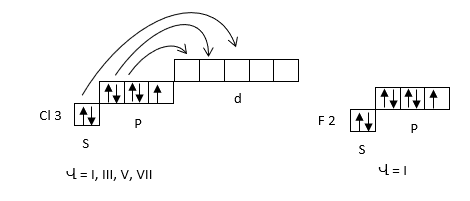
Վալենտական կապերի մեթոդի սկզբունքներն են.
1. Կովալենտ կապ առաջանում է փոխազդող ատոմների հակառակ սպիներ ունեցող չզույգված էլեկտրոնների էլեկտրոնային ամպերի փոխծածկման շնորհիվ:
2. Կապն այնքան ամուր է, որքան մեծ է փոխծածկումը:
3. Ամպերը մոտենում և փոխծածկվում են այնպես, որ այն լինի առավելագույնը:
Ջրածնի ատոմենրի
միջուկների միջև
եղած ![]() հեռավորությունը՝
կապի երկարությունը
կազմում է 74 նմ, որը
ամպերի փոխծածկման
հետևանքով ավելի
փոքր է քան
հեռավորությունը՝
կապի երկարությունը
կազմում է 74 նմ, որը
ամպերի փոխծածկման
հետևանքով ավելի
փոքր է քան![]() Կապի երկարության
կեսը՝ ջրածնի դեպքում
0,37 նմ կոչվում է ատոմի
կովալենտային
շառավիղ:
Կապի երկարության
կեսը՝ ջրածնի դեպքում
0,37 նմ կոչվում է ատոմի
կովալենտային
շառավիղ:
Վալենտական կապերի առաջացումը, կարելի է արտահայտել հետևյալ կերպ՝ ամպերի փոխծածկումով,
![]()
կամ վալենտային սխեմանի միջոցով, որտեղ զիգզագ գիծը ցույց է տալիս փոխծածկումը:
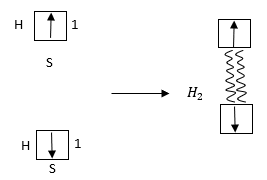
4.4. ԿՈՎԱԼԵՆՏ ԿԱՊԻ ՈՒՂՂՎԱԾՈՒԹՅՈՒՆԸ
Կովալենտ կապի ուղղվածության քվանտամեխանիկական բացատրությունը հիմնված է այն բանի վրա, որ ատոմների էլեկտրոնային օրբիտալներն ունեն տարբեր ձևեր: Քննարկենք H2O և NH3 մոլեկուլների կառուցվածքը:
H2O-իմոլեկուլը առաջանում է թթվածնի մեկ և ջրածնի երկու ատոմներից: Թթվածնի ատոմն ունի 2p-էլեկտրոններ, որոնք զբաղեցնում են երկու օրբիտալներ՝ դասավորված միմյանց նկատմամբ 90° անկյան տակ: Ջրածնի ատոմներն ունեն մեկական 1s-էլեկտրոններ:
Նկ. 4.4-ում պատկերված է ջրածնի ատոմների 1s-էլեկտրոնային ամպերի փոխծածկում թթվածնի ատոմի 2p-էլեկտրոնային ամպերի հետ:
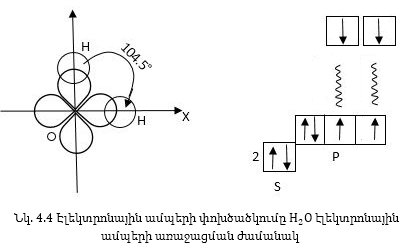
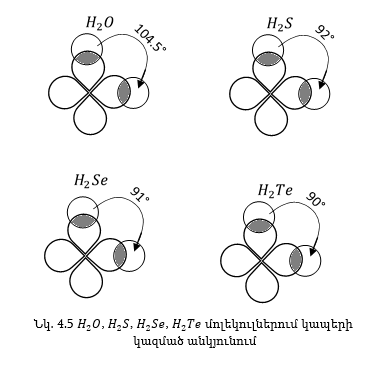
O-H կապերի միջև անկյունը պետք է մոտ լինի p-ամպերի կազմած անկյանը, այսինքն՝ 90°-ին, իրականում H2O մոլեկուլում կապերի միջև կազմված անկյունը հավասար է 104,5° և տարբերվում է 90°-ից, դա կարելի է բացատրեկ հետևյալ պատճառով:
O-Hկապը կովալենտ բևեռային կապ է, էլեկտրոնները խիստ տեղաշարժված են թթվածնի ատոմի կողմը, որովհետև թթվածնի ատոմը ավելի էլեկտրաբացասական է ան ջրածինը, որի արդյունքւմ ջրածնի ատոմում երևան է գալիս որոշ դրական լիցք, այդ լիցքերի վանումից կապերի անկյունը մեծանում է: Նշված գործոնը կլինի ավելի փոքր, H2S, H2Se, H2Te մոլեկուլներում, որովհետև կապի երկարությունը աճում է վանողական ուժերը թուլանում են,և անկյունը ձգտում է 90°-ի:
Նույն կերպ կարելի է գտնել ամոնիակի մոլեկուլի կառուցվածքը: Ազոտի ատոմն ունի երեք չզույգված p-էլեկտրոն, որոնց օրբիտալները դասավորված են իրար նկատմամբ ուղղահայաց: Ակնհայտ է, որ N-H կապերը պետք է դասավորվեն 90°-ի մոտ անկյան տակ:
Իրականում NH3-ի մոլեկուլում փորձարարական եղանակով չափված կապերի միջև եղած անկյունը հավասար է 107,3°: Պատճառը նույնն է, ինչ H2O -ի դեպքում:
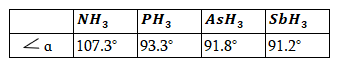
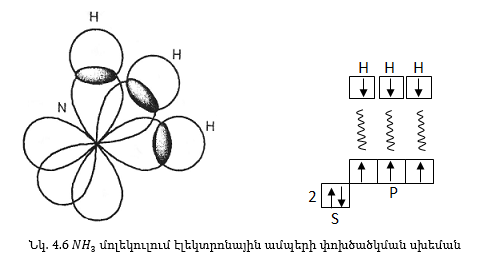
Շարադրվածից բխում է հետևյալ եզրակացությունը: Եթե հաշվի չառնենք երկրորդական գործոնների ազդեցությունը, ապա p-օրբիտալներից առաջացած կապերը դասավորվում են միմյանց նկատմամբ 90° անկյան տակ: H2O-ի (μ=1.84D) և NH3-ի (μ=1.84D) զգալի բևեռացվելիությունը պայմանավորված է նրանով, որ H2O-ի մոլեկուլը ունիանկյունայինկառուցվածք,իսկ NH3-ի մոլեկուլը՝ եռանիստ բուրգի կառուցվածք:
4.5. ՄԻԱԿԻ, ԿՐԿՆԱԿԻ, ԵՌԱԿԻ ԿԱՊԵՐ
Քննարկենք ազոտի մոլեկուլի կառուցվածքը. ազոտի ատոմն ունի 1s22s22p3, կոնֆիգուրացիան ունի երեք չզույգված էլեկտրոն, երեք p-օրբիտալներում, որոնք դասավորված են փոխուղղահայաց x, y, z առանցքների ուղղությամբ: Երբ երկու ատոմները մոտենում են իրար x առանցքի ուղղությամբ, ապա բավարար մոտեցման դեպքում 2Px օրբիտալները փոխծածկվում են առաջացնելով ընդհանուր էլեկտրոնային ամպ, դասավորված x առանցքի ուղղությամբ, որը և միացնում է միջուկները (նկ. 4.7): Տեսնենք, թե ինչ է կատարվում ազոտի ատոմի մնացած չզույգված էլեկտրոնների հետ երկու 2Pz և 2Py ամպերը նույնպես փոխծածկվում են, սակայն այլ կերպ: Այս դեպքում փոխծածկումը տեղի ունի միջուկներին միացնող գծի երկու կողմերում:
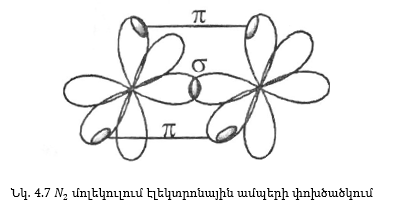
Այն կապը, որի դեպքում էլեկտրոնային ամպերի առավելագույն ծածկումը տեղի ունի միջուկները միացնող գծի ուղղությամբ, կոչվում է σ-կապ:
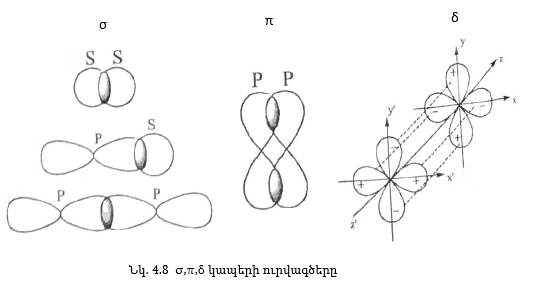
π կապ առաջանում է այն դեպքում, երբ էլեկտրոնային ամպերին փոխծածկումը տեղի է ունենում միջուկները միացնող գծի երկու կողմերում, δ կապի դեպքում՝ չորս կողմերում: Նկ. 4.8-ում բերված են σ, π, δ կապերի ուրվագծերը: Նույնպիսի օրբիտալների փոխծածկման դեպքում σ կապն ունի ավելի մեծ էներգիա, քանի π կապը:
Օրինակ 4.5.1
Քանի σ և π կապերը կան C3H6,CH3 OOH, N2 մոլեկուլներում:
Լուծում. Մոլեկուլների կառուցվածքն է՝
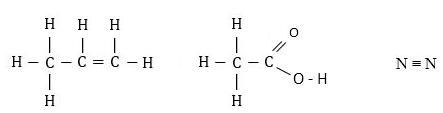
Բոլոր միակի կապերը σկապ են, իսկ կրկնակի և եռակի կապերից մեկը σ է, մյուսները՝ π: Հետևաբար C3H6 մոլեկուլում կա 8π և 1π: CH3OOH-ում 7σ և 1: N2-ում՝ 1σ և 2π կապեր:
4.6. ԷԼԵԿՏՐՈՆԱՅԻՆ ԱՄՊԵՐԻ ՀԻԲՐԻԴԱՑՈՒՄ
(ԽԱՉԱՍԵՐՈՒՄ)
Որոշ դեպքերում վալենտական կապի մեթոդը չի կարողանում բացատրել մոլեկուլի տարածական կառուցվածքը: Քննարկենք BeCl2 մոլեկուլի կառուցվածք: Be-ի ատոմը գրգռված վիճակում ունի մեկ հատ 2s և մեկ հատ 2p էլեկտրոն: Կարելի է կարծել, թե Be-ի 2p օրբիտալը փոխծածկվում է Cl-ի -օրբիտալի հետ՝ առաջացնելով σ կապ, իսկ քլորի մյուս ատոմը Be-ի 2s ամպի հետ կարող է փոխծածկվել ցանկացած անկյան տակ: Առաջացած երկու կապերի էներգիաները պետք է տարբեր լինեն, քանի որ p էլեկտրոնների փոխծածկումը ավելի մեծ չափով կկատարվի, քան s և p էլեկտրոններինը: Մինչդեռ իրականում առաջացած երկու կապերի էներգիաները հավասար են: Ստացվում է հակասություն, հաղթահարման համար Սլեյտեր ու Պոլինգը առաջարկեցին հիբրիդացման գաղափարը: Երկու և ավելի էներգետիկ և տարածական տեսակետից անհավասարազոր ատոմական օրբիտալների փոխազդեցությունից առաջանում են էներգետիկ և տարածական տեսակետից հավասարազոր հիբրիդային ատոմական օրբիտալներ: Հիբրիդացման գաղափարի անհրաժեշտությունը առաջանում է ամեն անգամ, երբ մի քանի կապեր առաջանում են այնպիսի էլեկտրոնների կողմից, որոնք ատոմում պատկանում են տարբեր թաղանթների և որոնք քիչ են տարբերվում էներգիայով (սովորաբար միևնույն մակարդակի տարբեր ենթամակարդակները):
Քննարկենք s և p օրբիտալների տարբեր հիբրիդացումը.
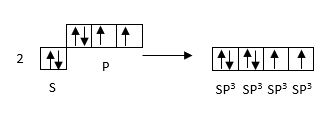
1. sp-հիբրիդացում, BeCl2 -ի մոլեկուլի օրինակով,
ա) էներգետիկ հավասարազորություն
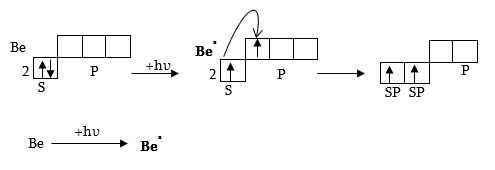
բ) տարածական հավասարազորություն

BeCl2-ի մոլեկուլն ունի գծային կառուցվածք:
2. sp2-հիբրիդացում, BeCl3-ի օրինակով,
ա) էներգետիկ հավասարազորություն
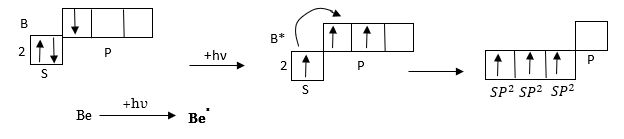
բ) տարածական հավասարազորություն
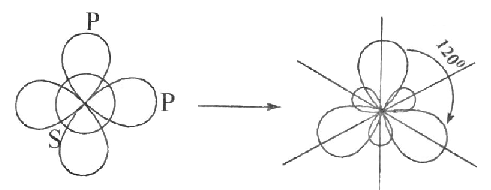
հետևաբար BeCl3 -ի կառուցվածք կլինի.

3. sp3 -հիբրիդացում, CH4 -ի օրինակով,
ա) էներգետիկ հավասարազորություն
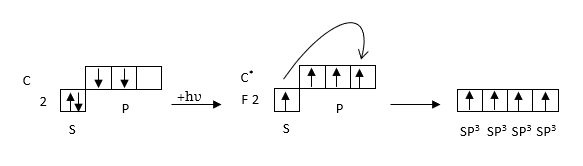
բ) տարածական հավասարազորություն
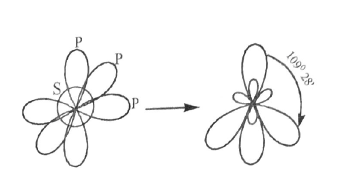
հետևաբար CH4 -ի կառուցվածք կլինի.
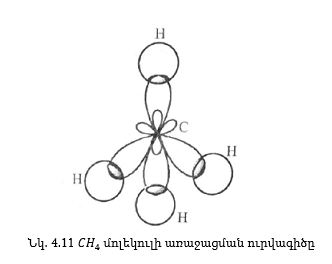
Հիբրիդային օրբիտալների առաջացումով կարելի է բացատրել H2O-ի կառուցվածք: H2O-ի դեպքում ունենք
1) էներգետիկ հավասարազորություն
Ինչպես երևում է գծագրից, թթվածնի ատոմում առաջանում են չորս sp3 հիբրիդային օրբիտալներ, որոնցից երկու օրբիտալներում կան չզույգված էլեկտրոնները, որոնք կարող են առաջացնել կապեր, իսկ մյուս երկուսում զույգված և կապ չեն կարող առաջացնել:

Այդ կապերի միջև անկյունը պետք է լինի 109° 28՛: Այդ արժեքը ավելի մոտ է փորձարարական արժեքին (104,5°) քան 90° -ը, որը պետք է լինի առանց հիբրիդացման:
4.7. ՄՈԼԵԿՈՒԼԻ ԴԻՊՈԼԱՅԻՆ ՄՈՄԵՆՏԸ
Եթե մոլեկուլում պարունակող կապերը բևեռային են, ապա դա դեռ չի նշանակում, որ մոլեկուլը ևս պետք է լինի բևեռային: Եթե յուրաքանչյուր կապի դիպոլային մոմենտը դիտենք որպես վեկտոր, ապա մոլեկուլի գումարային դիպոլային մոմենտը հավասար կլինի առանձին կապերի դիպոլային մոմենտների վեկտորական գումարին: Եթե մոլեկուլը երկատոմանի է AB տիպի և կապերը բևեռացված են, ապա մոլեկուլը ևս կլինի բևեռացված (նկ.4, 13ա):
Այդպիսին է, օրինակ. H→Cl մոլեկուլը: Եթե մոլեկուլը AB2 և AB3 տիպի է, ապա նրա բևեռացվածությունը կախված է կապերի երկրաչափական դասավորությունից, իսկ վերջինս հիբրիդացման տեսակից: ԵթեAB2 տիպի մոլեկուլներում A-ի ատոմը ունի spհիբրիդացում կապերը գծային դասավորություն ունեն 180˚-ի տակ (նկ.4.13, բ-1):
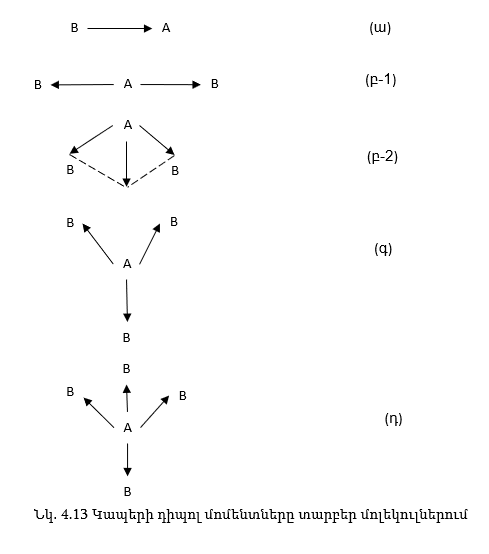
Հետևաբար A-B կապի դիպոլային մոմենտները հավասար են, բայց ուղղությամբ հակառակ, ուստի և մոլեկուլի դիպոլային մոմենտը կլինի զրո, մոլեկուլը կլինի ոչ բևեռային: Այսպիսին օրինակ են CO2, BeCl2-ը, AB2 տիպի մոլեկուլներում, եթե A-ի ատոմում կա sp2 կամ sp3 հիբրիդացում, ապա A-B կապերը կունենան անկյունային դասավորություն (նկ.4.13, բ-2) և երկու կապերի վեկտորային գումարը մեծ կլինի զրոյից, մոլեկուլը կլինի բևեռային: Այդպիսին է օրինակ H2O-ի մոլեկուլը: AB3 տիպի մոլեկուլները, եթե A-ն ունի sp2 հիբրիդացում, ապա չնայած կապերը բևեռացված են, մոլեկուլը կլինի չբևեռացված (նկ. 4.13, գ), օրինակ BH3 մոլեկուլը, իսկ եթե A-ն ունի sp3 հիբրիդացում, ապա մոլեկուլը կլինի բևեռացված՝ օրինակ NH3-ը: AB4 տիպի մոլեկուլները (նկ.4, 13դ), որտեղ A-ն ունի sp3 հիբրիդացում, մոլեկուլը կլինի չբևեռացված կապերի սիմետրիկ դասավորության պատճառով, օրինակ՝ CH4-ը:
4.8. ՄՈԼԵԿՈՒԼԱՅԻՆ ՕՐԲԻՏԱԼՆԵՐԻ ՄԵԹՈԴԸ
Վալենտական կապերի մեթոդը հնարավորություն է տալիս հասկանալ ատոմի որոշակի թվով կովալենտ կապեր առաջացնելու հատկությունը բացատրում է կովալենտ կապի ուղղվածությունը, տալիս է բազմաթիվ մոլեկուլների կառուցվածքը: Սակայն, կան դեպքեր, երբ այս մեթոդը չի կարողանում բացատրել կապի առաջացումը կամ դրա բացատրությունից բխող հատկությունները չեն համապատասխանում մոլեկուլի իրական հատկությունների հետ: Օրինակ՝ գոյություն ունի H+2 մոլեկուլային իոն, որտեղ կապ առաջացել է մեկ էլեկտրոնով, որը վալենտային կապերի մեթոդը բացատրել չի կարող: Վալենտական կապերի մեթոդով O2-ի առաջացումը կատվում է որպես երկու ընդհանուր էլեկտրոնային զույգերի առաջացման արդյունք:
Ինչպես երևում է գծագրից, O2 մոլեկուլը, ըստ վալենտային կապերի մեթոդի չզույգված էլեկտրոն չունի և պետք է լինի դիամագնիս:
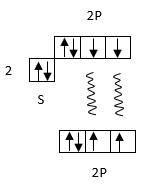
Սակայն O2 մագնիսական հատկություններն ուսումնասիրելիս պարզվել է, որ նա ունի պարամագնիսական հատկություն, հետևբար և չզույգված էլեկտրոններ:
Այս փաստերը բավարար չափով բացատրում է Մալիկենի կողմից առաջադրված մոլեկուլային օրբիտալների մեթոդը (ՄՕ մեթոդ): Վալենտական կապերի մեթոդում ենթադրվում է, որ կապ առաջացնելիս ատոմական օրբիտալները փոխծածկվում և քիչ փոփոխության են ենթարկվում:
Մոլեկուլային օրբիտալների մեթոդում ենթադրվում է, որ ատոմները կորցնում են իրենց ինքնուրույնությունը, ատոմային օրբիտալներից գոյանում են մոլեկուլային օրբիտալներ: Մոլեկուլային օրբիտալներն ատոմական օրբիտալների նման բնութագրվում են իրենց քվանտային թվերով, ունեն մակարդակներ, ենթամակարդակներ, ամպի ձև և այլն:
Ատոմական օրբիտալների գծային կոմբինացիան ՄՕ: Մեթոդի գլխավոր խնդիրը մոլեկուլի օրբիտալի ալիքային ֆունկցիայի շառավղային բաշխումը գտնելն է: Ներկայումս լայնորեն օգտագործվում է այն եղանակը, որի դեպքում մոլեկուլային միէլեկտրոն ալիքային ֆունկցիան վերցվում է որպես մոլեկուլը կազմող ատոմների ատոմական օրբիտալների ալիքային ֆունկցիայի գծային կոմբինացիան: Այդ տարբերակը կրճատ նշանակվում է “ՄՕԱՕԳԿ” (ատոմական օրբիտալների գծային կամբինացիա) բառերի առաջին տառերը:
Ենթադրենք
մոլեկուլի մեջ
մտնող ատոմների
էլեկտրոնային
օրբիտալները բնորոշվում
են ![]() և այլ ալիքային
ֆունկցիաներով:
Մեկ
էլեկտրոն ալիքային
ֆունկցիան մոլեկուլում
կարող է ներկայացվել
այսպես.
և այլ ալիքային
ֆունկցիաներով:
Մեկ
էլեկտրոն ալիքային
ֆունկցիան մոլեկուլում
կարող է ներկայացվել
այսպես.
![]()
որտեղ՝![]() թվային գործակիցներ
են:
թվային գործակիցներ
են:
Այսպիսով, յուրաքանչյուր էլեկտրոն գտնվում է որոշակի մոլեկուլային օրբիտալում, որը նկարագրվում է համապատասխան ալիքային ֆունկցիայով: Յուրաքանչյուր օրբիտալին համապատասխանում է որոշակի էներգիա: Մի օրբիտալում կարող են գտնվել երկու էլեկտրոն հակառակ սպիներով:
Երկու
միանման ատոմների
մոլեկուլային
օրբիտալները:
Քննարկենք, թե
ինչ մոլեկուլային
ալիքայինΨ ֆունկցիա կառաջանա
երկու միանման
ատոմների 1s օրբիտալների
ալիքային ֆունկցիայի
փոխազդեցությունից:
Դրա համար գտնենք
![]() գումարը:
Տվյալ դեպքում
դիտարկվող երկու
ատոմներն էլ միանման
են, այնպես որ C1,
C2գործակիցները
իրար հավասար են
(C1= C2 = C) և խնդիրը
հանգում է C (Ψ1+Ψ2)
գումարի որոշմանը:
Քանի որ C գործակիցը
չի ազդում մոլեկուլային
ալիքային ֆունկցիայի
տեսքի վրա, այլ
միայն փոխվում
է նրա բացարձակ
արժեքը, ապա մենք
կսահմանապակվենք
(Ψ1+Ψ2)
գումարի որոշմամբ
(Ψ
= Ψ1+Ψ2): Այդ
նպատկով տեղադրենք
փոխազդող ատոմների
միջուկները միմյանցից
այնպիսի (r) հեռավորության
վրա, որը համապատասխանում
է մոլեկուլում
նրանց հեռավորությանը:
Գծենք այդ ատոմների
1s օրբիտալների
ալիքային ֆունկցիաները
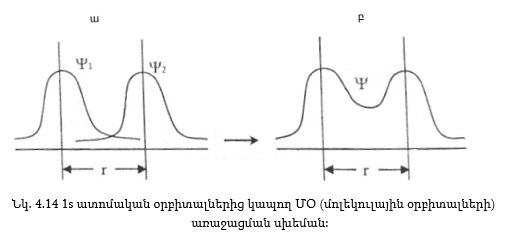
(նկ. 4.14), որոնցից յուրաքանչյուրը
ունի (նկ. 4.14, ա)-ում
բերված տեսքը:
Մոլեկուլային
ալիքային ֆունկցիան
գտնելու համար,
անհրաժեշտ է գումարել
Ψ1 և
Ψ2 մեծությունները,
որի արդյունքում,
կսատացվի (նկ.
4.14, բ)-ում բերված
կորը: Ինչպես երևում
է, միջուկների
միջև ընկած տարածությունում
Ψ
մոլեկուլային
ալիքային ֆունկցիան
քան ատոմական ալիքային
ֆունկցիաներից
ավելի մեծ է: Քանի
որ ալիքային ֆունկցիայի
քառակուսին բնորոշում
է էլեկտրենի գտնվելու
հավանականությունը
այդ մասում, այսինքն՝
էլեկտրոնային
ամպի խտությունը,
հետևաբար Ψ ֆունկցիայի
մեծացումը Ψ1 և
Ψ2 ալիքային
ֆունկցիաների
համեմատ, նշանակում
է որ ՄՕ-ի առաջացման
ժամանակ էլեկտրոնային
ամպի խտությունը
միջուկների միջև
եղած տարածության
աճում է:
գումարը:
Տվյալ դեպքում
դիտարկվող երկու
ատոմներն էլ միանման
են, այնպես որ C1,
C2գործակիցները
իրար հավասար են
(C1= C2 = C) և խնդիրը
հանգում է C (Ψ1+Ψ2)
գումարի որոշմանը:
Քանի որ C գործակիցը
չի ազդում մոլեկուլային
ալիքային ֆունկցիայի
տեսքի վրա, այլ
միայն փոխվում
է նրա բացարձակ
արժեքը, ապա մենք
կսահմանապակվենք
(Ψ1+Ψ2)
գումարի որոշմամբ
(Ψ
= Ψ1+Ψ2): Այդ
նպատկով տեղադրենք
փոխազդող ատոմների
միջուկները միմյանցից
այնպիսի (r) հեռավորության
վրա, որը համապատասխանում
է մոլեկուլում
նրանց հեռավորությանը:
Գծենք այդ ատոմների
1s օրբիտալների
ալիքային ֆունկցիաները
(նկ. 4.14), որոնցից յուրաքանչյուրը
ունի (նկ. 4.14, ա)-ում
բերված տեսքը:
Մոլեկուլային
ալիքային ֆունկցիան
գտնելու համար,
անհրաժեշտ է գումարել
Ψ1 և
Ψ2 մեծությունները,
որի արդյունքում,
կսատացվի (նկ.
4.14, բ)-ում բերված
կորը: Ինչպես երևում
է, միջուկների
միջև ընկած տարածությունում
Ψ
մոլեկուլային
ալիքային ֆունկցիան
քան ատոմական ալիքային
ֆունկցիաներից
ավելի մեծ է: Քանի
որ ալիքային ֆունկցիայի
քառակուսին բնորոշում
է էլեկտրենի գտնվելու
հավանականությունը
այդ մասում, այսինքն՝
էլեկտրոնային
ամպի խտությունը,
հետևաբար Ψ ֆունկցիայի
մեծացումը Ψ1 և
Ψ2 ալիքային
ֆունկցիաների
համեմատ, նշանակում
է որ ՄՕ-ի առաջացման
ժամանակ էլեկտրոնային
ամպի խտությունը
միջուկների միջև
եղած տարածության
աճում է:
Արդյունքում
առաջանում է ձգողական
ուժ միջուկների
և այդ մասի միջև,
այսինքն՝ առաջանում
է քիմիական կապ:
Այս ձևով ստացված
մոլեկուլային
օրբիտալը կոչվում
է կապող ՄՕ: Էլեկտրոնային
ամպի մեծ խտությունը
գտնվում է միջուկները
միացնող գծի վրա,
այսինքն՝ առաջացած
ՄՕ պատկանում է
կապի σ տիպին (![]() ): Կապող
ՄՕ-ում գտնվող
էլեկտրոնները
կոչվում են կապող
էլեկտրոններ:
): Կապող
ՄՕ-ում գտնվող
էլեկտրոնները
կոչվում են կապող
էլեկտրոններ:
Հայտնի է, որ 1s օրբիտալի ալիքային ֆունկցիան կարող է լինել դրական կամ բացասական, սակայն նրա քառակուսին միշտ դրական է: Առանձին ատոմի համար նշանի ընտրությունը կամայական է. մինչև այժմ ընդունել ենք այն դրական: Բայց երկու ատոմների փոխազդեցության ժամանակ նրանց 1s օրբիտալի ալիքային ֆունկցիան կարող են լինել տարբեր: Նման դեպքը բերված է նկ. 4.15-ում: Այստեղ ատոմներից մեկի1s օրբիտալի ալիքային ֆունկցիան դրական է, մյուսինը՝ բացասական (նկ. 4.15, ա):
Այդ ֆունկցիաների
գումարն արտահայտվում
է բ կորով: Այդպիսի
փոխազդեցությունից
առաջացած ՄՕ-ն
բնորոշվում է միջուկների
միջև եղած տարածությունում
ալիքային ֆունկցիայի
նվազմամբ: Որոշակի
կետում այն դառնում
զրո:Այս դեպքում
քիմիական կապ չի
առաջանում, և այդպիսի
ՄՕ-ն կոչվում է
խարխլող
(![]() ), իսկ նրանում
գտնվող էլեկտրոնները
խարխլող էլեկտրոններ:
), իսկ նրանում
գտնվող էլեկտրոնները
խարխլող էլեկտրոններ:

1s ատոմական
օրբիտալների էլեկտրոնների
անցումը կապող
ՄՕ-ի բերում է էներգիայի
անջատման: Ընհակառակը՝
1s ատոմական օրբիտալից
էլեկրոնների անցումը
խարխլող ՄՕ-ին
ուղեկցվում է էներգիայի
կլանումով: Հետևաբար
էլեկտրոնների
էներգիան ![]() 1s
օրբիտալում ավելի
փոքր է, իսկ
1s
օրբիտալում ավելի
փոքր է, իսկ
![]() 1s
օրբիտալում
ավելի մեծ է, քան
ատոմների 1s օրբիտալներում:
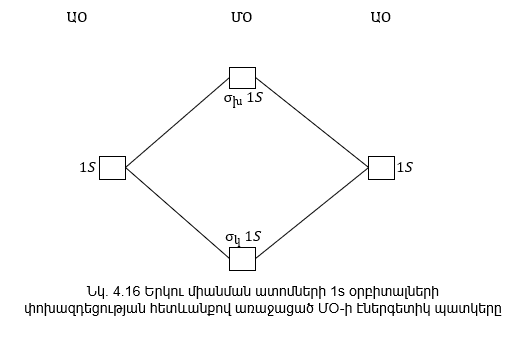
Նկ. 4.16-ում բերված
է
1s
օրբիտալում
ավելի մեծ է, քան
ատոմների 1s օրբիտալներում:
Նկ. 4.16-ում բերված
է ![]() 1s ,
1s ,![]() 1s
օրբիտալների,
ինչպես նաև ատոմների
1s օրբիտալների
գծապատկերները,
նշելով նրանց էներգիան:
1s
օրբիտալների,
ինչպես նաև ատոմների
1s օրբիտալների
գծապատկերները,
նշելով նրանց էներգիան:
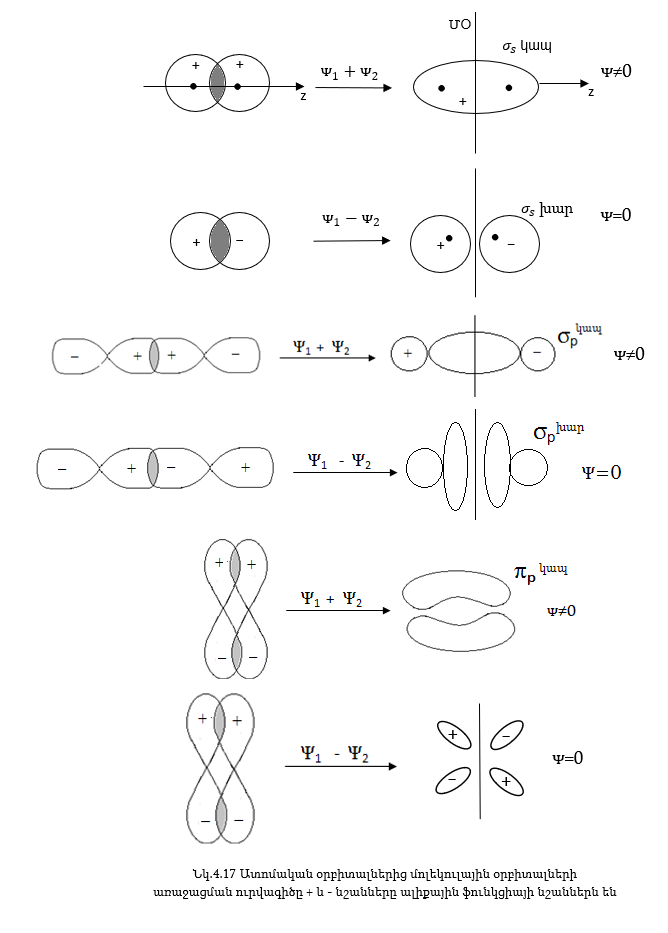
Ատոմական օրբիտալները կարող են փոխծածկել իրար, ինչպես σ այնպես էլ π տիպով, արդյունքում առաջանում է σ և π մոլեկուլային օրբիտալներ: Տարբեր տիպի մոլեկուլային օրբիտալների առաջացումը բերված է (նկ. 4.17)-ում:
s ատոմական
օրբիտալներից
առաջացած մոլեկուլային
օրբիտալները նշանակվում
են ![]() -նշանով,
իսկ p-օրբիտալից
առաջացած σ օրբիտալները
նշանակվում են
-նշանով,
իսկ p-օրբիտալից
առաջացած σ օրբիտալները
նշանակվում են![]() նշանով: p-օրբիտալներից
առաջացած π-օրբիտալները
նշանակվում են
նշանով: p-օրբիտալներից
առաջացած π-օրբիտալները
նշանակվում են
![]() նշանով:
նշանով:
4.9. ՈՐՈՇ ՄՈԼԵԿՈՒԼՆԵՐԻ ՄՈԼԵԿՈՒԼԱՅԻՆ ՕՐԲԻՏԱԼՆԵՐԸ
Էլեկտրոնների լրացման մոլեկուլային օրբիտալներում կատարվում է նույն սկզբունքներով, ինչ-որ ատոմական օրբիտալներում (Պաուլիի սկզբունք, Հունդի կանոն).
· Էլեկտրոնը սկզբում լրացնում է ավելի ցածր, հետո ավելի բարձր էներգիա ունեցող օրբիտալը:
· Մեկ օրբիտալում ամենաշատը կարող է լինել երկու էլեկտրոն հակառակ սպիներով:
· Տվյալ ենթամակարդակում էլեկտրոններ լրանում են սկզբում մեկական, սպիների նույն ուղղությամբ հետո զուգավորվում են:
Քննարկենք մի քանի մոլեկուլների առաջացումը:
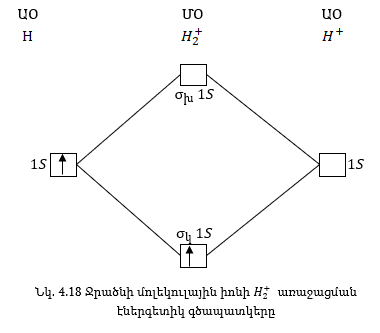
1. H+2մոլեկուլի առաջացումը.
H+2 մոլեկուլի
առաջացման ժամանակ
էլեկտրոնը 1s ատոմական
օրբիտալից անցնում
է ավելի քիչ էներգիա
ունեցող ![]() մոլեկուլային
կապող օրբիտալը,
որը ուղեկցվում
է էներգիայի անջատումով
և որը կարտահայտվի
հետևյալ գրառման
ձևով
մոլեկուլային
կապող օրբիտալը,
որը ուղեկցվում
է էներգիայի անջատումով
և որը կարտահայտվի
հետևյալ գրառման
ձևով
![]()
Նման ձևով առաջանում է H2 մոլեկուլը:
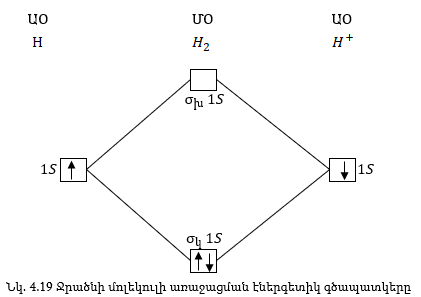
Ջրածնի ատոմների
H2 մոլեկուլի առաջացման
ժամանակ ջրածնի
ատոմների երկու
էլեկտրոնները,
լրացման սկզբունքի
համաձայն զբաղեցնում
են ![]() -մոլեկուլային
օրբիտալը հակառակ
սպիներով, ըստ
Պաուլիի սկզբունքի:
-մոլեկուլային
օրբիտալը հակառակ
սպիներով, ըստ
Պաուլիի սկզբունքի:
Քննարկենք
երկու արտասովոր
մոլեկուլների
He2+ և He2 մոլեկուլների
կառուցվածքը:
H+2 մոլեկուլում
կա երեք էլեկտրոն:
Կապող ![]() օրբիտալում
ըստ Պաուլիի սկզբունքի
կարող է լրացվել
երկու էլեկտրոն,
երրորդ էլեկտրոնը
զբաղեցնում է խարխլող
օրբիտալում
ըստ Պաուլիի սկզբունքի
կարող է լրացվել
երկու էլեկտրոն,
երրորդ էլեկտրոնը
զբաղեցնում է խարխլող
![]() մոլեկուլային
օրբիտալը: Այսպիսով
H+2 մոլեկուլն
ունի հետևյալ կառուցվածքը:
մոլեկուլային
օրբիտալը: Այսպիսով
H+2 մոլեկուլն
ունի հետևյալ կառուցվածքը:
![]()
H+2 մոլեկուլի առաջացման ժամանակ անջատվում է էներգիա, հետևաբար այն կայուն մասնիկ է: H+2 մոլեկուլում կապող էլեկտրոնները երկուսն են, խարխլողը՝ մեկը:
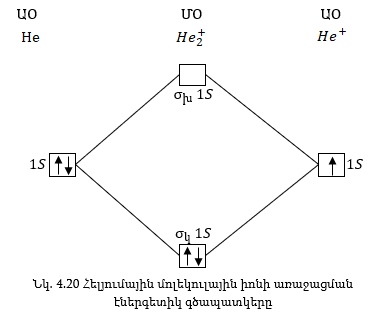
He2 հիպոթետիկ մոլեկուլը էներգիայի տեսակետից անկայուն է: Ատոմների չորս 1s էլեկտրոններից երկուսը լրանում են կապող օրբիտալում, երկուսը՝ խարխլող:
Հետևաբար
He2 մոլեկուլի առաջացման
ժամանակ էներգիա
չի անջատվում:
He2 մոլեկուլ գոյություն
չունի: Կապերի
թիվը ըստ ՄՕ-ի մեթոդի
որոշում է կապող
և խարխլող օրբիտալներում
եղած էլեկտրոնների
թվի՝ տարբերությունը
բաժանելով երկուսի:
Հետևաբար, այս
դեպքում կլինի
![]() Երկրորդ
տարբերության
տարրերի մոլեկուլներում
ՄՕ-ները առաջանում
է ատոմական 2s և 2p օրբիտալների
փոխազդեցությունից:
Նկ. 4.21-ում բերված
է ՄՕ-ների լրացումը
N2-ի մոլեկուլում:
Երկրորդ
տարբերության
տարրերի մոլեկուլներում
ՄՕ-ները առաջանում
է ատոմական 2s և 2p օրբիտալների
փոխազդեցությունից:
Նկ. 4.21-ում բերված
է ՄՕ-ների լրացումը
N2-ի մոլեկուլում:
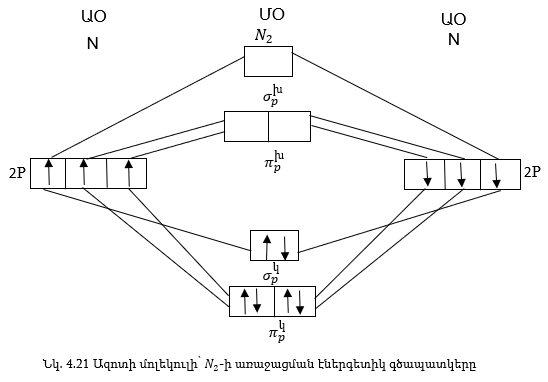
Ազոտի ատոմների վեց էլեկտրոնները լրանում են կապող օրբիտալներում,խարխլող օրբիտալում էլեկտրոն չկա, հետևաբար N2 -ի մոլեկուլում կա երեք կապ:
Թթվածնի
մոլեկուլի առաջացաման
դեպքում յուրաքանչյուր
ատոմից մասնակցում
են չորսական էլեկտրոններից
2 հատ p և 2 s էլեկտրոն:
(Նկ. 4.22): Այդ ութ էլեկտրոններից
երկուսը լրացվում
են![]() օրբիտալում,
չորսը՝
օրբիտալում,
չորսը՝ ![]() օրբիտալում
և երկուսը՝
օրբիտալում
և երկուսը՝ ![]() օրբիտալում:
Այսպիսով, ունենք
վեց կապող և երկու
խարխլող էլեկտրոն:
Կապող էլեկտրոնների
ավելցուկը չորս
է, հետևաբար կապը
կրկնակի կապ է:
օրբիտալում:
Այսպիսով, ունենք
վեց կապող և երկու
խարխլող էլեկտրոն:
Կապող էլեկտրոնների
ավելցուկը չորս
է, հետևաբար կապը
կրկնակի կապ է:
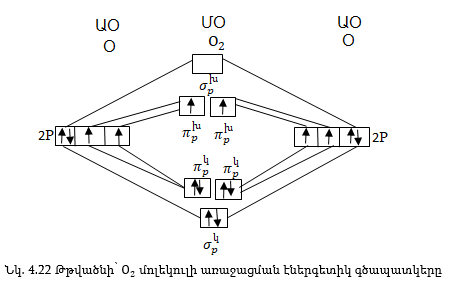
Երկու ![]() օրբիտալները
համարժեք են էներգետիկ
տեսակետից, և երկու
էլեկտրոնները
դրանցում դասավորվում
են ըստ Հունդի
կանոնի, այսինքն,
յուրաքանչյուր
օրբիտալները
համարժեք են էներգետիկ
տեսակետից, և երկու
էլեկտրոնները
դրանցում դասավորվում
են ըստ Հունդի
կանոնի, այսինքն,
յուրաքանչյուր![]() օրբիտալում
մեկ էլեկտրոն և
նույն ուղղությամբ՝
սպիներով:
օրբիտալում
մեկ էլեկտրոն և
նույն ուղղությամբ՝
սպիներով:
Այն
մասնիկները՝
ատոմները, մոլեկուլները
կամ իոնները, որոնք
ունեն չզույգված
էլեկտրոններ ձգվում
են մագնիսի կողմից
և կոչվում են պարամագնիսական
մասնիկներ: Քանի
որ թթվածնի մոլեկուլում
![]() օրբիտալներում
կան երկու կենտ
էլեկտրոններ, այդ
պատճառով O2ունի
պարամագնիսական
հատկություն:
օրբիտալներում
կան երկու կենտ
էլեկտրոններ, այդ
պատճառով O2ունի
պարամագնիսական
հատկություն:
Թթվածնի
մոլեկուլի առաջացման
էներգետիկ գծապատկերից
երևում է, որ O+2
մոլեկուլային
իոնի առաջացման
դեպքում առավելագույն
էներգիա ունեցող
խարխլող![]() օրբիտալների
էլեկտրոններից
մեկը պետք է պոկվի
և կապերի թիվը
կմեծանա
օրբիտալների
էլեկտրոններից
մեկը պետք է պոկվի
և կապերի թիվը
կմեծանա![]() : Այդ
պատճառով O+2 մոլեկուլային
իոնն ունի ավելի
մեծ դիսոցման էներգիա,
քան O2-ը: Այսպիսով,
քննարկված օրինակները
ցույց են տալիս,
որ ՄՕ-ի մեթոդը
հաջողությամբ
բացատրում է այն
մոլեկուլների
կառուցվածք և ֆիզիկական
հատկությունները,
որոնք վալենտական
կապերի մեթոդը
դժվարանում է բացատրել:
: Այդ
պատճառով O+2 մոլեկուլային
իոնն ունի ավելի
մեծ դիսոցման էներգիա,
քան O2-ը: Այսպիսով,
քննարկված օրինակները
ցույց են տալիս,
որ ՄՕ-ի մեթոդը
հաջողությամբ
բացատրում է այն
մոլեկուլների
կառուցվածք և ֆիզիկական
հատկությունները,
որոնք վալենտական
կապերի մեթոդը
դժվարանում է բացատրել:
4.10 ՋՐԱԾՆԱԿԱՆԿԱՊ
Ջրածինը միակ ատոմն է, որը չունի նախավերջին էլեկտրոնային թաղանթ՝ վալենտային շերտից հետո միջուկն է: Հետևաբար եթե ջրածնի ատոմը կորցնի էլեկտրոն, ապա կմնա միջուկը՝ պրոտոնը, որի չափերը հազարավոր անգամ փոքր են ատոմի չափերից: Երբ ջրածնի ատոմը միանում է խիստ էլեկտրաբացասական ատոմի հետ, ապա ջրածնի էլեկտրոն ըտեղաշարժվում է այդ ատոմի կողմը և մնում է համարյա մերկ պրոտոն, որը կարող է ձգվել խիստ էլեկտրաբացասական ատոմի կողմից և մխրճվել նրա էլեկտրոնային ամպի մեջ:
Ջրածնական կապ կոչվում է այն կապը, որն առաջանում է խիստ էլեկտրաբացասական ատոմի (F, O, Cl) հետ միացած ջրածնի և մի այլ խիստ էլեկտրաբացասական ատոմի միջև:
Ջրածնական կապի էներգիան ավելի փոքր է նույնպիսի ատոմների սովորական կովալենտ կապի էներգիայից:
Ջրածնական կապի շնորհիվ մոլեկուլները միանում են՝ առաջացնելով դիմերներ կամ այլ բարդ խմբավորումներ:

Օրինակ մրջնաթթուն, ինչպես հեղուկ, այնպես էլ գազային վիճակում գոյություն ունի գլխավորապես դիմերի ձևով.
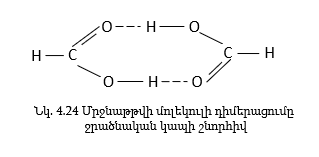
Ջրածնական կապը խիստ ազդում է նյութի ֆիզիկական հատկությունների վրա: Մոլեկուլների ասոցման շնորհիվ նյութի հալման, եռման ջերմաստիճանները բարձրանում են: Օրինակ, եթե հեղուկ ջրի մոլեկուլների ասոցումը չլիներ, ապա նա կունենար -1000C սառման և -800C եռման ջերմաստիճան:
Օրինակ 4-10.1
Ինչու՞ Cl2, H2, N2 նյութերը սովորական պայմաններում գազեր են, իսկ H2O, CH3OH նյութերը հեղուկներ:
Լուծում Cl2, H2, N2 մոլեկուլների կապերը ինչպես և իրենք՝ մոլեկուլները, ոչ բևեռային են, ուստի ասոցվում: H2O, CH3OH մոլեկուլներում ջրածինը միացած է խիստ էլեկտրաբացասական տարրի՝ թթվածնի, ուստի այդ մոլեկուլները միանում են իրար հետ ջրածնական կապով.
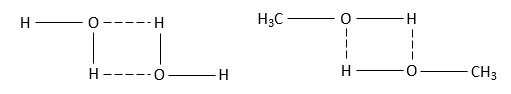
Առաջանում ենեն (H2O2), (H2O)3, (CH3OH)2 ասոցված մոլեկուլներ, ուստի եռման ջերմաստիճանը բարձրանում է:
Նման ջրածնական միացությունների եռման ջերմաստիճանը սովորաբար աճում է մոլեկուլային զանգվածների մեծացման հետ զուգահեռ:
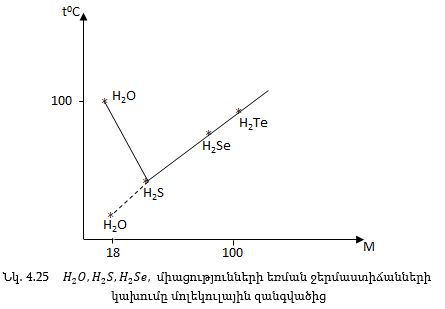
Ինչպես երևում է նկ. 4.25-ից, H2O-ի եռման ջերմաստիճանը չի ենթարկվում այդ օրինաչափությանը, այն աննորմալ բարձր է: Դա բացատրվում է նրանով, որ հեղուկից մոլեկուլ պոկելու համար բացի միջմոլեկուլային ուժերի հաղթահարումից անհրաժեշտ է ծախսել էներգիա ջրածնական կապը խզելու, ասոցված մոլեկուլները իրարից բաժանելու համար: Ջրածնական կապը լինում է միջմոլեկուլային (H2O, HF, HCOOH) և ներմոլեկուլային (սպիտակուցներ): Սպիտակուցի մոլեկուլի սպիրալը պայմանվորված է ջրածնական կապով, CO և NHխմբերի միջև, որը կոչվում է ɑ-սպիրալ: Մինչև 100°C սպիտակուցը տաքացնելիս ջրածնական կապերը քանդվում են, ɑ-սպիրալը կորցնում է իր կառուցվածքը: Սպիտակուցը ենթարկվում է բնափոխման:

4.11 ԴՈՆՈՐ-ԱԿՑԵՊՏՈՐԱՅԻՆ ԿԱՊ
Կապի այն տեսակը կովալենտ կապ է, առաջանում է ընդհանուր էլեկտրոնային զույգի շնորհիվ, սակայն ի տարբերություն սովորական կովալենտ կապի, որտեղ փոխազդող ատոմներից յուրաքանչյուրը տրամադրում է իր կենտ էլեկտրոնները առաջացնելով երկուսի համար ընդհանուր էլեկտրոնային զույգեր, այս դեպքում ընդհանուր զույգը տրամադրում է փոխազդող ատոմներից մեկը՝ էլեկտրոնների դոնորը: Մյուս ատոմը՝ ակցեպտորը արտաքին շերտում ունեցած դատարկ օրբիտալի շնորհիվ այդ զույգը դարձնում է իր համար ընդհանուր: Օրինակ՝ ազոտի ատոմը արտաքին շերտում ունի երեք վալենտական էլեկտրոն 2s22p3:
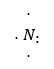
Ջրածնի հետ փոխազդելիս վերջինի և ազոտի կենտ էլեկտրոններից առաջանում են երեք ընդհանուր էլեկտրոնային զույգեր (ջրածնի կենտ էլեկտրոնները ցույց են տրված աստղիկներով):
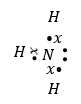
Շնորհիվ ազոտի ունեցած չբաժանվող 2s էլեկտրոնային զույգի այն կարող է առաջացնել նոր կապ: Ջրածնի H+ իոնն ունի դատարկ 1s օրբիտալ, ուստի ամոնիակի մոլեկուլը ջրածնի իոնի հետ փոխազդելիս ազոտը տրամադրում է իր էլեկտրոնային զույգը, որը դառնում է ընդհանուր երկու ատոմների համար:
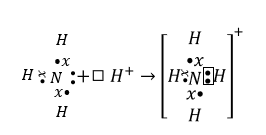
Այսպիսի կապը կոչվում դոնոր-ակցեպտորային կապ, որտեղ ազոտը էլեկտրոնների դոնորն է, իսկ ջրածնի իոնը՝ ակցեպտոր: Առաջացած չորս կապերը ամոնիում իոնի մեջ համարժեք են նրանց էլեկտրոնային խտությունը բաշխվում է հավասարաչափ:
Ամփոփում
Քիմիական կապի հիմնական տեսակը կովալենտ կապն է, որը առաջանում է ընդհանուր էլեկտրոնային զույգի շնորհիվ: Այն լինում է բևեռային, երբ փոխազդում են հավասար էլեկտրաբացասականություն ունեցող ատոմներ, և ոչ բևեռային՝ երբ տարբեր էլեկտրաբացասականություն ունեցող ոչ մետաղների ատոմներ: Մետաղի ոչ մետաղի միջև առաջանում է իոնական կապ: Ալիքային մեխանիկայի տեսակետից կապ առաջանում է, երբ փոխազդող ատոմների կենտ էլեկտրոնների ամպերը փոխծածկվում են, եթե փոխծածկումը կատարվում է միջուկները միացնող գծի ուղղությամբ՝ կապը կոչվում է σ, իսկ գծի երկու կողմերում՝ π կապ: Տվյալ ատոմում գոյություն ունեցող տարատեսակ վալենտական էլեկտրոնների ամպերը հիդրարատացվում են՝ առաջացնելով sp-,sp2-, և sp3- հիբրիդային ամպեր: Ըստ քիմիական կապի՝ մոլեկուլային օրբիտալների մեթոդի փոխազդող ատոմների ատոմական օրբիտալներից գոյանում են կապող և խարխլող մոլեկուլային օրբիտալներ: Կովալենտ կապի այն տեսակը, երբ ընդհանուր էլեկտրոնային զույգը տրամադրում է փոխազդող ատոմներից մեկը կոչվում է դոնոր-ակցեպտորային կապ: Ջրածնական կապ առաջանում է տարբեր մոլեկուլների միջև կամ նույն մոլեկուլի ներսում, եթե արդեն միացած ջրածինը փոխազդել է խիստ էլեկտրաբացասական տարրի հետ:
Սովորելու նպատակը
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք.
1. Բացատրել քիմիական կապի առաջացումը՝ էլեկտրոնը դիտարկելով որպեսմասնիկ: Հասկանալ կովալենտ կապի առաջացումը, տարբերել բևեռային և ոչ բևեռային կապերը, իմանալ իոնական կապի առաջացման մեխանիզմը:
2. Բացատրել քիմիական կապի առաջացումը էլեկտրոնի ալիքային հատկությունների տեսակետից: Կազմել մոլեկուլների վալենտային սխեմաները:
3. Տարբեր σ-, π-, և δ- կապերը: Հասկանալ էլեկտրոնային ամպերի հիբրիդացումը և ըստ դրա մոլեկուլների երկրաչափական կառուցածքը:
4. Հասկանալ քիմիական կապի մոլեկուլային օրբիտալների (ՄՕ) մեթոդի էությունը, կազմել տարբեր մոլեկուլների էներգետիկ ուրվագծերը:
5. Բացատրել ջրածնական և դոնոր-ակցեպտորային կապերի էությունը:
Հիմնական հասկացությունները
1. Կովալենտ կապ, առաջանում է, երբ փոխազդող ատոմների հակառակ սպին ունեցող կենտ էլեկտրոններից գոյանում է երկու ատոմների համար ընդհանուր էլեկտրոնային զույգեր:
2. Ոչ բևեռային կովալենտ կապ առաջանում է, երբ փոխազդում են հավասար էլեկտրաբացասականության ատոմներ, բևեռային, երբ տարբեր էլեկտրաբացասականության ոչ մետաղների ատոմներ:
3. Դիպոլի մոմենտը (μ) դիպոլի երկարության (l) և տեղաշարժված լիցքի (q) արտադրյալն է, μ=lq
4. Ալիքային մեխանիկայի տեսակետից քիմիական կապ առաջանում է, երբ փոխազդող ատոմների հակառակ սպին ունեցող կենտ էլեկտրոնների ամպերը փոխծածկվում են:
5. Քիմիական կապն ունի ուղղվածություն, ըստ ուղղվածության կապը լինում է σ, π, δ կապեր:
6. sp հիբրիդացում կոչվում է մեկական s և p ամպերի sp2` մեկ s և երկու հատ pամպերի և sp3-ը մեկ s և երեքpամպերի հիբրիդացումը:
7. Ըստ կապի մոլեկուլային օրբիտալների (ՄՕ) մեթոդի փոխազդող ատոմների ատոմական օրբիտալների առաջանում են կապող և խարխլող մոլեկուլային օրբիտալներ:
8. Դոնոր-ակցեպտորային կապը կովալենտ կապ է, երբ ընդհանուր էլեկտրոնային զույգը տրամադրում է ատոմներից մեկը՝ դոնորը, իսկ մյուսը՝ ակցեպտորը ունի դատարկ օրբիտալ:
9. Ջրածնական կապը միջմոլեկուլային կամ ներմոլեկուլային կապ է, որն առաջանում է, երբ ջրածինը փոխազդում է խիստ մեծ էլեկտրաբացասականություն ունեցող տարրերի հետ: